工程热力学第13讲-第7章-2理想溶液、相平衡基础
- 格式:ppt
- 大小:1.21 MB
- 文档页数:8




高等工程热力学童钧耕第章溶液和相平衡第一节:溶液的基本概念1.1 溶液的定义溶液是指由两个或两个以上的物质在一定温度和压力下混合形成的均相体系。
1.2 溶解度溶解度是指在某一温度和压力下,单位体积溶剂中最多溶解的物质的量,通常用摩尔溶解度表示。
在给定的温度和压力下,溶液中溶质的摩尔浓度等于溶解度,此时称为饱和溶液。
1.3 等温线等温线是指在恒定温度下,溶质在溶剂中溶解度随压力变化的曲线。
当某一压强下,溶质的摩尔浓度等于溶解度时,称为等温线上的点,该点就是该压强下的平衡点。
第二节:相平衡2.1 相平衡的定义相平衡是指在一定温度和压力下,两个或两个以上的不同相处于平衡状态时所对应的状态,即两个或两个以上的相间存在相互转化的正逆反应,并且反应速率相等,达到动态平衡。
2.2 平衡常数平衡常数是指在一定温度下,反应物与生成物之间的摩尔浓度比值,即为反应的平衡常数。
反应的正逆反应之间的平衡常数满足比例关系。
2.3 相图相图是描述物质(纯物质或混合物)在不同条件下相平衡关系的图形记录。
它通常是以温度和压力为轴,画出不同相的出现范围,用以研究物质在不同条件下的相变规律。
第三节:二元液体体系3.1 物质在不同条件下的相变物质在不同条件下的相变表现为液态、固态、气态之间的相互转化。
同一物质在不同条件下的相变规律与其在相图上的相变曲线有关。
3.2 系统的有序性和无序性在研究液体体系时,通常采用统计力学的方法。
在这种方法中,系统的有序程度通常用熵来描述。
对于二元液体体系,其混合熵对于温度和组成都是函数,因此可以得到相互作用参数。
3.3 凝聚度模型凝聚度模型用于描述液-液混合,其核心是假设体系可以分为两类分子,一类是聚集分子(偏好型分子),一类是单体分子(排斥型分子)。
据此可以得到混合自由能,用于计算热力学性质。
第四节:非理想溶液4.1 溶液中混合气体的非理想性在高压条件下,气体分子之间的相互作用不能忽略,导致混合气体的非理想性。
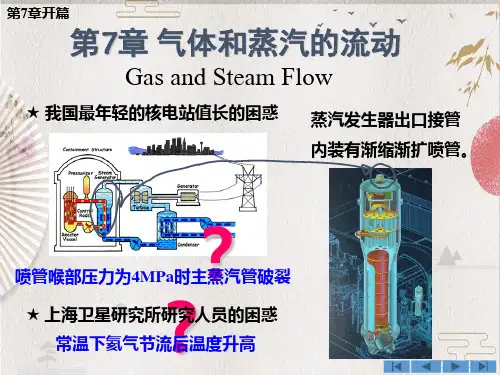





理想溶液的气液平衡关系遵循1. 引言嘿,大家好!今天咱们聊聊一个看似很高大上的话题——理想溶液的气液平衡关系。
听起来有点复杂,但别担心,我会尽量把它讲得简单易懂,毕竟,科学也是可以很有趣的嘛。
想象一下,如果你的朋友是个化学家,他和你聊起化学的时候,怎么才能让你觉得不那么无聊呢?这就是我今天的目标!2. 理想溶液是什么2.1 理想溶液的定义那么,啥是理想溶液呢?简单来说,理想溶液就是当两种或多种液体混合在一起时,它们的行为就像个一体的大家庭,彼此之间没有太多的摩擦和排斥。
比如,想象你和朋友一起做蛋糕,大家各自拿出自己的拿手好戏,然后把这些美味的食材混在一起,结果出来的蛋糕那叫一个美味可口,绝对的和谐。
这个过程就像是理想溶液的形成。
2.2 理想溶液的特性不过,理想溶液可不是随便就能凑合起来的哦。
它有几个特性,比如说它的组成成分在不同浓度下的蒸气压变化都是线性的。
就像你在超市看到的那些促销活动,买一送一,随着数量增加,价格的变化也不会太离谱。
而在理想溶液里,各种成分的挥发性也差不多,大家都在这个“气泡派对”上平起平坐,不分你我。
3. 气液平衡3.1 气液平衡的概念接下来,咱们得聊聊气液平衡。
想象一下,你在一个阳光明媚的日子里,喝着冰凉的饮料,饮料的水分不断蒸发,形成了小小的水珠在杯子表面上,乍一看还挺好看的!这就是气液平衡的一个小缩影。
气液平衡实际上就是液体和气体之间的一种状态,在这个状态下,蒸发和凝结的速度是一样的,听起来是不是很高深?但实际上就是一场小型的化学舞会,大家跳得不亦乐乎!3.2 理想溶液的气液平衡关系而在理想溶液中,这种气液平衡的关系可就特别“讲究”了。
根据拉乌尔定律,液体的蒸气压与它的摩尔分数成正比。
这就是说,如果你在混合液体中加入了更多的某种成分,它的蒸气压就会随之增加。
就像朋友聚会,如果你请了更多的朋友来,大家的热情自然会高涨,不是吗?这种动态平衡就像一场精心编排的舞蹈,互相配合得恰到好处。