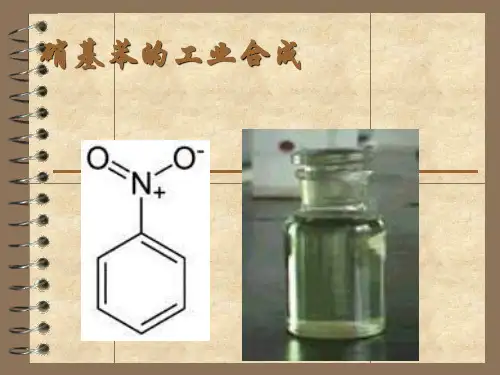
硝基苯的制备(课堂PPT)
- 格式:ppt
- 大小:367.50 KB
- 文档页数:72

硝基苯的制备本实验通过改变硝基苯的硝化度和苯的羟基上硝基碳原子数目来制备硝基苯,具体操作方法如下:【实验内容】一、原料与仪器:硝基苯,冰醋酸,乙醇,无水氯化钙,石棉网。
二、操作步骤: 1、向盛有冷的冰醋酸的小烧杯中缓慢滴加硝基苯,边滴边搅拌。
【实验步骤】 1、在烧杯中加入50g硝基苯,将它放入冷水浴中冷却。
待其温度降至室温后,再往其中加入4g无水氯化钙,将溶液搅拌均匀,然后将溶液倒入盛有50g冰醋酸的烧杯中,并且迅速将硝基苯沉淀于冰醋酸溶液之中。
接着将剩余的硝基苯和苯混合物加入到这个溶液中,最后将剩余的冰醋酸加入,使溶液中含有0.02mol/L的醋酸; 2、在盛有50g冰醋酸的烧杯中加入1.0g乙醇,并且搅拌均匀; 3、在这个烧杯中继续加入1g无水氯化钙,用玻璃棒将其轻轻地搅拌,直到溶液澄清为止。
2、向盛有冰醋酸的烧杯中加入50g硝基苯和1g乙醇,并且使它们充分混合。
3、继续向该烧杯中加入2g乙醇和1g无水氯化钙,将溶液搅拌均匀。
4、向该溶液中加入1.0g的乙醇和2g的无水氯化钙,使溶液中乙醇的浓度约为0.02mol/L,并且搅拌。
5、在该烧杯中加入1g乙醇和1g的无水氯化钙,使溶液中乙醇的浓度约为0.02mol/L。
6、继续向该溶液中加入1g乙醇和1g的无水氯化钙,使溶液中乙醇的浓度约为0.05mol/L。
7、继续向该溶液中加入1g乙醇和1g的无水氯化钙,使溶液中乙醇的浓度约为0.05mol/L。
8、在这个混合溶液中加入1.0g的乙醇和2g的无水氯化钙,使溶液中乙醇的浓度约为0.08mol/L,并且搅拌。
9、用硫酸铜溶液调节溶液的颜色至紫红色,并且使用紫外线检测器检测其颜色变化。
10、将此实验溶液放置24h,静置,得到实验产品。
【实验结果】将此溶液放置24h后,进行产品的检验,从其产品中分离出了硝基苯。
检验结果如下:3、继续向该烧杯中加入2g乙醇和1g无水氯化钙,使溶液中乙醇的浓度约为0.02mol/L。

硝基苯的制备原理
硝基苯是一种重要的有机化工原料,其制备可以通过硝化反应来实现。
具体的原理如下:
1. 硝化反应是一种重要的化学反应,可以将苯环上的氢原子替换为硝基(-NO2)基团。
硝基酸(如浓硝酸)在适当的条件
下与苯发生反应,生成硝基苯。
2. 硝化反应通常需要在酸性条件下进行,常用的催化剂是浓硫酸。
浓硝酸和浓硫酸的混合液中,硝酸自身具有强氧化性,而硫酸可提供酸性环境,并稀释浓硝酸,使其反应更加缓慢和安全。
3. 在反应过程中,苯分子中的一个氢原子首先与硝酸反应,生成硝酸苯。
随后,硝酸苯与互相处于平衡状态的硫酸和硝酸反应,生成硝基苯和水。
具体的反应式为:
C6H6 + HNO3 → C6H5NO3 + H2O
C6H5NO3 + H2SO4 ↔ C6H5NO2 + H2O + H2SO4
4. 反应后,硝基苯可以通过蒸馏、结晶等方法进行分离纯化。
值得注意的是,硝化反应是一种高温、高压、危险性大的反应,操作时需要注意安全,避免发生爆炸或其他意外事故。
在实际工业生产中,还要考虑反应的效率和环境友好性,例如寻找更优的催化剂、反应条件和工艺流程。


制备硝基苯的步骤
嘿,朋友们!今天咱就来讲讲制备硝基苯的那些事儿。
先把苯和硝酸准备好呀,这就像是做饭得有食材一样。
然后呢,把它们小心地混合在一起,这可得轻点儿,别跟大老粗似的。
这时候就好像是两个小伙伴要开始一场奇妙的化学反应之旅啦。
接下来,得加上浓硫酸这个厉害的角色。
它就像是化学反应中的催化剂,能让一切变得更精彩。
不过加的时候可得注意了,不能一股脑儿全倒进去,得慢慢的,就像给花浇水一样,得均匀。
然后呢,就开始加热啦。
这加热可不能瞎搞,温度得控制好,不然就像做饭火太大烧焦了一样,那就糟糕啦。
想象一下,要是温度不合适,反应不顺利,那多让人郁闷呀!
在这个过程中,要时刻关注着反应的情况,就像妈妈看着孩子做作业一样,认真仔细。
要是有啥不对劲的地方,得赶紧想办法调整。
等反应进行得差不多了,就得把产物分离出来啦。
这可不容易呢,就跟从一堆沙子里找出金子似的。
得有耐心,还得有技巧。
最后得到的硝基苯,可就是我们努力的成果啦。
就好像是辛苦种了好久的果树终于结出了甜甜的果实。
哎呀,制备硝基苯可不是一件简单的事儿呀,每一步都得小心谨慎,就跟走钢丝似的。
但只要我们认真对待,按照步骤来,就一定能成功呀!你们说是不是?。

硝基苯制取实验详细步骤嘿,咱今儿就来讲讲硝基苯制取实验的那些事儿哈!首先呢,你得把实验要用的家伙事儿都准备齐全咯。
圆底烧瓶、温度计、分液漏斗、玻璃管等等,一个都不能少,这就好比战士上战场,枪可不能不带呀!然后呢,把苯和浓硝酸按照一定的比例倒进圆底烧瓶里。
这时候你就得小心点啦,可别洒出来一星半点,不然可就浪费啦。
就好像做饭放盐一样,得恰到好处。
接着呀,再往烧瓶里加浓硫酸,这浓硫酸就像是调料里的辣椒,能给实验增添点“辣味”,让反应更带劲呢!加的时候也要慢慢的,别着急,心急可吃不了热豆腐哟!下面就是加热环节啦!要控制好温度,不能太高也不能太低,就跟洗澡水的温度似的,得刚刚好才舒服。
温度太高了,可能会出乱子;温度太低了,反应又进行不下去,你说麻烦不麻烦。
在加热的过程中,你可得瞪大眼睛瞧着,密切关注着烧瓶里的变化。
这就跟看着自己的宝贝似的,不能有一点马虎。
看着那些液体咕噜咕噜地冒泡,是不是挺有意思的呀!等反应进行得差不多了,就把产物倒出来。
这时候你会发现有一些杂质混在里面,就像大米里混了点沙子,得把它们分离开来。
用分液漏斗就可以把杂质去掉啦,让硝基苯变得干干净净的。
哎呀,你说这硝基苯制取实验是不是挺有趣的呀!但也不能掉以轻心哦,毕竟是做实验嘛,安全第一!要是不小心出了差错,那可就不好玩啦。
在做这个实验的时候,你得时刻保持警惕,就像警察巡逻一样。
每一个步骤都要认真对待,不能有丝毫的马虎。
就好像搭积木,一块没搭好,整个就可能垮掉。
而且呀,做完实验后,一定要把实验器具收拾好,不能乱糟糟的。
这就跟我们每天要整理房间一样,干干净净的看着才舒服嘛!总之呢,硝基苯制取实验虽然有点复杂,但只要你按照步骤一步一步来,小心谨慎,就一定能成功!怎么样,是不是迫不及待想试试啦?那就赶紧行动起来吧!。


硝基苯的制备原理硝基苯,又被称为硝基苯酚,是一种有机化合物,分子式为C6H5NO2,属于苯的衍生物。
它是一种无色晶体,具有特殊的香气,广泛应用于化学工业和医药工业。
硝基苯的制备原理主要通过硝化反应实现,一般有三种主要的制备方法,即硝化反应法、重氮化反应法和硝基化反应法。
1. 硝化反应法:硝化反应法是最常用的制备硝基苯的方法。
其制备原理是将苯系化合物与硝酸反应,生成硝基苯。
反应方程式如下:C6H6 + HNO3 →C6H5NO2 + H2O该反应是一种亲电取代反应,硝酸(HNO3)向苯环上的质子攻击,形成亲电炔氢离子,进而与硝酸根离子结合,生成硝基苯。
硝基苯的生成可以通过变化反应条件和反应时间来控制所得产物的选择性。
2. 重氮化反应法:重氮化反应法是一种以硝酸和苯胺为原料制备硝基苯的方法。
其制备原理是先将苯胺与硝酸反应生成相应的亚硝基化合物,然后再通过酸性条件下的重氮化反应得到硝基苯。
反应方程式如下:C6H5NH2 + HNO2 →C6H5N2+ + 2H2OC6H5N2+ + HNO3 →C6H5NO2 + H2O + N2↑在此反应过程中,苯胺与硝酸会先反应生成亚硝基苯胺,然后再通过酸性条件的重氮化反应得到硝基苯。
该方法相比硝化反应法,可大量减少亲电炔氢离子的生成,减小了反应的爆炸性。
3. 硝基化反应法:硝基化反应法是一种以苯为原料直接进行硝化反应的方法。
其制备原理是通过将苯置于亚硝酸和硫酸等混合酸中反应生成硝基苯。
反应方程式如下:C6H6 + HNO2 + H2SO4 →C6H5NO2 + H2SO4 + H2O在该反应过程中,亚硝酸作为硝基供体与苯发生反应,生成硝基苯。
在反应中,硫酸既能够起催化剂的作用,也能够将水抽取走,提高反应的产率。
总体来说,硝基苯的制备原理主要是通过硝化反应进行,可以使用硝酸、苯胺和亚硝酸等试剂作为原料,通过改变反应条件和反应时间来控制所得产物的选择性。
这种方法的优点在于操作简单、产率高,广泛应用于工业生产中。