化学反应的限度1
- 格式:pdf
- 大小:174.49 KB
- 文档页数:10

三化学反应的限度1.可逆反应AECD
1、概念:化学反应限度就是研究可逆反应所能达到的最大程度。
2、可逆反应:在同一反应条件下,既能向正反应方向进行,又能向逆反应方向进行的化学反应。
3、说明:
(1)绝大多数反应都有一定的可逆性。
一个反应是可逆反应的必需条件:在同一反应条件下进行。
(2)可逆反应在一定条件下进行到一定程度时,正反应速率和逆反应速率相等,反应物与生成物的浓度不再发生变化,反应达到化学平衡状态。
(3)化学平衡时一种动态平衡。
在化学平衡状态下化学反应仍进行,但是反应混合物的组成保持一致,当反应条件改变时,原化学平衡状态被破坏,一段时间后会达到新的平衡。

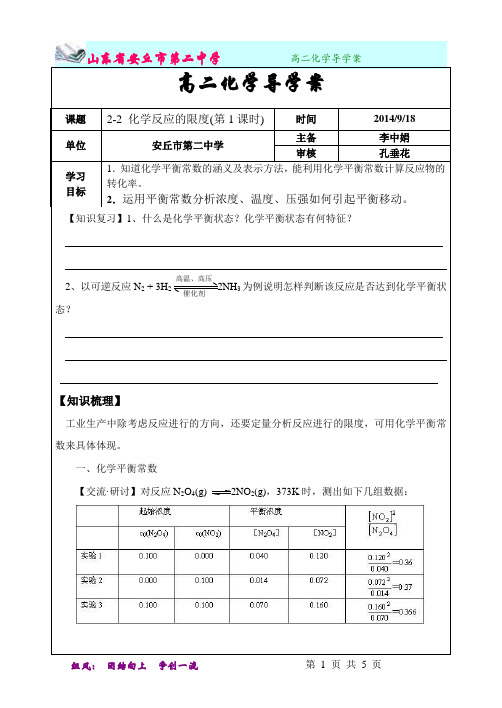
2.51化学反应的限度【学习目标】1、了解化学平衡的特征;2、掌握化学平衡状态的判断;3、掌握常用的控制反应条件的方法。
【要点梳理】要点一、化学反应的限度1.可逆反应:(1)可逆反应:一定条件下既能向正反应方向进行,同时又能向逆反应方向进行的化学反应。
要点诠释:不管反应方程式如何书写,向右方向进行的反应叫正反应,向左方向进行的反应叫逆反应。
一个可逆反应是2个反应组成的体系,含有2个反应速率:v(正)和v(逆)来表示各相应反应的快慢程度,v(正)与v(逆)既相互联系又各自独立。
(2)可逆反应在写化学方程式时不用“”而用“”。
如工业制硫酸时,SO 2与O2的反应是可逆反(3)可逆反应的特点:①由正反应和逆反应2个反应组成,分别用v(正)和v(逆)来衡量各自反应进行的快慢。
②反应物和生成物同时共存。
③若条件保持一定,最终都会建立一个化学平衡状态。
2.化学反应的限度——化学平衡状态(1)概念:在一定条件下可逆反应进行到一定程度时,正反应速率和逆反应速率相等,反应物和生成物浓度不再发生变化,这种状态称为化学平衡状态,这就是这个反应所能达到的限度。
(2)特点:①逆:化学平衡适用的是可逆反应。
②等:化学平衡引起的原因是正、逆反应速率相等(即v(正)=v(逆)),即同一时间内对某一物质来说,生成的量和消耗的量相等。
③定:正反应速率和逆反应速率相等,引起的结果是各物质的浓度都不再发生变化。
这种相对稳定的状态为化学平衡状态。
④动:平衡后,正、逆反应仍在进行,即正、逆反应速率相等但不为零,平衡为动态平衡。
⑤变:由于速率受条件的影响,当改变外界条件时,速率发生变化,正、逆反应速率可能不再相等(即v(正)≠v(逆)),平衡就会发生变化,这就是平衡移动。
综上所述,可知平衡建立的实质是速率相等,可用图像表示为:要点二、化学平衡状态的判断1.任何情况下均可作为标志的是:①v(正)=v(逆)要点诠释:v(正)=v(逆)在一个反应中,其含义是指对某一物质而言v(生)=v(消),必须包含两个方向的速率(即正反应速率和逆反应速率);同一物质,速率相等,不同物质,速率之比等于化学计量数之比。


《化学反应的限度》知识清单一、化学反应限度的概念在化学反应中,反应物不可能全部转化为生成物,存在着一定的限制。
当一个化学反应在一定条件下,正反应速率和逆反应速率相等,反应物和生成物的浓度不再发生变化,这时我们就说这个反应达到了化学平衡状态,也就是达到了化学反应的限度。
例如,工业合成氨的反应:N₂+ 3H₂⇌ 2NH₃。
即使不断提供合适的条件,氮气和氢气也无法完全转化为氨气,而是会在达到一定程度后,反应体系中各物质的浓度保持相对稳定。
二、影响化学反应限度的因素1、温度升高温度,化学平衡向吸热反应方向移动;降低温度,化学平衡向放热反应方向移动。
这是因为温度的改变会影响反应的活化能,从而改变反应速率。
以二氧化硫转化为三氧化硫的反应:2SO₂+ O₂⇌ 2SO₃(放热反应)为例。
升高温度,平衡会逆向移动,不利于三氧化硫的生成;降低温度,平衡会正向移动,有利于三氧化硫的生成。
2、浓度增大反应物浓度或减小生成物浓度,化学平衡向正反应方向移动;减小反应物浓度或增大生成物浓度,化学平衡向逆反应方向移动。
比如在可逆反应:Fe³⁺+ 3SCN⁻⇌ Fe(SCN)₃中,如果增加 Fe³⁺的浓度,平衡会向右移动,溶液颜色加深。
3、压强对于有气体参与的反应,增大压强,化学平衡向气体体积减小的方向移动;减小压强,化学平衡向气体体积增大的方向移动。
例如,N₂+ 3H₂⇌ 2NH₃这个反应,气体总体积在反应前后是变化的。
增大压强,平衡会向右移动,有利于氨气的生成。
4、催化剂使用催化剂能同等程度地改变正、逆反应的速率,化学平衡不发生移动,但可以缩短达到化学平衡所需的时间。
三、化学平衡状态的特征1、等正反应速率和逆反应速率相等。
这是化学平衡状态的本质特征,意味着反应在宏观上看起来似乎停止了,但实际上正反应和逆反应仍在进行。
2、定平衡体系中各物质的浓度保持恒定。
一旦达到平衡,反应物和生成物的浓度不再随时间变化而改变。

第2课时化学反应的限度化学反应条件的控制[学习目标定位] 1.通过实验认识化学反应的限度、可逆反应和化学平衡的含义,知道当一定的外界条件改变时化学反应限度可能发生改变。
2.了解控制反应条件在生产和科学研究中的作用。
一化学反应限度1.可逆反应(1)定义:在同一条件下,正反应方向和逆反应方向均能同时进行的化学反应称为可逆反应。
(2)特征①可逆反应在一定条件下不能进行到底,只能进行到一定程度,反应有一定限度,即达到平衡状态,此时各物质的量都大于零;②在可逆反应的化学方程式中,用“”号代替“===”号。
2.化学平衡的建立2SO3,在一定温度下,将2 mol SO2(g)和1 mol O2(g)通(1)对于可逆反应2SO2+O2催化剂△入一定体积的密闭容器中。
其化学反应速率与时间关系如图所示。
分析回答下列问题:①反应开始时,正反应速率最大,原因是反应物浓度最大;逆反应速率为0,原因是生成物浓度为0;②反应进行中,正反应速率的变化是逐渐减小,原因是反应物浓度逐渐减小;逆反应速率的变化是逐渐增大,原因是生成物浓度逐渐增大;③反应一段时间(t1)后,正反应速率和逆反应速率的关系是大小相等,反应物的浓度不再改变,生成物的浓度不再改变。
(2)化学平衡状态也可从逆反应开始建立。
如图:3.化学平衡状态(1)化学平衡状态的概念:如果外界条件(温度、浓度、压强等)不发生改变,当可逆反应进行到一定程度时,正反应速率与逆反应速率相等,反应物的浓度与生成物的浓度不再改变,达到一种表面静止的状态,称为“化学平衡状态”,简称化学平衡,化学平衡研究的对象是可逆反应。
(2)化学平衡状态的特征:4.影响化学反应的限度的因素(1)决定因素:化学反应的限度首先决定于反应物的化学性质。
不同的可逆反应在给定条件下的化学反应限度不同,反应物的最大转化率不同。
(2)外界因素:化学反应的限度受温度、浓度、压强等条件的影响。
改变其中的一个条件,可以在一定程度上改变一个化学反应的限度。
《化学反应的限度》知识清单一、化学反应限度的概念在化学变化中,反应物不可能全部转化为生成物,存在着一个反应进行的程度问题,这就是化学反应的限度。
通俗地说,化学反应限度就是指在给定条件下,化学反应所能达到的最大程度。
当一个化学反应达到限度时,反应物和生成物的浓度不再发生变化,反应处于一种动态平衡状态。
二、化学反应限度的特征1、动态平衡化学反应达到限度时,反应并没有停止,而是正反应速率和逆反应速率相等,反应物和生成物的浓度不再改变,但反应仍在不断进行。
2、条件一定化学反应的限度是在特定条件下(如温度、压强、浓度等)达到的。
当条件改变时,原来的平衡可能会被打破,从而建立新的平衡。
3、各物质浓度不变达到限度时,反应物和生成物的浓度不再随时间变化而变化,但它们的浓度不一定相等。
三、影响化学反应限度的因素1、浓度在其他条件不变的情况下,增大反应物的浓度或减小生成物的浓度,平衡向正反应方向移动;减小反应物的浓度或增大生成物的浓度,平衡向逆反应方向移动。
例如,对于反应 A + B ⇌ C + D,如果增加 A 的浓度,那么反应会朝着生成 C 和 D 的方向进行,以消耗多余的 A。
2、温度升高温度,平衡向吸热反应方向移动;降低温度,平衡向放热反应方向移动。
因为温度的改变会影响反应的活化能和反应速率。
比如,对于一个吸热反应,升高温度会提供更多的能量,使反应更容易向正方向进行。
3、压强对于有气体参加的反应,增大压强,平衡向气体体积减小的方向移动;减小压强,平衡向气体体积增大的方向移动。
这是因为压强的改变会影响气体的浓度。
但需要注意的是,如果反应前后气体体积不变,压强的改变对平衡没有影响。
4、催化剂催化剂能够同等程度地改变正反应和逆反应的速率,所以使用催化剂不能改变反应的限度,但可以加快反应达到平衡的时间。
四、化学平衡常数化学平衡常数(K)是衡量化学反应限度的一个重要参数。
对于一个一般的化学反应:aA + bB ⇌ cC + dD,其平衡常数表达式为:K = C^c × D^d / A^a × B^b其中,A、B、C、D分别表示各物质在平衡时的浓度。