高一化学乙酸和羧酸
- 格式:pdf
- 大小:975.83 KB
- 文档页数:8

乙酸的羧酸反应是有机化学中的一种重要的反应过程。
在这个反应中,一个酸基在水中失去了一个质子,并产生了相应的阴离子。
这个阴离子与另一个分子中含有活泼的亲电性基团的化合物发生反应,形成了一个新的分子。
这个反应过程是常见的有机合成中的一种基础反应,可以应用于制备酯、酰胺、酸酐等一系列的有机化合物。
1. 反应机理遵循一个经典的反应机理,称为酸催化羧酸反应机理。
这个机理的关键反应步骤是酸催化下的质子转移,使酸基的质子从它的羧基离子中转移出来,而转移到一个另一个活泼的亲电基团上。
这个质子转移过程使得羧基离子变得更加反应性,因为它成为了一个更强的亲电性中心,可以更容易地与另一个化合物中的亲电性基团反应。
羧酸反应通常需要使用酸作为催化剂,其中最常见的是硫酸。
硫酸游离的质子与羧基离子中游离的质子产生共振,形成了一个强电子吸引力的分子。
因此羧基离子变得更稳定,它变得更容易吸引邻近的分子,从而促进反应的进行。
2. 反应类型是有机化学中的一种常见反应类型,它在有机合成中的应用非常广泛。
它主要包括以下几种反应类型:酯化反应:在这个反应中,一个羧酸与醇在酸催化下反应,生成一个酯。
这个反应是一种重要的有机合成反应,可以用于合成各种不同的酯类化合物,如甲酸甲酯、乙酸乙酯、异丁酸异丁酯等。
酰胺反应:在这个反应中,一个羧酸与氨或者一个氨基化合物反应,生成一个酰胺。
像酰化反应一样,这个反应也通常需要在酸催化下进行,也可以利用催化剂进行。
酰胺在生物学和医学领域中应用广泛,也是一种有机化学中最基本的化合物之一。
酸酐反应:在这个反应中,两个分子的羧酸反应,生成一个酸酐。
酸酐是一种常见的有机化合物,在有机合成中的应用广泛。
例如,它可以用于制备酸酐衍生物、酰胺等化合物。
3. 反应条件由于是一种酸催化的反应,因此通常需要在酸性的条件下进行。
硫酸是乙酸羧酸反应中使用最广泛的酸催化剂之一,其他的酸催化剂也可以应用于这个反应中。
此外,反应需要进行在足够的温度下才能顺利进行。

高一化学必修三羧酸知识点羧酸是有机化合物中十分重要的一类物质,它在生物学、医药学、化工等领域都扮演着重要角色。
羧酸可用于制药、生物催化、有机合成等领域,因此,对于高中化学学生来说,了解羧酸的性质、结构和反应十分重要。
一、羧酸的基本结构羧酸分子由一个羧基(-COOH)和一个碳链组成。
羧基是由一个碳原子与一个氧原子和一个氢原子连接而成的。
羧酸的碳链可以是直链、支链或环状结构,其中直链和支链结构的羧酸是最常见的。
二、羧酸的命名和表示方法羧酸的命名通常以其碳链的命名为基础,然后在末端加上“酸”字。
例如,乙酸就是由两个碳原子组成的羧酸分子。
除了常见的化学式表示外,羧酸还可以用分子式、结构式和简图表示。
三、羧酸的性质1. 酸性:羧酸具有较强的酸性。
它们可以与碱反应生成相应的盐和水。
例如,乙酸与氢氧化钠反应生成乙酸钠和水。
2. 气味:羧酸在溶液中具有特殊的气味,例如,乙酸的气味呛鼻且具有辛辣的性质。
3. 溶解性:羧酸在水中具有一定的溶解性。
溶解度与羧酸的碳链长度有关,碳链越短,溶解度越高。
4. 沸点和熔点:羧酸的沸点和熔点与其分子大小、分子间相互作用力有关。
一般来说,分子量较大的羧酸沸点和熔点较高。
四、羧酸的常见反应1. 氧化反应:羧酸可以在适当条件下发生氧化反应,生成相应的醛、酮或羧酸。
例如,乙酸可以被氧气氧化生成乙醛。
2. 脱羧反应:羧酸可以在加热条件下发生脱羧反应,生成相应的酸酐和水。
例如,乙酸可以加热生成醋酸酐和水。
3. 还原反应:羧酸可以通过还原剂还原为相应的醛、酮或烃。
还原反应的条件取决于具体的羧酸和还原剂。
例如,乙酸可以被还原为乙醛。
五、羧酸的应用领域1. 制药:许多药物都是羧酸衍生物,包括乙酸钠、阿司匹林等。
羧酸可以增加药物的水溶性和生物利用度。
2. 化学工业:羧酸可用于合成香料、润滑剂、染料和橡胶等化工产品。
3. 生物学:在生物学中,羧酸是脂肪酸和氨基酸的重要成分,参与体内能量代谢和脂质合成等生物过程。
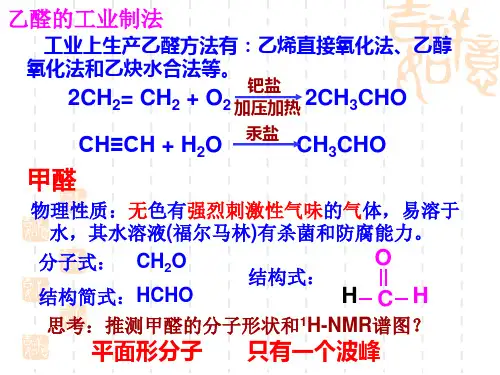

乙酸与羧酸一、组成:分子式:C 2H 4O 2饱和一元羧酸的通式:C n H 2n O 2 n ≥1二、结构:结构简式:CH 3COOH 官能团:—COOH一元羧酸的通式:RCOOH 结构特征:羧基与烃基相连。
饱和一元羧酸同系列:HCOOH 、CH 3COOH 、CH 3CH 2COOH 、CH 3CH 2CH 2COOH 羧酸有碳链异构,如CH 3CH 2CH 2COOH 与(CH 3)2CHCOOH也有类别异构,如CH 3COOH 与HCOOCH 3三、物理性质:乙酸是一种无色有特殊气味比水重可以溶于水的液体。
大部分的羧酸都溶于水,一般随碳原子数的增大,溶解性减弱。
四、化学性质1、酸性:羧酸都是弱酸,酸性一般比碳酸强,随碳原子增加而减弱,但苯甲酸酸性强于甲酸。
C 6H 5COOH>HCOOH>CH 3COOH>CH 3CH 2COOH>H 2CO 3>C 6H 5OH2CH 3COOH +2Na2CH 3COONa +H 2↑ 2CH 3COOH +MgO(CH 3COO)2Mg +H 2O CH 3COOH +NaOHCH 3COONa +H 2O CH 3COOH +CaCO 3(CH 3COO)2Ca +CO 2↑+H 2O CH 3COOH +NaHCO 3CH 3COONa +CO 2↑+H 2O2、酯化反应:羧酸与醇与浓硫酸共热,本质是羧酸脱羟基,醇脱羟基上的氢原子结合生成水,剩余基团结合生成酯。
CH 3COOH +CH 3CH 2OHCH 3COOCH 2CH 3+H 2O HCOOH +CH 3CH 2OHHCOOCH 2CH 3+H 2O CH 3COOH +CH 3OH CH 3COOCH 3+H 2OCH 3COOH +(CH 3)2CHOH CH 3COOCH(CH 3)2+H 2O3、缩聚反应:二元羧酸与二元醇、二元胺的缩聚反应。
加热浓硫酸加热 浓硫酸加热 浓硫酸 加热 浓硫酸 +2H 2O +2H 2O五、制法:2CH 3CHO +O 2 2CH 3COOH 六、用途:酸味调味剂;生产酯和香料。

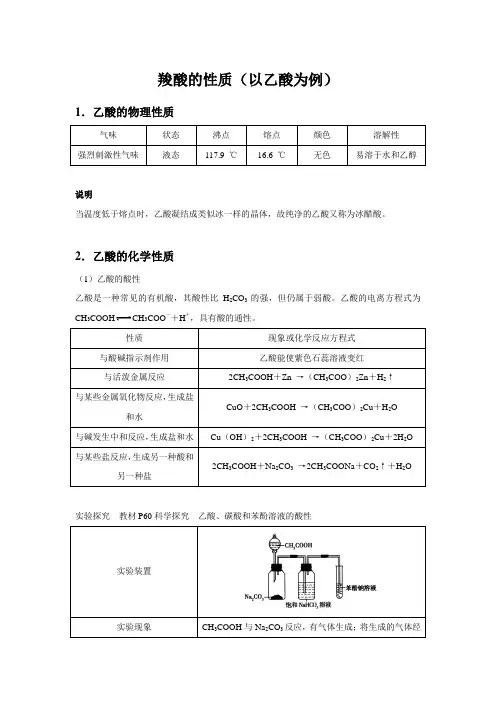
羧酸的性质(以乙酸为例)1.乙酸的物理性质说明当温度低于熔点时,乙酸凝结成类似冰一样的晶体,故纯净的乙酸又称为冰醋酸。
2.乙酸的化学性质(1)乙酸的酸性乙酸是一种常见的有机酸,其酸性比H2CO3的强,但仍属于弱酸。
乙酸的电离方程式为CH3COOH CH3COO-+H+,具有酸的通性。
实验探究教材P60科学探究乙酸、碳酸和苯酚溶液的酸性酸性:CH3COOH>H2CO3>(2)酯化反应用同位素示踪法探究酯化反应中的脱水方式。
用含有示踪原子的CH3CH218OH与CH3COOH反应,经测定,产物中含有示踪原子,说明酯化反应的脱水方式是“酸脱羟基醇脱氢”名师提醒(1)注意乙醇、乙酸和浓硫酸三种液体的混合顺序,不可先加浓硫酸。
(2)实验时应加碎瓷片并小火加热,防止暴沸及副反应的发生。
(3)导气管兼冷凝的作用,防止未反应的乙酸和乙醇挥发损失。
导管末端不可伸入液体中,防止出现倒吸。
(4)饱和碳酸钠溶液的作用是减少乙酸乙酯的溶解、中和挥发出的乙酸、溶解挥发出的乙醇。
酯化反应是醇和羧酸反应生成酯和水的一类反应,属于取代反应。
发生酯化反应时醇羟基中的氢原子与羧酸分子中的—OH结合生成水,其余部分连接成酯。
3.羧酸的化学性质羧酸的化学性质与乙酸相似,主要取决于羧基官能团。
发生化学反应时,羧酸分子中易断裂的化学键如图3-3-1所示。
图3-3-1①处:O—H键断裂时,易电离出H+,使羧酸表现出酸性;②处:C—O键断裂时,羧基中的一OH易被取代,如酯化反应;③处:C—H键断裂时,α-H易被取代,如RCH2COOH+Cl2RCHClCOOH+HCl。
典例详析例1(2019四川成都检测)巴豆酸的结构简式为CH3CH=CHCOOH。
现有①HCl ②溴的四氯化碳溶液③纯碱溶液④2-丁醇⑤酸性KMnO4溶液,根据巴豆酸的结构特点,判断在一定条件下能与巴豆酸反应的物质是A.②④⑤B.①③④C.①②③④D.①②③④⑤解析◆因为巴豆酸中含有,,所以巴豆酸可以与HCl、Br2发生加成反应,也可以被酸KMnO4溶液氧化;因为巴豆酸中含有—COOH,所以其可与2-丁醇发生酯化反应,也可与Na2CO3反应。





第六节乙酸羧酸一、乙酸1、分子结构分子式C2H4O2, 结构简式:CO O H3CHO HOC3CH或2、物理性质无色、强烈刺激性气味的液体,熔点为16.6℃,低于16.6℃凝结成冰状晶体,故无水乙酸又称冰醋酸。
能与水和乙醇任意比互溶。
3、化学性质由于羰基对羟基影响,使羟基活性增强。
(1)酸性:乙酸在水溶液里部分电离-++C O O3C HHC O O H3C H具有无机酸通性:①与指示剂反应,如使紫色石蕊试液变红色。
②与金属活动顺序表中排了H前金属反应生成乙酸盐和H2③与碱性氧化物反应生成盐和水④与碱反应生成盐和水⑤与某些弱酸盐或不稳定酸盐反应注意:CH3CH2OH、H、CH3COOH 酸性比较:乙醇:中性,能与活泼金属反应,不与盐和碱反应。
苯酚:弱酸性,不能使指示剂变色,能与强碱反应,不与NaHCO3反应(更不会产生CO2)。
乙酸:弱酸性,能使指示剂变色,能与NaOH反应,能与碳酸盐反应产生CO2。
故酸性:乙酸﹥碳酸﹥苯酚﹥乙醇(2)酯化反应:酸与醇作用生成酯和水的反应O2H5H2CO18OC3CH4SO2H5H2CO18HO HOC3CH+∆+浓注意:a)经同位素氧-18测定,乙酸与乙醇作用生成乙酸乙酯的反应原理是:乙酸脱去羧基上的羟基,乙醇脱去羟基上的氢原子。
b)反应中浓硫酸起催化、吸水作用。
c)吸收装置(如右图)中导管口不与液面接触是防止试管中液体倒吸入反应容器中。
d)试管中用饱和Na2CO3溶液收集乙酸乙酯,目的是中和蒸气中的乙酸,溶解乙醇,降低乙酸乙酯的溶解度。
e)酯与混合液分离:用分液漏斗分液,取上层油状液体得酯。
4、乙酸的制法(1)发酵法乙酸氧化乙醛发酵氧化乙醇酶发酵糖类淀粉−−−→−()((2)乙烯氧化法C O O H3CH 22O CHO 3CH 2CHO 3CH 22O 2CH 2CH 2−−−→−+−−−→−+=催化剂催化剂此法原料来源丰富,生产工艺流程简单 (3)烷烃直接氧化法—丁烷氧化法O 2H 2C O O H3CH 2O 53CH 2CH 2CH 3CH 2++5、乙酸的用途生产醋酸纤维 、合成维纶纤维 、作溶剂、制香料、染料、医药、农药等。
霍邱一中高中新课程教学设计课题:乙酸羧酸课型:新课(必修二)课时:2课标要求:知道乙酸的组成和性质,认识其在日常生活中的应用。
通过实验探究乙酸的化学性质,讨论从乙烯到乙酸的合成路线。
教材分析:必修2的主要任务是建立有机化学的基本概念和最为基本的化学学科素养。
通过乙酸的性质,进一步巩固有机化学的取代反应、酯化反应等基本反应类型。
通过乙酸的学习,进一步建立羧酸和官能团的概念,并以此了解饱和一元脂肪羧酸及其同系物组成、结构及性质。
教学目标(知识与技能、过程与方法、情感态度与价值观)⑴了解乙酸的结构及其结构特点。
⑵掌握乙酸的主要化学性质。
⑶了解取代反应酯化反应等概念。
⑷进一步巩固饱和一元脂肪酸的同系物组成、同分异构现象和同分异构体。
教学重点:⑴乙酸的分子结构;⑵乙酸的化学性质。
⑶饱和一元脂肪酸同系物的组成及性质递变。
⑷乙酸的组成、乙酸的酸性和酯化反应。
教学难点:⑴乙酸的分子结构;⑵乙酸的化学性质。
⑶饱和一元脂肪酸同系物的组成及性质递变。
⑷乙酸的组成、乙酸的酸性和酯化反应。
教学用品:结构模型、实验用品教学过程:新课引入[思考与讨论]⑴我们的饮食烹调中,有一种必不可少的调味品,它是什么?⑵你知道酒为什么有香味呢?为什么酒越陈越香呢?⑶为什么有“好酒酿成醋”一说呢?引入:从今天起,我们将一起来探讨这些话题。
新课进行[板书]一、乙酸[展示]乙酸的样品,观察乙酸的性状。
[强调] 乙酸又叫醋酸,食醋的主要成份。
乙酸是有强烈刺激性气味的无色液体。
沸点117.8℃,熔点16.6℃,能够形成像冰一样的无色晶体,所以无水乙酸又称冰醋酸,乙酸易溶于水和乙醇。
(能形成氢键)。
常见的调味品食醋中,约含有3%~5%的乙酸。
[展示] 乙酸的结构模型[观察与思考] 乙酸的分子式、最简式、结构式、结构简式。
[板书] C2H4O2、“CH2O”、、CH3COOH。
[强调] 官能团—COOH 羧基[思考与讨论] 醋酸是强酸还是弱酸?醋酸是否具有酸的通性?[交流与表达]1、乙酸的酸性①乙酸能使紫色石蕊试液变红②乙酸能与碳酸盐反应,生成二氧化碳气体利用乙酸的酸性,可以用乙酸来除去水垢(主要成分是CaCO3):2CH3COOH+CaCO3(CH3COO)2Ca+H2O+CO2↑乙酸还可以与碳酸钠反应,也能生成二氧化碳气体:2CH3COOH+Na2CO32CH3COONa+H2O+CO2↑上述两个反应都可以证明乙酸的酸性比碳酸的酸性强。
乙酸 羧酸 一、乙酸 羧酸1、 定义:分子中烃基(或氢原子)跟羧基()相连的化合物属于羧酸。
2、 物理性质:无色液体,易溶于水,随着碳原子数增多,水溶性降低。
具有弱酸性,随着碳原子数增多,酸性降低。
3、 饱和一元酸的通式_________________________ 二、乙酸(冰醋酸即无水乙酸) 1、 分子结构:分子式为___________,结构式为_______________,结构简式为_________________,俗称_______2、乙酸的化学性质 (1)酸性乙酸水溶液中存在以下电离方程式:CH 3COOH CH 3COO -+H +,故乙酸为弱酸,能体现酸的性质。
乙酸能与Na 、NaOH 、NaHCO 3、Na 2CO 3反应,酸性大于碳酸。
酸性比较:在某有机物A 的分子中,其结构简式如右图。
写出: A 跟NaOH 溶液反应的化学方程式是A 跟NaHCO 3溶液反应的化学方程式是A 在一定条件下跟Na 反应的化学方程式是:(2)酯化反应在一支试管中加入3 mL 乙醇,然后边摇动试管边慢慢加入2 mL 浓硫酸和2 mL 冰醋酸。
按图连接好装置用酒精灯小心均匀地加热试管3~5 min ,产生的蒸气经导管通到饱和的碳酸钠溶液的液面上。
可以看到碳酸钠饱和溶液的液面上有透明的油状液体产生,并可闻到香味。
生成乙酸乙酯的反应A 、这种有香味的无色透明油状液体就是乙酸乙酯,反应的化学方程式可以表示如下:+CH 3CH 2OH浓硫酸+H 2OCH 3COOH CH 3COOCH 2CH3反应类型:酯化反应(取代反应),反应规律:_______________________________酸和醇起作用,生成酯和水的反应叫做酯化反应,这里的酸是指像乙酸之类的有机酸和像硝酸之类的无机含氧酸。
如果用含氧的同位素188O 的乙醇与乙酸作用,请写出化学方程式:B 、乙酸乙酯是酯类化合物的一种,乙酸乙酯的密度约为0.9 g·cm -3,沸点77 ℃,易溶于乙醇等,微溶于水。