3.4 固液界面相互作用作用
- 格式:pdf
- 大小:830.69 KB
- 文档页数:51



第四节水环境中固—液界面的相互作用一、水中颗粒物的类别天然水中颗粒物主要包括各类矿物微粒,含有铝、铁、锰、硅水合氧化物等无机高分子,含有腐殖质、蛋白质等有机高分子。
此外还有油滴、气泡构成的乳浊液和泡沫、表面活性剂等半胶体以及藻类、细菌、病毒等生物胶体。
下面分别叙述天然水体中颗粒物的类别。
1、矿物微粒和粘土矿物天然水中常见矿物微粒为石英、长石、云母及粘土矿物等硅酸盐矿物。
石英(SiO2)、长石(KAlSi3O8)等不易碎裂,颗粒较粗,缺乏粘结性。
云母、蒙脱石、高岭石等粘土矿物则是层状结构,易于碎裂,颗粒较细,具有粘结性,可以生成稳定的聚集体。
天然水中具有显著胶体化学特性的微粒是粘土矿物。
粘土矿物是由其它矿物经化学风化作用而生成,主要为铝或镁的硅酸盐,它具有晶体层状结构,种类很多,可以按照其结构特征和成分加以分类。
2、金属水合氧化物铝、铁、锰、硅等金属的水合氧化物在天然水中以无机高分子及溶胶等形态存在,在水环境中发挥重要的胶体化学作用。
铝在岩石和土壤中是丰量元素。
但在天然水中浓度较低,一般不超过0.1mg/L。
铝在水中水解,主要形态是Al3+、Al(OH)2+、A12(OH)24+、Al(OH)2+、A1(OH)3,和Al(OH)4-等,并随pH值的变化而改变形态浓度的比例。
实际上,铝在一定条件下会发生聚合反应,生成多核配合物或无机高分子,最终生成[Al(OH)3]∞的无定形沉淀物。
铁也是广泛分布的丰量元素,它的水解反应和形态与铝有类似的情况。
在不Ⅲ的存在形态是Fe3+、Fe(OH)2+、Fe(OH)2+、Fe2(OH)24+和Fe(OH)3同pH值下,Fe()等。
固体沉淀物可转化为FeOOH的不同晶型物。
同样,它也可以聚合成为无机高分子和溶胶。
锰与铁类似,其丰度虽然不如铁,但溶解度比铁高,因而也是常见的水合金属氧化物。
硅酸的单体H 4SiO 4,若写成Si(OH)4,则类似于多价金属,是一种弱酸,过量的硅酸将会生成聚合物,并可生成胶体以至沉淀物。


固液界面化学反应机理固液界面化学反应是指在固液界面上进行的化学反应。
它具有重要的应用价值,如在能源转换、环境控制、材料制备、生命科学等领域。
固液界面化学反应的机理包括吸附、表面化学、界面扩散、反应动力学等多个方面。
一、吸附过程在固液界面化学反应中,吸附过程是首先发生的。
吸附是指分子或离子与一种固体表面相互作用以形成一个化学吸附层的过程。
吸附现象对于固液界面化学反应机理的研究至关重要。
吸附过程可以通过浸润实验和吸附等温线来研究。
具体而言,浸润实验是通过将液体缓慢滴入固体表面,观察其润湿情况来确定吸附现象。
而吸附等温线则是通过测量在一定温度下吸附剂与固体表面吸附的平衡浓度,获得吸附等温线。
二、表面化学表面化学是指化学在分界面或界面区域中发生的各种化学反应。
此处的“化学反应”包括化学键的形成与断裂、化学吸附等等。
这些反应很大程度上影响了固液界面的性质。
表面化学方法可以通过表面活性剂和表面电荷密度的研究来表征,也可以通过X射线光电子能谱等技术来研究。
三、界面扩散界面扩散是指在固液界面上,溶液中的物质从液相向固相的扩散过程。
固液界面中存在着液相分子和固相分子间的接触,因而使得溶液中的物质向固相扩散。
界面扩散过程对于固液界面化学反应过程的影响非常明显,因此,在固液界面化学反应论文中几乎都会涉及界面扩散。
四、反应动力学反应动力学是指化学反应过程中,反应物消耗或生成的速度以及化学反应机制的研究。
在固液界面化学反应中,反应动力学是研究液-固反应过程速率的一个方面。
它的研究旨在了解物质扩散和反应速率的规律,提高反应速率和反应效率并探究化学反应的机理。
总之,固液界面化学反应机理的研究对于理解固液界面交互作用、提高反应速率和效率以及探究化学反应机理方面具有重要的实用价值。
在固液界面化学反应的研究中,需要系统的考虑吸附、表面化学、界面扩散和反应动力学等多个方面。



固液界面效应
固液界面效应是一种在固体和液体间所促成的特殊交互过程。
即当液体与某种固体物质接触时,在两者间总会产生一层薄薄的界面带电层。
这种带电层为液体提供一层薄薄的保护,使液体具有更强的物质和热力学性质。
此外,固液界面效应尚可以保证环境温度稳定,进而实现液体的强有力清洁、抗污染及移动等等技术。
固液界面效应可说是一种有力且富有科学性的交互方式,其中物理、化学及生物等多种因素都有可能产生具有特殊性能的界面层。
而这种界面层受物理因素影响非常严重,它跟认知反应、化学反应、介质传输、活性物质扩散等机制有关,可以认为是多种实质因子交互的综合过程。
固液界面效应在当今的互联网行业中也有广泛的应用。
用户平台的安全性、动态性能、性能保证等等,都可能受到这一特定的界面效应的影响。
举例来说,在资源管理及其操作的过程中,固液界面效应的存在可以帮助确保用户的操作在形式和实际实施过程中受到最佳保护。
而在网络应用程序中,固液界面效应同样可以确保数据安全性、平滑及长久使用。
总之,固液界面效应具有多方面的应用,在互联网行业应运而生。
它所表现出的特殊性能,让整个互联网行业以及包括用户公司在内的实体行业给与了全新的交互传输机制及更贴近技术的可能性,从而使得对网络资源的管理更具有效率性。
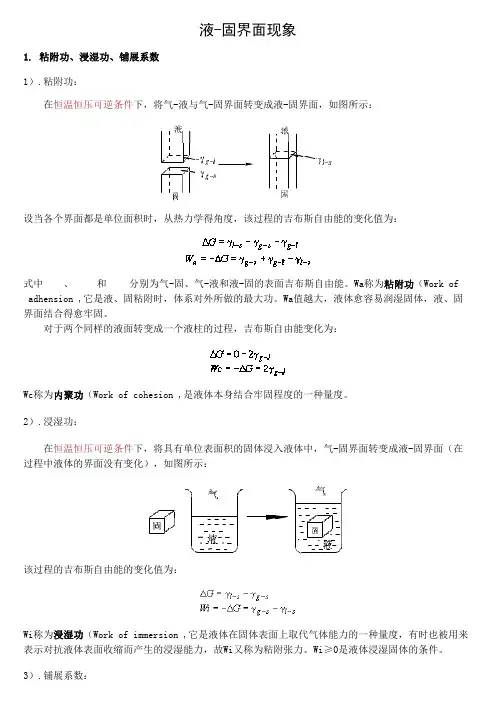
液-固界面现象1. 粘附功、浸湿功、铺展系数 1).粘附功: 在恒温恒压可逆条件下,将气-液与气-固界面转变成液-固界面,如图所示:设当各个界面都是单位面积时,从热力学得角度,该过程的吉布斯自由能的变化值为:式中 、 和 分别为气-固、气-液和液-固的表面吉布斯自由能。
Wa称为粘附功(Work of adhension),它是液、固粘附时,体系对外所做的最大功。
Wa值越大,液体愈容易润湿固体,液、固 界面结合得愈牢固。
对于两个同样的液面转变成一个液柱的过程,吉布斯自由能变化为:Wc称为内聚功(Work of cohesion),是液体本身结合牢固程度的一种量度。
2).浸湿功: 在恒温恒压可逆条件下,将具有单位表面积的固体浸入液体中,气-固界面转变成液-固界面(在 过程中液体的界面没有变化),如图所示:该过程的吉布斯自由能的变化值为:Wi称为浸湿功(Work of immersion),它是液体在固体表面上取代气体能力的一种量度,有时也被用来 表示对抗液体表面收缩而产生的浸湿能力,故Wi又称为粘附张力。
Wi≥0是液体浸湿固体的条件。
3).铺展系数:铺展过程是表示当液-固界面在取代气-固界面的同时,气-液界面也扩大了同样的面积,如图所 示:在恒温恒压下可逆铺展一单位面积时,体系吉布斯自由能的变化值为:式中S称为铺展系数(Spreading coefficient),当S≤0时,液体可以在固体表面自动铺展。
2. 接触角与润湿作用 1).接触角 设液体在固体表面上形成液滴,形成如下图所示的液滴到达平衡时,在气、液、固三相交界处,气-液界面和固-液界面之间的夹角称为接触角(contact angle),用θ表示。
它实际是液体表面张力 和液-固界面张力 间的夹角。
接触角的大小是由在 气、液、固三相交界处,三种界面张力的相对大小所决定的。
从接触角的数值可看出液体对固体润湿 的程度。
2).润湿作用: 当 、 和 达平衡时以下关系:上述方程称为杨(Young)方程。


液滴与固体界面相互作用的研究引言液滴与固体界面相互作用是一项重要的科研领域,涉及到物理、化学、材料等多个学科的知识。
液滴在生物、医药、化工等各个领域都有广泛的应用,理解液滴与固体界面的相互作用对于优化液滴的性质和应用具有重要意义。
本文将介绍液滴与固体界面相互作用的研究进展,包括液滴在固体界面上的接触角、表面张力、液滴形状变化等方面的研究结果。
液滴接触角的测量接触角是描述液滴与固体界面相互作用的重要参数之一,它可以反映液滴在固体界面上的稳定性和亲水性/疏水性。
目前有许多方法可以测量液滴接触角,其中最常用的是联系角和静态接触角测量法。
联系角联系角是定义在液滴、气体和固体三相交界处的一个角度,可以用来表征液滴在固体界面上的稳定性。
接触角越小,表示液滴对固体的亲水性越好;接触角越大,表示液滴对固体的疏水性越好。
液滴与固体界面的相互作用可以通过联系角来描述,因此联系角的测量成为研究液滴与固体界面相互作用的重要手段之一。
静态接触角测量法静态接触角测量法是一种常用的测量液滴接触角的方法,它基于液滴在接触固体界面时的几何形状和物理特性。
静态接触角可以通过液滴与固体界面相互作用的平衡状态来测量和计算。
液滴在固体界面上的尺寸和形状可以通过高精度的显微镜观察和图像处理技术来测量,从而确定液滴的接触角。
静态接触角的测量方法需要考虑液滴的形状、表面张力、液滴与固体界面之间的相互作用等因素,因此需要进行详细的实验设计和数据处理。
表面张力的影响液滴的表面张力是液滴与固体界面相互作用的另一个重要参数。
表面张力是液体分子之间的相互作用力,它决定了液滴在固体界面上的形状和稳定性。
表面张力的大小取决于液体的种类、温度和压力等因素,同时也受到固体界面的影响。
表面张力对液滴的接触角、液滴的形状和液滴在固体界面上的运动等方面都有重要影响。
影响因素表面张力受到多个因素的影响,包括液体的种类、温度、压力等因素。
不同种类的液体具有不同的表面张力特性,如水和油的表面张力就有明显的差异。
流体动力学中的液体固体相互作用在流体动力学中,液体与固体之间的相互作用是一个重要的研究领域。
液体固体相互作用涉及到表面张力、接触角、浸润等现象,对于液体的行为和固体的运动具有重要的影响。
1. 表面张力表面张力是液体分子间相互作用力在液体表面上所表现出的特性。
液体表面上的分子受到向内的引力而被拉紧形成一个薄薄的膜层。
这种张力使得液滴呈现出形状上的特殊性质,如球形、立体或扁平等。
表面张力的大小与液体的性质以及温度有关。
2. 接触角接触角是液体与固体接触界面上所形成的一种角度。
对于液体滴在固体表面上的接触情况,接触角描述了液滴与固体之间的接触性质。
当液体与固体之间的相互作用较强时,接触角较小,液滴完全展开在固体表面上;而当液体与固体之间的相互作用较弱时,接触角较大,液滴无法完全展开。
3. 浸润浸润是指液体在固体上的渗透现象。
当液滴与固体表面无法完全展开时,液体分子与固体分子之间存在一定的几何不匹配。
这种几何不匹配会导致液滴无法浸润固体表面,而形成一定的接触角。
4. 液体固体相互作用的应用液体固体相互作用在现实生活中有着广泛的应用。
例如,润滑油的使用就依赖于液体与固体之间的相互作用。
润滑油能够在机械零件表面形成一个润滑膜,减少摩擦力和磨损。
另外,液体固体相互作用还在纳米科技中发挥着重要作用。
纳米材料的表面性质常常由液体在其上的浸润程度所决定。
因此,对于液体固体相互作用的研究能够帮助优化纳米材料的性能。
此外,液体固体相互作用还在颗粒分离和沉降等工艺中起到重要的作用。
液体与固体之间的相互作用能够让固体颗粒在液体中沉降,从而实现物料的分离和纯化。
总之,流体动力学中的液体固体相互作用是一个复杂而重要的研究领域。
通过理解表面张力、接触角和浸润等现象,我们可以更好地掌握液体与固体之间的相互作用机制,并将其应用于各个领域,从而促进科技进步和工艺改进。
固液界面自由能
固液界面自由能是指固体和液体之间的界面自由能,也称为表面能、表面自由能或表面能量。
它是固体和液体之间的能量差,它可以用来描述固体和液体表面之间的能量交互。
它是一种物理量,它代表了固体和液体之间的界面能量。
固液界面自由能可以描述不同物质之间的相互作用,它可以反映出固体和液体之间的接触面积和界面能量。
它可以用来识别出不同物质之间的动力学相互作用,以及描述其自然表面的性质。
固液界面自由能是一种动能,它可以用来描述受温度和压力影响的固体和液体界面的形态变化,从而产生更多的理论研究和应用。
固液界面自由能的应用非常广泛,它可以用来研究固体和液体之间的能量交换,以及它们之间的相互作用。
它也可以用来研究固体表面的表面张力和润湿性,以及固体表面的胶结作用。
它还可以用来研究固体表面的抗腐蚀性和耐温性,以及不同固体表面的结构和性质。
固液界面自由能还可以用来研究不同液体之间的润湿性和胶结作用,以及液体拓扑结构的形成。
固液界面自由能是一种物理量,它可以用来描述固体和液体之间的能量交换和相互作用。
它可以用来研究液体的润湿性、胶结作用以及固体表面的表面张力和抗腐蚀性,以及不同固体表面的结构和性质。
它也可以用来研究不同液体之间的润湿性和胶结作用,以及液体拓扑结构的形成。
因此,固液界面自由
能可以作为一种重要的物理和化学工具,用于研究和识别固体和液体之间的能量交换和相互作用,以及液体的润湿性、胶结作用以及固体表面的表面张力和抗腐蚀性。
水环境化学水环境化学第二章天然水的性质和组成第三章水环境中无机污染物的迁移转化第四章水环境中有机污染物的迁移转化第五章水体污染物化学第四节3.4.1 3.4.2 3.4.3 3.4.4水中不同相间的化学、物理、生物过程3.4.1 水中颗粒物的类别矿物微粒和粘土矿物金属水合氧化物腐殖质水体悬浮沉积物其它¾矿物微粒主要指硅酸盐矿物,其中:石英(SiO 2)、长石(KAlSi 3O 8)等矿物微粒颗粒粗、不易碎裂,缺乏粘结性。
¾粘土矿物(云母、蒙脱石、高岭石)铝镁的硅酸盐,由其他矿物经化学风化而成,具有晶体层状结构、有粘性、具有胶体性质,可以生成稳定的聚集体。
¾铝、铁、锰、硅等金属的水合氧化物在天然水中以无机高分子及溶胶等形态存在,在水环境中发挥重要的胶体化学作用。
¾所有的金属水合氧化物都能结合水中微量物质,同时其本身又趋向于结合在矿物微粒和有机物的界面上。
¾腐殖质是一种带负电的高分子弱电解质,其形态构型与官能团的离解程度有关。
¾在pH值较高的碱性溶液中或离子强度低的条件下,羟基和羧基大多离解,沿高分子呈现的负电荷相互排斥,构型伸展,亲水性强,因而趋于溶解。
¾在pH值较低的酸性溶液中,或有较高浓度的金属阳离子存在时,各官能团难于离解而电荷减少,高分子趋于卷缩成团,亲水性弱,因而趋于沉淀或凝聚。
¾天然水体中各种环境胶体物质往往并非单独存在,而是相互作用结合成为某种聚集体(水中悬浮沉积物),它们可以沉降进入水体底部,也可重新再悬浮进入水中。
¾悬浮沉积物的结构组成并不是固定的,它随着水质和水体组成物质及水动力条件而变化。
¾悬浮沉积物是以矿物微粒,特别是粘土矿物为核心骨架,有机物和金属水合氧化物结合在矿物微粒表面上,成为各微粒间的粘附架桥物质,把若干微粒组合成絮状聚集体,经絮凝成为较粗颗粒而沉积到水体底部。
胶体的表面电荷(1)表面化学反应酸性介质中12()()()()()n n M OH s H M OH H O s ++−+→碱性介质中1()()()()n n M OH s MO OH s H −+−→+碱性介质中12()()n M OH H O +−1()n MO OH −−=聚凝该pH 发生的情况称为等电点或零电荷点(ZPC ,Zero Point of Charge )。
pH ZPC 对不同金属氧化物有不同数值,而且每种氧化物均是常数,与溶液中非电位离子的浓度无关。
水体中常见物质的pHzpc(2)离子吸附胶体颗粒通过离子吸附能够得到电荷,这种现象包含离子粘附在胶体表面,通过氢键或范德华力相互作用过程,但这里没有形成常规的共价键。
(3)离子置换在一些粘土矿物中,SiO2是一基本化学单元,用Al(Ⅲ)取代晶格中一些,生成一个净带负荷的位置。
[SiO2]+Al(Ⅲ)→[Al O-2]+ Si(Ⅳ)永久电荷双电层模型胶体表面存在电荷后,使溶液中界面区域内的电荷分布被扰乱而形成局部的不均等分布,由此构成双电层。
((1)双电层平板电容器模型(亥姆霍兹双电层模型)要点:A :正负离子整齐地排列于界面层的两侧。
B :正负电荷分布的情况就如同平行板电容器那样。
(2) 扩散双电层的模型要点:①由于静电吸引作用和热运动,靠近固体表面的反离子呈扩散状态分布在溶液中,并非整齐地排列在一个平面上。
②紧靠固体表面过剩的反离子浓度最大,相应的固体表面上的电势φ即为热力学电势。
(3)斯特恩双电层模型①紧靠固体表面形成一个固定的吸附层,称为固定层或斯特恩层。
②被吸附的反离子的中心构成的平面称为斯特恩面。
③在斯特恩面层以外,反离子呈扩散分布,构成扩散层。
④当固、液两相发生相对移动时,紧密层中吸附在固体表面的反离子和溶剂分子与质点作为一个整体一起运动,滑动面与溶液本体之间的电势差,称为ξ电势。
热力学电势ф:固体表面与溶液本体间的电势差斯特恩电势фδ:斯特恩面同溶液本体之间的电势差ξ电势:滑动面与溶液本体之间的电势差斯特恩双电层= 固定层+扩散层3.4.2 胶体颗粒的性质Stern 提出由紧靠界面的固定层和分散分布的扩散层构成的模型(S 型),即是用一个假想的分界面来划分双电层的水中部分。
静电静电,扩散静电,扩散,溶剂化,质子的体积影响胶体在水中稳定存在的因素•静电斥力:带相同电荷的胶粒产生静电斥力,而且ξ电位愈高,胶粒间的静电斥力愈大;•布朗运动:受水分子热运动的撞击,使微粒在水中作不规则的运动,即“布朗运动”;•范德华引力:胶粒之间还存在着相互引力——范德华引力。
范德华引力的大小与胶粒间距的2次方成反比,当间距较大时,此引力略去不计。
胶体在水中稳定存在的原因•静电斥力vs.范德华引力:一般水中的胶粒ζ电位较高。
其互相间斥力不仅与ξ电位有关,还与胶粒的间距有关,距离愈近,斥力愈大。
而布朗运动的动能不足以将两颗胶粒推近到使范德华引力发挥作用的距离。
因此,胶体微粒不能相互聚结而长期保持稳定的分散状态。
•水化膜阻力:由于胶粒带电,将极性水分子吸引到它的周围形成一层水化膜。
水化膜同样能阻止胶粒间相互接触。
但是,水化膜是伴随胶粒带电而产生的,如果胶粒的电位消除或减弱,水化膜也就随之消失或减弱。
3.4.2 胶体颗粒的性质胶体粒子的凝聚絮凝借助于某种架桥物质,通过化学键联结胶体粒子,使凝结的粒子变得更大。
聚沉外来因素(如化学物质)作用下降低静电斥力,从而使胶粒合在一起。
胶体粒子的凝聚压缩双电层胶体粒子的双电层结构决定了在胶体表面处反离子浓度最大,随着胶粒表面向外的距离呈递减分布,最终与溶液中离子浓度相等。
当向溶液中投加电解质,使溶液中离子浓度增高,则扩散层的厚度将减小。
该过程实质是加入的反离子与扩散层原有的反离子之间的静电斥力把原有部分反离子挤压到吸附层中,从而使扩散层厚度减小。
当两个胶粒相互接近,由于扩散层厚度减小,ξ电位降低,因此它们之间的斥力就减小了,也就是溶液中离子浓度高的胶粒间斥力比离子浓度低的要小。
胶粒间的吸力不受水的组成影响,但由于扩散层变薄,它们相撞的距离减少,这样相互间的吸力变大,其排斥与吸引的合力由斥力为主变为以引力为主(排斥势能消失了),胶粒得以迅速凝聚。
胶体粒子的凝聚沉淀物网捕及卷扫某些高价金属盐类作为水处理药剂,在投加量较大时会迅速沉淀产生金属氢氧化物或金属碳酸盐,水中的胶粒和细微悬浮物可被这些沉淀物在形成时作为晶核或吸附质所网捕。
已发生凝聚的絮凝体,在沉降过程中以其巨大的表面吸附卷扫其他胶体,生成更大的絮团。
3.4.3 水环境中颗粒物的吸附作用固体表面的吸附作用表面吸附离子交换吸附专属吸附¾胶体具有巨大的比表面和表面能,因此固液界面存在表面吸附作用,胶体表面积愈大,所产生的表面吸附能也愈大,胶体的吸附作用也就愈强,它是属于一种物理吸附。
•分子间力(范德华力)引起•没有选择性•放热较小•多分子层吸附•吸附剂的比表面积和细孔分布影响大¾环境中大部分胶体带负电荷,容易吸附各种阳离子¾物理化学吸附。
这种吸附是一种可逆反应,而且能够迅速地达到可逆平衡。
该反应不受温度影响,在酸碱条件下均可进行,其交换吸附能力与溶质的性质、浓度及吸附剂性质等有关。
对于那些具有可变电荷表面的胶体,当体系pH高时,也带负电荷并能进行交换吸附。
¾吸附过程中,除了化学键的作用外,尚有加强的憎水键和范德华力或氢键在起作用。
¾在水环境中,配合离子、有机离子、有机高分子和无机高分子的专属吸附作用特别强烈。
¾水合氧化物胶体对重金属离子有较强的专属吸附作用,吸附发生在胶体双电层靠近表面的Stern层中,被吸附的金属离子进入Stern层后,不能被通常提取交换性阳离子的提取剂提取,只能被亲和力更强的金属离子取代,或在强酸性条件下解吸。
负电荷减少,正电荷增加无对表面电荷的影响内层扩散层吸附发生的位置>或≤零电位点>零电位点发生吸附时要求体系的pH 值3.4.3 水环境中颗粒物的吸附作用吸附等温线和等温式水体中颗粒物对溶质的吸附是一个动态平衡过程,在固定的温度条件下,当吸附达到平衡时,颗粒物表面上的吸附量(G)与溶液中溶质平衡浓度(C)之间的关系,可用吸附等温线来表达。
Henry型Freundlich型Langmuir型式中 a ,B ——常数;Cs ——吸附质饱和浓度,mg/LCe ——平衡浓度,mg/L 。
[]1)(Ce/Cs)-(B 1Ce)-(Cs +验温度下液体的饱和蒸汽压,是相当于在固体表面上铺满单分子层时被吸附气体在标准状态下的体积,是与吸附热有关的常数。
∞V C¾颗粒物对重金属的吸附量随pH 值升高而增大。
当溶液pH 超过某元素的临界pH 值时,则该元素在溶液中的水解、沉淀起主要作用。
重金属的临界pH 值和最大吸附量10BpH G A C =i i¾颗粒物对重金属的吸附量随粒度增大而减少;当溶质浓度范围固定时,吸附量随颗粒物浓度增大而减少。
3.4.3 水环境中颗粒物的吸附作用氧化物表面吸附的配合模式2MeOH MeOH H ++≡≡+ 12{}[]{}sa MeOH H K MeOH ++≡=≡MeOH MeO H−+≡≡+ 2{}[]{}sa MeO H K MeOH −+≡=≡氧化物表面吸附的配合模式(1)z z MeOH M MeOM H +−++≡+≡+ 1sK ∗(2)22()2z z MeOH M MeO MH +−++≡+≡+ 2s β∗(1)z z MeOH A MeA OH −−−−≡+≡+ 1sK (2)22()2z z MeOH A Me A OH −−−−≡+≡+ 2s β•表面配合模式的实质内容就是把具体表面看作一种聚合酸,其大量羟基可以产生表面配合反应,但在配合平衡过程中需将邻近基团的电荷影响考虑在内。
氧化物表面吸附的配合模式•求定表面配合常数是比较复杂而精密的实验与计算过程。
3.4.4 沉积物中重金属的释放•盐浓度升高碱金属和碱土金属阳离子可将被吸附在固体颗粒上的金属离子交换出来,这是金属从沉积物中释放出来的主要途径之一。
•氧化还原条件的变化在湖泊、河口及近岸沉积物中一般均有较多的耗氧物质,使一定深度以下沉积物中的氧化还原电位急剧降低,并将使铁、锰氧化物可部分或全部溶解,故被其吸附或与之共沉淀的重金属离子也同时释放出来。
3.4.4 沉积物中重金属的释放•降低pH值pH值降低,导致碳酸盐和氢氧化物的溶解,H+的竞争作用增加了金属离子的解吸量。
•增加水中配合剂的含量天然或合成的配合剂使用量增加,能和重金属形成可溶性配合物,有时这种配合物稳定度较大,可以溶解态形态存在,使重金属从固体颗粒上解吸下来。
本章基本要求•了解天然水体中存在哪些胶体物质以及胶体物质的性质;•掌握颗粒物在水环境中的吸附作用和吸附机理;•了解影响沉积物中重金属释放的因素。