九年级化学溶液浓稀的表示
- 格式:pdf
- 大小:1.42 MB
- 文档页数:9


2018年秋九年级化学下册第七章溶液7.3 溶液浓稀的表示7.3.1 溶质的质量分数及其简单计算实验(新版)粤教版编辑整理:尊敬的读者朋友们:这里是精品文档编辑中心,本文档内容是由我和我的同事精心编辑整理后发布的,发布之前我们对文中内容进行仔细校对,但是难免会有疏漏的地方,但是任然希望(2018年秋九年级化学下册第七章溶液7.3 溶液浓稀的表示7.3.1 溶质的质量分数及其简单计算实验(新版)粤教版)的内容能够给您的工作和学习带来便利。
同时也真诚的希望收到您的建议和反馈,这将是我们进步的源泉,前进的动力。
本文可编辑可修改,如果觉得对您有帮助请收藏以便随时查阅,最后祝您生活愉快业绩进步,以下为2018年秋九年级化学下册第七章溶液7.3 溶液浓稀的表示7.3.1 溶质的质量分数及其简单计算实验(新版)粤教版的全部内容。
7.3 溶液浓稀的表示第1课时溶质的质量分数及简单计算探究点一溶液的浓度[情景展示]观察不同浓度硫酸铜溶液的颜色(如图):[问题探究]有色溶液的颜色深浅与溶液的浓稀是否有关?我们如何来定量地表示溶液的浓度呢?[思考交流] ___________________________________________________________________________________________________________________________________[归纳提升]有色溶液颜色的深浅,可粗略地反映溶液的浓稀。
溶液的浓度越大,有色溶液颜色越深;浓度越小,有色溶液颜色越浅.但是,要准确地解决有色及无色溶液的浓稀问题,我们就要用溶液的浓度来定量表示。
溶液的浓度就是溶质的质量分数,即一定量的溶液中所含溶质的量(溶质质量与溶液质量之比).[课堂速记] _____________________________________________________________________________________________________________________________________________探究点二有关溶液稀释问题的计算[情景展示]向一定量的水中加入一定量的98%的浓硫酸,或加入一定溶质质量分数的稀硫酸可得到另一种溶质质量分数的稀硫酸。


初中化学溶液的稀释计算及浓度的表示方法溶液的稀释是化学实验中常见的操作,它是将一定体积的浓溶液加入适量的溶剂,使其体积增大而浓度降低的过程。
溶液的浓度决定着其中溶质的含量,对于化学反应的进行和实验的准确性具有重要影响。
本文将介绍溶液的稀释计算方法和常见的浓度表示方法。
一、溶液的稀释计算方法溶液的稀释计算需要使用到稀释定律,即初始溶液的浓度与最终溶液的浓度及体积之间的关系。
稀释定律的数学表达式为:C1V1 = C2V2其中,C1为初始溶液的浓度,V1为初始溶液的体积,C2为最终溶液的浓度,V2为最终溶液的体积。
通过这个公式,我们可以推导出浓度和体积的关系:V2 = (C1V1) / C2这个公式表明,最终溶液的体积等于初始溶液的浓度乘以初始溶液的体积,再除以最终溶液的浓度。
以一个具体的例子来说明溶液的稀释计算。
例:某试剂浓度为0.2 mol/L,需制备100 mL浓度为0.05 mol/L的溶液,该如何操作?解:根据稀释定律,可以写出等式:0.2 mol/L × V1 = 0.05 mol/L × 100 mL通过变换单位,将体积V1由升转换为毫升:0.2 mol/L × V1 = 0.05 mol/L × 100 mL0.2 mol/L × V1 = 0.05 mol/L × 0.1 LV1 = (0.05 mol/L × 0.1 L) / 0.2 mol/LV1 = 0.025 L = 25 mL因此,需要取出25 mL试剂加入到适量的溶剂中,制备出100 mL 浓度为0.05 mol/L的溶液。
二、浓度的表示方法浓度表示的是单位体积内的溶质含量。
在化学实验中,常见的浓度表示方法有质量浓度、摩尔浓度和体积浓度。
1. 质量浓度(C):它表示单位体积溶液中溶质质量的多少,其数学表达式为:C = m/V其中,C为质量浓度,m为溶质的质量(单位为克),V为溶液的体积(单位为升)。


7.3溶液浓稀的表示学情分析1.本节教材从溶液的浓稀引出浓度的概念,说明日常生活中浓稀的说法不能准确的表明溶液里溶质的含量,生产中必须把溶液的浓稀水准给以数量的含义。
通过溶液的浓度的知识引导学生从定量的方面去理解溶液组成,是溶液知识的深化,也是在溶液、溶质、溶剂、溶解度等概念基础上的又一重要的化学计算,它能协助学生加深相关概念的理解,提升学生的化学计算水平,也为高中学习物质的量浓度做好坚实的基础。
2.我们的学生是农村学生,寒假在家过春节受到村子打工者的各种影响,刚从寒假回校,对学生教学要有耐心,多做思想教育工作,给他们以学习的信心。
教学目标知识与技能目标:1.明确溶液浓度的含义。
2.理解溶解度与溶质分数的区别与联系。
过程与方法目标:1.掌握溶液浓稀的一种定量表示方式——溶质的质量分数,能实行简单的溶质质量分数的计算。
2.初步学会配置一定溶质质量分数的溶液。
3.能实行关于溶质质量分数的简单计算。
情感态度价值观目标:通过溶液涵义的讲解和相关溶质质量分数的计算水平的培养,实行实事求是的科学态度的教育。
教学重点1.溶质质量分数的概念及其计算。
2.配制一定溶质质量分数的溶液。
教学难点溶解度与溶质质量分数的区别与联系。
教学课时3课时教学过程第一课时[板书]7.3溶液浓稀的表示[引言]某一溶液浓或稀到什么水准?用定量的方法表达出来,这就是通常说的“浓度”。
溶液的浓度有很多种表达方式,现在我们学习其中一种———溶质的质量分数。
[实验7-7]引导学生完成实验,比较蓝色的深浅,阅读课文,完成DEF三支试管内相关猜测的计算。
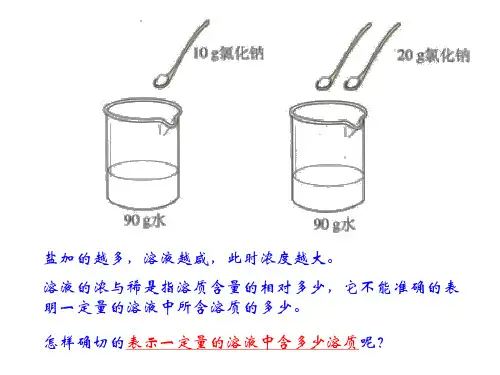
[自学]课文204-205[小组合作思考讨论]1.什么叫溶液的浓度?2.溶质质量分数是溶液浓度的一种方式,它是怎么样表示的?3.溶液的溶质质量分数有物理量单位吗?它能单独表明溶质的溶解量是多少吗?[讨 论]溶解度与溶质的质量分数有何区别?在常温下能否配制35%的氯化钠溶液?为什么?(实行小组讨论P206“讨论与交流”的两道题)[板 书]一.溶液的浓度1. 溶液浓稀水准(浓度)是指溶质质量所占溶液质量的相对多少。




溶质质量分数计算中的十字交叉法在浓溶液里加入水将它稀释为稀溶液,称为溶液的稀释。
在浓溶液里加入含有相同溶质的稀溶液,称为溶液的混合。
在溶液稀释与溶液混合的过程中,溶液中溶质的质量分数变了,但稀释前浓溶液里所含溶质的质量与稀释后稀溶液里所含溶质的质量相等;混合溶液中溶质的质量等于浓溶液中溶质质量与稀溶液中溶质质量之和。
抓住这一点,就抓住了这类计算的关键。
其实溶液的稀释也可以看作是溶液的混合,即把水看作是溶质质量分数为0%的稀溶液。
这样就可以合并成为一个问题来讨论了。
有关溶液混合的计算公式是:m(浓)×c%(浓)+m(稀)×c%(稀)= m(混)×c%(混),由于m(混)=m(浓)+m(稀),上式也可以写成:m(浓)×c%(浓)+m(稀)×c%(稀)= [m(浓)+m(稀)]×c%(混)此式经整理可得:m(浓)×[c%(浓)-c%(混)]=m(稀)×[c%(混)-c%(稀)]这个计算式也可以写成十字交叉图式,即利用这个十字交叉图式,可以比较简单地进行有关溶液混合的计算。
若进行溶液的稀释时把c(稀)视为水,把c(稀)中溶质的质量分数视为0%即可。
用十字交叉法解题过程可分为以下4步:(l)设出要求的未知数。
(2)把有关数据对号入座。
浓溶液的质量写在c(浓)的左方,稀溶液的质量写在c(稀)的左方,将c(浓)-c(混)、c(混)-c(稀)所得的差写在各自的右方,并用虚线画上方框。
(3)取四角虚线方框内的数值列成比例式。
(4)解比例式。
例如:将52%的KOH溶液与42%的KOH溶液以怎样的质量比混合,才能得到50%的KOH溶液?【解】设需52%的KO H的质量为x,需42%的KOH的质量为y【答】52%的KOH溶液与42%的KOH溶液的质量比为4∶l。