有关铁的化学方程式(答案)
- 格式:docx
- 大小:20.44 KB
- 文档页数:6

铁及其化合物的化学方程式和离子方程式答案铁及其化合物的化学方程式和离子方程式总结铁是一种常见的金属元素,它在不同条件下可以与氧气、氯气、硫、水蒸气等反应。
其中,铁在氧气中燃烧的化学方程式为3Fe+2O2→2Fe3O4,而在氯气中燃烧的方程式为2Fe+3Cl2→2FeCl3.此外,常温条件下铁锈的形成是由4Fe+3O2+2H2O→2Fe2O3·H2O引起的。
氧化亚铁是铁的一种氧化物,它也可以与一氧化碳、铝粉等物质发生反应。
例如,氧化亚铁在空气中加热会发生6FeO +O2→2Fe3O4的反应,而与一氧化碳高温反应的方程式为FeO+CO→Fe+CO2.此外,氧化亚铁与铝粉在高温下反应的方程式为3FeO+2Al→Al2O3+3Fe。
铁和硫的共热反应的方程式为Fe+S→FeS,而铁和水蒸气在高温条件下反应的方程式为3Fe+4H2O→Fe3O4+4H2.铁还可以与稀硫酸、浓硫酸、稀硝酸、浓硝酸等酸性物质反应,生成不同的产物和离子。
例如,铁与稀硫酸反应的方程式为Fe+H2SO4→FeSO4+H2↑,而少量的铁与浓硝酸共热的方程式为Fe+6HNO3(浓)→Fe(NO3)3+3NO2↑+3H2O。
需要注意的是,有些段落中出现了格式错误和明显有问题的内容,需要删除或修改。
例如,第10段中的化学方程式和离子方程式之间的符号错误,需要进行修改。
铁的化学性质1.氢氧化亚铁与浓硫酸反应,生成二价铁离子和二氧化硫气体,反应式为:2Fe(OH)2 + 4H2SO4 → Fe2+ + 2H2O +4SO2↑。
2.氢氧化亚铁与浓硝酸反应,生成二价铁离子和一氧化氮气体,反应式为:Fe(OH)2 + 4HNO3 → Fe2+ + 2NO↑ + 3H2O。
3.氢氧化亚铁与稀硝酸反应,生成二价铁离子和一氧化氮气体,反应式为:3Fe(OH)2 + 10HNO3 → 3Fe2+ + 2NO↑ +8H2O。
4.氢氧化亚铁在空气中被氧化,生成三价铁离子和水,反应式为:4Fe(OH)2 + O2 + 2H2O → 4Fe3+ + 4OH^-。

铁与稀盐酸燃烧的化学方程式
铁与稀盐酸燃烧是一种常见的化学反应,它的化学方程式为:Fe + 2HCl → FeCl2 + H2。
铁是一种金属元素,它是一种稳定的物质,在室温下不会自发燃烧。
稀盐酸是一种强酸,它具有很强的氧化性,可以将铁氧化,使其发生燃烧反应。
当铁与稀盐酸混合时,稀盐酸会将铁氧化,使其发生燃烧反应,产生氢气和氯化铁。
氢气是一种无色无味的气体,它是一种极易燃烧的气体,可以用来制造火焰。
氯化铁是一种淡黄色的晶体,它是一种极易溶于水的盐,可以用来制造漂亮的色彩。
铁与稀盐酸燃烧是一种常见的化学反应,它可以用来制造火焰和漂亮的色彩,是一种有趣的化学实验。
但是,由于稀盐酸是一种强酸,它会对人体造成伤害,因此在实验时应注意安全。

初中化学方程式大全1.镁在空气中燃烧:2.铁在氧气中燃烧:3.铜在空气中受热:4.铝在氧气中燃烧:5.氢气在空气中燃烧:6.红磷在空气中燃烧:7.硫粉在空气中燃烧:8.碳在充足的氧气中燃烧:9.碳在不充的氧气中燃烧:10.一氧化碳在氧气中燃烧:11.二氧化硫和氧气:12.二氧化碳和水反应:13.二氧化硫和水反应:14.三氧化硫和水反应:15.生石灰溶于水:16.二氧化碳通过灼热碳层:17.实验室用双氧水制氧气:18.加热高锰酸钾:19.水在直流电的作用下分解:20.碳酸不稳定易分解:21.高温煅烧石灰石:22.锌和稀硫酸23.铁和稀硫酸24.镁和稀硫酸25.铝和稀硫酸26.锌和稀盐酸27.铁和稀盐酸28.镁和稀盐酸29.铝和稀盐酸30.铁和硫酸铜溶液反应:31.锌和硫酸铜溶液反应:32.铜和硝酸银溶液反应:33.氧化铁和稀盐酸反应:34.氧化铁和稀硫酸反应:35.氧化铜和稀盐酸反应:36.氧化铜和稀硫酸反应:37.盐酸和烧碱起反应:38.盐酸和氢氧化钙反应:39.氢氧化铝药物治疗胃酸过多:40.硫酸和烧碱反应:41.硫酸和氢氧化钙反应:42.硝酸和烧碱反应:43.大理石与稀盐酸反应:44.碳酸钠与稀盐酸反应:45.碳酸氢钠与稀盐酸反应:46.硫酸和碳酸钠反应:47.硫酸和大理石反应:48.氢氧化钠与硫酸铜:49.氢氧化钙与硫酸铜:50.氢氧化钙与碳酸钠:51.氯化钙与碳酸钠:52.二氧化碳通过澄清石灰水(检验二氧化碳):53.氢氧化钠和二氧化碳反应(除去二氧化碳):54.苛性钠吸收二氧化硫气体:55.消石灰吸收二氧化硫:56.甲烷在空气中燃烧:57.一氧化碳还原氧化铁:58.一氧化碳还原四氧化三铁:59.植物的呼吸作用:60.植物的光合作用:初中化学方程式大全一、化合反应:(一)金属+氧气——金属氧化物1.镁在空气中燃烧:22 2 2.铁在氧气中燃烧:32O23O43.铜在空气中受热:22 2 4.铝在氧气中燃烧:43O222O3(二)非金属+氧气——非金属氧化物5.氢气在空气中燃烧:2H22 2H2O 6.红磷在空气中燃烧:45O2 2P2O5 7.硫粉在空气中燃烧:228.碳在充足的氧气中燃烧:229.碳在不充的氧气中燃烧:2C2 2(三)化合物+氧气10.一氧化碳在氧气中燃烧:222211.二氧化硫和氧气:222 23(四)非金属氧化物+水———酸12.二氧化碳和水反应:2223 13.二氧化硫和水反应:222314.三氧化硫和水反应:3224(五)金属氧化物+水———碱15.生石灰溶于水:2()2(六)其他16.二氧化碳通过灼热碳层:2 2二、分解反应17.实验室用双氧水制氧气:2H2O22H22↑18.加热高锰酸钾:24K2422↑19.水在直流电的作用下分解:2H2O2H2↑2↑ 20.碳酸不稳定易分解:H23H22↑21.高温煅烧石灰石:32↑三、置换反应(一)金属+ 酸——盐+ 氢气22.锌和稀硫酸2442↑23.铁和稀硫酸2442↑24.镁和稀硫酸2442↑25.铝和稀硫酸23H242(4)3+3H2↑26.锌和稀盐酸222↑27.铁和稀盐酸222↑28.镁和稀盐酸222↑29.铝和稀盐酸2623+3H2↑(二)金属单质+ 盐(溶液)——另一种金属+ 另一种盐30.铁和硫酸铜溶液反应:4431.锌和硫酸铜溶液反应:4432.铜和硝酸银溶液反应:23 (3)2+2四、复分解反应(一)金属氧化物+ 酸———盐+ 水33.氧化铁和稀盐酸反应:2O3+623+3H2O34.氧化铁和稀硫酸反应:2O3+3H242(4)3+3H2O35.氧化铜和稀盐酸反应:222O36.氧化铜和稀硫酸反应:2442O(二)酸+ 碱———盐+ 水37.盐酸和烧碱起反应:2O38.盐酸和氢氧化钙反应:2()22+2H2O39.氢氧化铝药物治疗胃酸过多:3()33+3H2O40.硫酸和烧碱反应:H24+224+2H2O41.硫酸和氢氧化钙反应:H24()24+2H2O42.硝酸和烧碱反应:332O(三)酸+ 盐———另一种酸+ 另一种盐43.大理石与稀盐酸反应:3+2222↑44.碳酸钠与稀盐酸反应: 23+2222↑45.碳酸氢钠与稀盐酸反应: 322↑46.硫酸和碳酸钠反应:23242422↑47.硫酸和大理石反应:324422↑(四)碱+ 盐———另一种碱+ 另一种盐48.氢氧化钠与硫酸铜:24()2↓2449.氢氧化钙与硫酸铜:()24()2↓450.氢氧化钙与碳酸钠:()2233↓+2(五)盐+ 盐———两种新盐51.氯化钙与碳酸钠:2233↓+2五、其他(一)非金属氧化物+ 碱———盐+ 水52.二氧化碳通过澄清石灰水(检验二氧化碳):()223↓2O 53.氢氧化钠和二氧化碳反应(除去二氧化碳):22232O 54.苛性钠吸收二氧化硫气体:22232O55.消石灰吸收二氧化硫:()223↓2O(二)其他56.甲烷在空气中燃烧:4+2O22+2H2O57.一氧化碳还原氧化铁:32O323258.一氧化碳还原四氧化三铁:43O4 34259.植物的呼吸作用:C6H12O6+6O262+6H2O60.植物的光合作用:62+6H26H12O6+6O2。

高考化学铁及其化合物综合练习题附答案一、高中化学铁及其化合物1.有一种埋在地下的矿物X(仅含四种元素),挖出后在空气中容易发黄,现探究其组成和性质,设计完成如下实验:请回答:(1)X的化学式_________________,挖出后在空气中容易发黄的原因______________。
(2)写出溶液分二等份,加KSCN无明显现象后,滴加双氧水的两个离子方程式:___________________,_________________。
【答案】Fe2(OH)2CO3或Fe(OH)2·FeCO3 +2价铁元素被空气氧化为+3价铁元素2Fe2++H2O2+2H+=2Fe3++2H2O Fe3++3SCN-= Fe(SCN)3【解析】【分析】⑴先计算分解生成的水的物质的量,再计算CO2的物质的量,根据现象得出含有亚铁离子并计算物质的量,根据比例关系得出化学式。
⑵滴加双氧水是Fe2+与H2O2反应生成Fe3+,Fe3+与3SCN-反应生成血红色。
【详解】⑴分解生成的水是1.8g,物质的量是0.1mol;无色无味气体是CO2,物质的量是0.1mol;黑色固体用稀硫酸溶解后分为两等分,滴加KSCN溶液没有实验现象,然后滴加双氧水变为血红色,则含有亚铁离子;另一份加入足量的氢氧化钠溶液得到沉淀,过滤洗涤并充分灼烧后得到8g固体,该固体是氧化铁,物质的量是0.05mol,其中铁元素的物质的量是0.1mol,则黑色固体中亚铁离子的物质的量是0.2mol,所以氧化亚铁是0.2mol,X中相当于含有0.1氢氧化亚铁和0.1mol碳酸亚铁,所以化学式为Fe2(OH)2CO3或Fe(OH)2·FeCO3,挖出后在空气中容易发黄的原因是+2价铁元素被空气氧化为+3价铁元素;故答案为:Fe2(OH)2CO3或Fe(OH)2·FeCO3;挖出后在空气中容易发黄的原因是+2价铁元素被空气氧化为+3价铁元素。

四氧化铁变成铁的化学方程式(一)
四氧化铁变成铁的化学方程式
在化学反应中,四氧化铁(Fe3O4)可以通过还原反应转化为铁(Fe)。
以下是几个相关的化学方程式及其解释:
1. 还原反应式
4Fe3O4 + 8H2 → 12Fe + 8H2O
在这个还原反应中,四氧化铁与氢气发生反应,产生纯铁和水。
这是一种常用的工业还原反应,常用于制备铁材料。
2. 反应解释
四氧化铁是一种黑色的固体,而铁是一种银灰色的金属。
通过向
四氧化铁中通入氢气,四氧化铁分子中的氧原子会被氢原子取代,生
成水分子。
同时,铁离子会被还原为原子状态,并聚集成金属铁。
这个反应过程可以看作是一种电子转移的过程。
氢原子失去电子
变为离子形式,而铁离子则接受这些电子,转变为铁原子。
这种电子
转移过程是化学反应的基础。
3. 实际应用
四氧化铁变成铁的反应对于铁的提取和制备具有重要意义。
工业
上常用该反应制备纯铁材料,用于制造各种铁制品,如钢铁、铁器等。
此外,该反应还被应用于环境治理。
四氧化铁广泛存在于自然界中,尤其是在土壤中。
通过还原反应,可以将四氧化铁转化为铁,达到修复污染土壤、净化环境的目的。
4. 总结
四氧化铁转化为铁的化学方程式是4Fe3O4 + 8H2 → 12Fe +
8H2O。
这个反应是一种还原反应,通过向四氧化铁中通入氢气,将氧原子还原为水分子,并将铁离子还原为金属铁。
这个反应在工业生产中具有重要作用,并且可以用于环境治理。
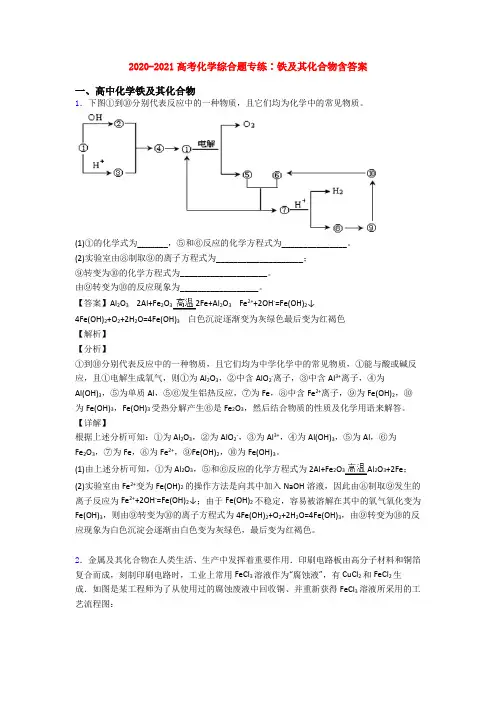
2020-2021高考化学综合题专练∶铁及其化合物含答案一、高中化学铁及其化合物1.下图①到⑩分别代表反应中的一种物质,且它们均为化学中的常见物质。
(1)①的化学式为_______,⑤和⑥反应的化学方程式为_______________。
(2)实验室由⑧制取⑨的离子方程式为____________________;⑨转变为⑩的化学方程式为____________________。
由⑨转变为⑩的反应现象为__________________。
【答案】Al2O3 2Al+Fe2O32Fe+Al2O3 Fe2++2OH-=Fe(OH)2↓4Fe(OH)2+O2+2H2O=4Fe(OH)3白色沉淀逐渐变为灰绿色最后变为红褐色【解析】【分析】①到⑩分别代表反应中的一种物质,且它们均为中学化学中的常见物质,①能与酸或碱反应,且①电解生成氧气,则①为Al2O3,②中含AlO2-离子,③中含Al3+离子,④为Al(OH)3,⑤为单质Al,⑤⑥发生铝热反应,⑦为Fe,⑧中含Fe2+离子,⑨为Fe(OH)2,⑩为Fe(OH)3,Fe(OH)3受热分解产生⑥是Fe2O3,然后结合物质的性质及化学用语来解答。
【详解】根据上述分析可知:①为Al2O3,②为AlO2-,③为Al3+,④为Al(OH)3,⑤为Al,⑥为Fe2O3,⑦为Fe,⑧为Fe2+,⑨Fe(OH)2,⑩为Fe(OH)3。
(1)由上述分析可知,①为Al2O3,⑤和⑥反应的化学方程式为2Al+Fe2O3Al2O3+2Fe;(2)实验室由Fe2+变为Fe(OH)2的操作方法是向其中加入NaOH溶液,因此由⑧制取⑨发生的离子反应为Fe2++2OH-=Fe(OH)2↓;由于Fe(OH)2不稳定,容易被溶解在其中的氧气氧化变为Fe(OH)3,则由⑨转变为⑩的离子方程式为4Fe(OH)2+O2+2H2O=4Fe(OH)3,由⑨转变为⑩的反应现象为白色沉淀会逐渐由白色变为灰绿色,最后变为红褐色。

铁及其化合物的化学方程式和离子方程式总结一、铁1、铁在氧气中燃烧:3Fe+2O22、铁在氯气中燃烧:2Fe+3Cl23、铁和硫共热:Fe+S4、铁与水蒸气在高温条件下反应:3Fe+4H2O5、铁与稀硫酸反应:Fe+H2SO4离:6、少量的铁与浓硫酸共热:2Fe+6H2SO4(浓)7、少量的铁与浓硝酸共热:Fe+6HNO3(浓)Fe+6H++3NO3-8、少量的铁与稀硝酸反应:Fe+4HNO3Fe+4H++NO3-9、过量的铁与稀硝酸反应:3Fe+8HNO33Fe+8H++2NO3-10、铁与硫酸铜溶液反应:Fe+CuSO4离:11、铁与氯化铁溶液反应:Fe+2FeCl3离:二、氧化亚铁1、氧化亚铁与一氧化碳高温反应:FeO+CO2、氧化亚铁与稀硫酸反应:FeO+H2SO4离:*3、氧化亚铁与浓硫酸反应:2FeO+4H2SO4(浓)*4、氧化亚铁与浓硝酸反应:FeO+4HNO3(浓)*5、氧化亚铁与稀硝酸反应:3FeO+10HNO3三、四氧化三铁1、四氧化三铁与铝粉高温下反应:8Al+3Fe3O42、四氧化三铁与一氧化碳高温下反应:Fe3O4+4CO3、四氧化三铁溶于稀盐酸:Fe3O4+8HClFe3O4+8H+四、氧化铁1、铝和氧化铁高温下反应:2Al+Fe2O32、一氧化碳和氧化铁高温下反应:Fe2O3+3CO3、氧化铁溶液稀盐酸:Fe2O3+6HClFe2O3+6H+*4、氧化铁与氢碘酸反应:Fe2O3+6HIFe2O3+6H++2I-五、氢氧化亚铁1、氢氧化亚铁与稀硫酸反应:Fe(OH)2+H2SO4Fe(OH)2+2H+2、氢氧化亚铁在空气中被氧化:4Fe(OH)2+O2+2H2O六、氯化亚铁1、氯化亚铁溶液中通入氯气:2FeCl2+Cl22FeCl32Fe2++Cl22Fe3++2Cl-*2、氯化亚铁溶液中加入溴水:6FeCl2+3Br24FeCl3+2FeBr32Fe2++Br22Fe3++2Br-3、氯化亚铁溶液中加入氢氧化钠溶液:FeCl2+2NaOH Fe(OH)2↓+2NaClFe2++2OH-Fe(OH)2↓4、氯化亚铁溶液中加入氨水:FeCl2+2NH3·H2O Fe(OH)2↓+2NH4ClFe2++2NH3·H2O Fe(OH)2↓+2NH4+5、氯化亚铁溶液中加入硫化钠溶液:FeCl2+Na2S FeS↓+2NaClFe2++S2-FeS↓七、氯化铁1、铁与氯化铁溶液反应:Fe+2FeCl33FeCl2Fe+2Fe3+3Fe2+2、铜和氯化铁溶液反应:Cu+2FeCl32FeCl2+CuCl2Cu+2Fe3+2Fe2++Cu2+3、氯化铁溶液呈酸性:FeCl3+3H2O Fe(OH)3+3HClFe3++3H2O Fe(OH)3+3H+4、氯化铁溶液中加入氢氧化钠溶液:FeCl3+3NaOH Fe(OH)3↓+3NaClFe3++3OH-Fe(OH)3↓5、向氯化铁溶液中加入氨水:FeCl3+3NH3·H2O Fe(OH)3↓+3NH4ClFe3++3NH3·H2O*6、向氯化铁溶液中加入碳酸钠溶液:2FeCl3+3Na2CO3+3H2O2Fe3++3CO32-+3H2O*7、向氯化铁溶液中加入碳酸氢钠溶液:FeCl3+3NaHCO3Fe3++3HCO3-*8、向氯化铁溶液中加入氢碘酸:2FeCl3+2HI2Fe3++2I-*9、氯化铁溶液与碘化钾溶液混合:2FeCl3+2KI2Fe3++2I-*10、氯化铁溶液中加入硫氰化钾溶液:FeCl3+3KSCNFe3++3SCN-铁及其化合物的化学方程式和离子方程式总结一、铁1、铁在氧气中燃烧:3Fe+2O2Fe3O42、铁在氯气中燃烧:2Fe+3Cl22FeCl33、铁和硫共热:Fe+S FeS4、铁与水蒸气在高温条件下反应:3Fe+4H2O Fe3O4+4H25、铁与稀硫酸反应:Fe+H2SO4FeSO4+H2↑离:Fe+2H+Fe2++H2↑6、少量的铁与浓硫酸共热:2Fe+6H2SO4(浓)Fe2(SO4)3+3SO2↑+6H2O7、少量的铁与浓硝酸共热:Fe+6HNO3(浓)Fe(NO3)3+3NO2↑+3H2OFe+6H++3NO3-Fe3++3NO2↑+3H2O8、少量的铁与稀硝酸反应:Fe+4HNO3Fe(NO3)3+NO↑+2H2OFe+4H++NO3-Fe3++NO ↑+2H2O9、过量的铁与稀硝酸反应:3Fe+8HNO33Fe(NO3)2+2NO ↑+4H2O3Fe+8H++2NO3-3Fe2++2NO +4H2O10、铁与硫酸铜溶液反应:Fe+CuSO4FeSO4+Cu 离:Fe+Cu2+Fe2++Cu11、铁与氯化铁溶液反应:Fe+2FeCl33FeCl2 离:Fe+2Fe3+3Fe2+二、氧化亚铁1、氧化亚铁与一氧化碳高温反应:FeO+CO Fe+CO22、氧化亚铁与稀硫酸反应:FeO+H2SO4FeSO4+H2O离:FeO+2H+Fe2++H2O*3、氧化亚铁与浓硫酸反应:2FeO+4H2SO4(浓)Fe2(SO4)3+SO2↑+4H2O*4、氧化亚铁与浓硝酸反应:FeO+4HNO3(浓)Fe(NO3)3+NO2↑+2H2O*5、氧化亚铁与稀硝酸反应:3FeO+10HNO33Fe(NO3)3+NO ↑+5H2O三、四氧化三铁1、四氧化三铁与铝粉高温下反应:8Al+3Fe3O44Al2O3+9Fe2、四氧化三铁与一氧化碳高温下反应:Fe3O4+4CO3Fe+4CO23、四氧化三铁溶于稀盐酸:Fe3O4+8HCl FeCl2+2FeCl3+4H2OFe3O4+8H+Fe2++2Fe3++4H2O四、氧化铁1、铝和氧化铁高温下反应:2Al+Fe2O3Al2O3+2Fe2、一氧化碳和氧化铁高温下反应:Fe2O3+3CO2Fe+3CO23、氧化铁溶液稀盐酸:Fe2O3+6HCl2FeCl3+3H2OFe2O3+6H+2Fe3++3H2O*4、氧化铁与氢碘酸反应:Fe2O3+6HI2FeI2+I2+3H2OFe2O3+6H++2I-2Fe2++I2+3H2O五、氢氧化亚铁1、氢氧化亚铁与稀硫酸反应:Fe(OH)2+H2SO4FeSO4+2H2OFe(OH)2+2H+Fe2++2H2O2、氢氧化亚铁在空气中被氧化:4Fe(OH)2+O2+2H2O4Fe(OH)3六、氯化亚铁1、氯化亚铁溶液中通入氯气:2FeCl2+Cl22FeCl32Fe2++Cl22Fe3++2Cl-*2、氯化亚铁溶液中加入溴水:6FeCl2+3Br24FeCl3+2FeBr32Fe2++Br22Fe3++2Br-3、氯化亚铁溶液中加入氢氧化钠溶液:FeCl2+2NaOH Fe(OH)2↓+2NaClFe2++2OH-Fe(OH)2↓4、氯化亚铁溶液中加入氨水:FeCl2+2NH3·H2O Fe(OH)2↓+2NH4ClFe2++2NH3·H2O Fe(OH)2↓+2NH4+5、氯化亚铁溶液中加入硫化钠溶液:FeCl2+Na2S FeS↓+2NaClFe2++S2-FeS↓七、氯化铁1、铁与氯化铁溶液反应:Fe+2FeCl33FeCl2Fe+2Fe3+3Fe2+2、铜和氯化铁溶液反应:Cu+2FeCl32FeCl2+CuCl2Cu+2Fe3+2Fe2++Cu2+3、氯化铁溶液呈酸性:FeCl3+3H2O Fe(OH)3+3HClFe3++3H2O Fe(OH)3+3H+4、氯化铁溶液中加入氢氧化钠溶液:FeCl3+3NaOH Fe(OH)3↓+3NaClFe3++3OH-Fe(OH)3↓5、向氯化铁溶液中加入氨水:FeCl3+3NH3·H2O Fe(OH)3↓+3NH4ClFe3++3NH3·H2O Fe(OH)3↓+3NH4+*6、向氯化铁溶液中加入碳酸钠溶液:2FeCl3+3Na2CO3+3H2O2Fe(OH)3↓+6NaCl+3CO2↑2Fe3++3CO32-+3H2O2Fe(OH)3↓+3CO2↑*7、向氯化铁溶液中加入碳酸氢钠溶液:FeCl3+3NaHCO3Fe(OH)3↓+3NaCl+3CO2↑Fe3++3HCO3-2Fe(OH)3↓+3CO2↑*8、向氯化铁溶液中加入氢碘酸:2FeCl3+2HI2FeCl2+I2+2HCl2Fe3++2I-2Fe2++I2*9、氯化铁溶液与碘化钾溶液混合:2FeCl3+2KI2FeCl2+I2+2KCl2Fe3++2I-2Fe2++I2*10、氯化铁溶液中加入硫氰化钾溶液:FeCl3+3KSCN Fe(SCN)3+3KClFe3++3SCN-Fe(SCN) 3。

化学方程式1.镁在空气中燃烧:1.2Mg+O2点燃2MO2现象:发出耀眼的白光,放出热量,生成白色固体.2.铁在氧气中燃烧:3Fe+2O2点燃Fe3O4现象:剧烈燃烧,火星四射,放出热量,生成黑色固体.3.铜在空气中加热:2Cu+O2△2CuO4.铝在空气中缓慢氧化:4Al+3O2====2Al2O35.氢气中空气中燃烧:.2H2+O2点燃2H2O现象:产生淡蓝色火焰,放出热量6.红磷在空气中燃烧:4P+5O2点燃2P2O5现象:放出热量,生成白色固体7.硫粉在空气中燃烧:S+O2点燃SO2现象:产生淡蓝色色火焰,放出热量,生成有刺激性气味的气体.8.碳在氧气中充分燃烧:.C+O2点燃CO29.碳在氧气中不充分燃烧:2C+O2点燃2CO10.汞和氧气反应:2Hg+O22HgO11.一氧化碳在氧气中燃烧:2CO+O2点燃2CO212.甲烷在空气中燃烧: CH4+2O2 点燃2 H2O+CO213.酒精在空气中燃烧.C2H5OH+3O2点燃3 H2O+2CO214.葡萄糖缓慢氧化C6H12O6+6O2酶6 H2O+6CO215.氧化汞受热分解:2HgO△2Hg+O2↑16.用过氧化氢和二氧化锰制氧气:2H2O2MnO22H2O+O2↑17.加热高锰酸钾:2KMnO4△K2MnO4+MnO2+O2↑现象:高锰酸钾为暗紫色,二氧化锰为黑色18.加热氯酸钾和二氧化锰的混合物:2KClO3MnO22KCl+3O 2↑现象:氯酸钾和氯化钾均为白色19.电解水:2H 2O 通电2H 2↑+O 2现象:电极上有气泡产生,与正极相连一端和与负极相连一端产生气体的体积比为1:21.生石灰与水反应:1.CaO+H 2O==Ca(OH)22.二氧化碳溶于水:CO 2+H 2O==H 2CO 33.电解水: 2H 2O 通电2H 2↑+O 2↑4.甲烷在空气中燃烧: CH 4+2O 2 点燃2 H 2O+CO 25.酒精在空气中燃烧:C 2H 5OH+3O 2点燃3 H 2O+2CO 2 6.葡萄糖缓慢氧化:C 6H 12O 6+6O 2酶6 H 2O+6CO 27.氢气中空气中燃烧:2H 2+O 2点燃H 2O 8.氢气还原氧化铜:.H 2+CuO △Cu+H 2O1.石灰水与二氧化碳反应:.Ca(OH)2+CO 2===CaCO 3↓+H 2O2.苛性钠暴露在空气中变质:2NaOH+CO 2==Na 2CO 3+H 2O3.碳与二氧化碳的反应:CO 2+C 高温2CO4.碳酸的分解: H 2CO 3===H 2O+CO 2↑5.实验室制二氧化碳的反应原理:CaCO 3+2HCl==CaCl 2+H 2O+CO 2↑6.碳酸钠与稀盐酸反应:Na 2CO 3+2HCl==2NaCl+H 2O+CO 2↑7.碳酸氢钠与稀盐酸反应:NaHCO 3+HCl==NaCl+H 2O+CO 2↑8.高温煅烧石灰石:CaCO 3高温CaO+CO 2↑9.木炭还原氧化铜:9.C+2CuO 高温2Cu+CO 2↑现象: 黑色粉末变红,生成能使澄清石灰水变浑浊的气体.10.焦炭还原氧化铁:.3C+2Fe 2O 3高温4Fe+3CO 2↑现象: 红色粉末变黑,生成能使澄清石灰水变浑浊的气体. 11.一氧化碳还原氧化铜:CO+CuO △Cu+CO 2H 2O CO 2、 CO现象: 黑色粉末变红,生成能使澄清石灰水变浑浊的气体. 12.用赤铁矿炼铁:3CO+Fe 2O 3高温2Fe+3 CO 2↑ 现象: 红色粉末变黑,生成能使澄清石灰水变浑浊的气体.13.一氧化碳在氧气中燃烧:2CO+O 2点燃2CO 21.用盐酸除铁锈: 1. Fe 2O 3+6HCl==2FeCl 3+3H 2O 现象: 红色固体逐渐消失,溶液由无色变为黄色.2.用硫酸除铁锈: Fe 2O 3+3H 2SO 4==Fe 2(SO 4)3+3H 2O 现象: 红色固体逐渐消失,溶液由无色变为黄色 1. 铁在氧气中燃烧:1. 3Fe+2O 2点燃Fe 3O 42.铁和稀硫酸:Fe+H 2SO 4 ==FeSO 4+H 2↑3.铁和稀盐酸: Fe+2HCl==FeCl 2+H 2↑4.铁和硫酸铜溶液: Fe+CuSO 4==FeSO 4+Cu 1.锌和稀硫酸:1.Zn+H 2SO 4==ZnSO 4+H 2↑现象: 有气泡产生.2.铁和稀硫酸: Fe+H 2SO 4 ==FeSO 4+H 2↑ 现象: 有少量气泡产生,溶液由无色变为浅绿色3.镁和稀硫酸: Mg+H 2SO 4==MgSO 4+H 2↑ 现象: 固体逐渐消失,有大量气泡产生,放出热量.4.铝和稀硫酸: 2Al+3H 2SO 4 ==Al 2(SO 4)3+3H 2↑5.锌和稀盐酸: Zn+2HCl==ZnCl 2+H 2↑现象: 有气泡产生.6.铁和稀盐酸: Fe+2HCl==FeCl 2+H 2↑现象: 有少量气泡产生,溶液由无色变为浅绿色. 7.镁和稀盐酸: Mg+2HCl==MgCl 2+H 2↑ Fe 2O 3 Fe 酸现象:固体逐渐消失,有大量气泡产生,放出热量.8.铝和稀盐酸: 2Al+6HCl==2AlCl3+3H2↑9.氧化铁和稀盐酸反应: Fe2O3+6HCl==2FeCl3+3H2O现象:红色固体逐渐消失,溶液由无色变为黄色.10.氧化铁和稀硫酸反应: Fe2O3+3H2SO4==Fe2(SO4)3+3H2O现象:红色固体逐渐消失,溶液由无色变为黄色.11.氧化铜和稀盐酸反应: CuO+2HCl==CuCl2+H2O现象: 黑色固体逐渐消失,溶液由无色变为蓝色.12.氧化铜和稀硫酸反应: CuO+H2SO4==CuSO4+H2O13.盐酸和烧碱反应: NaOH+HCl==NaCl+H2O现象:无现象14.硫酸和烧碱反应: 2NaOH+H2SO4==Na2SO4+2H2O现象:无现象15.氢氧化铝药物治疗胃酸过多: Al(OH)3+3HCl==AlCl3+3H2O16.盐酸和氢氧化钙反应: Ca(OH)2+2HCl==CaCl2+H2O17.硫酸和氢氧化钙反应:Ca(OH)2+H2SO4==CaSO4+2H2O18.大理石和稀盐酸反应: CaCO3+2HCl==CaCl2+H2O+CO2↑现象:有气泡产生19.碳酸钠与稀盐酸反应: Na2CO3+2HCl==2NaCl+H2O+CO2↑现象:有气泡产生20.碳酸钾与稀盐酸反应: .K2CO3+2HCl==2KCl+H2O+CO2↑现象:有气泡产生21.碳酸氢钠与稀盐酸反应: 21.NaHCO3+HCl==NaCl+H2O+CO2↑现象:有气泡产生22.硫酸和氯化钡反应: .H2SO4+BaCl2==2HCl+BaSO4↓现象: 生成白色沉淀23.盐酸和硝酸银反应: AgNO 3+HCl ==AgCl ↓+HNO 3现象: 生成白色沉淀 1.氢氧化钠变质: 1.2NaOH+CO 2==Na 2CO 3+H 2O 2.苛性钠吸收二氧化硫气体: 2NaOH+SO 2==Na 2SO 3+H 2O3.苛性钠与三氧化硫反应: 2NaOH+SO 3==Na 2SO 4+H 2O4.盐酸和烧碱反应: NaOH+HCl==NaCl+H 2O5.硫酸和烧碱反应: 2NaOH+H 2SO 4==Na 2SO 4+2H 2O6.氢氧化铝药物治疗胃酸过多: Al(OH)3+3HCl==AlCl 3+3H 2O7.盐酸和氢氧化钙反应: Ca(OH)2+2HCl==CaCl 2+H 2O8.氢氧化铜和硫酸反应:8.Cu(OH)2+H 2SO 4==CuSO 4+2H 2O 现象: 蓝色固体逐渐消失,溶液由无色变为蓝色.9.氢氧化钙与碳酸钠反应: Ca(OH)2+Na 2CO 3==CaCO 3↓+2NaOH 现象: 生成白色沉淀10.硫酸铜溶液和氢氧化钠溶液反应: CuSO 4+2NaOH==Cu(OH)2↓+Na 2SO 4 现象: 生成蓝色沉淀11.氯化铁溶液和氢氧化钠溶液: FeCl 3+3NaOH==Fe(OH)3↓+3NaCl 现象: 生成红褐色沉淀1.锌和硫酸铜溶液: 1.CuSO 4+Zn==ZnSO 4+Cu 现象: 生成红色固体,溶液由蓝色变为无色.2.铜和硝酸银溶液: Hg(NO 3)2+Cu==Cu(NO 3)2+Hg 现象: 生成 银白色固体,溶液由无色变为蓝色3.铝和硫酸铜溶液: 2Al+3CuSO 4 ==Al 2(SO 4)3+3Cu 现象: 生成红色固体,溶液由蓝色变为无色.4.碳酸钠与稀盐酸反应: Na 2CO 3+2HCl==2NaCl+H 2O+CO 2↑ 碱盐现象:有气泡生成5.用纯碱制烧碱: Ca(OH)2+Na2CO3==CaCO3↓+2NaOH现象:生成白色沉淀6.氯化钙溶液和碳酸钠溶液: Na2CO3+CaCl2==2NaCl+CaCO3↓现象:生成白色沉淀.。

铁及其化合物的化学方程式和离子方程式总结(注:带*的不要求记忆,但需要理解)一、铁1、铁在氧气中燃烧:3Fe+2O 2Fe3O42、铁在氯气中燃烧:2Fe+3Cl 22FeCl3*3、常温条件下铁锈的形成:4Fe+3O2+2H2O2[Fe2O3 ·H2O]*4、高温条件铁与氧气反应:2Fe+O 22FeO5、铁和硫共热:Fe+S FeS6、铁与水蒸气在高温条件下反应:3Fe+4H2O Fe3O4+4H27、铁与稀硫酸反应:Fe+H2SO 4FeSO4+H2↑离:Fe+2H +Fe2++H2↑8、少量的铁与浓硫酸共热:2Fe+6H2SO4(浓)Fe2(SO4)3+3SO2↑+6H2O9、少量的铁与浓硝酸共热:Fe+6HNO3(浓)Fe(NO3)3+3NO2↑+3H2OFe+6H++3NO3-Fe3++3NO2↑+3H2O10、少量的铁与稀硝酸反应:Fe+4HNO 3Fe(NO3)3+NO↑+2H2OFe+4H++NO3-Fe3++NO ↑+2H2O11、过量的铁与稀硝酸反应:3Fe+8HNO 33Fe(NO3)2+2NO ↑+4H2O3Fe+8H++2NO3-3Fe2++2NO +4H2O12、铁与硫酸铜溶液反应:Fe+CuSO 4FeSO4+Cu 离:Fe+Cu2+Fe2++Cu13、铁与硝酸银溶液反应:Fe+2AgNO 3Fe(NO3)2+2AgFe+2Ag +Fe2++2Ag14、铁与氯化铁溶液反应:Fe+2FeCl 33FeCl2 离:Fe+2Fe3+3Fe2+二、氧化亚铁*1、氧化亚铁在空气中加热:6FeO+O 22Fe3O42、氧化亚铁与一氧化碳高温反应:FeO+CO Fe+CO23、氧化亚铁与铝粉在高温下反应:3FeO+2Al Al2O3+3Fe4、氧化亚铁与稀硫酸反应:FeO+H2SO 4FeSO4+H2O 离:FeO+2H +Fe2++H2O *5、氧化亚铁与浓硫酸反应:2FeO+4H2SO4(浓)Fe2(SO4)3+SO2↑+4H2O*6、氧化亚铁与浓硝酸反应:FeO+4HNO3(浓)Fe(NO3)3+NO2↑+2H2OFeO+4H++NO3-Fe3++NO2↑+2H2O*7、氧化亚铁与稀硝酸反应:3FeO+10HNO 33Fe(NO3)3+NO ↑+5H2O3FeO+10H++NO3-3Fe3++NO ↑+5H2O三、四氧化三铁1、四氧化三铁与铝粉高温下反应:8Al+3Fe3O 44Al2O3+9Fe2、四氧化三铁与一氧化碳高温下反应:Fe3O4+4CO3Fe+4CO23、四氧化三铁溶于稀盐酸:Fe3O4+8HCl FeCl2+2FeCl3+4H2OFe3O4+8H +Fe2++2Fe3++4H2O*4、四氧化三铁溶于浓硫酸:2Fe3O4+10H2SO4(浓)3Fe2(SO4)3+SO2↑+10H2O*5、四氧化三铁溶于浓硝酸:Fe3O4+10HNO3(浓)3Fe(NO3)3+NO2↑+5H2OFe3O4+10H++NO3-3Fe3++NO↑+5H2O*6、四氧化三铁溶于稀硝酸:3Fe3O4+28HNO 39Fe(NO3)3+NO ↑+14H2O3Fe3O4+28H++NO3-9Fe3++NO ↑+14H2O*7、四氧化三铁溶于氢碘酸:Fe3O4+8HI3FeI2+I2+4H2OFe3O4+8H +3Fe2++I2+4H2O四、氧化铁1、铝和氧化铁高温下反应:2Al+Fe2O 3Al2O3+2Fe2、一氧化碳和氧化铁高温下反应:Fe2O3+3CO2Fe+3CO23、氧化铁溶液稀盐酸:Fe2O3+6HCl2FeCl3+3H2OFe2O3+6H +2Fe3++3H2O*4、氧化铁与氢碘酸反应:Fe2O3+6HI2FeI2+I2+3H2OFe2O3+6H++2I -2Fe2++I2+3H2O五、氢氧化亚铁1、氢氧化亚铁与稀硫酸反应:Fe(OH)2+H2SO 4FeSO4+2H2OFe(OH)2+2H +Fe2++2H2O*2、氢氧化亚铁与浓硫酸反应:2Fe(OH)2+4H2SO4(浓)Fe2(SO4)3+SO2↑+6H2O *3、氢氧化亚铁与浓硝酸反应:Fe(OH)2+4HNO3(浓)Fe(NO3)3+NO2↑+3H2OFe(OH)2+4H++NO3-Fe3++NO2↑+3H2O*4、氢氧化亚铁与稀硝酸反应:3Fe(OH)2+10HNO 33Fe(NO3)3+NO↑+8H2O3Fe(OH)2+10H++NO3-3Fe3++NO↑+8H2O 5、氢氧化亚铁在空气中被氧化:4Fe(OH)2+O2+2H2O4Fe(OH)3*6、氢氧化亚铁隔绝空气加热:Fe(OH)2FeO+H2O*7、氢氧化亚铁在空气中加热:4Fe(OH)2+O 22Fe2O3+4H2O六、氯化亚铁1、铝与氯化亚铁溶液反应:2Al+3FeCl 22AlCl3+3Fe2Al+3Fe2+2Al3++3Fe2、锌与氯化亚铁溶液反应:Zn+FeCl 2ZnCl2+FeZn+Fe2+Zn2++Fe*3、氯化亚铁暴露在空气中变质:12FeCl2+3O2+6H2O8FeCl3+4Fe(OH)3↓12Fe2++3O2+6H2O8Fe3++4Fe(OH)3↓*4、酸化的氯化亚铁溶液中通入氧气:4FeCl2+O2+4HCl4FeCl3+2H2O4Fe2++O2+4H +4Fe3++2H2O5、氯化亚铁溶液中通入氯气:2FeCl2+Cl 22FeCl32Fe2++Cl 22Fe3++2Cl-*6、氯化亚铁溶液中加入溴水:6FeCl2+3Br 24FeCl3+2FeBr32Fe2++Br 22Fe3++2Br-7、氯化亚铁溶液呈酸性:FeCl2+2H2O Fe(OH)2+2HClFe2++2H2O Fe(OH)2+2H+8、氯化亚铁溶液中加入氢氧化钠溶液:FeCl2+2NaOH Fe(OH)2↓+2NaClFe2++2OH -Fe(OH)2↓9、氯化亚铁溶液中加入氨水:FeCl2+2NH3·H2O Fe(OH)2↓+2NH4ClFe2++2NH3·H2O Fe(OH)2↓+2NH4+*10、氯化亚铁溶液中加入四羟基铝酸钠溶液:FeCl2+2Na[Al(OH)4] Fe(OH)2↓+2Al(OH)3↓+2NaClFe2++2[Al(OH)4]-+4H2O2Al(OH)3↓+Fe(OH)2↓11、氯化亚铁溶液中加入硝酸银溶液:FeCl2+2AgNO 3Fe(NO3)2+2AgCl↓Ag++Cl -AgCl↓12、氯化亚铁溶液中加入硫化钠溶液:FeCl2+Na2S FeS↓+2NaClFe2++S2-FeS↓*13、硫酸亚铁溶液与浓硫酸反应:2FeSO4+2H2SO4(浓)Fe2(SO4)3+SO2↑+2H2O *14、硝酸亚铁溶液与浓硝酸反应:Fe(NO3)2+2HNO3(浓)Fe(NO3)3+NO2↑+H2OFe2++2H++NO3-Fe3++H2O+NO2↑*15、硝酸亚铁溶液与稀硝酸反应:3Fe(NO3)2+10HNO 33Fe(NO3)3+NO ↑+5H2O3Fe2++10H++NO3-3Fe3++NO↑ +5H2O*16、酸化的氯化亚铁被过氧化氢所氧化:2FeCl2+H2O2+2HCl2FeCl3+2H2O2Fe2++H2O2+2H +2Fe3++2H2O*17、过氧化钠与氯化亚铁溶液反应:4Na2O2+4FeCl2+6H2O4Fe(OH)3↓+8NaCl+O2↑4Na2O2+4Fe2++6H2O4Fe(OH)3↓+8Na++O2*18、次氯酸钠溶液与氯化亚铁溶液反应2FeCl2+5NaClO+5H2O2Fe(OH)3↓+5NaCl+4HClO2Fe2++5ClO-+5H2O2Fe(OH)3↓+Cl-+4HClO*19、硫酸酸化的酸性高锰酸钾与氯化亚铁溶液反应5FeCl2+KMnO4+4H2SO4=3FeCl3+Fe2(SO4)3+MnSO4 +KCl+4H2O5Fe2+ + MnO4- + 8H+ = 5Fe3+ + Mn2+ + 4H2O七、氯化铁*1、少量的锌和氯化铁溶液反应:Zn+2FeCl 32FeCl2+ZnCl2Zn+2Fe3+2Fe2++Zn2+2、过量的锌与氯化铁溶液反应:3Zn+2FeCl 33ZnCl2+2Fe3Zn+2Fe3+3Zn2++2Fe3、铁与氯化铁溶液反应:Fe+2FeCl 33FeCl2Fe+2Fe3+3Fe2+4、铜和氯化铁溶液反应:Cu+2FeCl 32FeCl2+CuCl2Cu+2Fe3+2Fe2++Cu2+*5、向氯化铁溶液中通入二氧化硫:2FeCl3+SO2+2H2O2FeCl2+H2SO4+2HCl2Fe3++SO2+2H2O2Fe2++4H++SO42-6、氯化铁溶液呈酸性:FeCl3+3H2O Fe(OH)3+3HClFe3++3H2O Fe(OH)3+3H+7、氯化铁溶液中加入氢氧化钠溶液:FeCl3+3NaOH Fe(OH)3↓+3NaClFe3++3OH -Fe(OH)3↓8、向氯化铁溶液中加入氨水:FeCl3+3NH3·H2O Fe(OH)3↓+3NH4ClFe3++3NH3·H2O Fe(OH)3↓+3NH4+*9、向氯化铁溶液中加入碳酸钠溶液:2FeCl3+3Na2CO3+3H2O2Fe(OH)3↓+6NaCl+3CO2↑2Fe3++3CO32-+3H2O2Fe(OH)3↓+3CO2↑*10、向氯化铁溶液中加入碳酸氢钠溶液:FeCl3+3NaHCO 3Fe(OH)3↓+3NaCl+3CO2↑Fe3++3HCO3-2Fe(OH)3↓+3CO2↑*11、向氯化铁溶液中加入四羟基合氯酸钠溶液:FeCl3+3Na[Al(OH)4] Fe(OH)3↓+3Al(OH)3↓+3NaClFe3++3[Al(OH)4]-Fe(OH)3↓+3Al(OH)3↓*12、向氯化铁溶液中加入次氯酸钠溶液:FeCl3+3NaClO+3H2O Fe(OH)3↓+3NaCl+3HClOFe3++3ClO-+3H2O Fe(OH)3↓+3HClO*13、向氯化铁溶液中通入硫化氢:2FeCl3+H2S2FeCl2+S↓ +2HCl2Fe3++H2S2Fe2++S ↓+2H+*14、向氯化铁溶液中加入氢碘酸:2FeCl3+2HI2FeCl2+I2+2HCl2Fe3++2I -2Fe2++I2*15、向氯化铁溶液中加入少量的硫化钠溶液:2FeCl3+Na2S2FeCl2+S↓ +2NaCl2Fe3++S2-2Fe2++S ↓*16、向氯化铁溶液中加入过量的硫化钠溶液:2FeCl3+3Na2S2FeS↓+S↓ +6NaCl2Fe3++3S2-2FeS+S ↓*17、氯化铁溶液与碘化钾溶液混合:2FeCl3+2KI2FeCl2+I2+2KCl2Fe3++2I -2Fe2++I218、氯化铁溶液与硝酸银溶液混合:FeCl3+3AgNO 33AgCl↓ +Fe(NO3)3Ag++Cl -AgCl↓*19、氯化铁溶液中加入硫氰化钾溶液:FeCl3+3KSCN Fe(SCN)3+3KClFe3++3SCN -Fe(SCN) 3*20、氧化镁投入到氯化铁溶液中:3MgO+2FeCl3+3H2O3MgCl2+2Fe(OH)33MgO+2Fe3++3H2O3Mg2++2Fe(OH)3*21、氢氧化镁投入到氯化铁溶液中:3Mg(OH)2+2FeCl 33MgCl2+2Fe(OH)33Mg(OH)2+2Fe3+3Mg2++2Fe(OH)3。

铁相关的化学方程式全文共四篇示例,供读者参考第一篇示例:铁是化学元素周期表中的第26号元素,原子序数为Fe。
它在自然界中非常常见,是地壳中最常见的金属元素之一。
铁的化学性质非常稳定,但会在空气中与氧气发生反应生成铁氧化物。
铁的化学方程式涉及到多种反应类型,从简单的氧化还原反应到配位化学反应等等。
让我们来一起了解一下铁相关的化学方程式。
我们来看铁与氧气发生氧化反应的方程式:2Fe(s) + 3O2(g) → 2Fe2O3(s)这个方程式描述了铁与氧气氧化生成氧化铁的过程。
氧化铁是一种广泛应用的化合物,常见于建筑材料、涂料和颜料等行业中。
在酸性溶液中,铁可以发生还原反应:Fe2+(aq) + MnO4-(aq) + 8H+(aq) → Fe3+(aq) + Mn2+(aq) + 4H2O(l)这是铁与高锰酸根离子在酸性条件下的反应方程式。
在这个反应中,铁的氧化状态从+2升高到+3,高锰酸根离子的氧化状态则下降。
铁还可以参与到复杂的配位化学反应中。
铁配合物可以与氨形成铵铁络合物:FeCl3(aq) + 3(NH4)OH(aq) → Fe(OH)3(s) + 3NH4Cl(aq)在这个反应中,氨的配位能力使得铁与氢氧化物结合形成沉淀,而氯离子与铵离子结合形成溶解的氯化铵。
铁还可以与硫形成硫化铁,如下所示:8Fe(s) + S8(s) → 8FeS(s)这个反应描述了铁和硫发生化学反应生成硫化铁。
硫化铁是一种常见的矿石,广泛应用于金属冶炼和化工生产中。
第二篇示例:铁是一种广泛应用的金属元素,它在我们的日常生活中扮演着重要的角色。
从建筑结构到家用电器,从汽车制造到电子设备,铁都扮演着不可或缺的角色。
在化学领域,铁的化合物也有着许多重要的应用。
在本文中,我们将探讨一些关于铁的化学方程式,以及它们在各个领域的应用。
1. 铁的性质铁是一种化学元素,其符号为Fe,原子序数为26。
它是一种过渡金属,具有良好的导电性和热导性。

高考化学易错题精选-铁及其化合物练习题含答案一、高中化学铁及其化合物练习题(含详细答案解析)1.已知A、B、C、D四种物质均含有铁元素,彼此转化关系如下:请回答:(1)反应①称为铝热反应(属于置换反应),写出该反应的化学方程式:__、其中Al作__剂。
(2)反应④的离子方程式为:__。
(3)新配制的C溶液中应加入__,以防止其转化为D。
检验D溶液中阳离子的常用试剂是__(填化学式),实验现象为__。
【答案】2Al+Fe2O3高温2Fe+Al2O3还原剂 2Fe2++H2O2+2H+=2Fe3++2H2O 铁粉(屑) KSCN (或NH4SCN)溶液变红(或呈现血红色)【解析】【分析】氧化铁与铝单质在高温下发生铝热反应,生成A,则A为Fe,铁和水蒸气在高温下反应生成B,B为黑色磁性氧化物,则B为Fe3O4,Fe3O4中铁元素的化合价含有+2、+3价,与盐酸反应生成FeCl3和FeCl2,铁与过量盐酸反应生成FeCl2,则C为FeCl2,FeCl2与双氧水反应生成FeCl3,则D为FeCl3,据此分析解答。
【详解】(1)反应①称为铝热反应(属于置换反应),该反应的化学方程式:2Al+Fe2O3高温2Fe+Al2O3,反应中Al有0价变为+3价,化合价升高,失电子,被氧化,作还原剂;(2)反应④为FeCl2与双氧水反应生成FeCl3,离子方程式为:2Fe2++H2O2+2H+=2Fe3++2H2O;(3)C为FeCl2,D为FeCl3,亚铁离子具有还原性,易被氧化,新配制的FeCl2溶液中应加入铁粉(屑),以防止其转化为FeCl3。
检验三价铁离子常用试剂是KSCN(或NH4SCN),三价铁离子遇SCN-变为血红色溶液。
2.A、B、C均为中学化学常见的纯净物,它们之间存在如下转化关系:其中①②③均为有单质参与的反应。
(1)若A是常见的金属,①③中均有同一种黄绿色气体参与反应,B溶液遇KSCN显血红色,且②为化合反应,写出反应②的离子方程式_________________________。
高考化学铁及其化合物综合经典题含详细答案一、高中化学铁及其化合物1.已知有以下物质相互转化。
试回答:(1)写出B的化学式__________,D的化学式__________。
(2)写出由E转变成F的化学方程式_______________________。
(3)写出用KSCN鉴别G现象___________;向G溶液加入A的有关离子反应方程式___________。
【答案】(1)FeCl2;KCl(2)4Fe(OH)2+O2+2H2O===4Fe(OH)3(3)溶液变血红色;Fe+2Fe3+=3Fe2+。
【解析】试题分析:白色沉淀E在空气中转化为红褐色沉淀F,可推知E为Fe(OH)2、F为Fe(OH)3,F与盐酸反应得到G溶液,则G为FeCl3,G与A反应得到B、B与C反应得到E与,可推知B为FeCl2,A为Fe,C为碱,反应得到D为氯化物,D溶液与硝酸银、硝酸混合得到白色沉淀H为AgCl,反应得到的溶液进行焰色反应呈紫色,可以K元素,故D为KCl、C为KOH。
(1)由上述分析可知,B为FeCl2,D为KCl,故答案为FeCl2;KCl;(2)E转变成F的化学方程式为:4Fe(OH)2+O2+2H2O=4Fe(OH)3,故答案为4Fe(OH)2+O2+2H2O=4Fe(OH)3;(3)用KSCN鉴别FeCl3溶液的现象为:溶液呈血红色,向FeCl3溶液加入Fe的离子方程式为:Fe+2Fe3+=3Fe2+故答案为血红色;Fe+2Fe3+=3Fe2+。
考点:考查了无机物推断、Fe、Cl、K元素化合物的性质的相关知识。
2.物质X是某新型净水剂的中间体,它可以看成由AlCl3(在180℃升华)和一种盐A按物质的量之比1:2组成。
在密闭容器中加热X使之完全分解,发生如下转化:请回答下列问题:(1)X的化学式为__。
(2)将E混合晶体溶于水配成溶液,向溶液中加入过量稀NaOH溶液时发生的总反应的离子方程式为__。
炼铁的化学方程式在高温下,用还原剂将铁矿石还原得到生铁的生产过程。
炼铁的主要原料是铁矿石、焦炭、石灰石、空气。
铁矿石有赤铁矿(Fe2O3)和磁铁矿(Fe3O4)等。
铁矿石的含铁量叫做品位,在冶炼前要经过选矿,除去其它杂质,提高铁矿石的品位,然后经破碎、磨粉、烧结,才可以送入高炉冶炼。
焦炭的作用是提供热量并产生还原剂一氧化碳。
石灰石是用于造渣除脉石,使冶炼生成的铁与杂质分开。
炼铁的主要设备是高炉。
冶炼时,铁矿石、焦炭、和石灰石从炉顶进料口由上而下加入,同时将热空气从进风口由下而上鼓入炉内,在高温下,反应物充分接触反应得到铁。
高炉炼铁是指把铁矿石和焦炭,一氧化碳,氢气等燃料及熔剂(从理论上说把金属活动性比铁强的金属和矿石混合后高温也可炼出铁来)装入高炉中冶炼,去掉杂质而得到金属铁(生铁)。
有高炉法,直接还原法,熔融还原法,等离子法。
其反应式为:Fe2O3+3CO==2Fe+3CO2(高温) (还原反应)Fe3O4+4CO==3Fe+4CO2(高温)(还原反应)炉渣的形成:CaCO3=CaO+CO2 (条件:高温)CaO+SiO2=CaSiO3 (条件:高温)题目:炼铁的主要设备是______.主要原料是铁矿石、______和______.答案工业炼铁在高炉中进行,主要原料有:铁矿石、焦炭和石灰石,焦炭在过量空气中生成二氧化碳,同时放出大量热,二氧化碳又在焦炭的作用下生成一氧化碳,一氧化碳把铁从铁矿石中还原出来,从而制得铁.故答案为:高炉、焦炭、石灰石.赤铁矿炼铁的化学方程式赤铁矿的化学成分为α-Fe2O3,炼铁厂以赤铁矿石、焦炭、石灰石、空气等为主要原料炼铁,主要反应过程为——首先焦炭与空气中的氧气生成二氧化碳(提供热源),然后生成的二氧化碳继续与焦炭反应生成气体还原剂一氧化碳,接下来一氧化碳还原氧化铁生成铁和二氧化碳,从而冶炼得到生铁。
① C + O2 =高温= CO2;当然条件列为点燃也可以,但高温更准确。
四.单质、氧化物、酸、碱、盐的相互关系(1)金属单质 + 酸 -------- 盐 + 氢气(置换反应)26. 锌和稀硫酸Zn + H2SO4 = ZnSO4 + H2↑27. 铁和稀硫酸Fe + H2SO4 = FeSO4 + H2↑28. 镁和稀硫酸Mg + H2SO4 = MgSO4 + H2↑29. 铝和稀硫酸2Al +3H2SO4 = Al2(SO4)3 +3H2↑30. 锌和稀盐酸Zn + 2HCl=== ZnCl2 + H2↑31. 铁和稀盐酸Fe + 2HCl=== FeCl2 + H2↑32. 镁和稀盐酸Mg+ 2HCl=== MgCl2 + H2↑33. 铝和稀盐酸2Al + 6HCl == 2AlCl3 + 3H2↑(2)金属单质 + 盐(溶液) ------- 另一种金属 + 另一种盐34. 铁和硫酸铜溶液反应:Fe + CuSO4 === FeSO4 + Cu35. 铝和硫酸铜溶液反应:2Al+ 3CuSO4=== Al2(SO4)3 + 3Cu36. 铜和硝酸银溶液反应:Cu +2 AgNO3 === Cu(NO3)2 + 2Ag锌和硫酸铜溶液反应:Zn + CuSO4 === ZnSO4 + Cu镁与硫酸铜溶液反应:Mg + CuSO4 === MgSO4 + Cu(3)金属氧化物 +酸 -------- 盐 + 水37. 氧化铁和稀盐酸反应:Fe2O3 + 6HCl === 2FeCl3 + 3H2O38. 氧化铁和稀硫酸反应:Fe2O3 + 3H2SO4 === Fe2(SO4)3 + 3H2O39. 氧化铜和稀盐酸反应:CuO + 2HCl ==== CuCl2 + H2O40. 氧化铜和稀硫酸反应:CuO + H2SO4 ==== CuSO4 + H2O41. 氧化镁和稀硫酸反应:MgO + H2SO4 ==== MgSO4 + H2O42. 氧化钙和稀盐酸反应:CaO + 2HCl ==== CaCl2 + H2O氧化铝和稀硫酸反应:Al2O3+3H2SO4==Al2(SO4)3+3H2O氧化锌与硝酸:ZnO + 2H NO3 ==== Zn (NO3)2 + H2O氧化亚铁与硝酸:FeO + 2H NO3 ==== Fe (NO3)2 + H2O氧化钾与盐酸:K2O + 2HCl ==== 2KCl+ H2O氧化钠与硫酸:Na2O+ H2SO4 ==== Na2SO4 + H2O(4)非金属氧化物 +碱 -------- 盐 + 水43.苛性钠暴露在空气中变质:2NaOH + CO2 ==== Na2CO3 + H2O44.苛性钠吸收二氧化硫气体:2NaOH + SO2 ==== Na2SO3(亚硫酸钠)+ H2O45.苛性钠吸收三氧化硫反应:2NaOH + SO3 ==== Na2SO4 + H2O46.消石灰放在空气中变质:Ca(OH)2 + CO2 ==== CaCO3↓+ H2O47. 消石灰吸收二氧化硫:Ca(OH)2 + SO2 ==== CaSO3(亚硫酸钙)↓+ H2O熟石灰与三氧化硫:Ca(OH)2 + SO3 ==== CaSO4 + H2O氢氧化钾溶液与二氧化碳反应:2KOH + CO2 ==== K2CO3 + H2O氢氧化钡溶液与二氧化碳反应:Ba(OH)2 + CO2 ==== BaCO3↓+ H2O (5)酸 + 碱 -------- 盐 + 水48.盐酸和烧碱起反应:HCl + NaOH ==== NaCl +H2O49. 盐酸和氢氧化钾反应:HCl + KOH ==== KCl +H2O50.盐酸和氢氧化铜反应:2HCl + Cu(OH)2 ==== CuCl2 + 2H2O51. 盐酸和氢氧化钙反应:2HCl + Ca(OH)2 ==== CaCl2 + 2H2O52. 盐酸和氢氧化铁反应:3HCl + Fe(OH)3 ==== FeCl3 + 3H2O53.氢氧化铝药物治疗胃酸过多:3HCl + Al(OH)3 ==== AlCl3 + 3H2O54.硫酸和烧碱反应:H2SO4 + 2NaOH ==== Na2SO4 + 2H2O55.硫酸和氢氧化钾反应:H2SO4 + 2KOH ==== K2SO4 + 2H2O56.硫酸和氢氧化铜反应:H2SO4 + Cu(OH)2 ==== CuSO4 + 2H2O57.硫酸和氢氧化铁反应:3H2SO4 + 2Fe(OH)3==== Fe2(SO4)3 + 6H2O58. 硝酸和烧碱反应:HNO3+ NaOH ==== NaNO3 +H2O硝酸与氢氧化亚铁反应:2HNO3+ Fe(OH)2 ==== Fe( NO3)2 + 2H2O熟石灰改良硫酸型的酸性土壤:H2SO4 + Ca(OH)2 ==== CaSO4 + 2H2O 氢氧化镁与盐酸反应:2HCl + Mg(OH)2 ==== MgCl2 + 2H2O(6)酸 + 盐 -------- 另一种酸 + 另一种盐59.大理石与稀盐酸反应:CaCO3 + 2HCl === CaCl2 + H2O + CO2↑60.碳酸钠与稀盐酸反应: Na2CO3 + 2HCl === 2NaCl + H2O + CO2↑61.碳酸氢钠与盐酸反应:NaHCO3 + HCl === NaCl + H2O + CO2↑62.盐酸和硝酸银溶液反应:HCl + AgNO3 === AgCl↓+ HNO363.稀硫酸和碳酸钠反应:Na2CO3 + H2SO4 === Na2SO4 + H2O + CO2↑64.硫酸和氯化钡溶液反应:H2SO4 + BaCl2 ==== BaSO4↓+ 2HCl碳酸镁与稀盐酸反应: MgCO3 + 2HCl === MgCl2 + H2O + CO2↑碳酸氢钠与硫酸反应:2NaHCO3 + H2SO4 === Na2SO4 +2 H2O + 2CO2↑碳酸钡与硝酸反应:BaCO3+2HNO3=== Ba (NO3)2 + H2O + CO2↑SO形成的酸雨(H2SO4)腐蚀华表CaCO3+ H2SO4== H2O + CO2↑+ CaSO42(7)碱 + 盐 -------- 另一种碱 + 另一种盐65.氢氧化钠与硫酸铜:2NaOH + CuSO4 ==== Cu(OH)2↓+ Na2SO466.氢氧化钠与氯化铁:3NaOH + FeCl3 ==== Fe(OH)3↓+ 3NaCl67.氢氧化钠与氯化铵:NaOH+ NH4Cl==NH3↑+H2O+NaCl68.氢氧化钙与硫酸铵:Ca(OH)2+(NH4)2SO4== 2NH3↑+2H2O+ CaSO469. 氢氧化钙与碳酸钠:Ca(OH)2 + Na2CO3 === CaCO3↓+ 2NaOH氢氧化钠与氯化镁:2NaOH + MgCl2 ==== Mg(OH)2↓+ 2NaCl. 氢氧化钠与氯化铜:2NaOH + CuCl2 ==== Cu(OH)2↓+ 2NaCl氢氧化钾与硫酸锌溶液:2KOH +ZnSO4=== Zn(OH)2↓+K2SO4氢氧化钾溶液与硫酸铝:6KOH + Al2(SO4)3==2Al(OH)3↓+3K2SO4(8)盐 + 盐 ----- 两种新盐70.氯化钠溶液和硝酸银溶液:NaCl + AgNO3 == AgCl↓+ NaNO371.硫酸钠和氯化钡:Na2SO4 + BaCl2 ==== BaSO4↓+ 2NaCl碳酸钠溶液与氯化钙溶液Na2CO3 + CaCl2== CaCO3↓+2NaCl碳酸钠溶液与氯化钡溶液Na2CO3 + BaCl2 ==== BaCO3↓+ 2NaCl碳酸钠溶液和硝酸银溶液Na2CO3 + 2AgNO3 ==== Ag2CO3↓+ 2Na NO3硫酸铵溶液与硝酸钡溶液:(NH4)2SO4 +Ba(NO3)2==== BaSO4↓+2 NH4 NO3氯化铵溶液与硝酸银溶液:NH4Cl+ AgNO3 == AgCl↓+ NH4 NO3五.其它反应:72.氧化钠溶于水:Na2O + H2O ==== 2NaOH73.三氧化硫溶于水:SO3 + H2O ==== H2SO474.硫酸铜晶体受热分解:CuSO4·5H2O △CuSO4 + 5H2O75.验证水的存在:CuSO4 + 5H2O ==== CuSO4·5H2O (现象:白色变为蓝色)76..二氧化硫溶于水:SO2+H2O==H2SO377.碳酸钙遇到含有二氧化碳的水:CaCO3+ H2O + CO2== Ca(HCO3)278.碳酸氢钙的分解:Ca(HCO3)2== CaCO3+ H2O + CO2↑(压强减小,温度升高反应速度加快)二氧化碳溶于水:H2O + CO2=== H2CO3生石灰溶解于水:CaO + H2O ==Ca(OH)2二氧化碳和碳高温:CO2+C高温2CO。
四氧化三铁如何生成铁的化学方程式铁与什么反应生成三氧化二铁?写出化学方程式.:铁在常温下比较平缓的缓慢氧化生成三氧化二铁. 4Fe+3O2=2Fe2O3 铁在氧气里的剧烈的燃烧反应生成四氧化三铁. 点燃3Fe+2O2=====Fe3O4铁在空气中生成3氧化2铁的化学方程式怎么写 - 作业帮:[答案] 4Fe+3O2=====2Fe2O3四氧化三铁和三氧化二铁各是怎样生成的 - 作业帮:[答案] 3Fe+2O2=点燃=Fe3O44Fe+3O2=缓慢氧化=2Fe2O3铁锈的生成:2Fe+O2+2H2O=2Fe(OH)2,但实际上暴露在空气中Fe(OH)2边生成边被氧化,所以生成的是Fe(OH)3:4Fe+3O2+6H2O=4Fe(OH)3.Fe(OH)3在空气中进一步部分脱水形成疏松的Fe...温度为几时生成三氧化二铁的化学方程式 - :4Fe+3O2=2Fe2O3 铁在空气中缓慢氧化生成三氧化二铁,铁锈Fe3O4在高温下,易氧化成氧化铁.4Fe3O4+O2=高温=6Fe2O3铁怎么生成三氧化二铁 - : 4Fe+3O2=2Fe2O3制备纯净的三氧化二铁方程式 - :你没有说原料.如果能得到较纯净的氢氧化铁,加热分解就可以得到较纯净的三氧化二铁化学方程式为:2Fe(OH)3==加热==Fe2O3+3H2O单单只有三氧化二铁生成的化学方程式 - :4Fe3O4+O2=6Fe2O3(条件是高温)铁在空气中生成3氧化2铁的化学方程式怎么写 - :4Fe+3O2=====2Fe2O3,请采纳谢谢三氧化二铁是怎样生成的生成的反应式? - 作业帮:[答案] 4Fe+3O2=2Fe2O3 Fe3O4=Fe2O3+FeO 2Fe(OH)3=Fe2O3+3H2O4FeCl2+3O2=2Fe2O3+4Cl2 2FeO+2H2O2=Fe2O3+2H...4FeS2+11O2=2Fe2O3+8SO2↑ 4FeCl2+2Cl2+3O2=2Fe2O3+3Cl2 我想的起来的暂时就这么多.话说你要这个干什么额. 还有...三氧化二铁的化学方程式是什么啊?:化学式——Fe2O3.生成Fe2O3的方程式有很多, 比如:2Fe(OH)3=加=热=Fe2O3+3H2O。
有关铁的化学方程式∆
1.铁在氯气中燃烧2Fe +3Cl
2=== 2FeCl
3
∆
2.铁与硫反应Fe + S ==== FeS
3.铁与水反应3Fe + 4H
2O ===== Fe
3O
4+4H
2↑
高温
∆
4.铁与非氧化性酸反应Fe +2HCl === FeCl
2+ H
2↑
5.铁和过量的稀硝酸反应Fe + 4HNO
3(稀) ==== Fe(NO
3)
3+ NO↑+ 2H
6.过量的铁和稀硝酸反应3Fe + 8HNO 3(稀) === 3Fe(NO
3)
2+ 2NO↑+ 4H
2O
7.铁与硫酸铜反应Fe + CuSO
4=== FeSO
4+ Cu
8.氧化亚铁与酸反应FeO +2HCl === FeCl 2+ H
2O
3FeO + 10HNO
3(稀) === 3Fe(NO
3)
3+ NO↑+ 5H
2O
9.氧化铁与酸反应Fe
2O
3+ 6HNO
3=== 2Fe(NO
3+ 3H
2O
10.氯化铁与氢氧化钠反应FeCl
3+ 3NaOH === Fe(OH)
3↓ + 3NaCl
∆
11.氢氧化铁受热反应2Fe(OH)
3==== Fe
2O
3+ 3H
2O
12.硫酸亚铁与氢氧化钠反应FeSO
4+ 2NaOH === Fe(OH)
2↓+ Na
2SO
4
13.氢氧化亚铁转化成氢氧化铁4Fe(OH) 2+ O
2+ 2H
2O === 4Fe(OH)
14.氢氧化亚铁与酸反应Fe(OH)
2+ 2HCl === FeCl
2+ H
2O
3Fe(OH)
2+ 10HNO
3=== 3Fe(NO
3)
3+ NO↑+ 8H
2O
15.氢氧化铁与酸反应Fe(OH)
3+ 3HNO
3=== Fe(NO
3)
3+ 3H
2O
16.氯化铁与硫氰化钾溶液反应FeCl 3+ 3KSCN === Fe(SCN)
3+ 3KCl
3
17.亚铁离子转化成铁单质Fe2++ Zn === Fe + Zn2+
18.铁转化成亚铁离子Fe + 2H+=== Fe2++ H
2↑
∆
19.铁转化成铁离子2Fe + 3Cl
2=== 2FeCl
3
∆
20.铁离子转化成铁Fe
2O
3+ 3CO ==== 2Fe + 3CO
2
21.亚铁离子转化成铁离子2Fe2++ Cl
2=== 2Fe3++2Cl-
22.铁离子转化成亚铁离子2Fe3++ Fe ===3 Fe2+
23.氯化铁溶液中加入碳酸钠2FeCl
3+ 3Na
2CO
3+ 3H
2O === 2Fe(OH)
3↓ + 3CO
2↑ + 6NaCl
24.铁在氧气中燃烧3Fe + 2O 2===== Fe
3O
4
点燃。