HPV基因诊断试剂盒
- 格式:ppt
- 大小:1.74 MB
- 文档页数:1
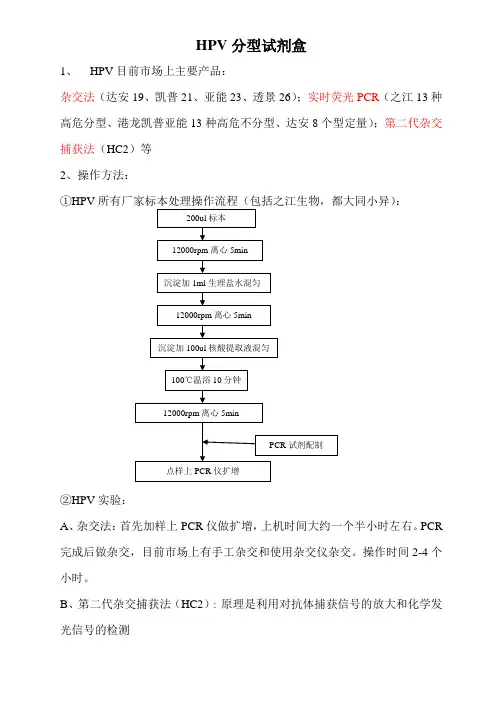
HPV分型试剂盒1、HPV目前市场上主要产品:杂交法(达安19、凯普21、亚能23、透景26);实时荧光PCR(之江13种高危分型、港龙凯普亚能13种高危不分型、达安8个型定量);第二代杂交捕获法(HC2)等2、操作方法::①HPV②HPV实验:A、杂交法:首先加样上PCR仪做扩增,上机时间大约一个半小时左右。
PCR 完成后做杂交,目前市场上有手工杂交和使用杂交仪杂交。
操作时间2-4个小时。
B、第二代杂交捕获法(HC2):原理是利用对抗体捕获信号的放大和化学发光信号的检测,C、荧光定量PCR:直接上机通过荧光信号累积实时监测整个PCR进程,之江生物是用多重PCR对标本进行准确的13个高危型的具体分型,其他不具体分型。
举例之江产品:之江八管双通道仪器(双色荧光PCR仪器都可以用):1 2 3 4 5 6 7 8 9 10 11 12A Mix1 Mix1 Mix1 Mix1 Mix1 Mix1 Mix1 Mix1 Mix1 Mix1 Mix1 Mix1B Mix2 Mix2 Mix2 Mix2 Mix2 Mix2 Mix2 Mix2 Mix2 Mix2 Mix2 Mix2C Mix3 Mix3 Mix3 Mix3 Mix3 Mix3 Mix3 Mix3 Mix3 Mix3 Mix3 Mix3D Mix4 Mix4 Mix4 Mix4 Mix4 Mix4 Mix4 Mix4 Mix4 Mix4 Mix4 Mix4E Mix5 Mix5 Mix5 Mix5 Mix5 Mix5 Mix5 Mix5 Mix5 Mix5 Mix5 Mix5F Mix6 Mix6 Mix6 Mix6 Mix6 Mix6 Mix6 Mix6 Mix6 Mix6 Mix6 Mix6G Mix7 Mix7 Mix7 Mix7 Mix7 Mix7 Mix7 Mix7 Mix7 Mix7 Mix7 Mix7H Mix8 Mix8 Mix8 Mix8 Mix8 Mix8 Mix8 Mix8 Mix8 Mix8 Mix8 Mix8一排八管做一个标本即可具体分型!HPV核酸荧光PCR检测混合液若FAM通道Ct值≤35,结果判断为若VIC通道Ct值≤35,结果判断为Mix1 16+56 HPV16 HPV56Mix2 18+45 HPV18 HPV45Mix3 35+59 HPV35 HPV59Mix4 39+51 HPV39 HPV51Mix5 58+52 HPV58 HPV52Mix6 31 HPV31Mix7 33 HPV33Mix8 68 HPV68②四管四通道仪器(ABI7500、罗氏480、伯乐CFX96、SLAN96孔等四色荧光PCR仪器):A Mix1 Mix1 Mix1 Mix1 Mix1 Mix1 Mix1 Mix1 Mix1 Mix1 Mix1 Mix1B Mix2 Mix2 Mix2 Mix2 Mix2 Mix2 Mix2 Mix2 Mix2 Mix2 Mix2 Mix2C Mix3 Mix3 Mix3 Mix3 Mix3 Mix3 Mix3 Mix3 Mix3 Mix3 Mix3 Mix3D Mix4 Mix4 Mix4 Mix4 Mix4 Mix4 Mix4 Mix4 Mix4 Mix4 Mix4 Mix4结果判断:3、产品分析比较:4、上海之江HPV优劣势:•优点:①闭管PCR操作,避免扩增污染②能够对13个高危型精确分型③灵敏度高,操作简单,减少了杂交的操作程序,一个实验大约2个小时内完成④针对开放荧光PCR检测系统,无需额外增加设备,有人员培训基础。



三家国产试剂盒HPV分型检测结果一致性比较分析余红;陆其兵【摘要】目的比较分析三家国产试剂盒HPV分型检测结果的一致性.方法收集近2个月来由之江检测的阳性标本82份,阴性标本10份,分别用3家国产试剂进行HPV基因分型检测2次,并进行比较.结果三家试剂结果重复性分别是之江95.6%,凯普96.7%,安普利95.6%.三家试剂检测结果完全一致率为51.1%(47/92),部分一致率为24.9%(22/92),不一致率为25.0%(23/92).单一型感染的一致率86.4%(32/37),多重感染完全一致率为22.2%(10/45),部分一致率为48.9%(22/45).结论三家国产试剂检测结果一致性不理想.建议患者进行前后治疗的效果对比,最好选在同一家医院进行检测,这样才具有可比性.【期刊名称】《临床输血与检验》【年(卷),期】2019(021)003【总页数】3页(P320-322)【关键词】人乳头瘤病毒;国产试剂盒;结果一致性【作者】余红;陆其兵【作者单位】224400 江苏省阜宁县人民医院检验科;224400 江苏省阜宁县人民医院检验科【正文语种】中文【中图分类】R373.9;R446.11人乳头瘤病毒(HPV)是常见的一种性传播疾病的病原体,分为高危型和低危型,其中高危型HPV感染已被证实与宫颈癌的发生密切相关,HPV检测在宫颈癌筛查中越来越受到重视[1]。
目前HPV检测主要采用分子生物学方法,我国注册的HPV检测试剂盒大部分检测L1基因序列,也有检测全基因组或HPV E6/7序列,但分子生物学方法检测技术也并不完美,这些设计无法顾全到HPV型别全覆盖和型别特异等问题。
本文选用了三家国产试剂进行HPV分型检测并进行比较,发现三家国产试剂检测结果的一致性很不理想。
材料与方法1 仪器与试剂仪器为上海复星SLAN-96S实时荧光扩增仪,三家国产试剂分别是上海之江生产的HPV分型试剂:6+11、16、18、31、33、35、39、45、51、52、56、58、59、66、68、82,其中两个低危不分型。

人乳头瘤病毒基因分型(32型)检测试剂盒使用说明书(PCR-反向斑点杂交法)【产品名称】通用名称:人乳头瘤病毒基因分型(32型)检测试剂盒(PCR-反向斑点杂交法)英文名称:Human Papillomavirus Genotyping Kit For 32 Types(PCR-RDB)【包装规格】25人份/盒【预期用途】本试剂盒用于检测宫颈脱落细胞是否感染人乳头瘤病毒(Human papillomavirus,HPV)并加以分型,对宫颈癌的早期诊断有重要意义。
【检测原理】反向斑点杂交法本试剂根据HPV基因组的特点设计生物素标记的引物,PCR扩增各基因型HPV的目的片段。
将32型HPV特异性寡核苷酸探针固定在尼龙膜上。
根据生物素-亲和素系统(Biotin-avidin system,BAS)原理,将PCR扩增产物与固化在膜条上的探针杂交,洗膜后加入辣根过氧化合物酶标记的亲和素(POD),与PCR产物上的生物素结合。
加入显色液(TMB,H2O2),辣根过氧化物酶催化其底物H2O2分解,TMB作为供氢体参与反应后产生蓝色的斑点。
根据杂交信号斑点的有无来判断样本中是否存在HPV的基因型。
本试剂盒能有效检测WHO确认的32种HPV的基因型,其中包括19种高危亚型:HPV16、18、26、31、33、35、39、45、51、52、53、56、58、59、66、68、73、82、83型;13种低危亚型:HPV6、11、40、42、43、44、55、61、67、69、70、72、81型。
【主要组成成分】【自备试剂】1、20×SSC:称取175.3gNaCl和88.2g枸橼酸钠二水,用800mL双蒸水溶解,浓HCl调节pH值至7.0,定容至1000mL,高压灭菌,室温保存。
2、10%SDS:将20gSDS溶解在180mL双蒸水中,浓HCl调节pH值至7.0,定容至200mL,高压灭菌,室温保存。
3、1M柠檬酸钠:294.1g柠檬酸钠加纯水800mL溶解,用浓HCl调pH值至5.0,定容至1000mL,室温保存。
人乳头瘤病毒核酸分型检测试剂盒(荧光PCR 法)标准操作流程一、目的:规范实验室操作,正确使用PCR扩增仪进行HPV-DNA扩增分析,以保证实验结果的准确性。
二、适用范围:人乳头状瘤病毒(HPV)基因分型检测试剂盒在扩增仪上进行扩增以及分析。
三、职责:由临床分子生物实验室专业技术人员制定程序文件,实验室负责人审核,科室主任批准实施。
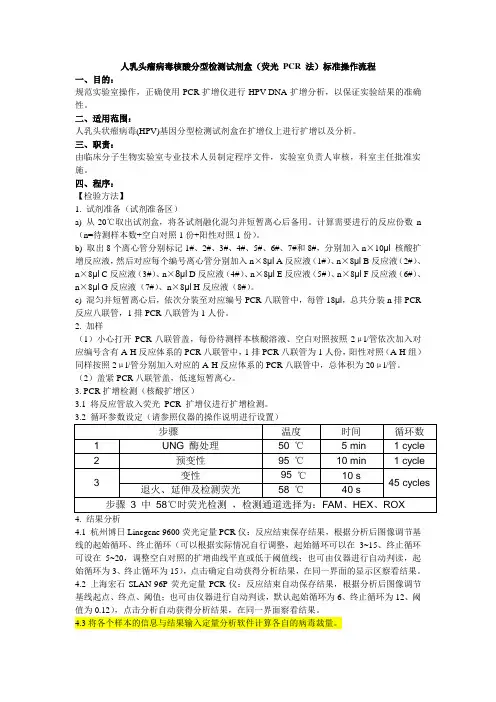
四、程序:【检验方法】1. 试剂准备(试剂准备区)a) 从-20℃取出试剂盒,将各试剂融化混匀并短暂离心后备用。
计算需要进行的反应份数n (n=待测样本数+空白对照1份+阳性对照1份)。
b) 取出8个离心管分别标记1#、2#、3#、4#、5#、6#、7#和8#,分别加入n×10μl 核酸扩增反应液,然后对应每个编号离心管分别加入n×8μl A反应液(1#)、n×8μl B反应液(2#)、n×8μl C反应液(3#)、n×8μl D反应液(4#)、n×8μl E反应液(5#)、n×8μl F反应液(6#)、n×8μl G反应液(7#)、n×8μl H反应液(8#)。
c) 混匀并短暂离心后,依次分装至对应编号PCR八联管中,每管18μl,总共分装n排PCR 反应八联管,1排PCR八联管为1人份。
2. 加样(1)小心打开PCR八联管盖,每份待测样本核酸溶液、空白对照按照2μl/管依次加入对应编号含有A-H反应体系的PCR八联管中,1排PCR八联管为1人份,阳性对照(A-H组)同样按照2μl/管分别加入对应的A-H反应体系的PCR八联管中,总体积为20μl/管。
(2)盖紧PCR八联管盖,低速短暂离心。
3. PCR扩增检测(核酸扩增区)3.1 将反应管放入荧光PCR 扩增仪进行扩增检测。
4. 结果分析4.1 杭州博日Linegene 9600荧光定量PCR仪:反应结束保存结果,根据分析后图像调节基线的起始循环、终止循环(可以根据实际情况自行调整,起始循环可以在3~15、终止循环可设在5~20,调整空白对照的扩增曲线平直或低于阈值线;也可由仪器进行自动判读,起始循环为3、终止循环为15),点击确定自动获得分析结果,在同一界面的显示区察看结果。

HPV分型试剂盒1、HPV目前市场上主要产品:杂交法(达安19、凯普21、亚能23、透景26);实时荧光PCR(之江13种高危分型、港龙凯普亚能13种高危不分型、达安8个型定量);第二代杂交捕获法(HC2)等2、操作方法::①HPV②HPV实验:A、杂交法:首先加样上PCR仪做扩增,上机时间大约一个半小时左右。
PCR 完成后做杂交,目前市场上有手工杂交和使用杂交仪杂交。
操作时间2-4个小时。
B、第二代杂交捕获法(HC2):原理是利用对抗体捕获信号的放大和化学发光信号的检测,C、荧光定量PCR:直接上机通过荧光信号累积实时监测整个PCR进程,之江生物是用多重PCR对标本进行准确的13个高危型的具体分型,其他不具体分型。
举例之江产品:之江八管双通道仪器(双色荧光PCR仪器都可以用):1 2 3 4 5 6 7 8 9 10 11 12A Mix1 Mix1 Mix1 Mix1 Mix1 Mix1 Mix1 Mix1 Mix1 Mix1 Mix1 Mix1B Mix2 Mix2 Mix2 Mix2 Mix2 Mix2 Mix2 Mix2 Mix2 Mix2 Mix2 Mix2C Mix3 Mix3 Mix3 Mix3 Mix3 Mix3 Mix3 Mix3 Mix3 Mix3 Mix3 Mix3D Mix4 Mix4 Mix4 Mix4 Mix4 Mix4 Mix4 Mix4 Mix4 Mix4 Mix4 Mix4E Mix5 Mix5 Mix5 Mix5 Mix5 Mix5 Mix5 Mix5 Mix5 Mix5 Mix5 Mix5F Mix6 Mix6 Mix6 Mix6 Mix6 Mix6 Mix6 Mix6 Mix6 Mix6 Mix6 Mix6G Mix7 Mix7 Mix7 Mix7 Mix7 Mix7 Mix7 Mix7 Mix7 Mix7 Mix7 Mix7H Mix8 Mix8 Mix8 Mix8 Mix8 Mix8 Mix8 Mix8 Mix8 Mix8 Mix8 Mix8一排八管做一个标本即可具体分型!HPV核酸荧光PCR检测混合液若FAM通道Ct值≤35,结果判断为若VIC通道Ct值≤35,结果判断为Mix1 16+56 HPV16 HPV56Mix2 18+45 HPV18 HPV45Mix3 35+59 HPV35 HPV59Mix4 39+51 HPV39 HPV51Mix5 58+52 HPV58 HPV52Mix6 31 HPV31Mix7 33 HPV33Mix8 68 HPV68②四管四通道仪器(ABI7500、罗氏480、伯乐CFX96、SLAN96孔等四色荧光PCR仪器):A Mix1 Mix1 Mix1 Mix1 Mix1 Mix1 Mix1 Mix1 Mix1 Mix1 Mix1 Mix1B Mix2 Mix2 Mix2 Mix2 Mix2 Mix2 Mix2 Mix2 Mix2 Mix2 Mix2 Mix2C Mix3 Mix3 Mix3 Mix3 Mix3 Mix3 Mix3 Mix3 Mix3 Mix3 Mix3 Mix3D Mix4 Mix4 Mix4 Mix4 Mix4 Mix4 Mix4 Mix4 Mix4 Mix4 Mix4 Mix4结果判断:3、产品分析比较:4、上海之江HPV优劣势:•优点:①闭管PCR操作,避免扩增污染②能够对13个高危型精确分型③灵敏度高,操作简单,减少了杂交的操作程序,一个实验大约2个小时内完成④针对开放荧光PCR检测系统,无需额外增加设备,有人员培训基础。


入空白对照、阳性质控、阳性DNA对照,建议加样编号顺序如下:首先依次是不同的样本编号,最后为阳性质控、阳性DNA对照、与空白对照管(蒸馏水)。
6.2.3 从冰箱中取出PCR试剂盒,将PCR Premix融化后,与Taq酶管一起放入离心机中点动离心。
6.2.4 将试剂放入生物安全柜内,将已点动离心了的PCR premix管、Taq酶管插在冰块上保持在低温条件下。
6.1.6 按照反应数计算所需的PCR各个组份的数量来准备PCR Mastermix(可参照PCR MIX与酶混合比例如下表)。
6.2.7 在生物安全柜内,按已计算好的PCR premix用量,从冰中取出相应的PCR premix管吸取准确量后加入对应的1.5ml离心管中,将PCR premix管放回冰块中。
6.2.8 垂直将枪头小心打入废液缸中,确保移液枪前臂没有碰到废液缸口。
6.2.9 从冰中取出Taq酶管,按计算好的用量(可参照PCR MIX与酶混合比例附表),吸取准确量后分别加入对应的1.5ml离心管中。
6.2.10 盖紧1.5ml离心管盖,同时将PCR premix管及Taq酶管从超净台中取出放回-20℃冰箱的原包装中,标注已使用数量。
6.2.11 将已加入PCR premix和Taq酶的1.5ml离心管在涡旋器上振荡5sec,放入离心机点动离心。
6.2.12 在生物安全柜中,将6种PCR混合液分装入对应的0.2ml PCR扩增管中,每管加入混合液18ul,加完后将所有PCR管盖盖上。
6.3 DNA提取6.3.1将临床样本及阴性对照品置室温下解冻,把标本编号,取出相应数量的样本管,对应编号。
6.3.2 将临床样本振荡混匀,伸入采集管底部吸取临床样本0.8ml 至管底,。

2024年人乳头瘤病毒核酸检测试剂盒市场环境分析一、市场概述人乳头瘤病毒(HPV)是一种常见的性传播疾病,其感染与宫颈癌、其他妇科癌症以及口腔颌面部等恶性肿瘤的发生密切相关。
HPV核酸检测试剂盒作为一种常用的检测工具,可以快速、准确地检测出患者体内是否存在HPV病毒感染。
随着人们对性健康的重视程度提高,HPV核酸检测试剂盒市场迅速发展。
本文将对该市场的环境进行分析。
二、市场规模与增长趋势根据市场调研数据显示,全球HPV核酸检测试剂盒市场在近年来呈现稳步增长的态势。
2019年,全球HPV核酸检测市场规模达到XX亿美元,预计到2025年,市场规模将达到XX亿美元,年均复合增长率约为XX%。
市场增长的主要驱动因素包括:1.HPV感染率的上升:随着性行为自由化和人们性健康意识的提高,HPV感染的发生率逐年上升,促进了检测需求的增加。
2.宫颈癌筛查政策的推动:许多国家和地区推行了宫颈癌筛查政策,将HPV核酸检测作为常规筛查项目,对市场的增长起到了推动作用。
3.技术进步的推动:HPV核酸检测技术不断改进,检测精度和敏感性得到提高,对市场需求的增加起到了积极作用。
三、市场竞争格局目前,全球HPV核酸检测试剂盒市场竞争激烈,主要竞争对手包括以下几家公司:1.公司A:是全球领先的生物技术公司,拥有先进的核酸检测技术和完善的售后服务体系,市场份额居于领先地位。
2.公司B:专注于HPV核酸检测领域多年,产品质量可靠,市场声誉良好,在某些地区占据较大市场份额。
3.公司C:新兴的生物技术公司,推出了具有创新性的HPV核酸检测试剂盒产品,正在逐步扩大市场份额。
四、市场驱动因素分析1.政策支持:一些国家和地区紧密结合公共卫生政策,推动HPV核酸检测的普及。
2.人口结构变化:全球人口老龄化趋势明显,特别是发达国家,需求增加。
3.市场渗透率低:尽管市场规模不断增长,但HPV核酸检测的普及率仍然相对较低,有较大的市场空间和潜力。
五、市场挑战因素分析1.技术标准与监管:HPV核酸检测技术标准尚不完善,各国监管要求不一,在产品研发和市场准入方面存在一定的挑战。

中国食品药品检定研究院人乳头瘤病毒全基因组分型参考品National reference materials for thecomplete genome of Human PapillomavirusGenotyping【批号】360003-201602【性状】无色液体【用途】用于以以非L1区域如E6、E7区域和全基因组为靶序列的人乳头瘤病毒核酸(基因分型)检测试剂盒质量控制和评价。
【包装】1.5mL 冻存管【规格】27支/套,HPV 全基因组分型不同型别重组质粒参考品27支,阴性参考品5支,分别为正常人基因组DNA、CMV、UU、CT、HSV2。
基质液为2ng/ul 正常人基因组,在通风橱中分装到1.5mL 冻存管中,每管100ul,每种不同HPV 基因型的重组质粒浓度约为106-107拷贝/ml。
注:●代表高危型,共有13种。
▲代表中等危险型,其余为低危型;82和ISO39、MM4等同,84和MM8等同。
中国食品药品检定研究院【使用方法和要求】1.本品核酸提取前常温溶解、混匀。
2.使用时要求按照106-107拷贝/ml 浓度进行稀释,稀释液应为2ng/ul 正常人基因组TE 溶液。
本参考品使用时,应满足:1、准确性(阳性符合率):要求检测试剂盒检测范围内人乳头瘤病毒不同型别国家分型参考品结果应均为阳性。
2、特异性:a)采用实时荧光PCR、PCR-杂交等原理检测试剂盒检测5份阴性参考品,检测结果应为阴性。
检测本参考品22种不同型别阳性参考品,检测结果应为不在其检测范围内的高危型别,应不得出现交叉;不在其检测范围内的低危型别,交叉反应率应分别不大于10.0%。
b)采用杂交捕获-化学发光法原理的检测试剂盒检测5份阴性参考品,检测结果应为阴性。
检测本参考品22种不同型别阳性参考品,检测结果应符合制造商的要求并注明可能产生交叉反应的型别。
3、重复性(精密度):a)采用实时荧光PCR 原理的检测试剂盒,要求批内精密度应符合Ct 值的变异系数(CV,%)不大于5.0%。
HPV基因分型检测试剂盒常见问题教学课件(一)HPV基因分型检测是一项重要的生化检验,对于病毒性疾病的预防和治疗具有重要意义。
而HPV基因分型检测试剂盒是目前市场上最常用的检测工具之一。
下面就来了解一下HPV基因分型检测试剂盒中常见的问题及教学课件。
常见问题:1.检测原理:HPV分型检测是基于荧光定量PCR技术,通过检测病毒DNA来识别和鉴定不同类型的HPV病毒。
2.样本类型:HPV基因分型检测的样本可以从阴道、宫颈、包皮等部位采集,其中以宫颈抹片为主要样本。
3.样本采集技巧:在采集样本前,需要女性病人禁止洗澡,性生活,以及使用药物等干扰因素。
采集时要求专业医护人员采用无菌操作的方式,以避免样本受到污染。
4.检测结果的解读:HPV基因分型检测试剂盒可将检测结果分为阳性和阴性两个结果。
如果检测结果为阳性,则需要根据检测结果中列举的不同亚型,结合病人的病情,对病情进行进一步的判断和治疗。
教学课件:1.样本采集技巧:课件中应该包括女性病人采集阴道、宫颈、包皮样本的步骤,以及采集时的禁忌和注意事项。
同时还应该介绍如何保障采集过程中的无菌操作。
2.检测原理:HPV基因分型检测的原理是基于PCR技术的,课件需着重说明PCR技术的基本原理,以及如何通过PCR扩增目标DNA的方法。
3.检测结果的解读:课件中应该列举常见的HPV病毒亚型以及其对应的感染和病症。
这样,医生在解读检测结果时,可以更加准确判断HPV 病毒的类型和严重程度。
4.资料分析与比较:HPV基因分型检测试剂盒有多种型号,不同型号之间的检测原理和检测结果解读可能会有所差别。
因此,课件应该将不同型号的测试盒进行分类,并对各个型号的检测原理、样本要求、结果解读等进行详细的说明。
这有助于医生根据不同型号进行测试时,避免操作失误和不必要的风险。
总之,HPV基因分型检测试剂盒教学课件的设计需要充分考虑实际使用中遇到的问题,并且应注重方法的简单明了,语言的易懂易学,让受众能够快速学习和掌握相关的知识和技能。
本参考品未经批准,说明书仅供参考版本号: V1.0中国食品药品检定研究院人乳头瘤病毒全基因组分型参考品National reference materials for the complete genome of HumanPapillomavirus genotyping【类别】体外诊断试剂参考品 【批号】370060-201901【性状】无色液体【用途】本参考品由病毒培养物和HPV全基因组质粒组成,适用于以非L1区域如E6、E7区域和全基因组为靶序列的人乳头瘤病毒核酸(基因分型)检测试剂盒的质量控制和评价,包括但不限于PCR-荧光探针法、PCR反向杂交法、基因芯片法、恒温扩增法、杂交捕获法、酶切信号放大、测序法等方法学原理。
【组成和规格】此参考盘组成为28支/套,包括23个不同型别的HPV参考品和5个HPV阴性参考品(分别为CMV、HSV-1、CT、GBS和UU),详细信息见下表。
参考品类型型别浓度(IU/ml) 规格 高危型HPV 参考品HPV16 1.49×107100μl/支 HPV18 6.52×106 100μl/支 HPV31 7.49×106 100μl/支 HPV33 6.55×106 100μl/支 HPV35 9.31×106 100μl/支 HPV39 6.63×106 100μl/支 HPV45 3.87×106 100μl/支 HPV51 5.18×106 100μl/支 HPV52 7.30×106 100μl/支 HPV56 1.02×107 100μl/支 HPV58 4.10×106 100μl/支 HPV59 5.57×106 100μl/支 HPV66 8.51×106 100μl/支 HPV68 8.72×106 100μl/支 潜在高危型HPV 参考品HPV26 1.45×107 100μl/支 HPV53 9.00×106 100μl/支 HPV735.72×106100μl/支本参考品未经批准,说明书仅供参考版本号: V1.0中国食品药品检定研究院HPV82 8.79×106100μl/支 低危型HPV 参考品HPV6 1.10×107100μl/支 HPV11 1.49×107 100μl/支 HPV42 9.78×106 100μl/支 HPV43 7.56×106 100μl/支 HPV81 1.30×107100μl/支 HPV 阴性参考品NC1 / 500μl/支 NC2 / 500μl/支 NC3 / 500μl/支 NC4 / 500μl/支 NC5/500μl/支注: 82和ISO39、MM4等同。
专利名称:一种检测HPV病毒感染致宫颈癌的试剂盒专利类型:发明专利
发明人:胡争,田瑞,崔资凤,金庄
申请号:CN202010992308.4
申请日:20200921
公开号:CN112114145A
公开日:
20201222
专利内容由知识产权出版社提供
摘要:本发明提供一种检测HPV病毒感染致宫颈癌的试剂盒,包含试剂亚组1、2,所述试剂亚组1、2分别以含检测Spondin 1和p16INK4a水平的试剂作为筛选和诊断HPV病毒感染致宫颈癌的标志物,主要分为捕获抗体、检测抗体、化学发光底物AMPPD、稀释液和洗涤浓缩液,所述检测抗体是将碱性磷酸酯酶加入到PBS,再加入戊二醛,然后分别与检测鼠抗人Spondin 1的单克隆抗体或检测鼠抗人p16INK4a的单克隆抗体混合制成,可检测的样品是来自所述对象的血液、血清、血浆、淋巴、脑脊液、腹水、尿和组织活检物。
本发明所提供的试剂盒的宫颈癌诊断方法和试剂盒的灵敏度和特异性均得到显著提高,极大地降低了假阳性率,能够有效用于宫颈癌的早期筛查。
申请人:中山大学附属第一医院
地址:510080 广东省广州市越秀区中山二路58号
国籍:CN
代理机构:广州粤弘专利代理事务所(普通合伙)
代理人:马腾飞
更多信息请下载全文后查看。