食品中大肠菌群的检验.
- 格式:ppt
- 大小:265.50 KB
- 文档页数:11

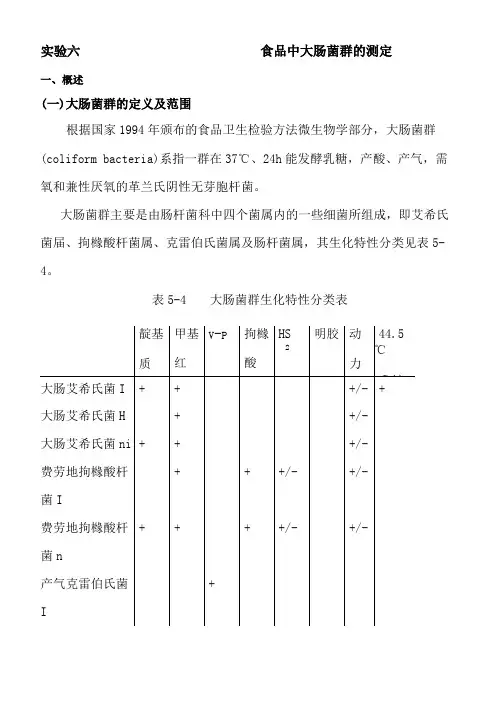
实验六食品中大肠菌群的测定一、概述(一)大肠菌群的定义及范围根据国家1994年颁布的食品卫生检验方法微生物学部分,大肠菌群(coliform bacteria)系指一群在37℃、24h能发酵乳糖,产酸、产气,需氧和兼性厌氧的革兰氏阴性无芽胞杆菌。
大肠菌群主要是由肠杆菌科中四个菌属内的一些细菌所组成,即艾希氏菌届、拘橼酸杆菌属、克雷伯氏菌属及肠杆菌属,其生化特性分类见表5-4。
表5-4 大肠菌群生化特性分类表产气克雷伯氏菌+ + +n阴沟肠杆菌+ —+ + ——+/——注:+,表示阳性;一,表示阴性;+/-,表示多数阳性,少数阴性。
由上表可以看出,大肠菌群中大肠艾希氏菌i型和ni型的特点是,对靛基质、甲基红、v-P和拘橼酸盐利用四个生化反应分别为“十十一一”通常称为典型大肠杆菌;而其他类大肠杆菌则披称为非典型大肠杆菌。
(二)大肠菌群的测定意义1、粪便污染的指标细菌早在1892年,沙尔丁格(Schardinger)氏首先提出大肠杆菌作为水源中病原菌污染的指标菌的意见,因为大肠杆菌是存在于人和动物的肠道内的常见细菌。
一年后,塞乌博耳德“斯密斯(Theobold. Smith)氏指出,大肠杆菌因普遍存在于肠道内,若在肠道以外的环境中发现,就可以认为这是由于人或动物的粪便污染造成的;从此,就开始应用大肠杆菌作为水源中粪便污染的指标菌。
据研究发现,成人粪便中的大肠菌群的含量为:108个/g —109个/g。
若水中或食品中发现有大肠菌群,即可证实已被粪便污染,有粪便污染也就有可能有肠道病原菌存在。
根据这个理由,就可以认为这种含有大肠菌群的水或食品供食用是不安全的。
所以目前为评定食品的卫生质量而进行检验时,也都采用大肠菌群或大肠杆菌作为粪便污染的指标细菌。
当然,有粪便污染,不一定就有肠道病原菌存在,但即使无病原菌,只要被粪便污染的水或食品,也是不卫生的,不受人喜欢的。
2.粪便污染指标菌的选择作为理想的粪便污染的指标菌应具备以下几个特性,才能起到比较正确的指标作用。


以下是一个示例的食品中大肠菌群测定实验报告的结构,你可以根据实际实验结果和要求进行相应的填写和修改:实验报告标题: 食品中大肠菌群测定实验报告实验目的:在本实验中,我们旨在测定食品样品中的大肠菌群的数量,以评估食品的卫生质量和食品安全性。
实验原理:大肠菌群是一类存在于肠道中的细菌,其存在于食品中可能是由于不良的卫生条件或食品受到污染导致的。
本实验将使用培养基和平板计数法来估算食品样品中大肠菌群的数量。
实验材料:食品样品:[填写食品样品的名称和来源]生理盐水或缓冲液大肠菌群选择性培养基(例如,MAC琼脂培养基)灭菌的培养皿移液器、微量环针或滤纸片烧杯、试管、无菌培养皿微量移液器或移液枪实验步骤:准备样品:称取适量的食品样品,并在无菌条件下将其加入到烧杯或试管中。
样品预处理:向样品中加入一定体积的生理盐水或缓冲液,并使用搅拌或振荡等方法将样品与溶液充分混合均匀。
稀释:从样品中取出适量的稀释液,依次进行稀释,制备一系列浓度逐渐减少的稀释液。
培养基接种:将每种稀释液分别接种于含有大肠菌群选择性培养基的无菌培养皿上。
培养:将接种的培养皿倒置,置于恒温培养箱中,在适当的温度下培养一定时间(通常为24-48小时)。
计数:在培养箱中观察培养皿,记录上面出现的典型大肠菌群菌落的数量。
数据处理:根据所使用的稀释倍数和接种量,计算出每克或每毫升食品样品中的大肠菌群菌落形成单位(CFU)。
实验结果:在本次实验中,我们测定了食品样品中大肠菌群的数量。
结果如下:样品1:大肠菌群数量为X CFU/g (或CFU/mL)。
样品2:大肠菌群数量为X CFU/g (或CFU/mL)。
...结论:根据我们的测定结果,食品样品中的大肠菌群数量符合/不符合相关卫生标准。
结合食品的使用和处理建议,可以评估食品样品的卫生质量和食品安全性。
结果讨论:讨论实验结果,包括与卫生标准的比较、潜在污染原因、可能的改进措施等。
实验总结:总结实验的目的、方法、结果和结论,并提出对未来工作的建议。


食品中大肠菌群的测定实验报告一、实验目的。
本实验旨在测定食品中的大肠菌群数量,以评估食品的卫生安全水平。
二、实验原理。
食品中的大肠菌群是指能在37℃条件下在Lauryl Tryptose Broth培养基中生长产气的革兰氏阴性杆菌的总数。
大肠杆菌是大肠菌群的代表性菌种,因此其数量可以作为食品卫生安全的指标之一。
三、实验步骤。
1. 取样,从不同来源的食品中取样,如肉类、蔬菜、水果、奶制品等。
2. 样品处理,将取样的食品样品进行处理,如洗涤、研磨等,以获得可检测的样品。
3. 菌落计数,将处理后的样品接种在Lauryl Tryptose Broth培养基中,培养一定时间后,进行菌落计数。
4. 数据分析,根据菌落计数结果,计算出食品中的大肠菌群数量。
四、实验结果。
经过实验测定,不同食品样品中的大肠菌群数量有所不同。
其中,肉类制品中的大肠菌群数量较高,蔬菜水果中次之,奶制品中较低。
这表明食品的卫生安全水平存在一定差异。
五、实验结论。
食品中的大肠菌群数量是评估食品卫生安全水平的重要指标之一。
通过本实验的测定,可以初步评估食品的卫生安全状况,为食品生产和消费提供参考依据。
未来可以结合其他指标和方法,进一步完善食品卫生安全评估体系。
六、实验注意事项。
1. 在取样和处理过程中,要注意避免外源污染,以保证实验结果的准确性。
2. 在菌落计数过程中,要严格按照操作规程进行,避免误差的产生。
3. 实验结束后,要及时清洗和消毒实验器材,以确保实验室的卫生安全。
七、参考文献。
1. 《食品微生物学实验指导》,XXX,XXX出版社,200X年。
2. 《食品卫生与安全》,XXX,XXX出版社,200X年。
以上为食品中大肠菌群的测定实验报告内容,谢谢阅读。


食品中大肠菌群的检验简介大肠菌群是指含有大肠菌属(Escherichia coli)和奇异变形杆菌属(Coliform bacteria)的细菌群体。
它们存在于人和动物的肠道中,也可以存在于环境中,如土壤、水体和食品中。
食品中的大肠菌群是导致食品中毒的主要病原体之一。
因此,对食品中大肠菌群的检验非常重要,以确保食品的卫生和安全。
本文将介绍食品中大肠菌群的检验方法和操作流程。
方法和步骤1. 样品采集样品采集是食品中大肠菌群检验的第一步。
根据需要检验的食品种类,选择合适的采样方法。
常见的食品样品包括水果、蔬菜、肉类和乳制品等。
采集样品时,应使用干净无菌的容器,并避免污染。
确保样品的代表性,避免极端状况下的取样,如选择已烂的水果或有明显变质的食品。
2. 样品处理样品处理是为了提取样品中的菌群以进行后续的检测。
处理过程应在无菌条件下进行,以避免外部的污染。
常见的样品处理方法包括:•加入盐水:将样品加入含有氯化钠的缓冲液中,以便菌群的释放。
•搅拌和均质:使用搅拌器或者均质器将样品搅拌均匀,以确保菌群的均匀分布。
•过滤:通过滤膜将样品过滤,以分离固体物质和悬浮物。
3. 培养基选择选择适当的培养基是进行大肠菌群检验的关键。
常用的培养基包括马铃薯葡萄糖琼脂(Plate Count Agar,PCA)、大肠杆菌选择琼脂(MacConkey Agar)、经典蓝琼脂(Eosin Methylene Blue Agar)等。
不同的培养基适用于不同目的的检验。
PCA适用于总菌群计数,MacConkey Agar适用于大肠菌群的选择性检测,Eosin Methylene Blue Agar适用于大肠杆菌的计数和鉴别。
4. 培养和孵育将样品处理后的培养基平板进行孵育。
孵育的时间和温度根据菌群的生长特性而定。
一般情况下,孵育时间为24小时,温度为37摄氏度。
培养过程中,需要注意避免交叉污染。
每个样品应使用独立的培养基平板进行孵育,且标记清楚以区分不同样品。

【GB/T 4789.3—1994】食品卫生微生物学检验大肠菌群测定1 主题内容与适用范围本标准规定了食品中大肠菌群的测定方法。
本标准适用于食品中大肠菌群的测定。
2 术语大肠菌群系指一群能发酵乳糖、产酸产气、需氧和兼性厌氧的革兰氏阴性无芽胞杆菌。
该菌主要来源于人畜粪便,故以此作为粪便污染指标来评价食品的卫生质量,推断食品中有否污染肠道致病菌的可能。
食品中大肠菌群数系以100mL(g)检样内大肠菌群最可能数(MPN)表示。
3 引用标准GB 4789.28 食品卫生微生物学检验染色法、培养基和试剂 4 设备和材料4.1 温箱:36±1℃。
4.2 冰箱:0~4℃。
4.3 恒温水浴:44.5±0.5℃。
4.4 天平。
4.5 显微镜。
4.6 均质器或乳钵。
4.7 平皿:直径为90mm。
4.8 试管。
4.9 吸管。
4.10 广口瓶或三角烧瓶:容量为500mL。
4.11 玻璃珠:直径约5mm。
4.12 载玻片。
4.13 酒精灯。
4.14 试管架。
5 培养基和试剂5.1 乳糖胆盐发酵管:按GB 4789.28中4.9规定。
5.2 伊红美蓝琼脂平板:按GB 4789.28中4.25沥规定。
5.3 乳糖发酵管:按GB 4789.28中4.10规定。
5.4 EC肉汤:按GB 4789.28中4.11规定。
5.5 磷酸盐缓冲稀释液:按GB 4789.28中3.22规定。
5.6 生理盐水。
5.7 革兰氏染色液:按GB 4789.28中2.2规定。
6 检验程序大肠菌群检验程序如下:(图略)7 操作步骤。

测试片法检测食品中大肠菌群的验证评价陶文靖1,董 彬2,焦凤莲3,周 琦1,曲连海1,王 琦3*(1.北京美正生物科技有限公司,北京 102200;2.北京光明健能乳业有限公司,北京 101300;3.通标标准技术服务(青岛)有限公司,山东青岛 266071)摘 要:为探究大肠菌群测试片法在食品检测中的可行性,依据国际标准ISO 16140-2:2016中的性能指标验证要求,对MicroFast®大肠菌群测试片法进行包容性、排他性,以及与国家标准《食品安全国家标准食品微生物学检验大肠菌群计数》(GB 4789.3—2016)中方法的一致性验证,采用t-检验和Bland-Altman分析方法进行一致性分析评价。
16株目标菌在测试片上形成典型菌落,24株非目标菌中的23株均未在测试片上形成菌落,阿巴特图巴沙门氏菌ATCC 35640在测试片上形成非典型菌落。
测试片法和GB 4789.3—2016中方法的检测结果呈正相关(R2>0.976);95%置信区间的样品比例为1∶25,满足不得高于1∶20的要求;所有食品类型的β-期望容忍区间(β-ETI)均在±0.5对数单位范围内,测试片法和GB 4789.3—2016方法具有很好的一致性。
MicroFast®大肠菌群测试片法对纯菌株的包容性和排他性良好,在一致性方面符合ISO 16140-2:2016对方法等效性的要求,可作为替代方法,用于检测食品中的大肠菌群。
关键词:测试片法;大肠菌群;平板计数法Validation of Coliform in Food by Test Tablets Method TAO Wenjing1, DONG Bin2, JIAO Fenglian3, ZHOU Qi1, QU Lianhai1, WANG Qi3*(1.Beijing Meizheng Bio-Tech Co., Ltd., Beijing 102200, China; 2.Beijing Guangming Jianeng Dairy Co., Ltd., Beijing 101300, China; 3.SGS-CSTC Standards Technical Services Co., Ltd., (Qingdao), Qingdao 266071, China) Abstract: This study was aimed to evaluate the feasibility of coliform detection in food by coliform test tablets. Based on performance indicator verification requirements of international standard ISO16140-2:2016, MicroFast®coliform test tablets method was used for evaluation, including inclusivity, exclusivity, and consistency with GB 4789.3—2016 method, and t-test and Bland-Altman analysis were used for consistency analysis and evaluation. The 16 target strains all grew typical colonies on the test tablets, and 23 of the 24 non-target strains had no colonies on the test tablets. Salmonella Abatetuba ATCC 35640 formed atypical colonies on the test tablets. There was a positive correlation between the test tablets method and the national standard method (R2>0.976). The proportion of samples exceeding the 95% confidence interval of the total average value of the difference was 1∶25, which met the ratio requirement of no more than 1∶20. The β-expected tolerance interval (β-ETI) for all food types was ±0.5log10 units, the two methods were in good agreement. MicroFast® coliform count plate had good performance in terms of inclusivity and exclusivity to pure strains, met the requirements of ISO16140-2:2016 for method equivalence in terms of consistency. It can be used as an alternative method for testing coliforms in food.Keywords: test tablets method; coliforms; plate count method大肠菌群(Coliforms)是指在一定培养条件下能发酵乳糖、产酸产气的需氧和兼性厌氧革兰氏阴性无芽孢杆菌[1]。

一、实验目的1. 了解大肠菌群在食品卫生检验中的意义。
2. 学习并掌握大肠菌群的检验原理和方法。
3. 通过实验,掌握食品卫生质量的判断标准。
二、实验原理大肠菌群是指一群能在37℃经24小时发酵乳糖、产酸产气、需氧和兼性厌氧的革兰氏阴性无芽孢杆菌。
该菌主要来源于人畜粪便,故以此作为粪便污染指标来评价食品的卫生质量,推断食品中是否有污染肠道致病菌的可能。
三、实验材料1. 样品:乳、肉、禽蛋制品、饮料、糕点、发酵调味品或其他食品。
2. 菌种:大肠埃希氏菌、产气肠杆菌。
3. 培养基及试剂:单料乳糖胆盐发酵管、双料乳糖胆盐发酵管、乳糖胆盐发酵管、伊红美蓝琼脂、革兰氏染色液、蛋白陈水、靛基质试剂、麦康凯(MA)。
4. 其他设备和材料:温箱、移液器、无菌试管、无菌吸管、无菌培养皿等。
四、实验方法1. 样品处理:取适量样品,加入适量的蛋白陈水,进行均质化处理。
2. 稀释:将均质化后的样品进行10倍梯度稀释,分别取不同稀释度的样品进行接种。
3. 接种:将稀释后的样品接种于乳糖胆盐发酵管中,每个稀释度接种3支试管。
4. 培养:将接种好的发酵管放入37℃恒温培养箱中培养24小时。
5. 观察结果:观察发酵管中的变化,如产生气泡、颜色变化等,判断大肠菌群的存在。
6. 鉴定:对疑似大肠菌群的菌落进行革兰氏染色、麦康凯培养基培养等鉴定。
五、实验结果与分析1. 发酵管观察结果:经过24小时培养,部分发酵管出现气泡、颜色变化等现象,表明存在大肠菌群。
2. 鉴定结果:对疑似大肠菌群的菌落进行革兰氏染色、麦康凯培养基培养,结果显示菌落呈革兰氏阴性、麦康凯培养基上呈现红色,确定为大肠菌群。
六、实验结论通过本次实验,我们掌握了食品中大肠菌群的检验原理和方法,成功检测出样品中存在大肠菌群。
这表明该食品可能存在粪便污染,存在食品安全隐患。
在实际生产过程中,应加强食品卫生管理,确保食品安全。
七、实验注意事项1. 实验操作过程中,注意无菌操作,防止污染。
食品微生物大肠菌群检测方法食品微生物大肠菌群检测是食品安全领域中的一项重要工作,其结果直接关系到食品的卫生安全。
在食品加工、储存和运输过程中,微生物大肠菌群的存在和数量是一个重要的指标,因此需要建立准确、可靠的检测方法来保障食品安全。
本文将介绍几种常用的食品微生物大肠菌群检测方法,以供参考。
一、传统培养法。
传统培养法是一种常用的微生物检测方法,其原理是将食品样品在适当的培养基上进行培养,然后通过计数菌落形成的数量来确定大肠菌群的存在和数量。
这种方法简单易行,成本低廉,但需要较长的培养周期,且存在一定的误差。
因此,在实际应用中,需要结合其他方法进行验证。
二、分子生物学方法。
分子生物学方法是近年来发展起来的一种食品微生物检测方法,其原理是利用PCR、实时荧光定量PCR等技术,通过检测食品样品中的微生物DNA或RNA来确定大肠菌群的存在和数量。
这种方法具有高灵敏度、高特异性和快速的优点,能够准确地检测出微生物的存在和数量,但需要较为复杂的实验操作和设备。
三、免疫学方法。
免疫学方法是利用抗原与抗体之间的特异性反应来检测微生物的存在和数量。
常用的免疫学方法包括酶联免疫吸附法(ELISA)和免疫荧光法等。
这种方法具有高灵敏度、高特异性和快速的优点,但需要较为复杂的实验操作和设备,且对样品的预处理要求较高。
综上所述,食品微生物大肠菌群检测方法有多种,各有优缺点,需要根据实际情况选择合适的方法进行检测。
在实际应用中,可以结合多种方法进行验证,以确保检测结果的准确性和可靠性。
希望本文介绍的方法能够为食品安全领域的从业人员提供一定的参考价值。
实验三十二食品中大肠菌群的测定1.目的要求(1)学习和掌握大肠菌群的测定方法。
(2)了解测定过程中每一步的反应原理。
2.基本原理大肠菌群是一群能在37。
C下培养48h发酵乳糖产酸、产气的需氧或兼氧革兰氏染色阴性无芽孢杆菌。
以大肠杆菌为主,包括肠细菌属、柠檬酸细菌属、埃希氏菌属和克雷伯氏菌属等。
大肠菌群数可用来判断水源或食品被粪便污染的可能性和程度。
因为大肠菌群在肠道和粪便中数量非常高,且与肠道和粪便中的病原菌生活习性相近,抗逆能力稍强,在数量上两者具有一定相关性,且大肠菌群易于培养和检测,所以非常适合用来作为判断样品是否被人、畜粪便污染的标志。
大肠菌群的测定方法一般采用多管发酵法。
此法是根据大肠菌群具有发酵乳糖产酸、产气的特性,利用含乳糖的培养基培养不同稀释度的样品,经初发酵、平板分离和复发酵3个检测步骤,最后根据结果查最大自然数表,算出食品中的大肠菌群数。
3.器材(1)被检样品-根据不同需要选择被检样品,如自来水、酱油、食醋、酸乳、啤酒等。
(2)培养基:乳糖胆盐发酵培养基,伊红美蓝固体培养基,乳糖发酵培养基。
(3)试剂:革兰氏染色液,芽孢染色液。
(4)其他物品:显微镜,天平,培养箱,水浴锅,研钵,平皿,杠氏管,试管‘,刻度吸管,涂布器等。
4.操作步骤(1)初发酵实验。
在3倍浓缩乳糖培养基中加入稀释度为10~,10~,10。
的被检样品10mL(如大肠菌群超出检测限,则可取更高的稀释度),每个稀释度进行5次重复,混匀置于370C下培养24h。
(2)平板分离。
培养24h后如不产酸(乳糖发酵液变黄色)、产气(小指管底部有气泡)和不变浑浊者为阴性反应,产酸、产气或仅产酸的乳糖发酵管为阳性反应。
将阳性反应划线接种于伊红美蓝平板上,在370C下培养24h。
在伊红美蓝平板上大肠菌群的典型菌落为深紫黑色,具有金属光泽;或者紫黑色,不带或略带金属;或者淡紫红色,中心较深的菌落。
将带有上述典型特征的菌落做革兰氏染色镜检。
实验四--食品中大肠菌群的测定一、实验目的掌握大肠菌群的原理及其检验方法,以判别食品的卫生质量了解MPN测定法在食品卫生检验中的意义二、实验原理大肠菌群是指一群在一定培养条件下可发酵乳糖、产酸产气的需氧和兼性厌氧革兰氏阴标评价食品的卫生状况,推断食品中肠道致病菌污染的可能。
最近似数测定法(MPN)是指对未知样品做连续的10倍稀释,选择3个连续的10倍稀释液,每种稀释液接种3管装有培养基的试管中培养,根据LST初发酵试验以及BGLB发酵证实实验,证实大肠菌群的阳性管数,查MPN检索表,报告每g(mL)样品中大肠菌群的最可能数。
食品中大肠菌群数以每g(mL)样品中大肠菌群的最可能数来表示,即为大肠菌群MPN值。
三、实验器材(一)培养基月桂基硫酸盐蛋白胨肉汤(LST)培养基煌绿乳糖胆盐肉汤(BGLB)培养基(二)实验材料市售饮料(三)其他三角瓶,试管,培养皿,移液管(四)仪器超净工作台,电子天平,高压蒸汽灭菌锅四、实验准备(一)配制培养基和试剂(以中央台为单位)1、配制生理盐水:1000mLNaCl8.5g水1000mL分装:3个三角瓶(含玻珠)中,225mL/个9支试管,3支/组,9mL/支灭菌:121~126℃灭菌20min2、月桂基硫酸盐蛋白胨肉汤(LST)培养基:300mL分装到27个已装有杜氏小管试管中,10mL/个包扎(3支一捆),112~115℃灭菌30min 胰蛋白胨6gNaCl1.5g乳糖KH2PO4水1.5g0.825g300mLK2HPO4十二烷基硫酸钠pH6.80.825g0.03g3、煌绿乳糖胆盐肉汤(BGLB)培养基:150mL分装到12个已装有杜氏小管试管中,10mL/个包扎,112~115℃灭菌30min蛋白胨牛胆粉溶液水1.5g30mL150mL乳糖0.1%煌绿水溶液pH7.21.5g2mL牛胆粉溶液制法:将3g牛胆粉溶于30mL水中,调pH至7.0~7.5BGLB制法:先将蛋白胨、乳糖溶于约100ml水中,加入牛胆粉溶液30mL,调节pH,再加入0.1%煌绿水溶液,最后用水补足到150ml,用纱布过滤后,再分装到试管中。