铬酸钾指示剂法
- 格式:ppt
- 大小:394.50 KB
- 文档页数:32

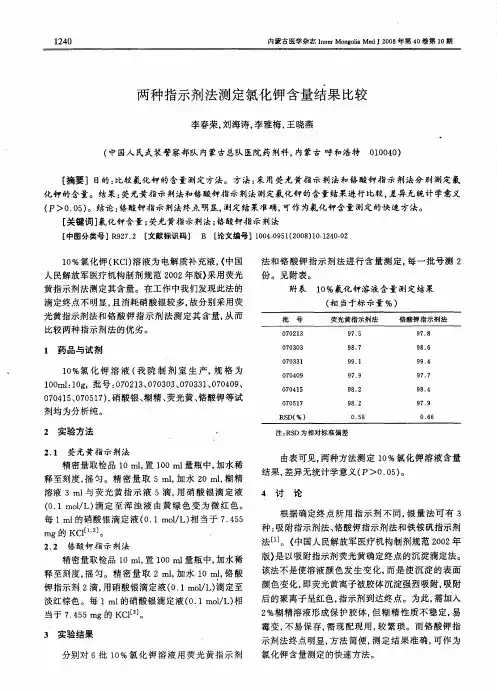
化验室测定氯化物含量操作规程一、方法提要在中性或弱碱性pH(5.0~9.5)的溶液中,氯化物与硝酸银作用生成白色氯化银沉淀,过量的硝酸银与铬酸钾作用生成砖红色沉淀,使溶液呈橙色,即为滴定终点。
Cl-+Ag+→AgCl↓(白色)2Ag++CrO42-→Ag2CrO4↓(砖红色)二、试剂和材料1、50g/L铬酸钾指示剂(配置完毕用硝酸银溶液滴至出现红色沉淀静置12小时后过滤收集滤液使用)。
2、硝酸溶液:1+300。
3、2g∕L氢氧化钠溶液。
4、酚酞指示剂:10g/L乙醇溶液。
5、0.01moL/L标准硝酸银溶液,配制:称取硝酸银1.698g用纯水溶于1000mL水中,摇匀保存于橙色瓶中。
标定:准确称取1.5~1.6gNaCl基准物质于250mL烧杯中,加100mL 水溶解,定量转入250mL容量瓶中,加水稀释至标线,摇匀。
准确移取25.00mLNaCl标准溶液于250mL锥形瓶中,加25mL水,1mL5%K2CrO4溶液,在不断摇动下用AgNO3溶液滴定至白色沉淀中出现砖红色沉淀为止。
平行测定4次。
CAgNO3=m×25×1000/(250×MV)=100m/M/V其中:m──氯化钠的质量,g;M──氯化钠摩尔质量分数,g/moL,M(NaCl)=58.442g/moL;V──实验消耗待标定的硝酸银的量,mL;三、分析步骤1、量取25mL试样A于250mL的锥形瓶中加2~3滴1%的酚酞指示剂,用氢氧化钠溶液或硝酸溶液调节水样pH,使红色刚好变成无色。
2、加入1mL50g∕L铬酸钾标定剂,在不断摇动的情况下,在白色背景下,用标准AgNO3溶液滴至砖红色沉淀出现,溶液呈橙色,记录AgNO3消耗量V。
同时做空白实验。
四、分析结果计算氯离子含量以质量浓度ρ1计,数值以%表示,按下式计算:ω3=35.45×C×(V1-V0)×4/m其中:V1──样品消耗硝酸银的体积,mL;V0──空白消耗AgNO3,mL;C──AgNO3标液浓度,moL/L;35.45-氯离子相对原子质量;m──氢氧化钾样品质量,g。



以硝酸银液为滴定液,测定能与Ag+反应生成难溶性沉淀的一种容量分析法。
以硝酸银液为滴定液,测定能与Ag+生成沉淀的物质,根据消耗滴定液的浓度和毫升数,可计算出被测物质的含量。
以生成难溶卤化银的沉淀滴定分析法。
用于测定Cl-,Br-,I-,SCN-,CN-和Ag+。
根据所选用指示剂的不同,又分为莫尔法(用铬酸钾作指示剂);佛尔哈德法(用铁铵矾作指示剂);法扬斯法(用吸附指示剂)。
适用范围:1.铬酸钾指示剂法:在中性或弱碱性溶液中用硝酸银滴定液滴定氯化物、溴化物时采用铬酸钾指示剂的滴定方法。
2.硫酸铁铵指示剂法:在酸性溶液中,用硫氰酸铵液为滴定液滴定Ag+,采用硫酸铁铵为指示剂的滴定方法。
3.吸附指示剂法:用硝酸银液为滴定液,以吸附指示剂指示终点测定卤化物的滴定方法。
银量法:根据其确定终点指示剂的方法不同常分为三种。
1莫尔法(Mohr Method)——K2CrO4指示剂(一)原理:以AgNO3标准溶液测定Cl-为例终点前:Ag++Cl-=AgCl(白色)Ksp=1.8×10ˉ10终点时:2Ag++CrO42-=Ag2CrO4(砖红色)Ksp=2.0×10ˉ12沉淀的溶解度S:S(AgCl)=1.34×10-5mol/L计量点附近终点出现的早晚与溶液中[CrO42-]有关:[CrO42-]过大------终点提前------结果偏低(-TE%)[CrO42-]过小-------终点推迟------结果偏高(+TE%)(二)指示剂用量(CrO42-浓度)实际滴定中:因为K2CrO4本身呈黄色,按[CrO42-]=5.9×10-2mol/L加入,则黄颜色太深而影响终点观察,实验中,采用K2CrO4浓度为2.6×10-3mol/L~5.6×10-3mol/L范围比较理想。
(计算可知此时引起的误差TE<±0.1%)在实验中:50~100ml溶液中加入5%K2CrO41ml。


盐分的测定(硝酸银沉淀滴定法)一、原理:以硝酸银液为滴定液,测定能与Ag+生成沉淀的物质,根据消耗滴定液的浓度和毫升数,可计算出被测物质的含量。
反应式:Ag++X-→AgX↓X-表示Cl-、Br-、I-、CN-、SCN-等离子。
二、方法——指示终点法(铬酸钾指示剂法)1.原理用AgNO3滴定液滴定氯化物、溴化物时,通常采用铬酸钾作指示剂的滴定方法。
滴定反应为:终点前Ag++Cl-→AgCl↓终点时2Ag++CrO42-→Ag2CrO4↓(砖红色)根据分步沉淀的原理,溶度积(K sp)小的先沉淀,溶度积大的后沉淀。
由于AgCl的溶解度小于Ag2CrO4的溶解度,当Ag+进入浓度较大的Cl-溶液中时,AgCl将首先生成沉淀,而[Ag+]2[CrO42-]<K sp,Ag2CrO4不能形成沉淀;随着滴定的进行,Cl-浓度不断降低,Ag+浓度不断增大,在等当点后发生突变,[Ag+]2[CrO42-]>K sp,于是出现砖红色沉淀,指示滴定终点的到达。
2.滴定条件(1)终点到达的迟早与溶液中指示剂的浓度有关。
为达到终点恰好与等当点一致的目的,必须控制溶液中CrO42-的浓度。
每50~100ml滴定溶液中加入5%(W/V)K2CrO4溶液1ml就可以了。
(2)用K2CrO4作指示剂,滴定不能在酸性溶液中进行,因指示剂K2CrO4是弱酸盐,在酸性溶液中CrO42-依下列反应与H+离子结合,使CrO42-浓度降低过多,在等当点不能形成Ag2CrO4沉淀。
2CrO42-+2H+→←2HCrO4-→←Cr2O72-+H2O也不能在碱性溶液中进行,因为Ag+将形成Ag2O沉淀:Ag++OH-→AgOH2AgOH →Ag2O↓+H2O因此,用铬酸钾指示剂法,滴定只能在近中性或弱碱性溶液(pH6.5~10.5)中进行。
如果溶液的酸性较强,可用稀NaOH溶液调至中性,或改用硫酸铁铵指示剂法。
此外,滴定不能在氨性溶液中进行,因AgCl和Ag2CrO4皆可生成[Ag(NH3)2]+而溶解。

铬酸钾指示剂法〔莫尔法〕
1.根本原理方法
滴定液:AgNO 3
指示剂:K 2CrO 4
滴定原理 终点前:AgCl 〔白色〕↓中性溶液
中,
终点时:2AgCrO
42CrO 4〔砖红色〕↓ 终点标志:出现砖红色沉淀
应用范围:Cl -和Br -。
滴定条件:〔1〕酸度: 中性或弱碱性 ,不适于酸性、强碱性、氨性。
〔2〕指示剂用量:×10-3mol·L -1
〔3〕干扰离子:发生副反响的离子应别离或掩蔽;
〔4〕滴定时摇动:减小吸附;
2滴定条件解释
〔1〕指示剂用量
铬酸钾用量过多→终点提前,用量太少→终点滞后 C CrO42-=5×10-3 mol·L -1
等量点: =
spAgCl K =×10-5 mol·L -1 -=2
4
2][ Ag CrO KspAg =×10-3mol·L -1 所以,较适宜的用量一般×10-3mol·L -1
〔2〕酸度
酸性溶液中:2H2CrO42-2HCrO4-Cr2O72-H2O 使CrO42-浓度降低,会消耗更多的AgNO3,,导致终点推迟,甚至不变色。
碱性太强:2Ag2OH-2AgOH↓2AgOH=Ag
2O↓H2O,Ag将形成Ag2O沉淀析出,会消耗更多的AgNO3滴定液,导致终点推迟,甚至不变色。
(3)溶液中有NH
4时,①与Ag生成沉淀的酸根阴离子
②与CrO42-生成沉淀的阳离子
③有色离子
④中性弱碱性下易水解的离子
〔4〕不宜I-、SCN-:AgI、AgSCN强烈吸附I-、SCN-,导致终点推迟。


盐分的测定(硝酸银沉淀滴定法)一、原理:以硝酸银液为滴定液,测定能与Ag+生成沉淀的物质,根据消耗滴定液的浓度和毫升数,可计算出被测物质的含量。
反应式:Ag++X-→AgX↓X-表示Cl-、Br-、I-、CN-、SCN-等离子。
二、方法——指示终点法(铬酸钾指示剂法)1.原理用AgNO3滴定液滴定氯化物、溴化物时,通常采用铬酸钾作指示剂的滴定方法。
滴定反应为:终点前Ag++Cl-→AgCl↓终点时2Ag++CrO42-→Ag2CrO4↓(砖红色)根据分步沉淀的原理,溶度积(K sp)小的先沉淀,溶度积大的后沉淀。
由于AgCl的溶解度小于Ag2CrO4的溶解度,当Ag+进入浓度较大的Cl-溶液中时,AgCl将首先生成沉淀,而[Ag+]2[CrO42-]<K sp,Ag2CrO4不能形成沉淀;随着滴定的进行,Cl-浓度不断降低,Ag+浓度不断增大,在等当点后发生突变,[Ag+]2[CrO42-]>K sp,于是出现砖红色沉淀,指示滴定终点的到达。
2.滴定条件(1)终点到达的迟早与溶液中指示剂的浓度有关。
为达到终点恰好与等当点一致的目的,必须控制溶液中CrO42-的浓度。
每50~100ml滴定溶液中加入5%(W/V)K2CrO4溶液1ml就可以了。
(2)用K2CrO4作指示剂,滴定不能在酸性溶液中进行,因指示剂K2CrO4是弱酸盐,在酸性溶液中CrO42-依下列反应与H+离子结合,使CrO42-浓度降低过多,在等当点不能形成Ag2CrO4沉淀。
2CrO42-+2H+→←2HCrO4-→←Cr2O72-+H2O也不能在碱性溶液中进行,因为Ag+将形成Ag2O沉淀:Ag++OH-→AgOH2AgOH →Ag2O↓+H2O因此,用铬酸钾指示剂法,滴定只能在近中性或弱碱性溶液(pH6.5~10.5)中进行。
如果溶液的酸性较强,可用稀NaOH溶液调至中性,或改用硫酸铁铵指示剂法。
此外,滴定不能在氨性溶液中进行,因AgCl和Ag2CrO4皆可生成[Ag(NH3)2]+而溶解。

沉淀滴定法—银量法一、定义以硝酸银液为滴定液,测定能与Ag+反应生成难溶性沉淀的一种容量分析法。
二、原理以硝酸银液为滴定液,测定能与Ag+生成沉淀的物质,根据消耗滴定液的浓度和毫升数,可计算出被测物质的含量。
反应式: Ag++ X-→ AgX↓X-表示Cl-、Br-、I-、CN-、SCN-等离子。
三、指示终点的方法(一)铬酸钾指示剂法1.原理用AgNO3滴定液滴定氯化物、溴化物时采用铬酸钾作指示剂的滴定方法。
滴定反应为:终点前 Ag++ Cl-→ AgCl↓终点时 2Ag++ CrO42-→ Ag2CrO4↓(砖红色)根据分步沉淀的原理,溶度积(Ksp)小的先沉淀,溶度积大的后沉淀。
由于AgCl的溶解度小于Ag2CrO4的溶解度,当Ag+进入浓度较大的Cl-溶液中时,AgCl将首先生成沉淀,而[Ag+]2[CrO42-]<Ksp,Ag2CrO4不能形成沉淀;随着滴定的进行,Cl-浓度不断降低,Ag+浓度不断增大,在等当点后发生突变,[Ag+]2[CrO42-]>Ksp,于是出现砖红色沉淀,指示滴定终点的到达。
2.滴定条件(1)终点到达的迟早与溶液中指示剂的浓度有关。
为达到终点恰好与等当点一致的目的,必须控制溶液中CrO42-的浓度。
每50~100ml滴定溶液中加入5%(W/V)K2CrO4溶液1ml就可以了。
(2)用K2CrO4作指示剂,滴定不能在酸性溶液中进行,因指示剂K2CrO4是弱酸盐,在酸性溶液中CrO42-依下列反应与H+离子结合,使CrO42-浓度降低过多,在等当点不能形成Ag2CrO4沉淀。
2CrO42-+ 2H+→←2HCrO4-→←Cr2O72-+ H2O也不能在碱性溶液中进行,因为Ag+将形成Ag2O沉淀: Ag++ OH-→ AgOH2AgOH → Ag2O↓+ H2O因此,用铬酸钾指示剂法,滴定只能在近中性或弱碱性溶液(pH6.5~10.5)中进行。
如果溶液的酸性较强可用硼砂、NaHCO3或CaCO3中和,或改用硫酸铁铵指示剂法。
离子滴定中变色反应的识别一一、络合滴定在络合滴定中,通常利用一种能与金属离子生成有色络合物的显色剂指示滴 定过程中金属离子浓度的变化。
这种显色剂称为金属指示剂。
1.1金属指示剂的显色原理滴定前加入指示剂: In + M ⇔ MIn游离态颜色 → 络合物颜色滴定开始至终点前: Y + M ⇔ MYMIn 形成背景颜色 MY 无色或浅色终点: Y + MIn ⇔ MY + In 络合物颜色游 MY 无色或浅色 离态颜色金属指示剂变色过程:滴定前加入指示剂, M + In = MIn 溶液呈乙色 甲色 乙色以EDTA 进行滴定,滴定反应为: M + Y = MY终点, MIn + Y = MY + In 溶液由乙色变为甲色 乙色 甲色二、化学计量点、理论变色点和滴定终点2.1化学计量点在配位滴定中,随着EDTA 的加入,游离金属离子浓度越来越少,当EDTA 恰好完全和金属离子反应时,我们称之为化学计量点,简称计量点,此时游离金属离子浓度,以pM sp 表示,考虑其它副反应,也可以pM ’sp 表示。
2.2理论变色点和滴定终点设被滴定的金属离子与指示剂生成有色配合物,它们在溶液中的平衡关系为:M + In ⇔ MIn[][][]In M MIn K MIn =当达到指示剂变色点时,[MIn]=[In],则此时[]M K M I n 1=或pM ep =lgK MIn若考虑到指示剂的副反应,则pM ep =lgK ’MIn实际配位滴定的滴定终点,是溶液完全呈现指示剂本身的颜色,这时,[In]≥10[MIn]设此时溶液中游离金属离子的浓度为pM ’sp ,则pM ’sp = lgK MIn +1考虑其它副反应,则pM ’sp = lgK ’MIn +1三、常用金属指示剂3.1铬黑T(EBT)铬黑T 为黑褐色粉末,略带金属光泽,溶于水后,结合在磺酸根上的Na +全部电离,以阴离子形式存在于溶液中。
铬黑T 是一个三元弱酸,以H 2In -表示,在不同pH 值时,其颜色变化为: H 2In - ⇔ HIn 2- ⇔ In 3-pH <6.3 pH =8~11 pH >11.5红紫色 蓝色 橙黄色铬黑T 与很多金属离子生成显红色的络合物,为使终点敏锐最好控制pH 在9~10间,这时终点由红色编导蓝色比较敏锐。
硝酸银滴定氯离子铬酸钾指示剂1. 什么是硝酸银滴定?你听说过硝酸银滴定吗?这玩意儿可是一门技术活。
简单来说,硝酸银滴定是一种用来测定溶液中氯离子的浓度的实验方法。
你可能会想,这有啥用啊?其实,氯离子在很多化学反应中都是个“主角”,比如在水质监测、食品安全等方面,检测氯离子非常重要。
哎,这就像我们生活中常说的“千里之行,始于足下”,搞明白这个过程,才能进一步深入研究哦。
在这个过程中,硝酸银作为滴定剂,它和氯离子发生反应,形成氯化银。
听起来是不是有点复杂?别急,慢慢来。
在实验室里,我们会慢慢往样品中滴入硝酸银,直到反应完全为止。
每滴都像是在做一场精心设计的舞蹈,期待着最终的结果。
2. 铬酸钾指示剂的作用2.1 什么是铬酸钾?铬酸钾,这个名字听起来有点拗口,其实它就是个小小的化学指示剂。
它的作用就是告诉我们滴定的终点,像个精明的小侦探。
你想想,滴了那么多硝酸银,咱们得知道啥时候才是“停”的时刻,是吧?铬酸钾就像个信号灯,一变色就提醒你:喂,别再滴了,够了!2.2 为什么选择铬酸钾?用铬酸钾的原因也很简单。
它在反应过程中会变成红色,和其他的指示剂相比,显得格外醒目。
而且,它的反应速度快,几乎是“电光火石”之间就能完成。
想象一下,正当你翘首以待的时候,突然红色一闪,简直是如梦初醒!当然,任何实验都得讲究个“分寸”,不能随便就用指示剂,得选择合适的浓度哦。
3. 实验步骤3.1 准备工作好啦,下面咱们进入正题,看看这个实验到底怎么做。
首先,你得准备好一些工具,比如滴定管、烧杯、量筒,哎,别小看这些工具,它们可是你“战斗”的伙伴啊!接下来,取一定量的含氯溶液,放在烧杯里。
然后,加入几滴铬酸钾溶液,这时候你可能会觉得颜色变化好神奇,仿佛一场魔术表演。
3.2 开始滴定接下来,才是关键时刻:开始滴定啦!你得缓缓地将硝酸银滴入烧杯,滴一滴停一停,观察颜色变化。
每当看到液体从无色变成红色,那一刻,心里是不是特别期待?要知道,这个过程就像是在猜谜,直到你找到答案的那一刻,真是让人心潮澎湃。
5%铬酸钾指示剂配制规程
摘要:
一、引言
二、5% 铬酸钾指示剂的配制方法
1.准备工具和材料
2.称取铬酸钾
3.溶解铬酸钾
4.调整溶液浓度
5.装瓶保存
三、注意事项
四、总结
正文:
一、引言
在实验室中,常常需要使用各种化学试剂,其中,指示剂是一种常用的试剂。
在本文中,我们将介绍如何配制5% 铬酸钾指示剂。
二、5% 铬酸钾指示剂的配制方法
1.准备工具和材料
在开始配制之前,需要准备好以下工具和材料:称量纸,天平,烧杯,玻璃棒,以及铬酸钾。
2.称取铬酸钾
首先,需要使用天平和称量纸,精确地称取2.5 克铬酸钾。
3.溶解铬酸钾
将称取的铬酸钾放入烧杯中,然后使用玻璃棒,慢慢地加入足够的水,直到铬酸钾完全溶解。
4.调整溶液浓度
将溶液搅拌均匀后,慢慢地加入更多的水,直到溶液的体积达到50 毫升。
这样,就得到了5% 的铬酸钾指示剂溶液。
5.装瓶保存
将配制好的铬酸钾指示剂溶液倒入无菌的瓶子中,密封保存,以备后续的实验使用。
三、注意事项
在配制过程中,需要注意以下几点:首先,称取铬酸钾的时候,要尽量准确,以保证配制出的指示剂浓度准确;其次,溶解铬酸钾的时候,要慢慢加入水,避免铬酸钾结块;最后,装瓶保存的时候,要确保瓶子无菌,以防止溶液污染。
四、总结
以上就是5% 铬酸钾指示剂的配制方法。
通过以上步骤,我们可以方便地配制出需要的指示剂,以满足实验的需要。
(一)基本原理
铬酸钾指示剂法是指在中性溶液中,用K2Cr04作指示剂,用硝酸银滴定液滴定氯化物或溴化物的方法。
其反应为:
滴定反应Ag++c1-→AgCl↓(白色)
指示终点反应2Ag++C r042-→Ag2Cr04↓(砖红色)
终点时,稍过量的Ag+立刻与C r042-反应,产生砖红色的Ag2Cr04沉淀,即到达终点。
(二)滴定条件
(1)指示剂的用量。
若C r042-的量过大,会使终点提前,从而使测定结果产生较大的负误差。
若C r042-的量过小,则使终点推后,使测定结果产生正误差。
在实际滴定时,一般在反应液总体积为50~100ml溶液中加入5%K2Cr04指示剂l~2ml即可。
(2)溶液的酸度。
滴定应在中性或弱碱性溶液(pH6.5~10.5)中进行。
酸度过高,C r042-与H+会产生如下平衡,从而使C r042-浓度降低。
(3)滴定时要剧烈振摇,防止AgCl胶体沉淀吸附Cl-,致使终点提前。
医学教|育网收集整理
(4)不宜测定I-和SCN-,因为AgI和AgSCN沉淀对I-和SCN-有较强烈的吸附作用,误差很大。
铬酸钾指示剂的配制方法以下是 7 条关于铬酸钾指示剂的配制方法:1. 嘿,知道吗,铬酸钾指示剂配制可不难哦!就像做菜一样,得把各种材料准备好。
先称取一定量的铬酸钾固体,这就好比挑选新鲜的食材一样重要呢!然后把它溶解在适量的水里,这不就跟把菜放进锅里煮是一个道理嘛。
比如说,你在做蛋糕时要精确地放每种材料,配制铬酸钾指示剂也是如此啊!2. 哇塞,来看看铬酸钾指示剂怎么配制呀!把那一小堆铬酸钾粉末放进瓶子里,就好像把宝贝放进小盒子里似的,可得小心别撒了哟!再缓缓倒入水,看着它慢慢溶解,就像看着雪花慢慢融化一样神奇呀!你想想,给宠物洗澡时得慢慢倒水吧,这和配制也差不多呢!3. 嘿呀,铬酸钾指示剂配制其实超简单啦!把铬酸钾准确称好,这就像给朋友准备礼物要选合适的一样重要哦!接下来加水溶解它,就如同给花浇水让它绽放美丽呀!就好像你要调制一杯特别的饮料,得精心搭配各种成分,是不是呀?4. 哇哦,想学会铬酸钾指示剂的配制方法吗?那很容易呀!把称好的铬酸钾像宝贝一样放进容器里,这感觉是不是有点像把心爱的玩具放进箱子里呀!然后加水搅拌,让它融为一体,这不就跟和好面准备做面包一样嘛,很有趣吧?5. 嘿,铬酸钾指示剂的配制不难哦!你看,拿好秤把铬酸钾准确量出来,这多像给人偶穿衣服要选合适尺码一样呀!再把水加进去让它溶解,就像是让小船在水面上航行呢!你说,这是不是很神奇呀?6. 哟呵,铬酸钾指示剂的配制其实很容易上手呢!把那些铬酸钾粉末轻轻地放进去,就仿佛给小猫咪铺柔软的垫子一样温柔呢!然后加水溶解,就像让小鱼在水里欢快地游起来,好玩吧?7. 哈哈,铬酸钾指示剂配制很简单的啦!准确称取后放进去,像不像给小盒子里放珍贵的糖果呀!再加上水让它溶解,就如同让阳光洒在大地上一样自然。
你想想,每次做手工时认真搭配材料,和这个道理一样呀,不是吗?我的观点结论:只要按照正确的步骤来,铬酸钾指示剂的配制真的不难,大家都可以试试哟!。
水中氯化物测定中的铬酸钾指示剂颜色及滴定终点时
的颜色照片展示
照片1的容量瓶里是铬酸钾指示剂配制好以后的颜色(刚开始配制时要求红棕色不褪为止,实际是一定要过量,再多滴1管子效果好一些)。
配制好以后的颜色当天是红棕色,次日将沉淀过滤完以后颜色变成黄色的了。
滴定管下的蒸发皿内是去离子水加完铬酸钾指示剂后的颜色是浅黄色,左边靠上的是用硝酸银滴定完后所谓的桔黄色,下面是自来水样。
由于含有氯化物与硝酸银形成沉淀的衬托下颜色有点不太好把握。