2014年高考真题——理综化学(天津卷)解析版
- 格式:doc
- 大小:429.00 KB
- 文档页数:13

2014年普通高等学校招生全国统一考试(大纲版全国卷)理科综合化学部分word精校高清重绘版解析6.下列叙述正确的是A.锥形瓶可用作加热的反应器B.室温下,不能将浓硫酸盛放在铁桶中C.配制溶液定容时,俯视容量瓶刻度会使溶液浓度偏高D.用蒸馏水润湿的试纸测溶液的pH,一定会使结果偏低【答案】A【解析】A、锥形瓶可用作加热的反应器,但在加热时必须垫上石棉网,A正确;B、室温下,铁(或Al)遇浓硫酸(或浓硝酸)发生钝化反应,工业上常用铁罐车(铝罐车)运输浓硫酸(或浓硝酸),B错误;C、容量瓶的瓶体上只有刻度线而没有具体的刻度,C错误;D、用pH试纸测定未知溶液的pH时,正确的操作方法为用玻璃棒蘸取少量待测液滴在干燥的pH试纸上,与标准比色卡对比来确定pH.不能用水湿润pH试纸,否则稀释了待测溶液,使溶液的酸碱性减弱(酸性降低pH值偏大,碱性溶液的PH偏小,中性溶液的PH不变),测定结果不准确,D错误。
7.N A表示阿伏加德罗常数,下列叙述正确的是A.lmol FeI2与足量氯气反应时转移的电子数为2N AB.2 L0.5 mol • L-1硫酸钾溶液中阴离子所带电荷数为N AC.1 mol Na2O2固体中含离子总数为4N AD.丙烯和环丙烷组成的42 g混合气体中氢原子的个数为6 N A【答案】D【解析】本题考查了阿伏伽德罗常数的计算应用。
A、足量的氯气发生的离子反应有2I—+Cl2=I2+2Cl—和2Fe2++Cl2=2Fe3++2Cl—,所以lmol FeI2(1mol Fe2+和2mol I—)与足量氯气反应时转移的电子数为3N A,A错误;B、2 L0.5 mol • L-1硫酸钾溶液中含溶质(K2SO4)的物质的量是1mol,所以阴离子SO42—的物质的量是2mol,B错误;C、Na2O2是由Na+和O22—构成,所以1 mol Na2O2固体中含离子总数是3mol,C错误;D、丙烯和环丙烷的最简式都是CH2,则42 g混合气体含有3mol CH2,则氢原子的物质的量是6mol,D正确。

绝密★启用前2014年普通高等学校招生全国统一考试理科综合·化学(天津卷)注意事项:1.答卷前,考生务必将自己的姓名、准考证号填写在答题卡上。
2.回答选择题时,选出每小题答案后,用铅笔把答题卡上对应题目的答案标号涂黑,如需改动,用橡皮擦干净后,再选涂其它答案标号。
回答非选择题时,将答案写在答题卡上,写在本试卷上无效。
3.考试结束后,将本试卷和答题卡一并交回。
可能用到的相对原子质量:H-1 Li-7 C-12 O-16 Si-28 S-32 Co-59一、选择题:本题共6小题,每小题6分,共36分。
在每小题给出的四个选项中,只有一项是符合题目要求的。
1.化学与生产、生活息息相关,下列叙述错误的是【B】A.铁表而镀锌可以增强其抗腐蚀性B.用聚乙烯塑料代替聚乳酸塑料可减少白色污染C.大量燃烧化石燃料是造成雾霾天气的一种重要因素D.含再金属离子的电镀废液不能随意排放2.实验室制备下列气体时,所用方法正确的是【A】A.制氧气时,用Na2O2或H2O2作反应物可选择相同的气体发生装置B.制氯气时,用饱和NaHCO3溶液和浓硫酸净化气体C.制乙烯时,用排水法或向上排空气法收集气体D.制二氧化氮时,用水或NaOH溶液吸收尾气3.运用相关化学知识进行判断,下列结论错误的是【D】A.某吸热反应能自发进行,因此该反应是熵增反应B.NH4F水溶液中含有HF,因此NH4F溶液不能存放于玻璃试剂瓶中C.可燃冰主要甲烷与水在低温高压下形成的水合物晶体,因此可存在于海底D.增大反应物浓度可加快反应速率,因此用浓硫酸与铁反应能增大生成H2的速率4.对如图两种化合物的结构或性质描述正确的是【C】A .不是同分异构体B .分子中共平面的碳原了数相同C .均能与溴水反应D .可用红外光谱区分,但不能用核磁共振氢谱区分5.下列有关电解质溶液中粒子浓度关系正确的是【A 】A .pH=1的NaHSO 4溶液:c (H +)=c (SO 42-)十c (OH -)B .含有AgCl 和AgI 固体的悬浊液:c (Ag +)>c (Cl -)=c (I -)C .CO 2的水溶液:c (H +)>c (HCO 3-)=2c (CO 32-)D .含等物质的量的NaHC 2O 4和Na 2C 2O 4的溶液:3c (Na +)=2[c (HC 2O 4-)+ c (C 2O 42-)+c (H 2C 2O 4)]6.已知:锂离子电池的总反应为:Li x C+Li 1-x CoO 2C+LiCoO 2 充电放电 锂硫电池的总反应为:2Li+S Li 2S 充电放电有关上述两种电池说法正确的是【B 】A .锂离子电池放电时,Li +向负极迁移B .锂硫电池充电时,锂电极发生还原反应C .理论上两种电池的比能量相同D .下图表示用锂离子电池给锂硫电池充电二、非选择题:本题共4小题,共64分。

2014年普通高等学校招生全国统一考试理综——化学解析版一、选择题:本题共13小题,每小题6分,在每小题给出的四个选项中,只有一项是符合题目要求的。
7.下列化合物中同分异构体数目最少的是( )A.戊烷B.戊醇C.戊烯D.乙酸乙酯考点:有机物同分异构体的种类及书写知识——必修2、选修58.化学与社会、生活密切相关。
对下列现象或事实的解释正确的是选项现象或事实解释A 用热的烧碱溶液洗去油污Na2CO3可直接和油污反应B 漂白粉在空气中久置变质漂白粉中的CaCl2 与空气中的CO2反应生成CaCO3C 施肥时,草木灰(有效成分为K2CO3)不能与NH4Cl混合使用K2CO3与NH4Cl反应生成氨气会降低肥效D FeCl3溶液可用于铜质印刷线路板制作FeCl3能从含有Cu2+的溶液中置换出铜考点:盐的水解及相关应用——选修49.已知分解1 mol H2O2 放出热量98KJ,在含少量I-的溶液中,H2O2的分解机理为:H2O2+I-→H2O +IO-慢H2O2+IO-→H2O +O2+I-快下列有关反应的说法正确的是( )A.反应的速率与I-的浓度有关B.IO-也是该反应的催化剂C.反应活化能等于98KJ·mol-1D.v(H2O2)=v(H2O)=v(O2)考点:影响化学反应速率的因素——选修410.W、X、Y、Z均是短周期元素,X、Y处于同一周期,X、Z的最低价离子分别为X2-和Z-,Y+和Z-离子具有相同的电子层结构。
下列说法正确的是( )A.原子最外层电子数:X>Y>Z B.单质沸点:X>Y>ZC.离子半径:X2->Y+>Z-D.原子序数:X>Y>Z考点:元素的推断,及元素的位置、结构和性质——必修211.溴酸银(AgBrO3)溶解度随温度变化曲线如图所示,下列说法错误的是( )A.溴酸银的溶解时放热过程B.温度升高时溴酸银溶解速度加快C.60 ℃时溴酸银的K sp约等于6×10-4D .若硝酸钾中含有少量溴酸银,可用重结晶方法提纯 考点:难溶物质溴酸银的溶解过程及原理——选修3 12.下列有关仪器的使用方法或实验操作正确的是( ) A .洗净的锥形瓶和容量瓶可以放进烘箱中烘干 B .酸式滴定管装标准液前,必须先用该溶液润洗C .酸碱滴定实验中,用待测溶液润洗锥形瓶以减小实验误差D .用容量瓶配溶液时,若加水超过刻度线,立即用滴定管吸出多余液体 考点:实验仪器的使用方法和实验规范操作——必修1和选修6 13.利用右图所示装置进行下列实验,能得出相应实验结论的是( )选项 ① ② ③ 实验结论A 稀硫酸 Na 2S AgNO 3与AgCl的浊液 K sp (AgCl)>K sp (Ag 2S) B 浓硫酸 蔗糖 溴水 浓硫酸具有脱水性、氧化性 C 稀盐酸 Na 2SO 3 Ba(NO 3)2溶液 SO 2与可溶性钡盐均可以生成白色沉淀D浓硝酸Na 2CO 3Na 2SiO 3溶液酸性:硝酸>碳酸>硅酸考点:物质的性质与相互转化——必修2和选修426、(13分)乙酸异戊酯是组成蜜蜂信息素质的成分之一,具有香蕉的香味,实验室制备乙酸异戊酯的反应 装置示意图和有关数据如下:实验步骤:在A 中加入4.4 g 的异戊醇,6.0 g 的乙酸、数滴浓硫酸和2~3片碎瓷片,开始缓慢加热A ,回流50分钟,反应液冷至室温后,倒入分液漏斗中,分别用少量水,饱和碳酸氢钠溶液和水洗涤,分出的产物加入少量无水硫酸镁固体,静置片刻,过滤除去硫酸镁固体,,进行蒸馏纯化,收集140~143 ℃馏分,得乙酸异戊酯3.9 g 。

2012年普通高等学校招生统一考试理科综合能力测试试题使用地区:陕西、山西、河南、河北、湖南、湖北、江西一、选择题(每小题6分。
在每小题给出的四个选项中,只有一项是符合题目要求的)7. 下列化合物中同分异构体数目最少的是( )A. 戊烷B. 戊醇C. 戊烯D. 乙酸乙酯【答案】A【解析】A.选项戊烷有正异新三种同分异构体B.选项戊醇可形成醇和醚两种类别同分异构体,数量远多于3种C.选项戊烯存在环戊烷和顺反异构,多于3种D.选项存在酸、酯、醇醛等多种类别,多于3种8. 化学与社会、生活密切相关。
对下列现象或事实的解释正确的是【答案】C【解析】A.烧碱为NaOH.纯碱为Na2CO3.前后不符.热的纯碱Na2CO3溶液可去油污,Na2CO3水解溶液为碱性,越热越水解,碱性增强,促进油脂水解,可去油污.B.选项漂白粉变质是其有效成分Ca(ClO)2与空气中的CO2反应生成CaCO3和HClO,CaCl2与空气中的CO2不会反应.C.选项草木灰K2CO3与NH4Cl双水解,生成氨气,氮元素损失,会降低肥效.D.选项制作印刷线路板的原理是2FeCl3+Cu=CuCl2+FeCl2.氯化铁和铜离子并不会反应.9. 已知分解1 mol H2O2 放出热量98 kJ,在含少量I−的溶液中,H2O2分解的机理为:H2O2 + I−→H2O + IO−慢H2O2 + IO−→H2O + O2 + I−快下列有关该反应的说法正确的是( )A. 反应的速率与I−的浓度有关B. IO−也是该反应的催化剂C. 反应活化能等于98 kJ·mol−1D. υ(H2O2)=υ(H2O)=υ(O2)【答案】A【解析】此反应为双氧水的分解反应.2H2O2 = 2H2O+O2 I-为催化剂.A.选项总反应速率应由最慢的反应决定,所以反应一决定反应速率,改变反应物I-可以改变反应速率. B.选项由IO3-应为反应二的氧化剂.C.选项活化能与反应的焓变无关.D.由总反应可知,速率之比为计量数之比为2:2:110. W、X、Y、Z均是短周期元素,X、Y处于同一周期,X、Z的最低价离子分别为X2−和Z-,Y+和Z-离子具有相同的电子层结构。

版语文、数学、英语、政治、历史、地理、物理、化学、生物全科(10份)经典答案解析目录2014年天津市高考语文试卷及答案 (2)2014年天津市高考数学(文)试卷及答案 (11)2014年天津市高考数学(理)试卷及答案 (19)2014年天津市高考数学英语试卷及答案 (37)2014年天津市高考文综(政治、历史、地理)试卷及答案 (44)2014年天津市高考理综(物理、化学、生物)试卷及答案 (60)2014年天津市高考语文试卷及答案语文本试卷分为第I卷(选择题)和第Ⅱ卷两部分,共150分,考试用时150分钟,第 I卷1至6页,第II卷7至11页。
答卷前,考生务必将自己的姓名、准考号填写在答题卡上,并在规定位置粘贴考试用条形码。
答卷时,考生务必将答案涂写在答题卡上,答在试卷上的无效,考试结束后,将本试卷和答题卡一并交回。
第I卷注意事项:1.每小题选出答案后,用铅笔将答题卡上对应题目的答案标号涂黑,如需改动,用橡皮擦干净后,再选涂其他答案标号。
2.本卷共12小题,每小题3分,共36分。
在每小题给出的四个选项中,只有一项是最符合题目要求的。
一、(15分)1.下列词语中加点字的读音,完全正确的一组是A.缜.(zhěn)密商.榷(quâ)和.(huî)稀泥揆情度.(duï)理B.取缔.(tì)木讷.(nâ)档.(dàng)案袋疾风劲.(jìn)草C.栖.(qī)息挟.(xiá)持白炽.(chì)灯戎马倥偬.(zǒng)D.葳蕤.(ruí) 豢.(huàn)养软着.(zhuï)陆扣人心弦.(xuán)2.下列词语中没有..错别字的一组是A.焕发剽悍鼎力相助失之毫厘,谬以千里B.璘选更迭流光异彩鹬蚌相争,渔人得利C.砥砺斡旋别出心裁黄钟毁弃,瓦釜雷鸣D.甄别笼络休养生息天网灰灰,疏而不漏3.下面语段横线处应填入的词句,最恰当的一组是中国文人对审美具有感知力,他们可以再安然怡悦中鸟翼几乎无声的浦东,还有灰板簌簌飘落的声音,他们喜爱“”那种让静寂更显清幽的氛围。

2014年普通高等学校招生全国统一考试(天津卷)理科综合生物部分1.二倍体生物细胞正在进行着丝点分裂时,下列有关叙述正确的是A.细胞中一定不存在同源染色体B.着丝点分裂一定导致DNA数目加倍C.染色体DNA一定由母链和子链组成D.细胞中染色体数目一定是其体细胞的2倍2.下图是细胞中糖类合成与分解过程示意图。
下列叙述正确的是A.过程①只在线粒体中进行,过程②只在叶绿体中进行B.过程①产生的能量全部储存在ATP中C.过程②产生的(CH2O)中的氧全部来自H2OD.过程①和②中均能产生[H],二者还原的物质不同3.图a、b分别为农村和城市生态系统的生物量(生命物质总量)金字塔示意图。
下列叙述正确的是A.两个生态系统均可通过信息传递调节种间关系B.两个生态系统的营养结构均由3个营养级组成C.城市生态系统不具有自我调节能力,抵抗力稳定性低D.流经两个生态系统的总能量均是其植物所固定的太阳能4.为达到相应目的,必须..通过分子检测的是A.携带链霉素抗性基因受体菌的筛选B.产生抗人白细胞介素-8抗体的杂交瘤细胞的筛选C.转基因抗虫棉植株抗虫效果的鉴定D.21三体综合征的诊断5.MRSA菌是一种引起皮肤感染的“超级细菌”,对青霉素等多种抗生素有抗性。
为研究人母乳中新发现的蛋白质H与青霉素组合使用对MRSA菌生长的影响,某兴趣小组的实验设计及结果如下表。
下列说法正确的是A.细菌死亡与否是通过光学显微镜观察其细胞核的有无来确定B.第2组和第3组对比表明,使用低浓度的青霉素即可杀死MRSA菌C.实验还需设计有2μg/mL青霉素做处理的对照组D.蛋白质H有很强的杀菌作用,是一种新型抗生素6.神经递质乙酰胆碱与突触后膜的乙酰胆碱受体(AChR)结合,突触后膜兴奋,引起肌肉收缩。
重症肌无力患者体内该过程出现异常,其发病机理示意图如下。
下列叙述错误的是A.物质a作为抗原能激活B细胞增殖分化为浆细胞B.抗a抗体与物质a的结合物不能被吞噬细胞清除C.物质a引发的上述免疫过程属于体液免疫D.患者体内乙酰胆碱与突触后膜的AChR特异性结合减少7.(16分)Kisspeptin,简称Kp,是Kp神经元产生的一类多肽类激素,它通过调节生物体内雌激素含量来调控生殖活动。
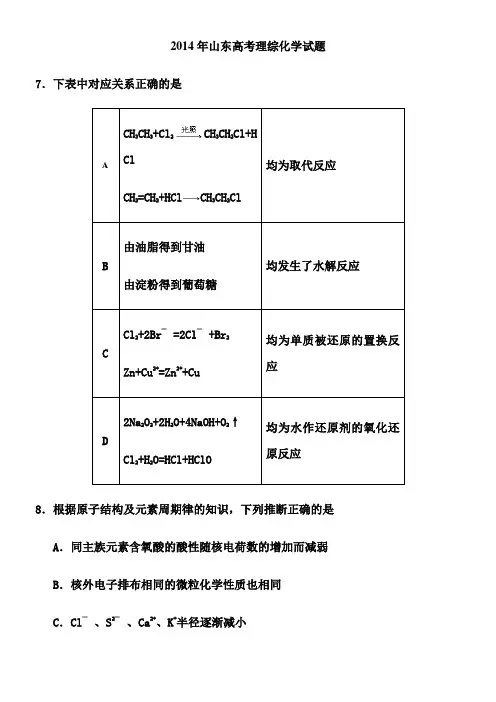
2014年山东高考理综化学试题7.下表中对应关系正确的是A CH3CH3+Cl2CH3CH2Cl+HClCH2=CH2+HCl CH3CH2Cl均为取代反应B由油脂得到甘油由淀粉得到葡萄糖均发生了水解反应CCl2+2Br‾=2Cl‾+Br2Zn+Cu2+=Zn2++Cu 均为单质被还原的置换反应D2Na2O2+2H2O+4NaOH+O2↑Cl2+H2O=HCl+HClO 均为水作还原剂的氧化还原反应8.根据原子结构及元素周期律的知识,下列推断正确的是 A.同主族元素含氧酸的酸性随核电荷数的增加而减弱 B.核外电子排布相同的微粒化学性质也相同C.Cl‾、S2‾、Ca2+、K+半径逐渐减小D.35Cl与3717Cl得电子能力相同179.等质量的下列物质与足量稀硝酸反应,放出NO物质的量最多的是A.FeO B. Fe2O3 C. FeSO4 D、Fe3O410.下列实验操作或装置(略去部分加持仪器)正确的是A.配制溶液 B.中和滴定C.制备乙酸乙酯 D.制取收集干燥氨气11.苹果酸的结构简式为,下列说法正确的是A.苹果酸中能发生酯化反应的官能团有2种B.1mol苹果酸可与3mol NaOH发生中和反应C.1mol苹果酸与足量金属Na反应生成生成1mol H2D.HOOC—CH2—CH(OH)—COOH与苹果酸互为同分异构体12.下列有关溶液组成的描述合理的是A.无色溶液中可能大量存在Al3+、NH4+、Cl‾、S2‾B.酸性溶液中可能大量存在Na+、ClO‾、SO42‾、I‾C.弱碱性溶液中可能大量存在Na+、K+、Cl‾、HCO3‾D.中性溶液中可能大量存在Fe3+、K+、Cl‾、SO42‾13.已知某温度下CH3COOH和NH3•H2O的电离常数相等,现向10mL浓度为0.1mol•L‾1的CH3COOH溶液中滴加相同浓度的氨水,在滴加过程中A.水的电离程度始终增大B.c(NH4+)/ c(NH3•H2O)先增大再减小C.c(CH3COOH)与c(CH3COO‾)之和始终保持不变D.当加入氨水的体积为10mL时,c (NH4+)= c (CH3COO‾)29.(17分)研究氮氧化物与悬浮在大气中海盐粒子的相互作用时,涉及如下反应:2NO 2(g)+NaCl(s)NaNO3(s)+ClNO(g) K1∆H < 0 (I)2NO(g)+Cl 2(g)2ClNO(g) K2∆H < 0 (II)(1)4NO 2(g)+2NaCl(s)2NaNO3(s)+2NO(g)+Cl2(g)的平衡常数K= (用K1、K2表示)。

2014年普通高等学校招生全国统一考试理科综合能力测试化学试题(天津卷)第Ⅰ卷注意事项:本卷共6题,每题6分,共36分。
在每题给出的四个选项中,只有一项是最符合题目要求的。
以下数据可供解题时参考:相对原子质量:H 1Li 7 C 12O 16Si 28S 32Co 591.(2014天津理综,1)化学与生产、生活息息相关,下列叙述错误的是()A.铁表面镀锌可增强其抗腐蚀性B.用聚乙烯塑料代替聚乳酸塑料可减少白色污染C.大量燃烧化石燃料是造成雾霾天气的一种重要因素D含重金属离子的电镀废液不能随意排放答案:B解析:铁上镀锌,形成一层保护膜,可以保护铁,A项正确;聚乙烯不易降解,易导致白色污染,B项错误;C、D项正确。
2.(2014天津理综,2)实验室制备下列气体时,所用方法正确的是()A.制氧气时,用Na2O2或H2O2作反应物可选择相同的气体发生装置B.制氯气时,用饱和NaHCO3溶液和浓硫酸净化气体C.制乙烯时,用排水法或向上排空气法收集气体D.制二氧化氮时,用水或NaOH溶液吸收尾气答案:A解析:Na2O2与H2O或H2O2在MnO2作催化剂制氧气均选用“固+液”不加热装置,A项正确;用MnO2和浓盐酸制Cl2时,气体中混有HCl,除HCl应该用饱和食盐水,NaHCO3与HCl、Cl2均会发生反应生成新杂质CO2,B项错误;乙烯与空气密度接近,不能用排空气法收集,C项错误;NO2与H2O反应产生NO,污染空气,D项错误。
3.(2014天津理综,3)运用相关化学知识进行判断,下列结论错误的是()A.某吸热反应能自发进行,因此该反应是熵增反应B.NH4F水溶液中含有HF,因此NH4F溶液不能存放于玻璃试剂瓶中C.可燃冰主要是甲烷与水在低温高压下形成的水合物晶体,因此可存在于海底D.增大反应物浓度可加快反应速率,因此用浓硫酸与铁反应能增大生成H2的速率答案:D解析:能自发进行的反应一定符合ΔH-TΔS<0,ΔH>0所以ΔS也一定大于0,A选项正确;氢氟酸能与玻璃反应,B正确;浓硫酸与Fe发生钝化,不能加快反应,D选项错误。

2014·天津卷(理科数学)1.[2014·天津卷] i 是虚数单位,复数7+i3+4i =( )A .1-iB .-1+i C.1725+3125i D .-177+257i 1.A [解析]7+i 3+4i =(7+i )(3-4i )(3+4i )(3-4i )=25-25i32+42=1-i. 2.[2014·天津卷] 设变量x ,y 满足约束条件⎩⎪⎨⎪⎧x +y -2≥0,x -y -2≤0,y ≥1,则目标函数z =x +2y 的最小值为( )A .2B .3C .4D .52.B [解析] 画出可行域,如图所示.解方程组⎩⎪⎨⎪⎧x +y -2=0,y =1,得⎩⎪⎨⎪⎧x =1,y =1,即点A (1,1).当目标函数线过可行域内A 点时,目标函数有最小值,即z min =1×1+2×1=3.图1-13.[2014·天津卷] 阅读如图11所示的程序框图,运行相应的程序,输出S 的值为( ) A .15 B .105 C .245 D .9453.B [解析] 第1次循环,i =1,T =3,S =1×3; 第2次循环,i =2,T =5,S =1×3×5; 第3次循环,i =3,T =7,S =1×3×5×7.执行完后,这时i 变为4,退出循环,故输出S =1×3×5×7=105. 4.[2014·天津卷] 函数f (x )=log 12(x 2-4)的单调递增区间为( )A .(0,+∞)B .(-∞,0)C .(2,+∞)D .(-∞,-2)4.D [解析] 要使f (x )单调递增,需有⎩⎪⎨⎪⎧x 2-4>0,x <0,解得x <-2.5.[2014·天津卷] 已知双曲线x 2a 2-y 2b 2=1(a >0,b >0)的一条渐近线平行于直线l :y =2x +10,双曲线的一个焦点在直线l 上,则双曲线的方程为( )A.x 25-y 220=1B.x 220-y 25=1 C.3x 225-3y 2100=1 D.3x 2100-3y 225=1 5.A [解析] 由题意知,双曲线的渐近线为y =±b a x ,∴ba =2.∵双曲线的左焦点(-c ,0)在直线l 上,∴0=-2c +10,∴c =5.又∵a 2+b 2=c 2,∴a 2=5,b 2=20,∴双曲线的方程为x 25-y 220=1. 6.[2014·天津卷]图1-2 如图12所示,△ABC 是圆的内接三角形,∠BAC 的平分线交圆于点D ,交BC 于点E ,过点B 的圆的切线与AD 的延长线交于点F .在上述条件下,给出下列四个结论:①BD 平分∠CBF ;②FB 2=FD ·F A ; ③AE ·CE =BE ·DE ; ④AF ·BD =AB ·BF .则所有正确结论的序号是( ) A .①② B .③④ C .①②③ D .①②④6.D [解析] 如图所示,∵∠1=∠3,∠2=∠4,且∠1=∠2,∴∠4=∠3,∴BD 平分∠CBF ,∴△ABF ∽△BDF .∵AB BD =AF BF ,∴AB ·BF =AF ·BD .∵AF BF =BF DF,∴BF 2=AF ·DF .故①②④正确. 7.[2014·天津卷] 设a ,b ∈R ,则“a >b ”是“a |a |>b |b |”的( ) A .充分不必要条件 B .必要不充分条件 C .充要条件 D .既不充分又不必要条件 7.C [解析] 当ab ≥0时,可得a >b 与a |a |>b |b |等价.当ab <0时,可得a >b 时a |a |>0>b |b |;反之,由a |a |>b |b |知a >0>b ,即a >b .8.[2014·天津卷] 已知菱形ABCD 的边长为2,∠BAD =120°,点E ,F 分别在边BC ,DC 上,BE =λBC ,DF =μDC .若AE →·AF →=1,CE →·CF →=-23,则λ+μ=( )A.12B.23C.56D.7128.C [解析] 建立如图所示的坐标系,则A (-1,0),B (0,-3),C (1,0),D (0,3).设E (x 1,y 1),F (x 2,y 2).由BE =λBC 得(x 1,y 1+3)=λ(1,3),解得⎩⎨⎧x 1=λ,y 1=3(λ-1),即点E (λ,3(λ-1)).由DF →=μDC →得(x 2,y 2-3)=μ(1,-3),解得⎩⎨⎧x 2=μ,y 2=3(1-μ),即点F (μ,3(1-μ)).又∵AE ·AF =(λ+1,3(λ-1))·(μ+1,3(1-μ))=1,① CE →·CF →=(λ-1, 3(λ-1))·(μ-1, 3(1-μ))=-23.②①-②得λ+μ=56.9.[2014·天津卷] 某大学为了解在校本科生对参加某项社会实践活动的意向,拟采用分层抽样的方法,从该校四个年级的本科生中抽取一个容量为300的样本进行调查.已知该校一年级、二年级、三年级、四年级的本科生人数之比为4∶5∶5∶6,则应从一年级本科生中抽取________名学生.9.60 [解析] 由分层抽样的方法可得,从一年级本科生中抽取学生人数为300×44+5+5+6=60.10.[2014·天津卷] 一个儿何体的三视图如图1-3所示(单位:m),则该几何体的体积为________m 3.图1-310.20π3 [解析] 由三视图可得,该几何体为圆柱与圆锥的组合体,其体积V =π×12×4+13π×22×2=20π3.11.、[2014·天津卷] 设{a n }是首项为a 1,公差为-1的等差数列,S n 为其前n 项和.若S 1,S 2,S 4成等比数列,则a 1的值为________.11.-12 [解析] ∵S 2=2a 1-1,S 4=4a 1+4×32×(-1)=4a 1-6,S 1,S 2,S 4成等比数列,∴(2a 1-1)2=a 1(4a 1-6),解得a 1=-12.12.[2014·天津卷] 在△ABC 中,内角A ,B ,C 所对的边分别是a ,b ,c .已知b -c =14a ,2sin B =3sin C ,则cos A 的值为________.12.-14[解析] ∵2sin B =3sin C ,∴2b =3c .又∵b -c =a 4,∴a =2c ,b =32c ,∴cos A =b 2+c 2-a 22bc =94c 2+c 2-4c 22×32c ×c =-14.13.[2014·天津卷] 在以O 为极点的极坐标系中,圆ρ=4sin θ和直线ρsin θ=a 相交于A ,B 两点.若△AOB 是等边三角形,则a 的值为________.13.3 [解析] 将ρ=4sin θ与ρsin θ=a 转化为直角坐标方程分别为x 2+(y -2)2=4与y =a .联立⎩⎪⎨⎪⎧y =a ,x 2+(y -2)2=4,得x 2=-a 2+4a ,且0<a <4. ∵△AOB 为等边三角形,∴a 2=3(-a 2+4a ),解得a =3或a =0(舍).14.[2014·天津卷] 已知函数f (x )=|x 2+3x |,x ∈R .若方程f (x )-a |x -1|=0恰有4个互异的实数根,则实数a 的取值范围为________.14.(0,1)∪(9,+∞) [解析] 在同一坐标系内分别作出y =f (x )与y =a |x -1|的图像如图所示.当y =a |x -1|与y =f (x )的图像相切时,由⎩⎪⎨⎪⎧-ax +a =-x 2-3x ,a >0,整理得x 2+(3-a )x+a =0,则Δ=(3-a )2-4a =a 2-10a +9=0,解得a =1或a =9.故当y =a |x -1|与y =f (x )的图像有四个交点时,0<a <1或a>9.15.、、[2014·天津卷] 已知函数f (x )=cos x ·sin ⎝⎛⎭⎫x +π3-3cos 2x +34,x ∈R .(1)求f (x )的最小正周期;(2)求f (x )在闭区间⎣⎡⎦⎤-π4,π4上的最大值和最小值.15.解:(1)由已知,有f (x )=cos x ·⎝⎛⎭⎫12sin x +32cos x -3cos 2x +34=12sin x ·cos x -32cos 2x +34 =14sin 2x -34(1+cos 2x )+34 =14sin 2x -34cos 2x=12sin ⎝⎛⎭⎫2x -π3, 所以f (x )的最小正周期T =2π2=π.(2)因为f (x )在区间⎣⎡⎦⎤-π4,-π12上是减函数,在区间⎣⎡⎦⎤-π12,π4上是增函数,f ⎝⎛⎭⎫-π4=-14,f ⎝⎛⎭⎫-π12=-12,f ⎝⎛⎭⎫π4=14, 所以函数f (x )在区间⎣⎡⎦⎤-π4,π4上的最大值为14,最小值为-12.16.、、[2014·天津卷] 某大学志愿者协会有6名男同学,4名女同学.在这10名同学中,3名同学来自数学学院,其余7名同学来自物理、化学等其他互不相同的七个学院.现从这10名同学中随机选取3名同学,到希望小学进行支教活动(每位同学被选到的可能性相同).(1)求选出的3名同学是来自互不相同学院的概率;(2)设X 为选出的3名同学中女同学的人数,求随机变量X 的分布列和数学期望. 16.解:(1)设“选出的3名同学是来自互不相同的学院”为事件A ,则P (A )=C 13·C 27+C 03·C 37C 310=4960,所以选出的3名同学是来自互不相同学院的概率为4960.(2)随机变量X 的所有可能值为0,1,2,3.P (X =k )=C k 4·C 3-k6C 310(k =0,1,2,3), 所以随机变量X 的分布列是 X 0 1 2 3 P 1612310130随机变量X 的数学期望E (X )=0×16+1×12+2×310+3×130=65.17.、[2014·天津卷] 如图1-4所示,在四棱锥P - ABCD 中,P A ⊥底面ABCD, AD ⊥AB ,AB ∥DC ,AD =DC =AP =2,AB =1,点E 为棱PC 的中点.(1)证明:BE ⊥DC ;(2)求直线BE 与平面PBD 所成角的正弦值;(3)若F 为棱PC 上一点,满足BF ⊥AC ,求二面角F - AB - P 的余弦值.图1-417.解:方法一:依题意,以点A 为原点建立空间直角坐标系(如图所示),可得B (1,0,0),C (2,2,0),D (0,2,0),P (0,0,2).C 由E 为棱PC 的中点,得E (1,1,1).(1)证明:向量BE =(0,1,1),DC =(2,0,0), 故BE ·DC =0, 所以BE ⊥DC .(2)向量BD =(-1,2,0),PB =(1,0,-2). 设n =(x ,y ,z )为平面PBD 的法向量,则⎩⎪⎨⎪⎧n ·BD =0,n ·PB =0,即⎩⎪⎨⎪⎧-x +2y =0,x -2z =0. 不妨令y =1,可得n =(2,1,1)为平面PBD 的一个法向量.于是有 cos 〈n ,BE 〉=n ·BE |n |·|BE |=26×2=33,所以直线BE 与平面PBD 所成角的正弦值为33. (3) 向量BC =(1,2,0),CP =(-2,-2,2),AC =(2,2,0),AB =(1,0,0).由点F 在棱PC 上,设CF =λCP →,0≤λ≤1.故BF =BC +CF =BC +λCP →=(1-2λ,2-2λ,2λ).由BF ⊥AC ,得BF ·AC =0,因此2(1-2λ)+2(2-2λ)=0,解得λ=34,即BF =⎝⎛⎭⎫-12,12,32.设n 1=(x ,y ,z )为平面F AB 的法向量,则⎩⎪⎨⎪⎧n 1·AB =0,n 1·BF =0,即⎩⎪⎨⎪⎧x =0,-12x +12y +32z =0.不妨令z =1,可得n 1=(0,-3,1)为平面F AB 的一个法向量.取平面ABP 的法向量n 2=(0,1,0),则cos 〈,〉=n 1·n 2|n 1|·|n 2|=-310×1=-31010.易知二面角F - AB - P 是锐角,所以其余弦值为31010.方法二:(1)证明:如图所示,取PD 中点M ,连接EM ,AM .由于E ,M 分别为PC ,PD 的中点,故EM ∥DC ,且EM =12DC .又由已知,可得EM ∥AB 且EM =AB ,故四边形ABEM为平行四边形,所以BE ∥AM .因为P A ⊥底面ABCD ,故P A ⊥CD ,而CD ⊥DA ,从而CD ⊥平面P AD .因为AM ⊂平面P AD ,所以CD ⊥AM .又BE ∥AM ,所以BE ⊥CD .(2)连接BM ,由(1)有CD ⊥平面P AD ,得CD ⊥PD .而EM ∥CD ,故PD ⊥EM .又因为AD =AP ,M 为PD 的中点,所以PD ⊥AM ,可得PD ⊥BE ,所以PD ⊥平面BEM ,故平面BEM ⊥平面PBD ,所以直线BE 在平面PBD 内的射影为直线BM .而BE ⊥EM ,可得∠EBM 为锐角,故∠EBM 为直线BE 与平面PBD 所成的角.依题意,有PD =22,而M 为PD 中点,可得AM =2,进而BE = 2.故在直角三角形BEM 中,tan ∠EBM =EM BE =AB BE =12,因此sin ∠EBM =33,所以直线BE 与平面PBD 所成角的正弦值为33. (3)如图所示,在△P AC 中,过点F 作FH ∥P A 交AC 于点H .因为P A ⊥底面ABCD ,所以FH ⊥底面ABCD ,从而FH ⊥AC .又BF ⊥AC ,得AC ⊥平面FHB ,因此AC ⊥BH .在底面ABCD 内,可得CH =3HA ,从而CF =3FP .在平面PDC 内,作FG ∥DC 交PD 于点G ,于是DG =3GP .由于DC ∥AB ,故GF ∥AB ,所以A ,B ,F ,G 四点共面.由AB ⊥P A ,AB ⊥AD ,得AB ⊥平面P AD ,故AB ⊥AG ,所以∠P AG 为二面角F - AB - P 的平面角.在△P AG 中,P A =2,PG =14PD =22,∠APG =45°.由余弦定理可得AG =102,cos∠P AG =31010,所以二面角F - AB - P 的余弦值为31010.18.、[2014·天津卷] 设椭圆x 2a 2+y 2b 2=1(a >b >0)的左、右焦点分别为F 1,F 2,右顶点为A ,上顶点为B .已知|AB |=32|F 1F 2|. (1)求椭圆的离心率;(2)设P 为椭圆上异于其顶点的一点,以线段PB 为直径的圆经过点F 1,经过原点O 的直线l 与该圆相切,求直线l 的斜率.18.解:(1)设椭圆右焦点F 2的坐标为(c ,0).由|AB |=32|F 1F 2|,可得a 2+b 2=3c 2. 又b 2=a 2-c 2,则c 2a 2=12,所以椭圆的离心率e =22. (2)由(1)知a 2=2c 2,b 2=c 2. 故椭圆方程为x 22c 2+y 2c2=1.设P (x 0,y 0).由F 1(-c ,0),B (0,c ), 有F 1P →=(x 0+c ,y 0),F 1B →=(c ,c ).由已知,有F 1P →·F 1B →=0,即(x 0+c )c +y 0c =0. 又c ≠0,故有x 0+y 0+c =0.① 又因为点P 在椭圆上, 所以x 202c 2+y 20c2=1.②由①和②可得3x 20+4cx 0=0.而点P 不是椭圆的顶点,故x 0=-43c .代入①得y 0=c 3,即点P 的坐标为⎝⎛⎭⎫-4c 3,c3. 设圆的圆心为T (x 1,y 1),则x 1=-43c +02=-23c ,y 1=c3+c 2=23c ,进而圆的半径r =(x 1-0)2+(y 1-c )2=53c . 设直线l 的斜率为k ,依题意,直线l 的方程为y =kx .由l 与圆相切,可得|kx 1-y 1|k 2+1=r ,即⎪⎪⎪⎪k ⎝⎛⎭⎫-2c 3-2c 3k 2+1=53c ,整理得k 2-8k +1=0,解得k =4±15, 所以直线l 的斜率为4+15或4-15. 19.、、[2014·天津卷] 已知q 和n 均为给定的大于1的自然数.设集合M ={0,1,2,…,q -1},集合A ={x |x =x 1+x 2q +…+x n q n -1,x i ∈M ,i =1,2,…,n }. (1)当q =2,n =3时,用列举法表示集合A .(2)设s ,t ∈A ,s =a 1+a 2q +…+a n q n -1,t =b 1+b 2q +…+b n q n -1,其中a i ,b i ∈M ,i =1,2,…,n .证明:若a n <b n ,则s <t .19.解:(1)当q =2,n =3时,M ={0,1},A ={x |x =x 1+x 2·2+x 3·22,x i ∈M ,i =1,2,3},可得A ={0,1,2,3,4,5,6,7}.(2)证明:由s ,t ∈A ,s =a 1+a 2q +…+a n q n -1,t =b 1+b 2q +…+b n q n -1,a i ,b i ∈M ,i =1,2,…,n 及a n <b n ,可得s -t =(a 1-b 1)+(a 2-b 2)q +…+(a n -1-b n -1)q n -2+(a n -b n )q n -1≤(q -1)+(q -1)q +…+(q -1)q n -2-q n -1=(q -1)(1-q n -1)1-q-q n -1=-1<0,所以s <t . 20.、[2014·天津卷] 设f (x )=x -a e x (a ∈R ),x ∈R .已知函数y =f (x )有两个零点x 1,x 2,且x 1<x 2.(1)求a 的取值范围;(2)证明:x 2x 1随着a 的减小而增大;(3)证明:x 1+x 2随着a 的减小而增大.20.解:(1)由f (x )=x -a e x ,可得f ′(x )=1-a e x . 下面分两种情况讨论:(i)a ≤0时,f ′(x )>0在R 上恒成立,可得f (x )在R 上单调递增,不合题意. (ii)a >0时,由f ′(x )=0,得x =-ln a .当x 变化时,f ′(x ),f (x )的变化情况如下表:x (-∞,-ln a )-ln a (-ln a ,+∞)f ′(x ) + 0 - f (x )-ln a -1这时,f (x )的单调递增区间是(-∞,-ln a );单调递减区间是(-ln a ,+∞).于是,“函数y =f (x )有两个零点”等价于如下条件同时成立:①f (-ln a )>0;②存在s 1∈(-∞,-ln a ),满足f (s 1)<0;③存在s 2∈(-ln a ,+∞),满足f (s 2)<0.由f (-ln a )>0,即-ln a -1>0,解得0<a <e -1.而此时,取s 1=0,满足s 1∈(-∞,-ln a ),且f (s 1)=-a <0;取s 2=2a +ln 2a,满足s 2∈(-ln a ,+∞),且f (s 2)=⎝⎛⎭⎫2a -e 2a +⎝⎛⎭⎫ln 2a -e 2a <0. 故a 的取值范围是(0,e -1).(2)证明:由f (x )=x -a e x =0,有a =x e x .设g (x )=xe x ,由g ′(x )=1-x e x ,知g (x )在(-∞,1)上单调递增,在(1,+∞)上单调递减.并且,当x ∈(-∞,0]时,g (x )≤0; 当x ∈(0,+∞)时,g (x )>0.由已知,x 1,x 2满足a =g (x 1),a =g (x 2).由a ∈(0,e -1)及g (x )的单调性,可得x 1∈(0,1),x 2∈(1,+∞).对于任意的a 1,a 2∈(0,e -1),设a 1>a 2,g (ξ1)=g (ξ2)=a 1,其中0<ξ1<1<ξ2;g (η1)=g (η2)=a 2,其中0<η1<1<η2.因为g (x )在(0,1)上单调递增,所以由a 1>a 2,即g (ξ1)>g (η1),可得ξ1>η1.类似可得ξ2<η2.又由ξ1,η1>0,得ξ2ξ1<η2ξ1<η2η1,所以x 2x 1随着a 的减小而增大.(3)证明:由x 1=a e x 1,x 2=a e x 2,可得ln x 1=ln a +x 1,ln x 2=ln a +x 2.故x 2-x 1=ln x 2-ln x 1=ln x 2x 1.设x 2x 1=t ,则t >1,且⎩⎪⎨⎪⎧x 2=tx 1,x 2-x 1=ln t ,解得x 1=ln t t -1,x 2=t ln tt -1,所以x 1+x 2=(t +1)ln t t -1.①令h (x )=(x +1)ln x x -1,x ∈(1,+∞),则h ′(x )=-2ln x +x -1x (x -1)2. 令u (x )=-2ln x +x -1x ,得u ′(x )=⎝⎛⎭⎫x -1x 2.当x ∈(1,+∞)时,u ′(x )>0.因此,u (x )在(1,+∞)上单调递增,故对于任意的x ∈(1,+∞),u (x )>u (1)=0,由此可得h ′(x )>0,故h (x )在(1,+∞)上单调递增.因此,由①可得x 1+x 2随着t 的增大而增大.而由(2),t 随着a 的减小而增大,所以x 1+x 2随着a 的减小而增大.。

2014年新课标高考全国I理综化学(含答案)D回流50 min。
反应液冷至室温后倒入分液漏斗中,分别用少量水、饱和碳酸氢钠溶液和水洗涤;分出的产物加入少量无水MgSO4固体,静止片刻。
过滤除去MgSO4固体,进行蒸馏纯化。
收集140~143℃馏分,得到乙酸异戊酯3.9 g。
回答下列问题:⑴仪器B的名称是⑵在洗涤操作中第一次水洗的主要目的是,第二次水洗的主要目的是。
⑶在洗涤、分液操作中,应充分振荡,然后静置,待分层后(填标号)a.直接将乙酸异戊酯从分液漏斗的上口倒出b.直接将乙酸异戊酯从分液漏斗的下口放出c.先将水层从分液漏斗的下口放出,再将乙酸异戊酯从下口放出d.先将水层从分液漏斗的下口放出,再将乙酸异戊酯从上口倒出⑷本实验中加入过量乙酸的目的是⑸实验中加入少量无水MgSO4的目的是⑹在蒸馏操作中,仪器选择及安装都正确的是(填标号)⑺本实验的产率是(填标号)a.30% b.40% c.60% d.90%⑻在进行蒸馏操作时,若从130℃开始收集馏分,会使实验的产率偏(填“高”或“低”),其理由是27.(15分)次磷酸(H3PO2)是一种精细磷化工产品,具有较强的还原性。
回答下列问题:⑴ H3PO2是一元中强酸。
写出其电离方程式⑵ H3PO2及NaH2PO2均可将溶液中的Ag+还原为银,从而可用于化学镀银。
① H3PO2中,P元素的化合价为②利用H3PO2进行化学镀银反应中,氧化剂与还原剂的物质的量之比为4︰1,则氧化产物为(填化学式)③ NaH2PO2为(填“正盐”或“酸式盐”),其溶液显(填“弱酸性”、“中性”或“弱碱性”)⑶H3PO2的工业制法是:将白磷(P4)与Ba(OH)2溶液反应生成PH3气体和Ba(H2PO2)2,后者再与H2SO4反应。
写出白磷与Ba(OH)2溶液反应的化学方程式:⑷H3PO2也可用电渗法制备,“四室电渗法”工作原理如图所示(阳膜和阴膜分别只允许阳离子、阴离子通过)①写出阳极的电极反应式②分析产品室可得到H3PO2的原因是③早期采用“三室电渗法”制备H3PO2:将“四室电渗法”中阳极室的稀硫酸用H3PO2稀溶液代替,并撤去阳极室与产品室之间的阳膜,从而合并了阳极室和产品室。
2014年普通高等学校招生全国统一考试(新课标I 卷)理科综合能力测试化学部分7.下列化合物中同分异构体数目最少的是()A .戊烷B .戊醇C .戊烯D .乙酸乙酯26、(13分)乙酸异戊酯是组成蜜蜂信息素质的成分之一,具有香蕉的香味,实验室制备乙酸异戊酯的反应装置示意图和有关数据如下:实验步骤:在A中加入4.4g的异戊醇,6.0g的乙酸、数滴浓硫酸和2~3片碎瓷片,开始缓慢加热A,回流50分钟,反应液冷至室温后,倒入分液漏斗中,分别用少量水,饱和碳酸氢钠溶液和水洗涤,分出的产物加入少量无水硫酸镁固体,静置片刻,过滤除去硫酸镁固体,,进行蒸馏纯化,收集140~143℃馏分,得乙酸异戊酯3.9g。
回答下列问题:(1)装置B的名称是:(2)在洗涤操作中,第一次水洗的主要目的是:;第二次水洗的主要目的是:。
(3)在洗涤、分液操作中,应充分振荡,然后静置,待分层后(填标号),(4(5(6(7(827、(15(1(2则氧化产物为:(填化(3(4):②分析产品室可得到H3PO2的原因③早期采用“三室电渗析法”制备H3PO2,将“四室电渗析法”中阳极室的稀硫酸用H3PO2稀溶液代替,并撤去阳极室与产品室之间的阳膜,从而合并了阳极室与产品室,其缺点是杂质。
该杂质产生的原因是:28、(15分)乙醇是重要的有机化工原料,可由乙烯直接水合法或间接水合法生产。
回答下列问题:(1)间接水合法是指先将乙烯与浓硫酸反应生成硫酸氢乙酯(C2H5OSO3H)。
再水解生成乙醇。
写出相应的反应的化学方程式(2)已知:甲醇脱水反应①2CH3OH(g)=CH3OCH3(g)+H2O(g)?△H1=-23.9KJ·mol-1甲醇制烯烃反应②2CH3OH(g)=C2H4(g)+2H2O(g)?△H2=-29.1KJ·mol-1乙醇异构化反应③CH3CH2OH(g)=CH3OCH3(g))?△H3=+50.7KJ·mol-1则乙烯气相直接水合反应C2H4(g)+H2O(g)=C2H5OH(g)的?△H=K J·mol-1与间接水合法相比,气相直接水合法的优点是:。
2014年普通高等学校招生全国统一考试(天津卷)理科综合能力测试化学部分第I 卷1.化学与生产、生活息息相关,下列叙述错误的是A.铁表而镀锌可以增强其抗腐蚀性B.用聚乙烯塑料代替聚乳酸塑料可减少白色污染C.大量燃烧化石燃料是造成雾霾天气的一种重要因素D.含再金属离子的电镀废液不能随意排放2.实验室制备下列气体时,所用方法正确的是A.制氧气时,用Na2O2或H2O2作反应物可选择相同的气体发生装置B.制氯气时,用饱和NaHCO3溶液和浓硫酸净化气体C.制乙烯时,用排水法或向上排空气法收集气体D.制二氧化氮时,用水或NaOH溶液吸收尾气3.运用相关化学知识进行判断,下列结论错误的是A.某吸热反应能自发进行,因此该反应是熵增反应B.NH4F水溶液中含有HF,因此NH4F溶液不能存放于玻璃试剂瓶中C.可燃冰主要甲烷与水在低温高压下形成的水合物晶体,因此可存在于海底D.增大反应物浓度可加快反应速率,因此用浓硫酸与铁反应能增大生成H2的速率4.对右图两种化合物的结构或性质描述正确的是A.不是同分异构体B.分子中共平面的碳原了数相同C.均能与溴水反应D.可用红外光谱区分,但不能用核磁共振氢谱区分5.下列有关电解质溶液中粒子浓度关系正确的是A.pH=1的NaHSO4溶液:c(H+)=c(SO42-)十c(OH-)B.含有AgCl和AgI固体的悬浊液:c(Ag+)>c(C1-)=c(I-)C.CO2的水溶液:c(H+)>c(HCO3-)=2c(CO32-)D.含等物质的量的NaHC2O4和Na2C2O4的溶液:3c(Na+)=2[c(HC2O4-)+ c(C2O42-)+c(H2C2O4)]6.已知:锂离子电池的总反应为:Li x C+Li1-x CoO2放电充电C+LiCoO2锂硫电池的总反应为:2Li+S 放电充电Li2S。
有关上述两种电池说法正确的是A.锂离子电池放电时,Li+向负极迁移B.锂硫电池充电时,锂电极发生还原反应C.理论上两种电池的比能量相同D.右图表示用锂离子电池给锂硫电池充电第II卷7.(14分)元素单质及其化合物有广泛用途,请根据周期表中第三周期元素相关知识回答下列问题:(1)按原子序数递增的顺序(稀有气体除外),以下说法正确的是。
理科综合能力测试试卷 第1页(共34页)理科综合能力测试试卷 第2页(共34页)绝密★启用前2014普通高等学校招生全国统一考试(天津卷)理科综合 物理部分理科综合共300分,考试用时150分钟。
物理试卷分为第Ⅰ卷(选择题)和第Ⅱ卷两部分,第Ⅰ卷1至3页,第Ⅱ卷3至6页,共120分。
答卷前考生务必将自己的姓名、准考证号填写在答题卡上,并在规定位置粘贴考试用条形码。
答卷时,考生务必将答案涂写在答题卡上,答在试卷上的无效。
考试结束后,将本试卷和答题卡一并交回。
祝各位考生考试顺利!第Ⅰ卷注意事项:1. 每题选出答案后,用铅笔将答题卡上对应题目的答案标号涂黑。
如需改动,用橡皮擦干净后,再选涂其他答案标号。
2. 本卷共8题,每题6分,共48分。
一、单项选择题(本题共5小题,每小题6分,共30分。
每小题给出的四个选项中,只有一个选项是正确的)1. 质点做直线运动的速度—时间图象如图所示,该质点( )A. 在第1秒末速度方向发生了改变B. 在第2秒末加速度方向发生了改变C. 在前2秒内发生的位移为零D. 第3秒末和第5秒的位置相同2. 如图所示,电路中1R 、2R 均为可变电阻,电源内阻不能忽略,平行板电容器C 的极板水平放置。
闭合电建S ,电路达到稳定时,带电油滴悬浮在两板之间静止不动。
如果仅改变下列某一个条件,油滴仍能静止不动的是 ( )A. 增大1R 的阻值B. 增大2R 的阻值C. 增大两板间的距离D. 断开开关S3. 研究表明,地球自转在逐渐变慢,3亿年前地球自转的周期约为22小时。
假设这种趋势会持续下去,地球的其他条件都不变,未来人类发射的地球同步卫星与现在相比( )A. 距地球的高度变大B. 向心加速度变大C. 线速度变大D. 角速度变大4. 如图所示,平行金属板A 、B 水平正对放置,分别带等量异号电荷。
一带点微粒水平射入板间,在重力和电场力共同作用下运动,轨迹如图中虚线所示,那么 ( ) A. 若微粒带正电荷,则A 板一定带正电荷 B. 微粒从M 点运动到N 点电势能一定增加C. 微粒从M 点运动到N 点动能一定增加D. 微粒从M 点运动到N 点机械能一定增加5. 平衡位置处于坐标原点的波源S 在y 轴上振动,产生频率50Hz 的简谐波向x 轴正、负两个方向传播,波速均为100 m/s 。
2014年天津高考理综化学试题及答案一、单项选择题【2014天津】1.化学与生产、生活息息相关,下列叙述错误的是( )A.铁表面镀锌可增强其抗腐蚀性B.用聚乙烯塑料代替聚乳酸塑料可减少白色污染C.大量燃烧化石燃料是造成雾霾天气的一种重要因素D.含重金属离子的电镀废液不能随意排放【答案】B【解析】A、锌的化学性质活泼,铁表面镀锌,铁被保护,A项正确B、;聚乳酸塑料易降解,而聚乙烯塑料难降解,是产生白色污染的主要污染物,B项错误;C、化石燃料燃烧时生成大量的二氧化碳,同时生成一氧化碳、二氧化硫等有害气体,还能产生大量的粉尘等有害颗粒物,故大量燃烧化石燃料是造成雾霾天气的一种重要因素,C项正确;D、含重金属离子的电镀废液随意排放会造成水体污染,D项正确。
【2014天津】2.实验室制备下列气体时,所用方法正确的是( )A.制氧气时,用Na2O2或H2O2作反应物可选择相同的气体发生装置B.制氯气时,用饱和NaHCO3溶液和浓硫酸净化气体C.制乙烯时,用排水法或向上排空气法收集气体D.制二氧化氮时,用水或NaOH溶液吸收尾气【答案】A【解析】A、用Na2O2和水反应制取氧气,与用在MnO2催化下分解H2O2制取氧气的发生装置相同,A项正确;B、饱和NaHCO3溶液显碱性,能与氯气反应,B项错误;C、相同条件下,乙烯的密度与空气的密度相差不大,故不能用排空气法收集乙烯,C项错误;D、NO2与水发生反应3NO2+H2O===2HNO3+NO,产生的NO仍是有毒气体,故不能用水吸收含NO2的尾气,D项错误。
【2014天津】3.运用相关化学知识进行判断,下列结论错误的是( )A.某吸热反应能自发进行,因此该反应是熵增反应B.NH4F水溶液中含有HF,因此NH4F溶液不能存放于玻璃试剂瓶中C.可燃冰主要是甲烷与水在低温高压下形成的水合物晶体,因此可存在于海底D.增大反应物浓度可加快反应速率,因此用浓硫酸与铁反应能增大生成H2的速率【答案】D【解析】A 、当ΔH -TΔS <0时,反应能自发进行,吸热反应的ΔH >0,吸热反应能自发,说明ΔS >0,A 项正确;B 、NH 4F 溶液中F -水解生成HF ,HF 能与玻璃中的SiO 2发生反应4HF +SiO 2===SiF 4↑+2H 2O ,故NH 4F 溶液不能存放在玻璃试剂瓶中,B 项正确;C 、可燃冰需在低温高压下形成,所以可燃冰可存在于海底,C 项正确;D 、常温下,浓硫酸使铁发生钝化,D 项错误。
2014年天津高考理综化学试题及答案一、单项选择题【2014天津】1.化学与生产、生活息息相关,下列叙述错误的是()A.铁表面镀锌可增强其抗腐蚀性B.用聚乙烯塑料代替聚乳酸塑料可减少白色污染C.大量燃烧化石燃料是造成雾霾天气的一种重要因素D.含重金属离子的电镀废液不能随意排放【答案】B【解析】A、锌的化学性质活泼,铁表面镀锌,铁被保护,A项正确B、;聚乳酸塑料易降解,而聚乙烯塑料难降解,是产生白色污染的主要污染物,B项错误;C、化石燃料燃烧时生成大量的二氧化碳,同时生成一氧化碳、二氧化硫等有害气体,还能产生大量的粉尘等有害颗粒物,故大量燃烧化石燃料是造成雾霾天气的一种重要因素,C项正确;D、含重金属离子的电镀废液随意排放会造成水体污染,D项正确。
【2014天津】2.实验室制备下列气体时,所用方法正确的是()A.制氧气时,用Na2O2或H2O2作反应物可选择相同的气体发生装置B.制氯气时,用饱和NaHCO3溶液和浓硫酸净化气体C.制乙烯时,用排水法或向上排空气法收集气体D.制二氧化氮时,用水或NaOH溶液吸收尾气【答案】A【解析】A、用Na2O2和水反应制取氧气,与用在MnO2催化下分解H2O2制取氧气的发生装置相同,A项正确;B、饱和NaHCO3溶液显碱性,能与氯气反应,B项错误;C、相同条件下,乙烯的密度与空气的密度相差不大,故不能用排空气法收集乙烯,C项错误;D、NO2与水发生反应3NO2+H2O===2HNO3+NO,产生的NO仍是有毒气体,故不能用水吸收含NO2的尾气,D项错误。
【2014天津】3.运用相关化学知识进行判断,下列结论错误的是()A.某吸热反应能自发进行,因此该反应是熵增反应B.NH4F水溶液中含有HF,因此NH4F溶液不能存放于玻璃试剂瓶中C.可燃冰主要是甲烷与水在低温高压下形成的水合物晶体,因此可存在于海底D.增大反应物浓度可加快反应速率,因此用浓硫酸与铁反应能增大生成H2的速率【答案】D【解析】A、当ΔH-TΔS<0时,反应能自发进行,吸热反应的ΔH>0,吸热反应能自发,说明ΔS>0,A项正确;B、NH4F溶液中F-水解生成HF,HF能与玻璃中的SiO2发生反应4HF+SiO2===SiF4↑+2H2O,故NH4F溶液不能存放在玻璃试剂瓶中,B项正确;C、可燃冰需在低温高压下形成,所以可燃冰可存在于海底,C项正确;D、常温下,浓硫酸使铁发生钝化,D项错误。
2014年普通高等学校招生全国统一考试(天津卷)
理科综合能力测试化学部分
第I卷
1.化学与生产、生活息息相关,下列叙述错误的是
A.铁表而镀锌可以增强其抗腐蚀性
B.用聚乙烯塑料代替聚乳酸塑料可减少白色污染
C.大量燃烧化石燃料是造成雾霾天气的一种重要因素
D.含再金属离子的电镀废液不能随意排放
2.实验室制备下列气体时,所用方法正确的是
A.制氧气时,用Na2O2或H2O2作反应物可选择相同的气体发生装置
B.制氯气时,用饱和NaHCO3溶液和浓硫酸净化气体
C.制乙烯时,用排水法或向上排空气法收集气体
D.制二氧化氮时,用水或NaOH溶液吸收尾气
3.运用相关化学知识进行判断,下列结论错误的是
A.某吸热反应能自发进行,因此该反应是熵增反应
B.NH4F水溶液中含有HF,因此NH4F溶液不能存放于玻璃试剂瓶中
C.可燃冰主要甲烷与水在低温高压下形成的水合物晶体,因此可存在于海底
D.增大反应物浓度可加快反应速率,因此用浓硫酸与铁反应能增大生成H2的速率
4.对右图两种化合物的结构或性质描述正确的是
A.不是同分异构体
B.分子中共平面的碳原了数相同
C.均能与溴水反应
D.可用红外光谱区分,但不能用核磁共振氢谱区分
5.下列有关电解质溶液中粒子浓度关系正确的是
A.pH=1的NaHSO4溶液:c(H+)=c(SO42-)十c(OH-) B.含有AgCl和AgI固体的悬浊液:c(Ag+)>c(C1-)=c(I-) C.CO2的水溶液:c(H+)>c(HCO3-)=2c(CO32-)
D.含等物质的量的NaHC2O4和Na2C2O4的溶液:3c(Na+)=2[c(HC2O4-)+ c(C2O42-)+c(H2C2O4)]
6.已知:锂离子电池的总反应为:Li x C+Li1-x CoO2放电
充电C+LiCoO2
锂硫电池的总反应为:2Li+S 放电
充电Li2S
有关上述两种电池说法正确的是
A.锂离子电池放电时,Li+向负极迁移
B.锂硫电池充电时,锂电极发生还原反应
C.理论上两种电池的比能量相同
D.右图表示用锂离子电池给锂硫电池充电
【答案】B
第II卷
7.(14分)元素单质及其化合物有广泛用途,请根据周期表中第三周期元素相关知识回答下列问题:
(1)按原子序数递增的顺序(稀有气体除外),以下说法正确的是。
a.原子序数和离子半径均减小b.金属性减弱,非金属性增强
c.氧化物对应的水合物碱性减弱,酸性增强d.单质的熔点降低(2)原子最外层电子数与次外层电子数相同的元素名称为,氧化性最弱的简单阳离子是。
(3)已知:
工业制镁时,电解MgCl2而不电解MgO的原因
是;制铝时,电解Al2O3而不电解AlCl3的原因
是。
(4)晶体硅(熔点1410℃)是良好的半导体材料。
由粗硅制纯硅过程如下:
写出SiCl4的电子式:;在上述由SiCl4制纯硅的反应中,测得每生
成 1.12kg纯硅需吸收akJ热量,写出该反应的热化学方程
式:。
(5)P2O5是非氧化性干燥剂,下列气体不能用浓硫酸干燥,可用P2O5干燥的是。
a.NH3b.HI c.SO2 d .CO2
(6)KClO3可用于实验室制O2,若不加催化剂,400℃时分解只生成两种盐,其中一种是无氧酸盐,另一种盐的阴阳离子个数比为1:1。
写出该反应的化学方程
式:。
【答案】(1)b
【解析】
8.(18分)从薄荷油中得到一种烃A(C10H16),叫ɑ—非兰烃,与A相关反应如下:
(1)H的分子式为。
(2)B所含官能团的名称为。
(3)含两个—COOCH3基团的C的同分异构体共有种(不考虑手性异构),其中核磁共振氢谱呈现2个吸收峰的异构体结构简式为。
(4)B→D,D→E的反应类型分别为、。
(5)G为含六元环的化合物,写出其结构简式:。
(6)F在一定条件下发生聚合反应可得到一种高级吸水性树脂,该树脂名称为。
(7)写出E→F的化学方程式:。
(8)A的结构简式为,A与等物质的量的Br2进行加成反应的产物共有种(不考虑立体异构)。
(8);3
9.(18分)Na2S2O3是重要的化工原料,易溶于水。
在中性或碱性环境中稳定。
I.制备Na2S2O3•5H2O
反应原理:Na2SO3(aq)+S(s)Na2S2O3(aq)
实验步骤:
①称取15g Na2SO3加入圆底烧瓶中,再加入80ml蒸馏水。
另取5g研细的硫粉,用3ml 乙醇润湿,加入上述溶液中。
②安装实验装置(如图所示,部分加持装置略去),水浴加热,微沸60分钟。
③趁热过滤,将滤液水浴加热浓缩,冷却析出Na2S2O3•5H2O,经过滤,洗涤,干燥,得到产品。
回答问题:
(1)硫粉在反应前用乙醇润湿的目的是。
(2)仪器a的名称是,其作用是。
(3)产品中除了有未反应的Na2SO3外,最可能存在的无机杂质是,检验是否存在该杂质的方法
是。
(4)该实验一般控制在碱性环境下进行,否则产品发黄,用离子方程式表示其原因:。
II.测定产品纯度
准确称取Wg产品,用适量蒸馏水溶解,以淀粉作指示剂,用0.1000 m ol•L‾1碘的标准溶液滴定。
反应原理为:2S2O32‾+I2=S4O62-+2I‾
(5)滴定至终点时,溶液颜色的变化:。
(6)滴定起始和终点的液面位置如图,则消耗碘的标准溶液体积为mL。
产品的纯度为(设Na2S2O3•5H2O相对分子质量为M)。
III.Na2S2O3的应用
(7)Na2S2O3还原性较强,在溶液中易被Cl2氧化成SO42‾,常用作脱氧剂,该反应的离子方程式
为。
【答案】(1)使硫粉易于分散到溶液中
(2)冷凝管冷凝回流
(3)Na2SO4
取少量产品溶于过量稀盐酸,过滤,向滤液中加BaCl2溶液,若有白色沉淀,则产品中含有Na2SO4
(4)S2O32‾+2H+=S↓+SO2↑+H2O
(5)由无色变为蓝色
(6)18.10
(7)S2O32‾+4Cl2+5H2O = 2SO42‾+8Cl‾+10H+
【解析】
10.(14分)合成氨是人类科学技术上的一项重大突破,其反应原理为:
N 2(g)+3H2(g)2NH3(g)∆H=—92.4kJ•mol‾1
一种工业合成氨的简易流程图如下:
(1)天然气中的H2S杂质常用常用氨水吸收,产物为NH4HS。
一定条件下向NH4HS溶液中通入空气,得到单质硫并使吸收液再生,写出再生反应的化学方程式:。
(2)步骤II中制氯气原理如下:
对于反应①,一定可以提高平衡体系中H2百分含量,又能加快反应速率的是。
a.升高温度
b.增大水蒸气浓度
c.加入催化剂
d.降低压强
利用反应②,将CO进一步转化,可提高H2产量。
若1mol CO和H2的混合气体(CO 的体积分数为20%)与H2O反应,得到1.18mol CO、CO2和H2的混合气体,则CO 转化率为。
(3)图1表示500℃、60.0MPa条件下,原料气投料比与平衡时NH3体积分数的关系。
根据图中a点数据计算N2的平衡体积分数:。
(4)依据温度对合成氨反应的影响,在图2坐标系中,画出一定条件下的密闭容器内,从通入原料气开始,随温度不断升高,NH3物质的量变化的曲线示意图。
(5)上述流程图中,使合成氨放出的热量得到充分利用的主要步骤是(填序号),简述本流程中提高合成氨原料总转化率的方法:。