单糖的化学性质-zy
- 格式:ppt
- 大小:4.97 MB
- 文档页数:75
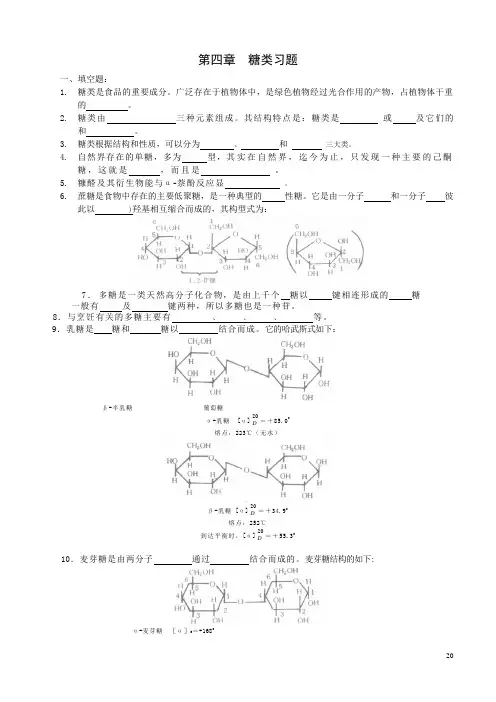
第四章糖类习题一、填空题:1.糖类是食品的重要成分。
广泛存在于植物体中,是绿色植物经过光合作用的产物,占植物体干重的。
2.糖类由三种元素组成。
其结构特点是:糖类是或及它们的和。
3.糖类根据结构和性质,可以分为、和三大类。
4.自然界存在的单糖,多为型,其实在自然界,迄今为止,只发现一种主要的己酮糖,这就是,而且是。
5.糠醛及其衍生物能与α-萘酚反应显。
6.蔗糖是食物中存在的主要低聚糖,是一种典型的性糖。
它是由一分子和一分子彼此以 )羟基相互缩合而成的,其构型式为:7.多糖是一类天然高分子化合物,是由上千个糖以键相连形成的糖一般有及键两种,所以多糖也是一种苷。
8.与烹饪有关的多糖主要有、、、等。
9.乳糖是糖和糖以结合而成。
它的哈武斯式如下:β-半乳糖葡萄糖α-乳糖 [α]20D=+85.0熔点:223℃(无水)β-乳糖 [α]20D=+34.9熔点:252℃到达平衡时,[α]20D=+55.310.麦芽糖是由两分子通过结合而成的。
麦芽糖结构的如下:α-麦芽糖[α]D=+1680β-麦芽糖 [α]D=+1180达到平衡时,[α]D=+136011.从植物中分离得到的淀粉多是白色粉末状,若在显微镜下观察,可以看到不同来源的淀粉粒的形状和大小都不相同,一般来说,地下淀粉多为的颗粒,地上淀粉多为的颗粒。
而每一个淀粉分子又是由许多个分子聚合而成的,由于分子结构不同,又分成了和两类。
12.淀粉是由单位组成的链状结构。
用热水处理可将淀粉分为两种成分:一种为可溶解部分,是淀粉,另一种不溶解部分是淀粉。
13.直链淀粉是以键连接起来的,一条的多苷链。
每个直链淀粉分子有一个和一个。
直链淀粉不是完全伸直的,它的分子通常是卷曲成的,每一圈有个葡萄糖残基。
直链淀粉热水,以碘液处理产生色。
14.支链淀粉首先由糖以键连结成一条主链,然后在主链上以键与较短的以键连结的链相连结,形成支链。
在支链与主链的衔接处都是糖残基的键结合。
15.淀粉与碘能起显色反应。


一、单糖的结构(一)单糖的链式结构单糖的种类虽多,但其结构和性质都有很多相似之处,因此我们以葡萄糖为例来阐述单糖的结构。
葡萄糖的分子式为C6H12O6,具有一个醛基和5个羟基,我们用费歇尔投影式表示它的链式结构:以上结构可以简化:(二)葡萄糖的构型葡萄糖分子中含有4个手性碳原子,根据规定,单糖的D、L构型由碳链最下端手性碳的构型决定。
人体中的糖绝大多数是D-糖。
(三)葡萄糖的环式结构葡萄糖在水溶液中,只要极小部分(<1%)以链式结构存在,大部分以稳定的环式结构存在。
环式结构的发现是因为葡萄糖的某些性质不能用链式结构来解释。
如:葡萄糖不能发生醛的NaHSO3加成反应;葡萄糖不能和醛一样与两分子醇形成缩醛,只能与一分子醇反应;葡萄糖溶液有变旋现象,当新制的葡萄糖溶解于水时,最初的比旋是+112度,放置后变为+52.7度,并不再改变。
溶液蒸干后,仍得到+112度的葡萄糖。
把葡萄糖浓溶液在110度结晶,得到比旋为+19度的另一种葡萄糖。
这两种葡萄糖溶液放置一定时间后,比旋都变为+52.7度。
我们把+112度的叫做α-D(+)-葡萄糖,+19度的叫做β-D(+)-葡萄糖。
这些现象都是由葡萄糖的环式结构引起的。
葡萄糖分子中的醛基可以和C5上的羟基缩合形成六元环的半缩醛。
这样原来羰基的C1就变成不对称碳原子,并形成一对非对映旋光异构体。
一般规定半缩醛碳原子上的羟基(称为半缩醛羟基)与决定单糖构型的碳原子(C5)上的羟基在同一侧的称为α-葡萄糖,不在同一侧的称为β-葡萄糖。
半缩醛羟基比其它羟基活泼,糖的还原性一般指半缩醛羟基。
葡萄糖的醛基除了可以与C5上的羟基缩合形成六元环外,还可与C4上的羟基缩合形成五元环。
五元环化合物不甚稳定,天然糖多以六元环的形式存在。
五元环化合物可以看成是呋喃的衍生物,叫呋喃糖;六元环化合物可以看成是吡喃的衍生物,叫吡喃糖。
因此,葡萄糖的全名应为α-D(+)-或β-D(+)-吡喃葡萄糖。


![[复习]实验八糖类化合物的性质](https://uimg.taocdn.com/0d5afc9f85868762caaedd3383c4bb4cf7ecb76a.webp)
实验八糖类化合物的性质糖类化合物是一类多羟基的内半缩醛、酮及其聚合物。
按其水解情况的不同,糖类化合物可分为单糖、低聚糖和多糖三类。
1、单糖的性质:单糖的性质包括一般性质和特殊性质。
一般性质主要表现为羰基的典型反应及羟基的典型反应。
特殊性质有水溶液中的变旋现象;与苯肼成砂;稀碱介质中的差向异构化;半缩醛、酮羟基与含羟基的化合物成苷;氧化反应(醛糖能被溴水温和氧化成糖酸;醛、酮都能被吐伦试剂、斐林试剂氧化;被稀硝酸氧化为糖二酸;被高碘酸氧化断裂成甲醛或甲酸);强酸介质中与酚类化合物缩合而呈现颜色反应(如Molicsh反应、Seliwanoff反应)等。
2、双糖的性质:双糖根据分子中是否还保留有原来一个单糖分子的半缩醛羟基而分成还原性双糖(如麦芽糖、乳糖、纤维二糖)与非还原性双糖(如蔗糖)。
还原性双糖由于分子中还保留有原来单糖分子中的一个半缩醛羟基,水溶液中能开环成开链的醛式而表现出还原性(能被吐伦试剂或斐林试剂氧化)、变旋现象及成砂反应。
非还原性糖由于分子中没有半缩醛羟基而没有上述性质。
双糖分子可在酸或酶催化下水解成单糖而表现出单糖的还原性。
3、多糖的性质:多糖由成千上万个单糖单位缩合而成,难溶于水,无甜味,无还原性,能被酸或碱催化而逐步水解成单糖。
淀粉是一种常见的多糖,在酸或酶催化下水解,可逐步生成分子较小的多糖,最后水解成葡萄糖:淀粉-各种糊精-麦芽糖-葡萄糖。
碘与淀粉显蓝紫色,与不同分子量的糊精显红色或黄色,糖分子量太小时,与碘不显色。
常用碘实验对淀粉进行定性分析及检验淀粉的水解程度。
【实验步骤】一、糖的还原性1、与吐伦试剂反应:取4支试管,各加入吐伦试剂1ml,然后分别加入4滴2%葡萄糖、2%果糖、2%蔗糖、2%麦芽糖溶液,摇匀,将试管同时50~60℃水浴中加热,观察有无银镜产生。
2、与斐林试剂的反应:取5支试管,各加入1ml斐林试剂A和1ml斐林试剂B,混匀,然后分别加入4滴2%葡萄糖、2%果糖、2%蔗糖、2%麦芽糖、1%淀粉溶液,摇匀,将试管同时放入沸水浴中加热2~3分钟,然后取出冷却,观察。

单糖的化学性质及应用单糖是一种最基本的糖类,也是其他多糖和复合糖的构建单元。
它们由一个具有5或6个碳原子的环状分子组成,具有许多重要的化学性质和广泛的应用。
首先,单糖具有可溶性。
由于其小分子结构和强大的亲水性,单糖可以轻松地在水中溶解。
这使得它们在生物体内起着非常关键的作用,可以传递能量、构建细胞结构以及参与许多生化反应。
其次,单糖具有还原性。
具有醛基(如葡萄糖和半乳糖)的单糖可以被氧化还原反应还原为相应的醇。
这种还原反应是单糖参与许多重要代谢途径的基础,如糖酵解。
此外,单糖还具有光学性质。
几乎所有的单糖都存在构象异構體。
最常见的有两种异构体,即D型和L型。
这种异构体的存在可以通过旋光法进行检测。
D型和L型单糖的分子结构基本相同,只是它们的立体构型(手性)不同。
大多数自然界中存在的单糖都是D型,如葡萄糖。
而L型单糖在人体中极少见。
此外,单糖还具有水解性。
单糖可以通过水解反应,如酸水解或酶水解,在适当的条件下被分解为单体的糖。
这种水解反应对于人类消化吸收和能量代谢至关重要。
单糖具有广泛的应用。
首先,作为重要的能源源,单糖在人体中参与葡萄糖新陈代谢,为细胞提供能量。
其次,单糖是构建细胞壁、核酸和蛋白质的基本单元,参与细胞的生长和发育。
此外,单糖还被广泛用于食品工业中作为甜味剂,如蔗糖和果糖,以增加食品的甜味。
此外,单糖还可以用作一种药物基础,用于制备各种药物,如抗生素、抗癌药物和代谢疾病的治疗药物。
此外,单糖还可以用于生物燃料制备、能源储存等领域。
总之,单糖是一类非常重要的糖类化合物,具有多种化学性质和广泛的应用。
通过了解和研究单糖的性质和应用,有助于我们更好地理解糖的生物学功能,开发新的糖类药物和应用,为人类的健康和可持续发展做出贡献。

糖类的化学性质糖是一种广泛存在于自然界的重要有机化合物,它们的化学性质与其结构密切相关。
糖包含羟基、醛基、酮基等官能团,因此在化学反应中极易发生氧化、还原、酸碱水解、缩合等反应。
本文将从这些方面来探讨糖的化学性质。
一、氧化还原反应糖具有重要的还原性质。
在存在比它们还原性更强的还原剂时,糖可以发生氧化反应,同时还原剂被还原成较弱的物质。
对于单糖来说,它们可以在碱性条件下与空气中的氧气发生氧化反应,生成羧酸和醛。
例如,葡萄糖在碱性条件下可被氧化为葡萄糖酸,下面是反应式:C6H12O6 + O2 → C6H10O7 + H2O另一方面,糖还具有重要的还原性质,可以被强氧化剂还原为醇或糖醇。
例如,葡萄糖在浓硝酸的作用下可以被还原为甘露醇:C6H12O6 + 6 HNO3 → C6H14O6 + 6 NO2 + 3 H2O二、酸碱水解糖在弱酸或弱碱条件下可以发生水解反应。
这种水解反应被称为糖水解或糖分解。
在酸性条件下,糖分解产生分子量较小的产物,如果糖和葡萄糖。
在碱性条件下分解,产物主要是己糖和戊糖。
下面是葡萄糖的酸性水解反应:C6H12O6 + H2O → C5H10O5 + C6H12O6在碱性条件下,葡萄糖的水解反应的产物为:C6H12O6 + 2 NaOH → C6H10O5Na2 + 2 H2O三、缩合反应糖分子的羟基和醛基在缩合反应中可以发挥重要作用。
缩合反应是一种重要的糖化学反应,它可以合成二糖、三糖、多糖等复杂化合物。
常见的缩合反应有糖醛基在酸性条件下与羟基缩合形成的糖苷键和异构糖在碱性条件下与羟基缩合形成的糖苷键等。
下面是葡萄糖和果糖缩合形成蔗糖的反应:C6H12O6 + C6H12O6 → C12H22O11 + H2O四、其他反应除以上三类反应之外,还有一些其他的反应也体现了糖的化学性质。
例如,在存在酸催化剂下,葡萄糖和果糖可以发生环化反应,形成半乳糖、伊莫球碱、凝集素等化合物。
此外,还可以通过糖转移酶催化的反应,形成糖链分子,构成多种多样的糖蛋白和糖类化合物。


第十三章 糖类第一节 单糖定义:多羟基醛或酮以及它们失水结合而成的缩聚物。
糖类化合物又称碳水化合物,因为当初发现的葡萄糖和果糖等的分子式都是C 6H 12O 6,即C 6(H 2O )6,可看成是碳和水结合的化合物,于是用通式C x (H 2O)y 来表示。
但后来发现有些化合物在结构和性质方面都和糖类相似,但它们的分子组成并不符合通式,如 李糖是一种甲基戊糖,它的分子式是C 6H 12O 5。
此外,有些分子组成符合上述通式的化合物,如乙酸,其分子式为C 2H 4O 2,符合通式,但从结构和性质上看,不属于糖类,所以,“碳水化合物”不能确切地代表糖类化合物,但因沿用已久,至今还在保留着。
分类:糖类根据其能否水解及水解后产物的情况将其分成三大类。
单糖:是不能水解的多羟基醛或酮,如葡萄糖、果糖。
低聚糖:是水解后产生2个或几十个单糖分子的糖类。
最常见的是二糖,如麦芽糖、蔗糖。
多糖:是水解后产生数十、数百乃至成千上万个单糖分子的糖类。
如淀粉、纤维素等。
第一节 单糖单糖分为两类:醛糖和酮糖。
最简单的醛糖是二羟基丙醛,最简单的酮糖是二羟基丙酮。
存在于自然界的大多数单糖是含有5个碳原子的戊糖和6个碳原子的已糖。
一、单糖的组成及结构(一)葡萄糖的组成及结构1、链状结构式由元素分析和分子量测定确定了葡萄糖的分子式为C 6H 12O 6。
其平面结构式为:CH 2OHCHOHCHOHCHOHCHOHCHO其费歇尔投影式为:D-(+)-葡萄糖在葡萄糖的投影式中,定位编号最大的手性碳原子上的羟基位于右边,按照单糖构型的D 、L 表示法规定,葡萄糖属于D-型糖,又因葡萄糖的水溶液具有右旋性,所以通常写为D-(+)-葡萄糖。
葡萄糖是已醛糖,分子中有4个手性碳原子,应有16个光学异构体,其中8个为D 型,8个为L 型。
2、变旋光现象及环状结构式变旋光现象:某些旋光性化合物的旋光度在放置过程中会逐渐上升或下降,最终达到恒定值而不再改变的现象。

第一节单糖的结构和性质第一节单糖的结构和性质第一节单糖与低聚糖的食品性质与功能一、物理性质与功能(一)甜味蜂蜜和大多数果实的甜味主要取决于蔗糖、d-果糖、葡萄糖的含量。
优质糖应具有甜味纯正,反应慢,很快达至最低甜度,甜度多寡适度,甜味消失迅速等特征。
单糖都存有甜味,果糖火腿蛋。
(二)旋光性:具有手性的分子都具有旋光性,要判断一个化合物是否有旋光性,就要看它是否为手性分子。
每个单糖分子都含有不对称碳原子,所以都具有旋光能力。
(三)溶解度各种糖都能够溶水,其溶解度随其温度增高而减小。
清澈的单糖为白色晶体,存有较强的吸湿性。
单糖分子中存有多个羟基,减少了它的水溶解性,所以极易溶于水,尤其在热水中的溶解度很大。
单糖在乙醇中也能够熔化,但不溶乙醚、丙酮等有机溶剂。
(四)结晶性蔗糖极易结晶,晶体非常大;葡萄糖也极易结晶,但晶体细小;果糖和转变糖则较难于结晶。
糖果生产时,必须应用领域糖结晶性质上的差别。
例如,生产硬糖果不能单独用蔗糖,而应添加适量的淀粉糖浆(葡萄糖值42),这是因为:①淀粉糖浆不含果糖,吸潮性较转化糖低,糖果保存性较好。
②淀粉糖浆所含糊精,能够减少糖果的韧性、强度和粘性,并使糖果难于脱落。
(五)粘度葡萄糖和果糖的粘度较蔗糖低;淀粉糖浆的粘度较高,而且其粘度随转化程度的增低而减少。
葡萄糖的粘度随着温度升高而增大,而蔗糖的粘度则随着温度升高而减小。
?在食品生产中,可借调节糖的粘度来提高食品的稠度和可口性。
二、化学性质与功能(一)水解反应(酸、热条件下的反应):在室温下,稀酸对单糖的稳定性并无影响。
当在酸的浓度大于12%的浓盐酸以及热的作用下,单糖易脱水,生成糠醛及其衍生物。
(三)复合反应单糖受酸和冷的促进作用,酯化脱水分解成低聚糖的反应称作无机反应。
它水解反应的逆反应。
比如:2c6h12o6-----c12h22o11+h2o(四)焦糖化反应焦糖化反应产生色素的过程:糖经强热处理可发生两种反应:1.分子内脱水:向分子内导入双键,然后水解产生一些挥发性醛、酮,经酯化、生成分解成深色物质。