【备战中考】2020年最新中考化学基础知识梳理:专题6 原子结构示意图、离子符号、常见物质的俗名
- 格式:docx
- 大小:188.77 KB
- 文档页数:5
2024年中考化学复习考点归纳总结—物质的构成与组成(全国通用)知识点一、分子、原子和离子1.构成物质的微粒有分子、原子、离子等。
2.分子(由原子构成)(1)定义:保持由分子构成的物质的化学性质的最小微粒。
(2)性质:①体积、质量都很小;②总是在不断地运动,温度越高,分子运动速率越快,如花香四溢、酒精挥发等;③分子间有间隔,如天然气加压后贮存在钢瓶中;④同种分子化学性质相同,不同种分子化学性质不同。
(3)分子运动现象的实验探究①实验装置(如图)②实验现象:过一段时间,烧杯A中的溶液变红。
③解释:烧杯B中浓氨水有挥发性,氨分子运动到烧杯A中与水反应生成氨水,氨水显碱性,使酚酞溶液变红。
④实验结论:分子总在不断地做无规则运动。
3.原子定义:化学变化中的最小微粒,在化学变化中不可再分。
4.离子(1)定义:带电的原子或原子团。
(2)阳离子:带正电的原子或原子团;核内质子数>核外电子数,如Ca2+、N H4+等。
阴离子:带负电的原子或原子团;核内质子数<核外电子数,如C O32−、Cl-等。
5.离子符号:在元素符号(或原子团)的右上角用“+”或“-”表示离子的正负电性,数值在前,正负号在后。
数字为1时,可忽略不写。
意义:如3Mg2+,“3”表示3个镁离子,“2”表示1个镁离子带2个单位正电荷。
知识点二、原子的结构1.原子的结构原子原子核(带正电)质子:一个质子带一个单位的正电荷中子:不带电核外电子:一个电子带一个单位的负电荷总结:①原子内部不是实心体,很多是“空”的;②并不是所有的原子中都含有中子(如:氢原子中没有中子);③原子不显电性:质子数=核电荷数=核外电子数;④原子的质量主要集中在原子核上,原子的相对原子质量(取整数时)≈质子数+中子数;⑤相对原子质量的单位为1,一般不写也不读。
2.原子结构示意图(以氧原子为例):小圈表示原子核,圈内的数字表示质子数,弧线表示电子层,弧线上的数字表示电子数,最外层电子数决定元素的化学性质。
![课题2 原子的结构-2020年版 [Repaired]](https://img.taocdn.com/s1/m/0d1e47a689eb172ded63b793.png)

考点06 原子结构化学键一、微粒的组成与结构1.原子结构模型的演变2.原子的构成3.原子内的等量关系(1)质量数(A)=质子数+中子数(2)质子数=核电荷数=原子序数=核外电子数4.元素、同位素、核素(1)“三素”概念辨析(2)同位素的特征①相同存在形态的同位素,化学性质几乎完全相同,物理性质不同。
②天然存在的同一元素各核素所占的原子百分数一般不变。
(3)常见的重要核素及其应用51.核外电子排布规律2.原子结构示意图3.1~18号元素原子结构的特点归纳(1)原子核中无中子的原子:H。
(2)最外层有1个电子的元素:H、Li、Na。
(3)最外层有2个电子的元素:Be、Mg、He。
(4)最外层电子数等于次外层电子数的元素:Be、Ar。
(5)最外层电子数是次外层电子数2倍的元素:C;最外层电子数是次外层3倍的元素:O;最外层电子数是次外层4倍的元素:Ne。
(6)电子层数与最外层电子数相等的元素:H、Be、Al。
(7)电子总数为最外层电子数2倍的元素:Be。
(8)次外层电子数是最外层电子数2倍的元素:Li、Si。
(9)内层电子总数是最外层电子数2倍的元素:Li、P。
(10)电子层数是最外层电子数2倍的元素:Li。
(11)最外层电子数是电子层数2倍的元素:He、C、S。
(12)最外层电子数是电子层数3倍的元素:O。
三、化学键1.化学键(1)定义:相邻原子间强烈的相互作用。
(2)分类2.离子键(1)概念:阴、阳离子之间的相互作用.(2)成键粒子:离子.(3)成键实质:静电作用。
(4)形成条件:通常是活泼金属元素与活泼非金属元素的原子相结合. (5)表示方法: ①用电子式表示物质②用电子式表示离子化合物的形成过程3.共价键(1)概念:原子间通过共用电子对形成的相互作用。
(2)成键粒子:原子。
(3)成键实质:共用电子对。
(4)形成条件:通常是非金属元素的原子相结合。
(5)分类:(6 ①用电子式表示物质②用结构式表示物质③用电子式表示共价化合物的形成过程4.离子键和共价键的比较5除稀有气体内部无化学键外,其他物质内部都存在化学键。
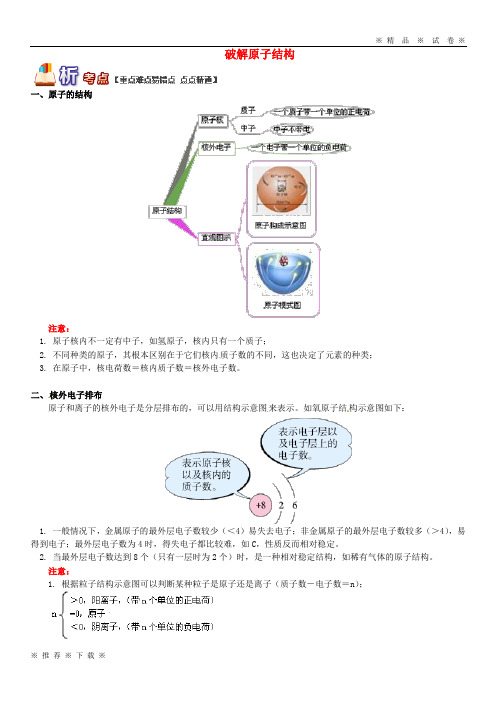
破解原子结构一、原子的结构注意:1. 原子核内不一定有中子,如氢原子,核内只有一个质子;2. 不同种类的原子,其根本区别在于它们核内质子数的不同,这也决定了元素的种类;3. 在原子中,核电荷数=核内质子数=核外电子数。
二、核外电子排布原子和离子的核外电子是分层排布的,可以用结构示意图来表示。
如氧原子结构示意图如下:1. 一般情况下,金属原子的最外层电子数较少(<4)易失去电子;非金属原子的最外层电子数较多(>4),易得到电子;最外层电子数为4时,得失电子都比较难,如C,性质反而相对稳定。
2. 当最外层电子数达到8个(只有一层时为2个)时,是一种相对稳定结构,如稀有气体的原子结构。
注意:1. 根据粒子结构示意图可以判断某种粒子是原子还是离子(质子数-电子数=n);2. 元素的化学性质与其原子的最外层电子数关系密切。
三、相对原子质量 1. 定义以一种碳原子(核内质子数和中子数都是6的碳原子,这种碳原子也叫碳-12原子)质量的1/12作为标准,其他原子的质量与其比较所得的比值,作为这种原子的相对原子质量(符号为A r )。
2. 表达式某原子的相对原子质量=原子的质量碳一个该原子的质量原子的质量碳一个该原子的质量121212112⨯=⨯注意:电子质量很小,因此原子的主要质量集中在原子核上。
相对原子质量≈质子数+中子数。
例题 根据下列粒子结构示意图,回答问题。
(1)上图A 、B 、C 、D 四种粒子共表示 种元素。
(2)D 原子在化学反应中易 (填“得到”或“失去”)电子。
(3)由B 元素和C 元素组成的化合物BC 的电子总数是 。
(4)E 粒子带1个单位正电荷,则X = 。
解析:(1)决定元素、原子种类的是原子核内质子数,根据图示信息可以看出,A 、B 、C 、D 中质子数一共是三种,故表示的是三种元素;(2)D 原子最外层电子数是7,在化学反应中容易得到一个电子;(3)B 元素是镁元素,最外层电子数是2,容易失去2个电子,C 元素是硫元素,最外层电子数是6,容易得到2个电子,所以当它们组合在一起时,原子个数是1:1,然后双方均可达到稳定结构,所以它们形成化合物BC 里电子总数是两个原子核外电子总数之和,也就是它们核内质子总数之和,总数为12+16=28;(4)E 粒子带1个单位正电荷,说明E 原子失去一个电子,原子核外电子总数应该是2+8+1=11; 答案:(1)三(2)得到(3)28 (4)11【方法提炼】抓住等量关系,巧解原子结构题原子是由居中的原子核和核外电子构成的,原子核带正电,核外电子带负电。

物质构成的微粒1. 原子的结构:原子由居于原子中心的原子核和核外电子构成;原子核由质子和中子构成。
在原子中:原子的核电荷数=质子数=核外电子总数。
2.请写出相应的粒子符号,并画出粒子的结构示意图。
氧原子O 铝离子Al 3+ 氯离子Cl - 3.: 氢离子H + 锂离子Li + 氧离子O 2- 氟离子F - 钠离子Na + 镁离子Mg 2+硫离子S 2- 钾离子K + 钙离子Ca 2+4. 写出下列原子团的符号:5. 铵根NH 4+,氢氧根OH -,硝酸根NO 3-,硫酸根SO 42-,碳酸根CO 32-。
6. 相对原子质量 ≈ 质子数+中子数。
原子的相对原子质量为23,核电荷数为11,则中子数为12。
7. 水由水分子构成,铁由铁原子构成,氯化钠由Na +、Cl -构成(填微粒符号)8. 判断下列说法的错或对(填“√”或“×”)。
(1)质子数和中子数一定相等 × (2)任何原子核都是由质子和中子构成的 × 。
(3)2个镁离子:2Mg +2 × (4)氦原子和镁原子最外层电子数相同,所以氦元素和镁元素化学性质相似 × 。
9.有下列几种粒子的结构示意图。
回答下列问题:(1)以上示意图中,共有5种元素。
(2)图中能表示阳离子的是B (填序号),该元素的质子数为11。
(3)化学性质相似的原子是CF (填序号)。
(4)B 粒子与D 粒子形成化合物的化学式是NaCl 。
(5)元素M 形成的氧化物为M 2O 3,则M 的原子结构示意图可能是图中的C 或F (填序号)。
(6)E为锌原子的结构示意图,其中x=8;Zn2+的核外电子数为28。
化学式与化合价1.写出化学式H2SO4的意义:①硫酸这种物质;②硫酸由氢元素、硫元素、氧元素组成;③一个硫酸分子;④一个硫酸分子由两个氢原子、一个硫原子、四个氧原子构成。
2.写出3CO2的含义:三个二氧化碳分子;其中“2”表示一个二氧化碳分子中有两个氧原子。

2020年中考化学试题分类汇编:原子的构成、离子物质的构成5.(2020·广州)如图为氧原子的结构示意图,从图中可获得的信息是()A. 氧原子核内质子数为8、中子数为0,核外电子数为8B. 氧原子核外第一层上有6个电子C. 氧原子的原子核在整个原子中所占体积极小D. 氧原子在化学反应中容易得到2个电子【答案】D【解析】从氧原子的结构示意图中,可以知道核内质子数为8,核外电子数为8,氧原子核外第一层上有2个电子,第二层上有6个电子,在化学反应中容易得到2个电子;而氧原子的中子数、原子核的体积大小,都无法通过氧原子的结构示意图中获取。
8.(2020·襄阳)右图是硫原子的结构示意图,下列由图中获取的信息错误的是()A.硫原子的核电荷数为16B.硫原子在化学反应中易失去电子C.硫原子的结构示意图中的x等于8D.硫原子所形成离子的符号为S2-【答案】B【解析】硫原子的质子数=核电荷数=电子数=16,结构示意图中x=16﹣2﹣6=8;硫原子的最外层电子数是6,大于4,在反应中易得到两个电子,形成硫离子,符号为S2﹣。
8.(2020·青岛)下列物质由分子构成的是A.氧气B.金刚石 C.铜 D.氯化钠【答案】A【解析】氧气是由氧气分子构成的;金刚石是由碳原子构成的;铜是由铜原子构成的;氯化钠是由氯离子和钠离子构成的。
7.(2020·北京)下列物质含有氧分子的是()A. O2B. H2O2C. H2CO3D. SO2【答案】A【解析】氧气由氧分子构成,过氧化氢由过氧化氢分子构成,碳酸由碳酸分子构成,二氧化硫由二氧化硫分子构成。
4.(2020•苏州)下列物质由离子构成的是()A.铜B.水C.氯化钠D.氖气【答案】C【解析】铜属于金属原子,是由铜原子直接构成的;水是由水分子构成的;氯化钠是由钠离子和氯离子构成,是由离子构成的;氖气是单原子分子,是由氖原子直接构成的。
4.(2020·扬州)下列物质由离子构成的是A.氢气B氯化钾 C.金刚石 D.二氧化碳【答案】B【解析】氢气由氢气分子构成,氯化钾由氯离子和钾离子构成,金刚石由碳原子构成,二氧化碳由二氧化碳分子构成。
第 1 页 共 1 页 2020年中考化学一轮复习:原子
(1)原子结构示意图的认识
(2)在原子中由于原子核带正电,带的正电荷数(即核电荷数)与核外电子带的负电荷数(数值上等于核外电子数)相等,电性相反,所以原子不显电性 因此: 核电荷数
= 质子数 = 核外电子数
(3)原子的质量主要集中在原子核上
注意:①原子中质子数不一定等于中子数
②并不是所有原子的原子核中都有中子。
例如:氢原子核中无中子
2
、相对原子质量:
⑵相对原子质量与原子核内微粒的关系: ⑴ 相对原子质量 = 质子数 + 中子数
(4)分子与原子
相对原子质量=。
一、选择题1.下图为元素周期表部分内容和两种微观粒子的结构示意图。
结合图示信息判断,下列说法中正确的是A.钠原子核内有11个质子B.氖的相对原子质量为20.18gC.氖原子与钠原子的电子层数相同D.氖原子与钠原子的化学性质相似2.据《自然》杂志报道,科学家研究出一种以锶(Sr)做钟摆的钟,它是世界上最精确的钟,锶的原子结构示意图如图所示,下列说法错误的是A.x为29B.B.锶原子最外层电子数为2C.锶原子核外有5个电子层D.锶原子在化学变化中易失电子3.下列是五种微粒的结构示意图,有关说法正确的是A.他们表示五种元素的不同粒子B.微粒③③的化学性质相似C.微粒③在化学反应中易得到电子形成阴离子D.微粒③所表示的元素位于元素周期表中的第二周期4.硒有防癌、抗癌作用。
如图为硒的原子结构示意图,下列说法不正确的是A.图中x的值为8B.硒原子的质子数为34C.硒原子核外有四个电子层D.硒在反应中易得电子5.“天为棋盘星作子,中国北斗耀太空”,铷原子钟被称为北斗卫星的心脏。
如图是铷元素在元素周期表中的信息及其原子结构示意图。
下列有关铷原子的说法错误的是A.铷元素属于金属元素B.铷原子核内有37个中子微专题离子、原子结构示意图(二)十分钟练习C.铷元素在元素周期表的第五周期D.铷原子在化学反应中容易失去电子形成阳离子,离子符号为Rb+6.如图为钪在元素周期表中的相关信息及其原子结构示意图。
下列说法不正确的是A.钪元素位于元素周期表第四周期B.原子结构示意图中x的数值为9C.钪原子易得电子而形成钪离子D.钪原子的相对原子质量是44.967.氯原子、碘原子结构示意图如下图所示。
下列说法不正确...的是A.氯元素和碘元素的化学性质相似B.符号“2I-”可表示2个碘原子C.圆圈中“+”表示两种原子核均带正电荷D.氯原子在化学反应中易得到1个电子8.如图是砷元素在元素周期表中的信息及原子结构示意图。
下列说法错误的是A.砷属于非金属元素B.砷原子的质子数为33C.砷原子的相对原子质量为74.92gD.x=5,砷与磷元素化学性质相似9.高精度地磁监测系统可实现“震前”预报,该仪器的材料中含有金属钴,钴原子的结构示意图如图所示,下列有关说法正确的是A.x的数值为8B.钴元素属于金属元素C.钴在化学反应中容易得到电子D.钴原子的中子数为2710.氮化镓(GaN)是生产通信芯片的关键材料,氮的原子结构示意图及其在元素周期表中的信息如图,下列说法正确的是A.x=3B.氮的相对原子质量为14.01gC.氮原子在化学反应中容易失去电子D.氮元素位于元素周期表的第二周期11.国产C919大型客机使用了第三代铝锂合金。
中考化学考点知识:离子
化学对我们认识和利用物质具有重要的作用。
化学网为大家准备了中考化学考点知识,希望能对准备高考的同学们有所帮助。
中考化学考点知识:离子一、离子:带电的原子或原子团(1)表示方法及意义:如Fe3+ :一个铁离子带3个单位正电荷(2)离子结构示意图的认识注意:与原子示意图的区别:质子数=电子数则为原子结构示意图*质子数≠电子数为离子结构示意图(3)与原子的区别与联系粒子的种类:原子、离子离子有阳离子和阴离子两种区别: 粒子结构:原子:质子数=电子数阳离子:质子数>电子数阴离子:质子数
第 1 页共 1 页。
2024年初中化学分子、原子和离子必考知识点总结一、原子结构和元素周期表1. 原子的组成:原子由质子、中子和电子组成。
质子和中子位于原子的中心核心,电子围绕核心运动。
2. 元素周期表:元素周期表是化学元素按一定顺序排列的表格,包含了元素的名称、原子序数、原子量等信息。
元素周期表是按原子序数(即质子数)的顺序排列的。
二、离子1. 离子的定义:当一个原子失去或获得电子时,形成带电的粒子,这种带电的粒子称为离子。
2. 阳离子和阴离子:失去电子的离子称为阳离子(正离子),获得电子的离子称为阴离子(负离子)。
3. 离子的符号:阳离子通常用元素符号后加上正号(如Na+),阴离子通常用元素符号后加上负号(如Cl-)表示。
三、分子1. 分子的定义:由两个或更多原子通过共用电子形成的化学结构被称为分子。
2. 共价键:分子中原子之间的化学键称为共价键,是通过共享电子对来连接原子的。
3. 分子式:用化学元素符号表示分子中各种原子的数量比例的式子。
例如,水的分子式为H2O。
四、原子和分子的相对质量和化学式1. 原子的相对质量:原子的相对质量是指一个原子质量与质子质量的比值。
2. 分子的相对质量:分子的相对质量是指一个分子质量与质子质量的比值。
可以通过分子式计算得出。
3. 化学式:化学式是用化学符号表示化合物的组成和结构的一种简洁表达方式。
化学式可以表示分子、离子或晶体的组成。
五、原子和分子的化学变化1. 化学反应:原子和分子之间的重新排列被称为化学反应。
2. 反应物和生成物:参与化学反应的物质被称为反应物,反应后形成的新物质被称为生成物。
3. 反应物的消耗与生成物的生成:在化学反应中,反应物的质量会发生减少,而生成物的质量会发生增加。
六、元素与化合物1. 元素:由只含有相同种类原子的一种物质被称为元素。
2. 化合物:由含有不同种类原子的物质被称为化合物。
3. 氧化与还原:化合物中的某些原子失去电子被称为氧化,而其他原子获得电子被称为还原。
专题6 原子结构示意图、离子符号、常见物质的俗名1.画出1~18号元素的原子结构示意图。
2.写出下列离子的符号。
3.常见物质的化学名称、俗名和化学式
另外,________的主要成分是氯化钠,化学式为__________;__________________的主要成分是甲烷,化学式为__________。
最后把答案和教材对照一下,把写错的再写一遍:
________________________________________________________________________
________________________________________________________________________。
备战中考应试口诀
各位同学要牢记,一看二审三注意;
拿到试卷别慌忙,首先看有多少题。
检查试卷齐全否,前后页码看仔细;答题记号搞明确,单选多选莫麻痹!铃声未响不许做,不妨用手作标记。
题多时少巧安排,先易后难细审题。
找出解题突破口,选对选错莫岔题!关键字词要抓稳,文字书写要麻利;专用名词切莫错,代号符号要规矩。
若是碰上拦路虎,一时半刻想不起,不如暂时放一边,先做把握最大的。
单选填空和推断,一般没有大问题;遇到多选组合判,千万小心别轻敌!力争做到稳准狠,一次成功最省力。
现在流行新情境,变换花样考能力;此类多是纸老虎,故弄玄虚吓唬你。
首先安慰你自己:没有什么了不起!读懂题目玄机现,顺藤摸瓜不费力。
多数计算可巧解:画出流程找关系,质量电荷皆守恒,寻找捷径来解题。
最后一道综合题,题巧分重拉距离。
先把题目读两遍,再做两次深呼吸;化整为零分步做,设计未知列比例;
公式定理要活用,引入数据要合理;步骤书写要规范,做完作答别忘记;还有单位小数点,这些扣分太可惜!难题最后来攻克,信心百倍难变易。
时间若是有富余,首先检查分多的,不到最后不交卷,出场后悔就晚矣!时间多数不够用,千万不要干着急,首先扫清空白点,连猜带估写上去!多选若是拿不准,只填一个保险的。
能写几步是几步,多得一分压一批!中考一科接一科,出了考场别再提。
讨论对答猜分数,考试期间不可取!若有这些闲工夫,不如睡觉养精力。
考试往往靠发挥,技巧用活出成绩。
心理素质很重要,劝君早日做练习。
别人劝告是外因,关键还靠你自己。
家长老师在祈祷,祝愿你们创奇迹!
教师详解详析
1.
2.H+Ag+K+Na+Cl-MnO4-NH4+Al3+Cu2+Fe3+Mg2+Fe2+OH-NO3-Ca2+Zn2+
Ba2+S2-SO42-CO32-
3.水银Hg硫黄S生石灰CaO干冰CO2盐酸
HCl烧碱、火碱、苛性钠NaOH熟石灰、消石灰Ca(OH)2纯碱、苏打Na2CO3小苏打NaHCO3蓝矾、胆矾CuSO4·5H2O铜绿Cu2(OH)2CO3
酒精C2H5OH醋酸CH3COOH食盐NaCl
沼气、天然气CH4。