2019年高三化学最新信息卷九
- 格式:doc
- 大小:1.05 MB
- 文档页数:10

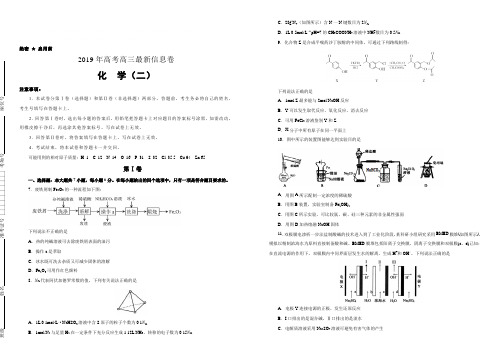
绝密★启用前注意事项:2019年高考高三最新信息卷化学(三)A.标准状况下,22.4L CO和CO2的混合物中,含碳原子的数目为N AB.14g分子式为C5H10的烃中,含有的碳碳双键的数目为0.2N AC.0.1mol/L的CH3COONH4溶液中,含铵根离子数目小于0.1N AD.标准状况下2.24L Cl2通入足量水中或NaOH溶液中,转移电子数目为0.1N A10.依据反应2NaIO3+5SO2+4H2O=I2+3H2SO4+2NaHSO4,利用下列装置从含NaIO3的废液中制取单质碘的CCl4溶液并回收NaHSO4。
其中装置正确且能达到相应实验目的是号位1.本试卷分第Ⅰ卷(选择题)和第Ⅱ卷(非选择题)两部分。
答题前,考生务必将自己的姓名、座考生号填写在答题卡上。
2.回答第Ⅰ卷时,选出每小题的答案后,用铅笔把答题卡上对应题目的答案标号涂黑,如需改动,用橡皮擦干净后,再选涂其他答案标号。
写在试卷上无效。
3.回答第Ⅱ卷时,将答案填写在答题卡上,写在试卷上无效。
4.考试结束,将本试卷和答题卡一并交回。
A.①②③④B.①②③C.②③④D.②④11.青出于蓝而胜于蓝,“青”指的是靛蓝,是人类使用历史悠久的染料之一,下列为传统制备靛蓝的过程:号场可能用到的相对原子质量:H1C12N14O16Na23S32Cl35.5K39考一、选择题:本大题共7小题,每小题6分。
在每小题给出的四个选项中,只有一项是符合题目要求的。
7.下列说法正确的是A.高级脂肪酸乙酯是生物柴油中的一种成分,它属于油脂B.天然纤维、聚酯纤维、光导纤维都属于有机高分子材料C.离子交换膜在工业上应用广泛,如在氯碱工业中使用的阴离子交换膜下列说法不正确的是A.靛蓝的分子式为C16H10N2O2B.浸泡发酵过程发生的反应为取代反应号证考准D.国产大客机C919大规模使用先进的材料铝锂合金,该合金密度小,强度高8.从废铅蓄电池铅膏(含PbSO4、PbO2和Pb等)中回收铅的一种工艺流程如下:C.吲哚酚的苯环上的二氯代物有4种D.1mol吲哚酚与H2加成时可消耗4mol H212.主族元素W、X、Y、Z的原子序数依次增加,且均不大于20,它们可以组成化学式为ZXY3W8的硅酸已知:浓硫酸不与PbO2反应,K sp(PbCl2)=2.0×10−5,K sp(PbSO4)=1.5×10−8,PbCl2(s)+2Cl−(aq)=PbCl24−(aq)。

2019届辽宁省部分重点高中高三9月联考化学试题本试卷分选择题和非选择题两部分,共100分,时间90分钟。
★祝考试顺利★注意事项:1、答题前,先将自己的姓名、准考证号填写在试题卷和答题卡上,并将准考证号条形码粘贴在答题卡上的指定位置。
用2B铅笔将答题卡上试卷类型A后的方框涂黑。
2、选择题的作答:每小题选出答案后,用2B铅笔把答题卡上对应题目的答案标号涂黑。
写在试题卷、草稿纸和答题卡上的非答题区域均无效。
3、填空题和解答题的作答:用签字笔直接答在答题卡上对应的答题区域内。
写在试题卷、草稿纸和答题卡上的非答题区域均无效。
4、选考题的作答:先把所选题目的题号在答题卡上指定的位置用2B铅笔涂黑。
答案写在答题卡上对应的答题区域内,写在试题卷、草稿纸和答题卡上的非答题区域均无效。
5、考试结束后,请将本试题卷和答题卡一并上交。
可能用到的相对原子质量: C-12 N-14 O-16 Al-27 Si-28 Mn-55 Cu-64一、选择题(本题包括25小题,每小题只有一个选项符合题意,请将正确答案涂在答题卡上。
)1.我国汉书中记载:“高奴县有洧水,可燃”,沈括在《梦溪笔谈》对洧水的使用有如下描述:“予知其烟可用,试扫其烟为墨,黑光如漆,松墨不及也”,对上述史实记载分析正确的是()A. 该物质属于纯净物B. 该物质可能属于无机化合物C. 该物质是由同一类烃组成的混合物D. 烟是该物质不完全燃烧的产物【答案】D【解析】【详解】由两种或两种以上的物质组成的物质为混合物,只含一种物质的为纯净物,由题中信息可知,“洧水”是石油,是烃的混合物;A.“洧水”是石油,含有多种烃,是烃的混合物,故A错误;B.“洧水”是石油,主要成分是不同类型的烃,烃属于有机物,故B错误;C.“洧水”是石油,含有多种不同类型的烃,是烃的混合物,故C错误;D.石油中C元素的含量较高,点燃时不完全燃烧会生成大量的黑烟,故D正确;正确选项D。
2.化学与日常生活密切相关,下列物质的使用不涉及化学变化的是()A. 液氨用作制冷剂B. 明矾用作净水剂C. 氢氟酸蚀刻石英制艺术品D. 铁质容器盛放浓硫酸【答案】A【解析】【详解】A项,液氨用作制冷剂利用了液氨气化吸热的性质,为物理变化,不涉及化学变化,故选A项;B项,明矾在水中电离出Al3+,Al3+水解生成的Al(OH)3胶体有较强的吸附能力,因此可用作净水剂,涉及化学变化,故不选B项;C项,石英成分为二氧化硅,氢氟酸与二氧化硅能发生反应,因此刻蚀石英制艺术品涉及化学变化,故不选C项;D项,用铁质容器盛放浓硫酸时铁与浓硫酸发生钝化,涉及化学变化,故不选D项。
绝密★ 启用前2019年高考高三最新信息卷化学(二)注意事项:1.本试卷分第Ⅰ卷(选择题)和第Ⅱ卷(非选择题)两部分。
答题前,考生务必将自己的姓名、考生号填写在答题卡上。
2.回答第Ⅰ卷时,选出每小题的答案后,用铅笔把答题卡上对应题目的答案标号涂黑,如需改动,用橡皮擦干净后,再选涂其他答案标号。
写在试卷上无效。
3.回答第Ⅱ卷时,将答案填写在答题卡上,写在试卷上无效。
4.考试结束,将本试卷和答题卡一并交回。
可能用到的相对原子质量:H1 C12 N14 O16 P31 S32 Cl35.5 Cu 64 Zn 65第Ⅰ卷一、选择题:本大题共7小题,每小题6分。
在每小题给出的四个选项中,只有一项是符合题目要求的。
7.废铁屑制Fe2O3的一种流程如下图:下列说法不正确的是A.热的纯碱溶液可去除废铁屑表面的油污B.操作a是萃取C.冰水既可洗去杂质又可减少固休的溶解D.Fe2O3可用作红色颜料8.N A代表阿伏加德罗常数的值。
下列有关说法正确的是A.1L 0.1mol·L−1 NaHSO3溶液中含S原子的粒子个数为0.1N AB.1mol N2与足量H2在一定条件下充分反应生成1.12L NH3,转移的电子数为0.15N AC.28g N4(如图所示)含N一N键数目为2N AD.1L 0.5mol·L−1 pH=7的CH3COONH4溶液中NH+4数目为0.5N A9.化合物Z是合成平喘药沙丁胺醇的中间体,可通过下列路线制得:下列说法正确的是A.1mol Z最多能与2mol NaOH反应B.Y可以发生取代反应、氧化反应、消去反应C.可用FeCl3溶液鉴别Y和ZD.X分子中所有原子在同一平面上10.图中所示的装置图能够达到实验目的是A.用图A所示配制一定浓度的稀硫酸B.用图B装置,实验室制备Fe(OH)2C.用图C所示实验,可比较氯、碳、硅三种元素的非金属性强弱D.用图D加热熔融NaOH固体11.双极膜电渗析一步法盐制酸碱的技术进入到了工业化阶段,某科研小组研究采用BMED膜堆(如图所示),模拟以精制浓海水为原料直接制备酸和碱。

2019届高三化学联考卷及答案本试卷分选择题和非选择题两部分,共6页。
全卷满分100分,考试时间90分钟。
注意事项:1.答卷前,考生务必将自己的姓名、准考证号填写在答题卡上。
2.回答选择题时,选出每小题答案后,用铅笔把答题卡上对应题目的答案标号涂黑。
如需改动,用橡皮擦干净后,再选涂其它答案标号。
回答非选择题时,将答案写在答题卡上。
写在本试卷上无效。
3.考试结束后,将本试卷和答题卡一并交回。
4.本试卷可能用到的相对原子质量:H 1 C 12 0 16 Na 23 Mg 24 S 32 Cl 35.5Fe 56 Cu 64一、选择题:本题共16小题,每小题3分,共48分。
在每小题给出的四个选项中,只有一项是符合题目要求的。
1.化学与生产和生活密切相关。
下列过程中没有发生化学变化的是A.海水提溴B.纯碱去除油污C.用四氯化碳萃取溴水中的Br2D.粗故水的精制2.化学与生产、生活密切相关。
下列说法正确的是A.使用光导纤维长距离输送高压电,可以降低电能损耗B.钢管和铜管露天堆放在一起,钢管容易生锈C.天然纤维素和合成纤维素的主要成分都是纤维素D.食用花生油和鸡蛋清都不能发生水解反应3.设N A为阿伏加德罗常数的数值。
下列说法正确的是A.标准状况下,1:1.2 L H2与11.2 L D2所含的质子数均为N AB. 1 L 0.1 mol . LT1 FeCl3 溶液中含 Fe3+数目为 0.1 N AC.6.4gCu与3.2gS粉混合隔绝空气加热,充分反应后,转移电子数为0.2N AD.O.1 mol乙醇与0.1 mol乙酸在浓硫酸催化并加热下,生成乙酸乙酯分子数为0.1 N A4.下列关于有机化合物的说法正确的是A. C4H10O有4种同分异构体B.纤维素、蛋白质、油脂及聚乙烯均属于高分子化合物C.光照下CH4与Cl2等物质的量混合可制得纯净的CH3C1D.由苯生成环已烷、硝基苯的反应分别属于加成反应和取代反应5.下列有关离子能大量共存或离子方程式书写正确的是6.下列化学用语中正确的是7.已知4种短周期元素X、Y、Z、W的核外电子数之和为42。
百度文库 - 让每个人平等地提升自我3 绝密 ★ 启用前2019年高考高三最新信息卷化 学(九)注意事项:1.本试卷分第Ⅰ卷(选择题)和第Ⅱ卷(非选择题)两部分。
答题前,考生务必将自己的姓名、考生号填写在答题卡上。
2.回答第Ⅰ卷时,选出每小题的答案后,用铅笔把答题卡上对应题目的答案标号涂黑,如需改动,用橡皮擦干净后,再选涂其他答案标号。
写在试卷上无效。
3.回答第Ⅱ卷时,将答案填写在答题卡上,写在试卷上无效。
4.考试结束,将本试卷和答题卡一并交回。
可能用到的相对原子质量:H 1 C 12 N 14 O 16 Na 23 S 32 Cl 35.5 K 39 一、选择题:本大题共7小题,每小题6分。
在每小题给出的四个选项中,只有一项是符合题目要求的。
7.化学与生产、生活密切相关,下列说法不正确的是A .聚乙烯塑料可用作食品袋、餐具、地膜等B .苯可用作洗涤剂、有机溶剂、消毒剂、染料等C .红葡萄酒密封储存时间越长,质量越好,原因之一是储存过程中生成了有香味的酯D .生物柴油和石油分馏所得的柴油都是碳氢化合物组成的混合物8.N A 代表阿伏加德罗常数。
下列说法正确的是A .1mol N 2与3mol H 2在一定条件下充分反应,转移电子数为6N AB.标准下,22.4L CH 4与Cl 2在光照条件下反应生成HCl 分子数为4N AC .25℃时,PH=13的Ba(OH)2溶液中含有OH −离子数为0.1N AD .28g 由N 2和CO 组成的混合气体中含有的原子数为2N A9.用下图所示实验装置进行相应实验,能达到实验目的的是A .用图甲所示装置,蒸干AlCl 3饱和溶液制备AlCl 3晶体B .按装置乙所示的气流方向可用于收集H 2、NO 等C .用图丙所示装置,分离CCl 4萃取碘水后的有机层和水层D .用图丁所示装置,可以证明氧化性:Cl 2>Br 2>I 2 10.短周期主族元素W 、X 、Y 、Z 的原子序数逐渐增大,W 原子的核外电子总数与X 原子次外层的电子数相同。

2019年高考高三最新信息卷化学(九)注意事项:1.本试卷分第Ⅰ卷(选择题)和第Ⅱ卷(非选择题)两部分。
答题前,考生务必将自己的姓名、考生号填写在答题卡上。
2.回答第Ⅰ卷时,选出每小题的答案后,用铅笔把答题卡上对应题目的答案标号涂黑,如需改动,用橡皮擦干净后,再选涂其他答案标号。
写在试卷上无效。
3.回答第Ⅱ卷时,将答案填写在答题卡上,写在试卷上无效。
4.考试结束,将本试卷和答题卡一并交回。
可能用到的相对原子质量:H 1 C 12 N 14 O 16 Na 23 S 32 Cl 35.5 K 39一、选择题:本大题共7小题,每小题6分。
在每小题给出的四个选项中,只有一项是符合题目要求的。
7.化学与生产、生活密切相关,下列说法不正确的是A.聚乙烯塑料可用作食品袋、餐具、地膜等B.苯可用作洗涤剂、有机溶剂、消毒剂、染料等C.红葡萄酒密封储存时间越长,质量越好,原因之一是储存过程中生成了有香味的酯D.生物柴油和石油分馏所得的柴油都是碳氢化合物组成的混合物8.N A代表阿伏加德罗常数。
下列说法正确的是A.1mol N2与3mol H2在一定条件下充分反应,转移电子数为6N AB.标准下,22.4L CH4与Cl2在光照条件下反应生成HCl分子数为4N AC.25℃时,PH=13的Ba(OH)2溶液中含有OH−离子数为0.1N AD.28g由N2和CO组成的混合气体中含有的原子数为2N A9.用下图所示实验装置进行相应实验,能达到实验目的的是A.用图甲所示装置,蒸干AlCl3饱和溶液制备AlCl3晶体B.按装置乙所示的气流方向可用于收集H2、NO等C.用图丙所示装置,分离CCl4萃取碘水后的有机层和水层D.用图丁所示装置,可以证明氧化性:Cl2>Br2>I210.短周期主族元素W、X、Y、Z的原子序数逐渐增大,W原子的核外电子总数与X原子次外层的电子数相同。
X和Y的简单阳离子的电子层结构相同,Z的一种含氧酸具有杀菌消毒和漂白作用。
2019高考全国Ⅲ卷化学试题(解析版)(word版可编辑修改)编辑整理:尊敬的读者朋友们:这里是精品文档编辑中心,本文档内容是由我和我的同事精心编辑整理后发布的,发布之前我们对文中内容进行仔细校对,但是难免会有疏漏的地方,但是任然希望(2019高考全国Ⅲ卷化学试题(解析版)(word版可编辑修改))的内容能够给您的工作和学习带来便利。
同时也真诚的希望收到您的建议和反馈,这将是我们进步的源泉,前进的动力。
本文可编辑可修改,如果觉得对您有帮助请收藏以便随时查阅,最后祝您生活愉快业绩进步,以下为2019高考全国Ⅲ卷化学试题(解析版)(word版可编辑修改)的全部内容。
2019年普通高等学校招生全国统一考试理科综合能力测试注意事项:1.答卷前,考生务必将自己的姓名、准考证号填写在答题卡上。
2.回答选择题时,选出每小题答案后,用铅笔把答题卡上对应题目的答案标号涂黑,如需改动,用橡皮擦干净后,再选涂其它答案标号。
回答非选择题时,将答案写在答题卡上,写在本试卷上无效。
3.考试结束后,将本试卷和答题卡一并交回。
可能用到的相对原子质量:H 1 Li 7 C 12 N 14 O 16 Na 23 S 32 Cl 35.5 Ar 40 Fe 56 I 1277.化学与生活密切相关.下列叙述错误的是()A. 高纯硅可用于制作光感电池B。
铝合金大量用于高铁建设C. 活性炭具有除异味和杀菌作用D。
碘酒可用于皮肤外用消毒【答案】C【解析】A、硅是半导体,高纯硅可用于制作光感电池,A正确;B、铝合金硬度大,密度小,可用于高铁建设,B正确;C、活性炭具有吸附性,可用于除异味,但不能杀菌消毒,C错误;D、碘酒能使蛋白质变性,可用于皮肤外用消毒,D正确。
8.下列化合物的分子中,所有原子可能共平面的是( )A。
甲苯 B。
乙烷 C。
丙炔 D. 1,3−丁二烯【答案】D【解析】A、甲苯中含有饱和碳原子,所有原子不可能共平面,A不选;B、乙烷是烷烃,所有原子不可能共平面,B不选;C、丙炔中含有饱和碳原子,所有原子不可能共平面,C不选;D、碳碳双键是平面形结构,因此1,3-丁二烯分子中所有原子共平面,D选。
绝密★ 启用前2019 年高考高三最新信息卷化学(八)7.化学与生活密切相关。
下列解释错误的是A.一氯乙烷冷镇痛喷雾剂用于受伤运动员应急处理,主要是一氯乙烷的麻醉作用B.铅笔的主要成分是石墨与黏土,黏土含量越多,铅笔硬度越大C.松花皮蛋中的氨基酸盐是蛋白质在碱性条件下水解所形成D.季铵盐表面活性剂能吸收空气中的水份,从而具有优良的抗静电效果8.阿司匹林的有效成分是乙酰水杨酸( ),可以用水杨酸(邻羟基苯甲酸)与乙酸酐[(CH3CO)2O]为原料合成。
下列说法正确的是A.可用酸性KMnO4溶液鉴别水杨酸和乙酰水杨酸B.已知HCHO 为平面形分子,则乙酸酐中最多8 个原子共平面C.1mol 乙酰水杨酸最多消耗2mol NaOHD.服用阿司匹林时若出现水杨酸反应,应立即停药并静脉注射Na2CO3溶液9.N A代表阿伏加德罗常数的值。
下列说法正确的是A.H2S 的燃烧热是Q kJ/mol。
充分燃烧H2S,当有0.5Q kJ 热量放出时,转移的电子数为6N A B.25℃时,500mL pH=11 的碳酸钠溶液中,由水电离出的OH-数目为0.0005N AC.pH=2 的H3PO4溶液中,H+的数目为0.01N AD.0.10L 2.0 mol·L−1 的NaHCO3溶液中HCO −3和CO 23−的离子数之和为0.2N A10.MnO2是一种重要的化工原料,可用于合成工业的催化剂和氧化剂。
采用软锰矿(主要成分为MnO2)可制备高纯MnO2,其流程如下:下列叙述错误的是A.“含Mn2+、A13+的溶液”中还含Fe3+ B.加入“氨水”同时搅拌,搅拌的目的是提高反应速率C.“滤渣”可完全溶解在NaOH 溶液中D.电解含Mn2+的溶液,MnO2为阳极产物11.几种短周期元素的原子半径及主要化合价如下表所示元素符号X Y Z W原子半径/nm 0.160 0.143 0.070 0.066主要化合价+2 +3 +3,+5,-3 -2A.四种元素位于元素周期表的同一周期B.电解X 的氯化物的水溶液可以得到单质X C.Y 的最高价氧化物对应的水化物既能溶解在盐酸中,又能溶解在氨水中D.W、Z 的氢化物均多于1 种12.锂—铜空气燃料电池(如图)容量高、成本低,该电池通过一种复杂的铜腐蚀“现象”产生电力,其中放电过程为:2Li+Cu2O+H2O=2Cu+2Li++2OH-,下列说法错误的是A.放电时,当电路中通过0.1 mol 电子的电量时,有0.1mol Li+透过固体电解质向Cu 极移动,有标准状况下1.12L 氧气参与反应B.整个反应过程中,氧化剂为O2 C.放电时,正极的电极反应式为:Cu2O+H2O+2e−=2Cu+2OH−D.通空气时,铜被腐蚀,表面产生Cu2O13.常温下,用0.10 mol·L-1 的氨水滴定20.00 mL a mol·L-1 的盐酸,混合溶液的pH 与氨水的体积(V)的关系如图所示。
2019年高考高三最新信息卷化学(八)注意事项:1.本试卷分第Ⅰ卷(选择题)和第Ⅱ卷(非选择题)两部分。
答题前,考生务必将自己的姓名、考生号填写在答题卡上。
2.回答第Ⅰ卷时,选出每小题的答案后,用铅笔把答题卡上对应题目的答案标号涂黑,如需改动,用橡皮擦干净后,再选涂其他答案标号。
写在试卷上无效。
3.回答第Ⅱ卷时,将答案填写在答题卡上,写在试卷上无效。
4.考试结束,将本试卷和答题卡一并交回。
可能用到的相对原子质量:H 1 C 12 N 14 O 16 Na 23 S 32 Cl 35.5 K 39一、选择题:本大题共7小题,每小题6分。
在每小题给出的四个选项中,只有一项是符合题目要求的。
7.化学与生活密切相关。
下列解释错误的是A.一氯乙烷冷镇痛喷雾剂用于受伤运动员应急处理,主要是一氯乙烷的麻醉作用B.铅笔的主要成分是石墨与黏土,黏土含量越多,铅笔硬度越大C.松花皮蛋中的氨基酸盐是蛋白质在碱性条件下水解所形成D.季铵盐表面活性剂能吸收空气中的水份,从而具有优良的抗静电效果8.阿司匹林的有效成分是乙酰水杨酸(),可以用水杨酸(邻羟基苯甲酸)与乙酸酐[(CH3CO)2O]为原料合成。
下列说法正确的是A.可用酸性KMnO4溶液鉴别水杨酸和乙酰水杨酸B.已知HCHO为平面形分子,则乙酸酐中最多8个原子共平面C.1mol乙酰水杨酸最多消耗2mol NaOHD.服用阿司匹林时若出现水杨酸反应,应立即停药并静脉注射Na2CO3溶液9.N A代表阿伏加德罗常数的值。
下列说法正确的是A.H2S的燃烧热是Q kJ/mol。
充分燃烧H2S,当有0.5Q kJ热量放出时,转移的电子数为6N AB.25℃时,500mL pH=11的碳酸钠溶液中,由水电离出的OH-数目为0.0005N AC.pH=2的H3PO4溶液中,H+的数目为0.01N AD.0.10L 2.0 mol·L−1的NaHCO3溶液中HCO−3和CO2−3的离子数之和为0.2N A10.MnO2是一种重要的化工原料,可用于合成工业的催化剂和氧化剂。
绝密★启用前2019年全国高考统一高考化学试卷(新课标Ⅲ)(解析版)注意事项:1.答卷前,考生务必将自己的姓名、准考证号填写在答题卡上。
2.回答选择题时,选出每小题答案后,用铅笔把答题卡上对应题目的答案标号涂黑,如需改动,用橡皮擦干净后,再选涂其它答案标号。
回答非选择题时,将答案写在答题卡上,写在本试卷上无效。
3.考试结束后,将本试卷和答题卡一并交回。
可能用到的相对原子质量:H 1 Li 7 C 12 N 14 O 16 Na 23 S 32 Cl 35.5 Ar 40 Fe56 I 127一、选择题:本题共13个小题,每小题6分。
共78分,在每小题给出的四个选项中,只有一项是符合题目要求的。
1.化学与生活密切相关。
下列叙述错误的是A. 高纯硅可用于制作光感电池B. 铝合金大量用于高铁建设C. 活性炭具有除异味和杀菌作用D. 碘酒可用于皮肤外用消毒【答案】C【解析】【详解】A、硅是半导体,高纯硅可用于制作光感电池,A正确;B、铝合金硬度大,可用于高铁建设,B正确;C、活性炭具有吸附性,可用于除异味,但不能杀菌消毒,C错误;D、碘酒能使蛋白质变性,可用于皮肤外用消毒,D正确;答案选C。
2.下列化合物的分子中,所有原子可能共平面的是A. 甲苯B. 乙烷C. 丙炔D. 1,3−丁二烯【答案】D【解析】【详解】A、甲苯中含有饱和碳原子,所有原子不可能共平面,A不选;B、乙烷是烷烃,所有原子不可能共平面,B不选;C、丙炔中含有饱和碳原子,所有原子不可能共平面,C不选;D、碳碳双键是平面形结构,因此1,3-丁二烯分子中所有原子共平面,D选。
答案选D。
3.X、Y、Z均为短周期主族元素,它们原子的最外层电子数之和我10,X与Z同族,Y最外层电子数等于X次外层电子数,且Y原子半径大于Z。
下列叙述正确的是A. 熔点:X的氧化物比Y的氧化物高B. 热稳定性:X的氢化物大于Z的氢化物C. X与Z可形成离子化合物ZXD. Y的单质与Z的单质均能溶于浓硫酸【答案】B【解析】【详解】Y的最外层电子数等于X次外层电子数,由于均是主族元素,所以Y的最外层电子数不可能是8个,则X只能是第二周期元素,因此Y的最外层电子数是2个,又因为Y的原子半径大于Z,则Y只能是第三周期的Mg,因此X与Z的最外层电子数是(10-2)/2=4,则X是C,Z是Si。
2019年高考高三最新信息卷化学(九)注意事项:1.本试卷分第Ⅰ卷(选择题)和第Ⅱ卷(非选择题)两部分。
答题前,考生务必将自己的姓名、考生号填写在答题卡上。
2.回答第Ⅰ卷时,选出每小题的答案后,用铅笔把答题卡上对应题目的答案标号涂黑,如需改动,用橡皮擦干净后,再选涂其他答案标号。
写在试卷上无效。
3.回答第Ⅱ卷时,将答案填写在答题卡上,写在试卷上无效。
4.考试结束,将本试卷和答题卡一并交回。
可能用到的相对原子质量:H 1 C 12 N 14 O 16 Na 23 S 32 Cl 35.5 K 39一、选择题:本大题共7小题,每小题6分。
在每小题给出的四个选项中,只有一项是符合题目要求的。
7.化学与生产、生活密切相关,下列说法不正确的是A.聚乙烯塑料可用作食品袋、餐具、地膜等B.苯可用作洗涤剂、有机溶剂、消毒剂、染料等C.红葡萄酒密封储存时间越长,质量越好,原因之一是储存过程中生成了有香味的酯D.生物柴油和石油分馏所得的柴油都是碳氢化合物组成的混合物8.N A代表阿伏加德罗常数。
下列说法正确的是A.1mol N2与3mol H2在一定条件下充分反应,转移电子数为6N AB.标准下,22.4L CH4与Cl2在光照条件下反应生成HCl分子数为4N AC.25℃时,PH=13的Ba(OH)2溶液中含有OH−离子数为0.1N AD.28g由N2和CO组成的混合气体中含有的原子数为2N A9.用下图所示实验装置进行相应实验,能达到实验目的的是A.用图甲所示装置,蒸干AlCl3饱和溶液制备AlCl3晶体B.按装置乙所示的气流方向可用于收集H2、NO等C.用图丙所示装置,分离CCl4萃取碘水后的有机层和水层D.用图丁所示装置,可以证明氧化性:Cl2>Br2>I210.短周期主族元素W、X、Y、Z的原子序数逐渐增大,W原子的核外电子总数与X原子次外层的电子数相同。
X和Y的简单阳离子的电子层结构相同,Z的一种含氧酸具有杀菌消毒和漂白作用。
Y单质可以用于野外焊接钢轨。
下列说法正确的是A.简单离子半径:X>Y>ZB.最高价氧化物对应水化物的碱性:X>YC.W、Z的简单氢化物的沸点:W<ZD.Z与X、Y两种元素都能形成二元离子化合物11.某化学小组拟设计微生物燃料电池将污水中的乙二胺[H2N(CH2)2NH2]氧化成环境友好的物质,工作原理如图所示(a、b均为石墨电极)。
下列分析正确的是A.电子流动方向为a→导线→bB.H+经质子交换膜由右向左移动C.放电一段时间b极附近pH不变D.a电极发生反应:H2N(CH2)2NH2+16e−+4H2O=2CO2↑+N2↑+16H+12.一种形状像蝴蝶结的有机分子Bowtiediene,其形状和结构如图所示,下列有关该分子的说法中错误的是A.生成1mol C5 H12至少需要4mol H2B.该分子中所有碳原子在同一平面内C.三氯代物只有一种D.与其互为同分异构体,且只含碳碳三键的链烃有两种13.25°C时,用氢氧化钠调节浓度为2.0×10−3mol·L−1的氢氟酸溶液的pH(忽略体积变化),溶液中c(HF)、c(F−)与pH的变化关系如下图所示。
下列说法不正确的是2A .a 〜b 〜d 曲线代表c(F -)随pH 的变化B .25°C 时,HF 电离平衡常数的数值K a =10−3.6C .从b 点到c 点发生的离子反应方程式是:HF+OH −=H 2O+F −D .图中a 点溶液粒子浓度大小是:c(HF)>c(H +)>c(F −)>c(OH −)二、非选择题:本卷包括必考题和选考题两部分。
第26-28题为必考题,每个试题考生都必须作答。
第35-36题为选考题,考生根据要求作答。
26.(14分)亚硝酸钙是一种阻锈剂,可用于燃料工业,某兴趣小组拟制备Ca(NO 2)2并对其性质进行探究。
[背景素材]Ⅰ.NO+NO 2+Ca(OH)2=Ca(NO 2)2+H 2OⅡ. Ca(NO 2)2能被酸性KMnO 4溶液氧化成NO −3,MnO −4被还原为Mn 2+Ⅲ.亚硝酸不稳定,易分解,且有一定氧化性,在酸性条件下,Ca(NO 2)2能将I −氧化为I 2,2NO −2+4H ++2I −=I 2+2NO↑+2H 2O ,S 2O 2−3能将I 2还原为I −,I 2+2S 2O 2−3=2I −+S 4O 2−6。
[制备氮氧化物] 甲组同学拟利用如下图所示装置制备氮氧化物。
(1)仪器X 的名称是________________。
(2)装置B 中逸出的NO 与NO 2的物质的量之比为1∶1,则装置B 中发生反应的化学方程式为__________,若其他条件不变,增大硝酸的浓度,则会使逸出的气体中n(NO)________n(NO 2)(填“>”或“<”)。
[制备Ca(NO 2)2]乙组同学拟利用装置B 中产生的氮氧化物制备Ca(NO 2)2,装置如图。
[测定Ca(NO 2)2的纯度]丙组同学测定Ca(NO 2)2的纯度(杂质不参加反应),可供选择的试剂: a .稀硫酸 b .c 1 mol·L −1的KI 溶液 c .淀粉溶液 d .c 2 mol·L −1的Na 2S 2O 3溶液 e .c 3 mol·L −1的酸性KMnO 4溶液 (3)利用Ca(NO 2)2的还原性来测定其纯度,可选择的试剂是______ (填字母序号)。
该测定方法发生反应的离子方程式为____________________________ (4)利用Ca(NO 2)2的氧化性来测定其纯度的步骤:准确称取m g Ca(NO 2)2样品放入锥形瓶中,加适量水溶解,加入________,然后滴加稀硫酸,用c 2 mol/L Na 2S 2O 3溶液滴定至溶液__________,读取消耗Na 2S 2O 3溶液的体积,重复以上操作3 次,(请用上述给出试剂补充完整实验步骤)。
若三次消耗Na 2S 2O 3溶液的平均体积为V mL ,则Ca(NO 2)2纯度的表达式为__________。
27.(14分)碳酸二甲酯(简称DMC)作为“绿色”化工产品具有广泛的应用。
用甲醇、二氧化碳制备DMC 的方程式为:2CH 3OH(g)+CO 2(g)→CH 3O(CO)OCH 3(g)+H 2O(g) ΔH 1=-15kJ·mol -1(平衡常数为K 1)已知:生成焓是某温度下,用处于标准状态的各种元素的最稳定单质生成标准状态下1mol 某纯物质的热效应。
(1)H 2O(g)生成焓Q 为_____,从平衡移动的角度选择有利于制得DMC 的条件是_______(填序号)。
A .高温 B .高压 C .低温 D .低压 (2)在体积为1L 的密闭容器中,甲醇、二氧化碳分别投料4×10−2mol 、2×10−2mol 。
不同温度下平衡转化率如图所示。
温度降为100℃以内平衡转化率变化显著,原因之一有_____。
100℃时平衡常数为______L·mol −1 (结果保留一位有效数字)(3)有研究者用CO和O2代替CO2进行实验:2CH3OH(g)+CO(g)+1/2O2(g)→CH3O(CO)OCH3(g)+H2O(g) ΔH2(平衡常数为K2)①CO和O2生成CO2的反应是_______(填“放热反应”或“吸热反应”),则ΔH2________ΔH1(填“大于”、“小于”或“等于”)。
②在100-200℃的范围内,相同温度时关于K2与K1的推理正确的是______(填编号)A.K2远大于K1 B.K2略大于K1 C.K2等于K1 D.K2远小于K128.(15分)金属Co、Ni性质相似,在电子工业以及金属材料上应用十分广泛。
现以含钴、镍、铝的废渣(含主要成分为CoO、Co2O3、Ni、少量杂质Al2O3)提取钴、镍的工艺如下:(1)酸浸时SO2的作用是___________________________________(2)除铝时加入碳酸钠产生沉淀的离子反应_________________________________(3)有机层提取出的Ni2+可用于制备氢镍电池,该电池工作原理:NiOOH+MH Ni(OH)2+M,电池放电时正极电极反应式为___________________.(4)用CoCO3为原料采用微波水热法和常规水热法均可制得H2O2分解的高效催化剂CoxNi(1-x)Fe2O4(其中Co、Ni均为+2价)。
如图是用两种不同方法制得的CoxNi(1-x)Fe2O4在10℃时催化分解6%的H2O2溶液的相对初始速率随x变化曲线。
①H2O2的电子式______________.②由图中信息可知:___________________法制取的催化剂活性更高③Co2+、Ni2+两种离子中催化效果更好的是_________________________________(5)已知煅烧CoCO3时,温度不同,产物不同。
在400℃充分煅烧CoCO3,得到固体氧化物的质量2.41g,CO2的体积为0.672L(标况下),则此时所得固体氧化物的化学式为____________。
35.【化学——选修3:物质结构与性质】(15分)稀土元素是指元素周期表中原子序数为57到71的15种镧系元素,以及与镧系元素化学性质相似的钪(Sc)和钇(Y),共17种元素。
稀土有“工业维生素”的美称,如今已成为极其重要的战略资源。
(1)镧系元素位于元素周期表第_______族,镧系元素位于周期表的______区。
(2)钪(Sc)为21号元素,其基态原子M能层电子数为_______;基态镝(Dy)原子的电子排布式为[Xe]4f106s2,一个基态镝原子所含的未成对电子数为______。
(3)稀土元素最常见的化合价为+3价,但也有少数还有+4价。
请根据下表中的电离能数据,判断表中最可能有+4价的元素是___。
几种稀土元素的电离能(单位:kJ·mol−1):(4)Sm(钐)的单质与1,2-二碘乙烷可发生反应Sm+ICH2CH2I→SmI2+CH2=CH2。
ICH2CH2I中碳原子的杂化轨道类型为_____,1mol CH2=CH2中含有的σ键数目为____。
常温下,1,2-二碘乙烷为液体而乙烷为气体,其主要原因是_____。
(5)PrO2(二氧化镨)的晶体结构与CaF2相似,晶胞中Pr(镨)原子位于面心和顶点,则PrO2(二氧化镨)的晶胞中有_____个氧原子。
(6)Ce(铈)单质为面心立方晶体,其相对原子质量为140,其晶胞参数为α=516pm。