荧光定量原理与分析方法
- 格式:pdf
- 大小:1.65 MB
- 文档页数:59

荧光定量pcr的原理方法
荧光定量PCR(Fluorescent Quantitative PCR,qPCR)是一种用荧光信号量化检测PCR产物的方法,用于定量分析目标DNA或RNA的含量。
荧光定量PCR的基本原理如下:
1.引物设计:设计特异性引物,使其能够特异性地扩增目标DNA或RNA序列。
2.模板DNA或RNA的提取:从样品中提取目标DNA或RNA。
3.cDNA合成:对于RNA样品,需要首先将RNA反转录成cDNA,作为PCR 的模板。
4.Real-time PCR扩增反应:将模板DNA或cDNA与引物和荧光探针一起加入PCR反应体系中,进行实时PCR扩增。
PCR反应体系中还包括核苷酸,聚合酶和缓冲液等。
5.荧光信号检测:随着PCR的进行,荧光探针被解旋成单链,释放出与之配对的荧光染料。
荧光染料产生荧光信号,信号强度与扩增产物的数量成正比。
6.荧光信号检测系统:荧光信号检测系统实时检测PCR反应体系中的荧光信号,并将其转换成数值。
7.标准曲线绘制:通过使用已知浓度的标准品进行一系列稀释,绘制出标准曲线。
标准曲线将荧光信号强度与目标DNA或RNA的初始浓度之间建立了一个标准关系。
8.样品定量:通过对样品的荧光信号强度进行测量,并使用标准曲线进行插值计算,确定样品中目标DNA或RNA的初始浓度。
荧光定量PCR具有高灵敏度、高特异性、宽动态范围、低检测限和快速分析等优点,广泛应用于分子生物学和疾病诊断等领域。
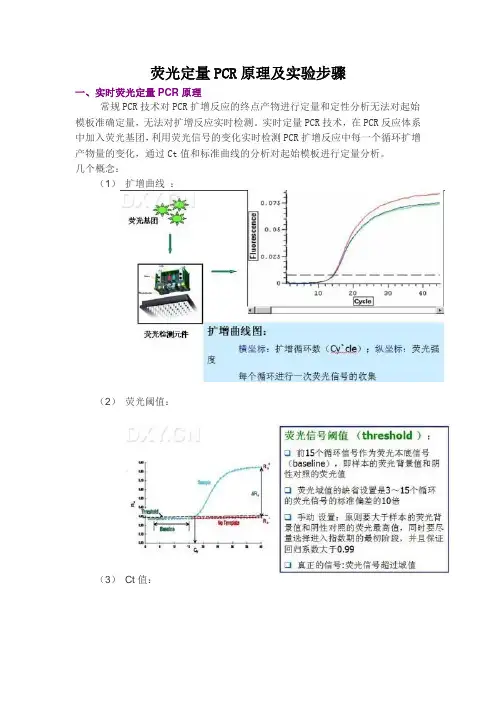
荧光定量PCR原理及实验步骤
一、实时荧光定量PCR原理
常规PCR技术对PCR扩增反应的终点产物进行定量和定性分析无法对起始模板准确定量,无法对扩增反应实时检测。
实时定量PCR技术,在PCR反应体系中加入荧光基团,利用荧光信号的变化实时检测PCR扩增反应中每一个循环扩增产物量的变化,通过Ct值和标准曲线的分析对起始模板进行定量分析。
几个概念:
(1)扩增曲线:
(2)荧光阈值:
(3)Ct值:
(4)标准曲线
SYBR Green工作原理:
1、SYBR Green 能结合到双链DNA的小沟部位
2、SYBR Green 只有和双链DNA结合后才发荧光
3、变性时,DNA双链分开,无荧光
4、复性和延伸时,形成双链DNA,SYBR Green 发荧光,在此阶段采集荧光
信号。
二、实验步骤
1. 实验前先在大型仪器共享平台上预约多元荧光定量PCR仪。
1、将所需引物和SYBgreen(避光)拿出,解冻。
计算好所有引物和SYBgreen
的用量。
2、反应体系(25μL)如下:
H2O 11μL
SYBgreen 12.5Μl
上游引物0.25μL
下游引物0.25μL
cDNA 1μL
可先将H2O 和SYBgreen按照所需量配好后,分装,再根据需要加引物和模板。
4、加完所有试剂后,盖上盖子,混匀,离心。
上机。

荧光定量法一、引言在生物医学研究中,荧光定量法是一种常用的实验技术,用于测量样品中特定物质的浓度。
荧光定量法基于荧光现象,通过测量样品发出的荧光强度来确定目标物质的含量。
本文将详细介绍荧光定量法的原理、应用以及优缺点。
二、原理荧光定量法基于荧光现象,即当物质受到激发光照射后,能够吸收光能并发出辐射光。
荧光现象是由于物质的电子在激发态和基态之间跃迁所导致的。
在荧光定量法中,使用荧光染料或荧光标记的抗体等荧光探针与目标物质结合后,通过测量荧光强度来确定目标物质的浓度。
荧光定量法的基本原理如下: 1. 激发:使用特定波长的激发光照射样品,使样品中的荧光探针被激发到激发态。
2. 荧光发射:被激发的荧光探针从激发态跃迁回基态时,会发出荧光。
荧光的波长和强度与样品中目标物质的浓度相关。
3. 检测:使用荧光仪测量样品发出的荧光强度,并将其与标准曲线进行比较,从而确定目标物质的浓度。
三、应用荧光定量法在生物医学研究中有广泛的应用,以下是一些常见的应用领域:1. 生物分析荧光定量法可用于测量生物样品中的蛋白质、核酸、细胞等目标物质的浓度。
例如,可以使用荧光探针标记的抗体来定量检测特定蛋白质在细胞中的表达水平,或者使用荧光探针检测核酸序列的浓度。
2. 药物研发荧光定量法在药物研发中起着重要的作用。
通过荧光定量法可以测量药物在体内的药物浓度,评估药物的代谢和排泄情况,从而优化药物剂量和给药方案。
3. 环境监测荧光定量法可用于环境监测中,例如测量水样中的污染物浓度。
通过使用荧光探针与目标污染物结合,可以快速、准确地测量水样中的污染物含量,为环境保护提供重要参考。
4. 食品安全荧光定量法在食品安全领域也有应用。
例如,可以使用荧光探针检测食品中的有害物质,如重金属、农药残留等。
荧光定量法具有高灵敏度和高选择性,能够有效地检测食品中的微量有害物质。
四、优缺点荧光定量法作为一种常用的实验技术,具有以下优点: - 高灵敏度:荧光探针的荧光强度可以非常敏感地反映目标物质的浓度变化。

实时荧光定量PCR原理与分析方法实时荧光定量PCR(qPCR)是一种基于PCR技术的DNA定量方法,可以在实时反应过程中实时监测PCR产物的累积情况。
与传统的终点PCR相比,qPCR具有更高的灵敏度和准确性,可以定量检测非常低浓度的目标DNA。
实时荧光定量PCR的原理是利用荧光染料与PCR产物结合发出荧光信号,通过监测荧光信号的强度来测定PCR产物的数量。
qPCR有两种常用的检测方法:SYBR Green I染料法和探针法(如TaqMan探针法)。
SYBR Green I染料法是一种简单而常用的qPCR检测方法。
SYBR Green I是一种DNA结合荧光染料,在PCR反应过程中会与PCR产物的DNA结合,从而产生荧光信号。
这种方法的优点是简便、经济,但缺点是非特异性,可能产生假阳性结果。
探针法是一种更为特异和准确的定量PCR方法。
在这种方法中,需要设计一对特异性引物和一个包含荧光探针的引物。
在PCR反应过程中,引物与目标DNA特异性结合,探针结合在引物的靶区上,当PCR反应进行到延伸阶段时,Taq聚合酶会切割探针上的荧光标记,导致断裂,这样就分离出信号的发射荧光信号。
探针法具有高特异性和准确性,能够避免假阳性结果。
无论是SYBR Green I染料法还是探针法,实时荧光定量PCR的分析方法都是通过构建标准曲线并计算目标DNA的模板数量来定量分析样品中的目标物质。
首先,需要用已知浓度的目标DNA制备标准品,根据不同浓度标准品的CT值(荧光信号阈值)绘制标准曲线。
然后,将样品DNA与引物一起进行PCR扩增反应,监测荧光信号强度并记录CT值。
利用标准曲线可以计算出样品中目标物质的浓度。

荧光定量PCR技术原理与结果分析一、荧光定量PCR技术原理1.基本原理荧光定量PCR技术基于传统的PCR技术,其中关键的步骤是DNA的扩增。
PCR过程中,DNA模板会通过聚合酶链式反应在多个循环中进行指数级扩增。
在扩增过程中,每一个循环都包括三个主要步骤:变性,引物结合和扩增。
2.荧光标记3.荧光信号检测与分析在PCR反应的扩增过程中,荧光强度会随着PCR产物的扩增而增加。
荧光信号的强度与扩增目标DNA的数量成正比。
因此,通过测量PCR反应中发出的荧光信号的强度,可以确定目标DNA的起始数量。
二、荧光定量PCR技术结果分析1.标准曲线2.反应效率反应效率是PCR扩增的关键因素之一、反应效率是通过标准曲线的斜率来表示的,斜率越接近1,表示反应效率越高。
较低的PCR反应效率可能是由于试剂的浓度不足、PCR条件不合适或者目标DNA的起始浓度低。
3.CT值CT值是PCR反应过程中,荧光信号由背景噪声中分离出来的阈值周期数。
在荧光定量PCR实验中,CT值用于计算目标DNA的起始浓度。
CT值越小,表示目标DNA的起始数量越多。
4.荧光指数荧光指数是指测量PCR反应中特定周期(一般为指定阈值之后的周期)的荧光信号的增加量。
荧光指数也可以用来评估PCR的效果和目标DNA的起始数量。
荧光指数越高,表示目标DNA的起始数量越多。
5.目标基因的相对表达量总结起来就是,荧光定量PCR技术通过引入荧光标记的引物和探针,在PCR反应中实时监测荧光信号的强度变化来定量分析目标DNA的起始数量。
通过制备标准曲线、测量CT值和荧光指数,可以对PCR反应的效果和目标DNA的表达量进行定量分析。
此外,荧光定量PCR还可以用于研究目标基因的相对表达量。

荧光定量法是一种常用的实验技术,用于测量和定量分析样品中的特定荧光信号。
这种方法基于荧光分子的性质,通过激发样品中的荧光分子,并测量它们产生的荧光信号的强度来得出定量结果。
荧光定量法的基本原理是利用荧光分子的特性。
荧光分子具有吸收光子能量后发出比吸收能量低的荧光能量的特点。
当样品中的荧光分子受到特定波长的激发光照射时,荧光分子会吸收光子能量并跃迁到激发态。
随后,荧光分子会在极短的时间内从激发态返回到基态,并释放出荧光能量。
这个过程是一个自发发光的过程。
荧光定量法的步骤如下:1.激发光源:选择合适波长的激发光源,可以是可见光或紫外光。
根据需要,可以选择不同的波长来激发不同的荧光分子。
2.样品制备:将待测样品制备成适合荧光测量的形式。
这可能涉及到样品的稀释、提取或染色等处理。
3.荧光测量:将样品放置在荧光测量仪器中,通过激发光源照射样品,并收集样品发出的荧光信号。
荧光信号的强度与样品中荧光分子的浓度成正相关。
4.数据分析:使用合适的荧光定量软件或算法处理所得数据,得出目标物质在样品中的浓度。
荧光定量法具有以下优点:1.高灵敏度:荧光分子具有较高的荧光量子产率,荧光定量法能够检测到低浓度的目标物质,通常比其他定量方法更加灵敏。
2.高选择性:通过选择激发光源的波长和使用特定的荧光探针,可以实现对特定目标物质的选择性定量分析。
3.宽线性范围:荧光信号的强度与荧光分子的浓度之间通常具有良好的线性关系,可以实现宽范围内的定量分析。
4.实时监测:荧光定量法通常具有快速的响应速度,可以在实时监测过程中进行定量分析。
荧光定量法在许多领域中得到广泛应用,例如生物学、环境监测、药物发现和医学诊断等。
它可以用于测量蛋白质、核酸、细胞分子和微生物等生物分子的浓度,也可以用于测量环境中的污染物浓度。
由于其高灵敏度、高选择性和实时监测的特点,荧光定量法成为了研究和应用领域中不可或缺的工具。
总之,荧光定量法是一种基于荧光分子特性的定量分析方法。

荧光定量PCR的原理方法及结果分析荧光定量PCR(quantitative polymerase chain reaction,qPCR)是一种常用的检测DNA或RNA含量的方法,通过测定荧光信号的强度来确定起始模板数量的多少。
其原理主要包括引物的选择、PCR反应的进行、荧光信号的测定以及数据分析等步骤。
首先,荧光定量PCR需要选择适当的引物。
引物的设计要求首先能够特异性地与目标序列结合,这样才能保证只有起始模板被扩增。
引物的长度通常在18-24个碱基对之间,GC含量在40-60%之间,碱基序列中不能存在太多的重复序列或者分子倒序等结构。
此外,引物的Tm值应该相近,不应过于接近,以免引物发生二次结合。
另外,荧光标记的引物通常采用双探针(dual-labeled probe)和SYBR Green I染料,二者的优缺点各有不同:双探针对应用的目标突变不敏感,但是对于长序列的目标扩增效果较好;SYBR Green I适用于鉴定多个不同基因的扩增,但是对于PCR产物的目标特异性检测较差。
其次,PCR反应的进行是荧光定量PCR的核心步骤。
反应体系通常包括引物、模板DNA、DNA聚合酶、荧光标记剂和反应缓冲液。
PCR反应过程中,首先是变性,将模板DNA的双链分离;然后是退火,使引物与目标序列结合;接着是延伸,DNA聚合酶在适当的温度下进行链延伸。
PCR反应的循环数通常在25-40之间,具体循环数多少需要根据目标序列的长度和浓度来决定。
PCR反应条件的优化要注意引物浓度、PCR温度和时间。
第三,荧光信号的测定是荧光定量PCR中不可或缺的步骤。
通常,荧光信号的测定可以通过荧光实时扩增仪来进行。
在每一个PCR循环过程中,荧光实时扩增仪会记录下PCR反应管中荧光信号的强度。
随着PCR反应的进行,PCR产物的数量也在逐渐增加,荧光信号的强度也会增加。
荧光信号的强度与PCR产物的数量之间存在着一定的线性关系,利用标准曲线可以将荧光信号的强度转化为起始模板的绝对数量。



荧光定量PCR实验原理及数据分析1.前处理:首先对待测样本进行DNA提取,并且根据需要可对DNA进行适当的纯化和稀释处理。
2. 反应体系的准备:将PCR反应所需的各种试剂组装到反应管中,包括模板DNA、引物、荧光探针和PCR Master Mix等。
其中荧光探针是含有特定标记荧光分子及其互补序列的寡核苷酸。
3.反应机使用条件的设定:根据所需扩增目标的不同,设置适当的反应条件,包括温度控制、循环次数和步骤等。
4.PCR反应过程监测:在PCR反应的过程中,通过荧光信号的实时监测来定量检测目标DNA。
在扩增过程中,如果靶标DNA存在,则引物与目标DNA结合,荧光探针被引物酶切释放出来,从而增大荧光信号。
5.数据收集与分析:实时采集PCR反应过程中的荧光信号,并通过相应的软件进行数据分析。
常见的荧光曲线分析方法有阈值循环数法(Ct 法)和相对定量法(ΔCt法)等。
在数据分析方面1.Ct值分析:阈值循环数法(Ct法)是一种常用的数据分析方法。
通过设定一个荧光信号的阈值(通常为反应曲线的背景荧光信号的两倍标准差),根据荧光信号的曲线与阈值的交点来计算Ct值。
Ct值越小,说明目标DNA起始含量越多。
2.标准曲线分析:通过引入已知浓度的标准品,制作一条标准曲线。
根据标准曲线,可以推算出待测样本中的靶标DNA的含量。
3.相对定量分析:采用相对定量法(ΔCt法)来比较两个不同样本间的靶标DNA的表达量。
通过比较目标基因与内参基因(如表达稳定的参考基因)的Ct值,计算两者Ct值间的差异(ΔCt),进而得到靶标基因的表达差异。
4.绝对定量分析:通过构建外部标准曲线或使用串联基因的方法,直接定量目标DNA的浓度。
总之,荧光定量PCR技术在医学、生物学和分子生物学等领域的应用非常广泛,对荧光信号的实时监测及数据分析能够提供准确快速的定量结果,为研究者们提供了一个强大的实验工具。

荧光定量PCR技术原理与结果分析荧光定量PCR(qPCR)是一种广泛应用于分子生物学的实验技术,可以对DNA或RNA目标序列进行定量分析。
本文将介绍荧光定量PCR的原理和结果分析,包括实验步骤、PCR曲线的解读以及测定目标序列的相对表达水平等。
一、荧光定量PCR的原理荧光定量PCR技术主要基于PCR的原理,即通过模板DNA的逐渐扩增,来定量分析起始模板DNA或RNA的数量。
在实验中,荧光定量PCR通常使用DNA合成酶来合成目标序列的拷贝,通过在每个扩增周期后测量荧光信号的变化,来定量反应的进程。
1.准备试剂和反应体系:包括引物、合成的目标序列等。
2.PCR反应:在热循环PCR仪中,通过一系列不同温度的循环,使模板DNA的扩增合成逐渐发生。
3.荧光信号检测:通过在每个循环后侦测荧光信号的变化,来定量PCR反应的进程和模板DNA的数量。
4.数据分析:通过荧光信号的变化来计算模板DNA或RNA的相对表达水平。
二、荧光定量PCR结果分析1.PCR曲线的解读在荧光定量PCR反应中,通常会绘制荧光信号与PCR循环数的关系图即PCR曲线。
根据PCR曲线的形状,可以得到以下几个关键结果:(1)阈值循环数(Ct):阈值循环数是PCR曲线上荧光信号超过背景信号的循环数。
Ct值越小,目标序列的初始模板数量越多。
(2) 扩增效率(Efficiency):扩增效率可以通过计算PCR曲线斜率的反向值得到,通常表达为百分比。
扩增效率越高,说明PCR反应的有效性越好。
(3)Ct值偏移:Ct值偏移是指实验组与对照组(如阴性对照或基准组)之间的Ct值差异。
Ct值偏移的大小可以用于计算相对表达水平。
2.相对表达水平的测定相对表达水平是指在不同实验条件下,目标序列在不同组织或细胞中的表达量相对比较和定量分析。
常用的计算方法有:(1)∆∆Ct法:通过计算实验组与对照组的相对Ct值差异来获得相对表达水平。
∆∆Ct值越大,目标序列的表达水平差异越明显。
荧光定量法摘要:一、荧光定量法的概述二、荧光定量法的原理三、荧光定量法的应用领域四、荧光定量法的优缺点五、荧光定量法的发展前景正文:一、荧光定量法的概述荧光定量法是一种生物学研究中常用的实验技术,它的主要作用是通过检测荧光信号的强度,来定量分析样本中特定目标物质的含量。
这种方法具有高灵敏度、高特异性和高重复性等优点,被广泛应用于分子生物学、生物化学、免疫学等领域。
二、荧光定量法的原理荧光定量法的原理主要基于荧光信号的特性。
荧光信号是一种光信号,当特定波长的光照射在荧光物质上时,荧光物质会吸收光能,然后以另一种波长的光形式释放出能量,这种释放的光就是荧光信号。
荧光定量法就是通过检测这种荧光信号的强度,来定量分析样本中特定目标物质的含量。
三、荧光定量法的应用领域荧光定量法在生物学研究中的应用领域非常广泛,包括但不限于以下几个领域:1、基因表达分析:通过荧光定量法,可以定量分析基因的表达水平,以研究基因在生物过程中的作用。
2、蛋白质分析:荧光定量法可以用于检测和定量蛋白质,从而研究蛋白质的生物学功能。
3、细胞分析:通过荧光定量法,可以定量分析细胞的数量和活性,以研究细胞的生物学特性。
四、荧光定量法的优缺点荧光定量法的主要优点包括:高灵敏度,可以检测到非常低浓度的目标物质;高特异性,可以针对特定的目标物质进行定量分析;高重复性,可以进行大量的重复实验。
然而,荧光定量法也存在一些缺点,例如:需要特定的实验设备,操作相对复杂;可能会受到荧光物质的毒性影响等。
五、荧光定量法的发展前景随着科学技术的发展,荧光定量法在生物学研究中的应用前景非常广阔。
未来,随着荧光物质的研发和改进,荧光定量法的灵敏度和特异性将会进一步提高。
荧光定量法(最新版)目录一、荧光定量法的概述二、荧光定量法的原理三、荧光定量法的应用领域四、荧光定量法的优缺点五、荧光定量法的发展前景正文一、荧光定量法的概述荧光定量法是一种利用荧光物质在特定波长下产生的荧光强度与物质的浓度成正比的原理,对样品进行定量分析的方法。
该方法具有高灵敏度、高精度、快速等特点,被广泛应用于生物学、化学、环境科学等领域。
二、荧光定量法的原理荧光定量法的原理主要基于荧光物质在特定波长下的荧光强度与物质的浓度之间的相关性。
当荧光物质与待测样品混合后,荧光物质的荧光强度会受到样品中荧光物质浓度的影响。
通过测量荧光强度,可以推算出样品中荧光物质的浓度,从而实现对样品的定量分析。
三、荧光定量法的应用领域荧光定量法在多个领域具有广泛的应用,主要包括以下几个方面:1.生物学领域:荧光定量法可用于检测蛋白质、核酸等生物大分子的浓度,为生物科学研究提供重要手段。
2.医学领域:荧光定量法可用于检测血液、尿液等生物样本中的疾病标志物,为疾病的诊断和监测提供依据。
3.环境科学领域:荧光定量法可用于检测水中重金属离子、有机污染物等环境污染物的浓度,为环境监测和污染治理提供技术支持。
4.化学领域:荧光定量法可用于分析化学品中的荧光物质含量,为化学品的生产和质量控制提供依据。
四、荧光定量法的优缺点荧光定量法具有以下优点:1.高灵敏度:荧光定量法能够检测到非常低浓度的荧光物质,具有很高的灵敏度。
2.高精度:荧光定量法可以实现对荧光物质浓度的精确测量,有利于提高分析结果的可靠性。
3.快速:荧光定量法能够在短时间内完成对样品的定量分析,具有较高的分析效率。
然而,荧光定量法也存在一定的缺点:1.仪器设备要求较高:荧光定量法需要使用专门的荧光光谱仪等设备,对仪器设备要求较高。
2.易受干扰:荧光定量法在实际应用过程中,可能会受到其他物质的荧光干扰,影响分析结果的准确性。
五、荧光定量法的发展前景随着科学技术的不断发展,荧光定量法在理论研究和应用技术方面都将取得新的突破。
荧光定量法摘要:一、荧光定量法简介二、荧光定量法原理三、荧光定量法应用四、荧光定量法优缺点五、发展趋势与展望正文:荧光定量法是一种灵敏、高效的核酸检测技术,广泛应用于生物学、医学等领域。
它通过测量样品中特定目标物质的荧光信号强度,实现对目标物质的定量分析。
一、荧光定量法简介荧光定量法起源于上世纪80年代,随着荧光染料和核酸扩增技术的不断发展,荧光定量法逐渐成为一种重要的核酸检测手段。
与传统定性PCR技术相比,荧光定量法不仅可以判断目标物质是否存在,还可以实现对其含量的高精度测定。
二、荧光定量法原理荧光定量法的原理主要基于荧光信号与目标物质的定量关系。
在实验过程中,将荧光标记的核酸探针与待测样品中的目标序列杂交,通过核酸扩增反应,使目标序列数量呈指数级增加。
在扩增过程中,荧光染料或荧光标记的核酸探针与目标序列特异性结合,从而产生荧光信号。
根据荧光信号的强度,可以计算出目标物质的含量。
三、荧光定量法应用荧光定量法在生物学、医学等领域具有广泛应用,如基因表达检测、突变检测、病原体检测等。
此外,荧光定量法还应用于药物研发、疾病诊断、遗传病筛查等方面。
四、荧光定量法优缺点荧光定量法具有较高的灵敏度和特异性,可以实现对目标物质的定量分析。
同时,该方法操作简便、检测速度快,适用于大规模样本筛查。
然而,荧光定量法也存在一定的局限性,如对荧光染料的选择要求较高,易受实验条件影响,以及设备成本较高等。
五、发展趋势与展望随着科学技术的进步,荧光定量法在检测灵敏度、检测速度、成本等方面仍有很大的提升空间。
未来发展趋势包括:(1)开发新型荧光染料,提高荧光信号强度;(2)优化实验操作和仪器设备,提高检测效率;(3)发展多重荧光定量法,实现对多种目标物质的同步检测;(4)结合大数据和人工智能技术,实现对检测结果的智能分析。
总之,荧光定量法作为一种重要的核酸检测技术,在生物学、医学等领域具有广泛应用。