氢气还原氧化铁
- 格式:doc
- 大小:13.00 KB
- 文档页数:1

《还原反应的例子10 个》朋友们,今天咱们来瞧瞧10 个还原反应的例子。
先说氢气还原氧化铜,这就像是氢气这个小勇士,把氧化铜里的氧给夺走了,让氧化铜变回了铜。
再看一氧化碳还原氧化铁,一氧化碳这家伙可厉害啦,把氧化铁中的氧抢走,生成了铁和二氧化碳,就像一场激烈的抢夺大战。
还有木炭还原氧化铜,木炭就像个大力士,把氧化铜中的氧拉走,得到了单质铜。
金属和酸的反应也是还原反应,比如锌和稀硫酸反应生成氢气和硫酸锌,这就好比是锌把酸中的氢给“挖”了出来。
碳还原二氧化碳生成一氧化碳,这就像碳给二氧化碳来了个“大变身”。
氢气还原氧化铁,让氧化铁乖乖地交出了氧,变回了铁。
一氧化碳还原氧化亚铁,就像给氧化亚铁做了个“整形手术”,氧被拿走,变成了铁。
镁在二氧化碳中燃烧,把二氧化碳中的碳给还原了出来,这可真是一场精彩的“魔法表演”。
铝和氧化铁的铝热反应,铝把氧化铁中的铁给“解救”了出来,那场面相当壮观。
最后说铁从硫酸铜溶液中置换出铜,铁把铜离子给“拉”了过来,变成了单质铜。
这些还原反应的例子是不是很有趣?《还原反应的例子10 个》朋友们,今天咱们好好说说10 个还原反应的例子。
首先是氢气还原四氧化三铁,氢气就像个机灵的小偷,悄悄地把四氧化三铁里的氧偷走,留下了铁。
接着是碳还原氧化锌,碳这个“大力士”硬是把氧化锌中的氧给拽走,得到了锌。
一氧化碳还原氧化铅,这就像是给氧化铅来了个“瘦身行动”,氧被一氧化碳带走,只留下了铅。
氢气还原氧化银,氢气如同一个勇敢的战士,打败了氧,让氧化银变回了银。
金属钠还原四氯化钛生成钛和氯化钠,这就好比是钠给四氯化钛来了个“改头换面”。
碳还原氯化铜生成铜和氯化氢,碳把氯化铜中的铜给“抢”了过来。
一氧化碳还原氧化镍,就像给氧化镍施了个魔法,氧跑掉了,镍出现了。
镁还原氯化钛得到钛和氯化镁,镁可真有本事,把氯化钛中的钛给“揪”了出来。
铝还原二氧化锰生成锰和氧化铝,铝像是个神奇的魔术师,让二氧化锰发生了奇妙的变化。

中考复习资料总结九年级上册化学方程式及实验现象总结一、化合反应1、木炭(碳)在空气中燃烧现象:发出红光..,放出热量,生成能使澄清石灰水变浑浊的气体;在氧气中燃烧现象:发出白光..,放出热量,生成能使澄清石灰水变浑浊的气体。
C+O2点燃CO2(充分燃烧)2C+O2点燃 2 CO (不充分燃烧)2、硫在空气中燃烧现象:发出微弱的淡蓝色......火焰,生成有刺激性气味的气体,放出热量;在氧气中燃烧现象:发出明亮的蓝紫色......火焰,生成有刺激性气味的气体,放出热量。
S+O2点燃SO23、红磷(或者白磷)在空气中燃烧现象:产生大量白烟,放出热量。
4P+5O2点燃2P2O54、注意..铁丝在空气中不能燃烧;在氧气燃烧现象:剧烈燃烧,火星四射,生成黑色固体,放出热量。
3Fe+2O2点燃Fe3O45、镁带在空气中燃烧现象:发出耀眼的白光,冒白烟,生成白色粉末,放出热量。
2Mg+O2点燃2MgO6、氢气在空气(或氧气)中燃烧现象:发出淡蓝色火焰,放出热量,火焰上罩一个干而冷的烧杯,烧杯内壁出现水雾。
2H2+O2点燃2H2O7、铜在空气中加热现象:红色固体逐渐变成黑色2Cu+O2△2CuO8、一氧化碳在空气中燃烧现象:发出蓝色火焰,放出热量,火焰上罩一个涂有澄清石灰水的烧杯,澄清石灰水变浑浊。
2CO+O2点燃2CO29、汞在加热的条件下与氧气反应:2Hg+O2△2HgO10、铝在空气中燃烧:4Al+3O2点燃2Al2O311、二氧化碳通过灼热的碳层:CO2 +C高温2CO12、二氧化碳与水反应:CO2 +H2O == H2CO3(二氧化碳通入紫色石蕊试液,溶液变红的原因)二、分解反应1、氧化汞加热分解:2HgO△2Hg+O2↑2、高锰酸钾制氧气:2KMnO4△K2MnO4+MnO2+O2↑3、氯酸钾制氧气:2KClO3MnO22KCl+3O2↑△MnO24、过氧化氢制氧气:2H2O2 2H2O+O2↑5、电解水:2H2O通电2H2↑+O2↑6、碳酸不稳定,易分解:H2CO3 === H2O+CO2↑ (二氧化碳通入石蕊试液,溶液变红,加热红色变为紫色的原因)三、其他反应1、实验室制取二氧化碳:CaCO3+2HCl==CaCl2+ H2O + CO2↑ (大理石或石灰石和稀盐酸)2、木炭还原氧化铜:C+2CuO高温2Cu+CO2↑ (CuO为黑色粉末)现象:黑色粉末逐渐变为红色,澄清石灰水变浑浊。
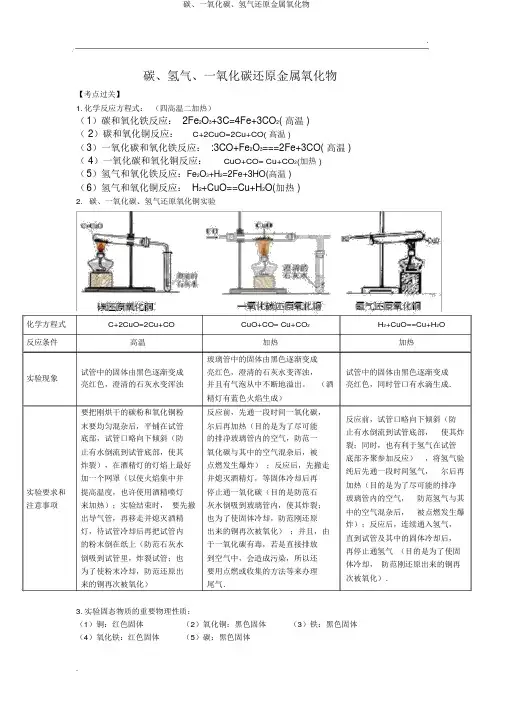
.碳、氢气、一氧化碳还原金属氧化物【考点过关】1.化学反应方程式:(四高温二加热)(1)碳和氧化铁反应: 2Fe2O3+3C=4Fe+3CO2( 高温 )( 2)碳和氧化铜反应:C+2CuO=2Cu+CO( 高温 )(3)一氧化碳和氧化铁反应: :3CO+Fe2O3===2Fe+3CO( 高温 )( 4)一氧化碳和氧化铜反应:CuO+CO= Cu+CO2(加热 )(5)氢气和氧化铁反应:Fe2O3+H2=2Fe+3HO(高温 )(6)氢气和氧化铜反应: H2+CuO==Cu+H2O(加热 )2.碳、一氧化碳、氢气还原氧化铜实验化学方程式C+2CuO=2Cu+CO CuO+CO= Cu+CO2H2+CuO==Cu+H2O 反应条件高温加热加热玻璃管中的固体由黑色逐渐变成实验现象试管中的固体由黑色逐渐变成亮红色,澄清的石灰水变浑浊,试管中的固体由黑色逐渐变成亮红色,澄清的石灰水变浑浊并且有气泡从中不断地溢出。
(酒亮红色,同时管口有水滴生成.精灯有蓝色火焰生成)要把刚烘干的碳粉和氧化铜粉反应前,先通一段时间一氧化碳,反应前,试管口略向下倾斜(防末要均匀混杂后,平铺在试管尔后再加热(目的是为了尽可能止有水倒流到试管底部,使其炸底部,试管口略向下倾斜(防的排净玻璃管内的空气,防范一裂;同时,也有利于氢气在试管止有水倒流到试管底部,使其氧化碳与其中的空气混杂后,被底部齐聚参加反应),将氢气验炸裂),在酒精灯的灯焰上最好点燃发生爆炸);反应后,先撤走纯后先通一段时间氢气,尔后再加一个网罩(以使火焰集中并并熄灭酒精灯,等固体冷却后再加热(目的是为了尽可能的排净实验要求和提高温度,也许使用酒精喷灯停止通一氧化碳(目的是防范石玻璃管内的空气,防范氢气与其注意事项来加热);实验结束时,要先撤灰水倒吸到玻璃管内,使其炸裂;中的空气混杂后,被点燃发生爆出导气管,再移走并熄灭酒精也为了使固体冷却,防范刚还原炸);反应后,连续通入氢气,灯,待试管冷却后再把试管内出来的铜再次被氧化);并且,由直到试管及其中的固体冷却后,的粉末倒在纸上(防范石灰水于一氧化碳有毒,若是直接排放再停止通氢气(目的是为了使固倒吸到试管里,炸裂试管;也到空气中,会造成污染,所以还体冷却,防范刚还原出来的铜再为了使粉末冷却,防范还原出要用点燃或收集的方法等来办理次被氧化).来的铜再次被氧化)尾气.3.实验固态物质的重要物理性质:(1)铜:红色固体(2)氧化铜:黑色固体(3)铁:黑色固体(4)氧化铁:红色固体(5)碳:黑色固体4.实验气态物质的除杂与检验:气体氢气一氧化碳二氧化碳让待检气体在空气中点燃,在火焰上方燃烧,在火焰上方罩一罩一个干冷的烧干燥的小烧杯,烧杯上将气体通入澄清的石灰检验杯。

微尺度氧化铁粉的低温还原机理王秀;孙菲;林姜多;李秋菊;洪新【摘要】用热重分析法研究低温条件下(450、500、550和600℃),氢气还原微尺度氧化铁的还原动力学行为.结果表明:随氧化铁粉粒径减小和反应温度升高,初始反应速率加快,后期反应速率减慢.这是因为反应后期生成大量铁须,铁须之间形成搭桥,导致还原后的粉末严重烧结并致密化,阻碍气体的扩散,致使反应速率减慢.且随着粉体粒径减小,粉体表面吸附能增大,粉体致密程度提高,反应后期的粘结现象更加严重,反应速率相应减慢.采用Hancock-Sharp方法分析微尺度氧化铁粉恒温还原的动力学过程,发现前期阶段Fe2O3→Fe3O4,在500℃以下,相界面化学反应的阻力所占的比例较大,表明此阶段的反应控速环节为界面化学反应,温度超过500℃时,则由界面化学反应机理和相转变机理共同控制,点阵结构由Fe2O3的斜方六面体结构转变为Fe3O4的立方结构;后期阶段Fe3O4→Fe,由于粉体发生粘结,还原反应的控速环节转变为扩散控速.【期刊名称】《粉末冶金材料科学与工程》【年(卷),期】2012(017)002【总页数】7页(P153-159)【关键词】微尺度氧化铁粉;低温;氢气;Hancock-Sharp法;还原动力学【作者】王秀;孙菲;林姜多;李秋菊;洪新【作者单位】上海大学上海市现代冶金与材料制备重点实验室,上海200072;上海大学上海市现代冶金与材料制备重点实验室,上海200072;上海大学上海市现代冶金与材料制备重点实验室,上海200072;上海大学上海市现代冶金与材料制备重点实验室,上海200072;上海大学上海市现代冶金与材料制备重点实验室,上海200072【正文语种】中文【中图分类】TF11钢铁生产中排放的CO2和二恶英以及废弃物对环境的破坏,造成人类生存环境恶化[1]。
块矿储量日益减少,并且铁矿石的开采、加工和使用过程中会产生大量的粉矿,此外,现有的钢铁工业每年产生大量的含铁粉尘,这些粉矿及粉尘一般要进行烧结才能作为炼铁原料。


氢气还原铁的化学方程式氢气还原铁的过程,听起来有点高大上,但其实就像是科学界的一场魔法表演。
想象一下,在一个实验室里,科学家们像魔术师一样,把氢气放进铁矿石里,结果就是一场惊艳的化学反应。
嘿,大家知道吗?铁矿石里其实有很多氧化铁,我们把这些氧化铁放在高温下,轻轻一吹,嘿,氢气来了!这氢气可不简单,像个勇士,义无反顾地冲上去,跟氧化铁进行“战斗”。
大家可能会问,这氢气到底是个啥?它可是一种无色无味的气体,轻得像羽毛,飘在空中几乎不留下痕迹。
要是把它跟氧气放在一起,哎呀,那可就热闹了,瞬间能爆炸,简直是化学界的“火药桶”。
但是在这里,氢气的作用可是非常温柔。
它不是真的要跟氧化铁打架,而是要把氧从铁里“撬”出来。
你看,化学反应就是这么简单又神奇。
这时候,铁矿石就会变得光鲜亮丽,慢慢释放出纯铁。
而这纯铁可是有大用处的,听说它能用来造汽车、建房子,甚至做刀具,真是无所不能。
有人说,铁是个好东西,没错。
想想那锃亮的汽车,没了铁,嘿,那可就成了“无车可骑”的窘境。
好吧,可能稍微夸张了一点,但铁的确是工业的“脊梁”。
再说说氢气的“英勇表现”。
在高温下,它就像是个热情的舞者,随着温度的上升,翩翩起舞。
氢气和氧化铁一接触,立刻就开始了它的表演。
氧化铁中的氧分子被氢气“吸引”,然后悄悄地走开。
这个过程就像是在进行一场华丽的换衣秀,氧气换下了铁,铁则换上了纯净的光辉。
氢气还原铁的过程也告诉我们一个道理,团结就是力量。
氢气和氧化铁这对“组合”正是一个团队合作的典范。
一个轻飘飘的氢气和一块沉甸甸的铁矿石,居然能够在高温的环境下,共同完成这场化学的“交响曲”。
这不禁让我想到,我们生活中也是这样,有时候看似微不足道的小事,经过努力和合作,也能变成大事情。
就像冰块融化成水一样,慢慢地,涓涓细流汇聚成河。
氢气还原铁的化学方程式其实是个简单的表达式,听起来像是外星语,但只要了解了其中的奥妙,大家都会觉得“哦,原来如此!”氢气的魅力就在于它的简单与高效。

氢气和氧化铁反应方程式
特别声明:本文仅供参考,无任何抄袭成份。
氢气和氧化铁反应是一个典型的重要的化学反应,在工业应用中非常重要,方
程式为:2H2(氢气)+O2(氧气)=2H2O(水)+2Fe(氧化铁)。
通过上述方程式容易可见,这一反应是一个复杂的二元化学反应,其催化阶段
和机理尚不非常清晰,但经过大量实验证明,此反应中氢气的参与至关重要,可以明显促进反应的发生。
首先,氢气可以显著提高底物的活化能,减少颗粒物的表面张力。
此外,氢气
还能够抑制催化剂的催化作用,使催化剂的聚集性降低,减少液滴的体积,有利于它们参与反应,使反应得以更快地发生,而氧气参与活性物种的形成相当容易。
此外,负压和温度调节是影响氢气和氧化铁反应进程及其反应效率的重要环节,引入负压可以抑制反应过程中反应物和产物挥发损失,提高反应得率。
从综合这些反应中的特性来看,氢气和氧化铁反应很可能会受到工业污染物影响,工业界有必要采取有效的措施以改善反应过程和反应效率,以及清除水环境中的污染物。
为此,贤明的读者可借助重要的化学技术,在进行氢气和氧化铁反应的同时,对周边环境进行有效的控制和管理。

氢气炼铁原理
氢气炼铁原理是指利用氢气作为还原剂,将铁矿石中的氧化铁还原成金属铁的过程。
氢气炼铁技术是一种新型的高效、环保、节能的炼铁方法。
氢气炼铁原理的关键是利用氢气与氧化铁反应,生成水蒸气和金属铁。
在炼铁过程中,氢气与氧化铁反应时放出的热量能够提供还原反应所需的能量,并控制反应温度,确保反应的顺利进行。
同时,由于氢气和氧化铁反应后生成的水蒸气可以被回收和利用,因此氢气炼铁技术具有很强的环保性和节能性。
氢气炼铁技术的优点不仅在于其高效、环保、节能的特性,还在于其能够适用于各种不同类型的铁矿石,而且与传统炼铁技术相比,氢气炼铁技术所需的设备和成本也更低。
虽然氢气炼铁技术在国内尚处于研究阶段,但在国外已经得到了广泛的应用。
未来,随着我国对于环保和节能的重视,氢气炼铁技术将有望在我国得到更加广泛的应用和推广。
- 1 -。

氢还原铁工艺技术氢还原铁工艺技术是指利用氢气与氧化铁反应,将氧化铁还原为金属铁的一种工艺技术。
该技术在冶金、化工、能源等领域有广泛的应用。
首先,氢还原铁的工艺过程可分为预处理、还原、冷却等几个主要步骤。
首先,通过机械或化学方法将原料中的杂质去除,以保证还原后的铁的纯度。
接下来,将经过预处理的原料与氢气放置于特定的反应器中,加热至一定温度,使氢气与氧化铁发生还原反应。
随着反应的进行,氧化铁逐渐转化为金属铁,同时反应产生的水蒸气被冷凝收集。
最后,将还原后的金属铁冷却至室温,得到产品。
氢还原铁的关键技术是反应温度和反应时间的控制。
合适的反应温度有助于反应的进行,而过高或过低的温度都会对还原效率产生不利影响。
反应时间的控制则需要根据实际情况进行调整,以确保反应达到最佳状态。
此外,还需要合理控制氢气的流量和压力,以提高还原效率和产品纯度。
氢还原铁技术的优点有很多。
首先,该技术具有高度纯化的效果,能够将原料中的杂质去除,得到高纯度的金属铁。
其次,与传统的炼铁工艺相比,氢还原铁工艺涉及的能源消耗相对较低,有利于节能减排。
此外,该工艺还能有效地处理一些难以回收的铁矿石资源,对促进资源的综合利用具有重要意义。
最后,氢还原铁工艺技术具有灵活性和适应性较强的特点,可以根据不同的需求进行调整和优化。
尽管氢还原铁工艺技术在许多领域都有应用,但也存在一些问题和挑战。
一方面,该技术需要大量的氢气供应,氢气的制备和存储成本较高,限制了其规模化应用。
另一方面,该工艺对反应器的设计和材料选择有一定要求,需要耐受高温、高压和腐蚀等环境条件的材料。
因此,在进一步推广和应用该技术时,需要解决这些问题,提高其经济性和可靠性。
综上所述,氢还原铁工艺技术是一种重要的金属冶炼技术,具有高纯化效果、节能减排和资源综合利用等优点。
随着氢能源的不断发展和成熟,氢还原铁工艺技术也将进一步推广和应用,为实现可持续发展和绿色生产做出贡献。

氧化铁和氢气反应条件
氧化铁和氢气的反应是一个重要的化学反应,其反应条件对于反应的顺利进行至关重要。
以下是关于这一反应条件的详细分析。
首先,氧化铁和氢气的反应需要在高温下进行。
这是因为该反应是一个吸热反应,需要外部提供能量以克服反应活化能,使反应得以进行。
高温条件下,分子间的碰撞频率和能量都会增加,从而提高了反应速率。
其次,反应过程中需要保持适当的压力。
过高的压力可能会使反应物分子间的碰撞过于频繁,导致反应速率下降;而过低的压力则可能使反应物分子间的碰撞减少,同样影响反应速率。
因此,选择合适的压力对于反应的顺利进行至关重要。
此外,催化剂的使用也是影响反应条件的重要因素。
催化剂可以降低反应的活化能,从而在较低的温度和压力下使反应得以进行。
在氧化铁和氢气的反应中,适当的催化剂可以提高反应速率,减少能耗,使反应更加经济高效。
最后,反应物的纯度和浓度也会影响反应条件。
高纯度的反应物可以减少副反应的发生,提高反应的选择性;而适当的浓度则可以使反应物分子间的碰撞更加有效,从而提高反应速率。
综上所述,氧化铁和氢气的反应条件包括高温、适当的压力、催化剂的使用以及反应物的纯度和浓度。
这些条件的合理控制对于反应的顺利进行和产物的质量具有重要影
响。
在实际应用中,需要根据具体情况优化反应条件,以实现最佳的反应效果。

氢气和氧化铁反应条件引言氢气和氧化铁是两种常见的化学物质,在适当的条件下可以发生反应。
本文将探讨氢气和氧化铁反应的条件、机理以及可能的应用。
反应条件在氢气和氧化铁反应中,以下条件对于反应的进行至关重要:温度反应温度是决定反应速率和产物选择性的关键因素之一。
在一定范围内,温度的升高会加速反应速率。
然而,在过高的温度下,可能会引起不可逆的物质变化或发生副反应。
对于氢气和氧化铁的反应,适宜的温度范围为300℃-500℃。
压力压力对于气相反应的平衡状态和速率同样起着重要作用。
通常情况下,增加压力会增加反应速率。
在氢气和氧化铁反应中,适宜的压力范围取决于反应体系的具体情况。
反应物比例在氢气和氧化铁反应中,反应物的比例也是重要的因素之一。
合适的反应物比例有助于实现完全反应,并最大限度地产生所需的产物。
催化剂催化剂可以显著影响反应速率和选择性。
对于氢气和氧化铁反应,常用的催化剂包括金属催化剂、氧化物催化剂等。
反应机理氢气和氧化铁反应的机理可以分为以下几个步骤:吸附氢气分子和氧化铁表面发生物理吸附或化学吸附。
在吸附过程中,氢气分子和氧化铁之间发生相互作用,为后续的反应创造条件。
激活氧化铁表面氧化铁表面的激活是实现反应的关键步骤。
通过与氢气分子的相互作用,氧化铁表面的活性位点被激活,使得氧化铁上存在的吸附氧分子能够参与反应。
氧化铁还原在激活氧化铁表面后,氢气和氧化铁之间发生氧化还原反应。
氢气分子作为还原剂,将氧化铁上的吸附氧分子还原成水。
反应产物氢气和氧化铁反应的主要产物是水。
在反应过程中,还可能生成少量的其他副产物或中间产物。
应用氢气和氧化铁反应在许多领域具有广泛的应用潜力:燃料电池氢气和氧化铁反应可以作为燃料电池的反应系统之一。
通过控制反应条件和催化剂,可以实现高效的能量转化,并产生清洁的电能和水。
氢气制备氢气是一种重要的能源和化工原料。
氢气和氧化铁反应可以提供一种有效的氢气制备方法。
通过优化反应条件和催化剂的选择,可以实现高效率的氢气产生。
氢气炼铁原理
氢气炼铁是一种新型的铁矿石还原技术,该技术利用氢气将铁矿石还原成金属铁,同
时产生的废气是水蒸气。
氢气炼铁具有环保、无害、高效、能源利用率高等优点,是铁矿
石还原领域的一项重大突破。
氢气炼铁原理是基于化学反应原理,将铁矿石中的氧化铁还原成金属铁。
当铁矿石通
过加热进入还原区域时,铁矿石中的氧化铁(Fe2O3)会和氢气(H2)发生气相反应,生成水蒸气(H2O)和金属铁(Fe)。
反应方程式为:Fe2O3 + 3H2 → 2Fe + 3H2O
在此反应过程中,氢气起到还原剂的作用,氧化铁中的氧原子被还原成水蒸气,而剩
余的铁原子则变成金属铁。
氢气炼铁还原反应需要在高温下进行,最适宜的温度范围为600-800°C,当反应温度过低时,反应速率会变慢,氢气不能充分的与铁矿石反应;如果温度过高,会导致副反应
的发生,比如水蒸气会进一步分解成氢气和氧气,使得反应的反应物消耗过快,反应不能
进行得更好。
如今,氢气炼铁技术已经被大量应用于工业生产,其产物质量和环保性能都得到了广
泛的认可。
在氢气炼铁过程中,金属铁是产生的主要产物,但是,还会产生少量的氧化铁、碳和其他副产物。
为了保证生产的品质和环保要求,需要对产物进行分离和处理。
总体来说,氢气炼铁技术的出现为铁矿石还原领域创造了新的机会,其具有高效、环保、无害等优点,未来将有更多的研究与应用。
2006 粉末冶金原理课程I考试题标准答案一、名词解释:( 20 分,每小题 2 分)临界转速:机械研磨时,使球磨筒内小球沿筒壁运动能够正好经过顶点位置而不发生抛落时,筒体的转动速度比表面积:单位质量或单位体积粉末具有的表面积一次颗粒:由多个一次颗粒在没有冶金键合而结合成粉末颗粒称为二次颗粒;离解压:每种金属氧化物都有离解的趋势,而且随温度提高,氧离解的趋势越大,离解后的氧形成氧分压越大,离解压即是此氧分压。
电化当量:这是表述电解过程输入电量与粉末产出的定量关系,表达为每 96500库仑应该有一克当量的物质经电解析出气相迁移:细小金属氧化物粉末颗粒由于较大的蒸气压,在高温经挥发进入气相,被还原后沉降在大颗粒上,导致颗粒长大的过程颗粒密度:真密度、似密度、相对密度比形状因子:将粉末颗粒面积因子与体积因子之比称为比形状因子压坯密度:压坯质量与压坯体积的比值粒度分布:将粉末样品分成若干粒径,并以这些粒径的粉末质量(颗粒数量、粉末体积)占粉末样品总质量(总颗粒数量、总粉末体积)的百分数对粒径作图,即为粒度分布二、分析讨论:( 25 分)1 、粉末冶金技术有何重要优缺点,并举例说明。
( 10 分)重要优点:* 能够制备部分其他方法难以制备的材料,如难熔金属,假合金、多孔材料、特殊功能材料(硬质合金);* 因为粉末冶金在成形过程采用与最终产品形状非常接近的模具,因此产品加工量少而节省材料;* 对于一部分产品,尤其是形状特异的产品,采用模具生产易于,且工件加工量少,制作成本低 , 如齿轮产品。
重要缺点:* 由于粉末冶金产品中的孔隙难以消除,因此粉末冶金产品力学性能较相同铸造加工产品偏低;* 由于成形过程需要模具和相应压机,因此大型工件或产品难以制造;* 规模效益比较小2 、气体雾化制粉过程可分解为几个区域,每个区域的特点是什么?( 10 分)气体雾化制粉过程可分解为金属液流紊流区,原始液滴形成区,有效雾化区和冷却区等四个区域。
氢气还原氧化铁
3H2 + Fe2O高温3H2O +2 Fe 氧化铁应该是你说的这个吧
氢气还原氧化铁:Fe2O3+3H2==高温==2Fe+3H2O
氢气还原四氧化三铁:Fe3O4+4H2==高温==3Fe+4H2O
氢气还原氧化铁的条件的高温不过高温是指600℃以上,如果用酒精喷灯那么它的温度一般就在1000℃左右,如果用酒精灯一般是达不到这个要求的,但如果在酒精灯上加一个灯罩也可以使其温度高于600℃,基本达到1000℃,就可以用于氢气还原氧化铁的实验.
氢气还原氧化铁条件是什么
氢气能否还原氧化铁---能,但是只到+2价就停止了条件都是高温,氢气在高温下可以还原活动性表中在铝之后的所有金属,而且制得的金属相当纯净
氢气还原氧化铁的化学方程式及现象,
氢气还原氧化铁的化学方程式及现象,还有氢气还原氧化铜的现象,镁在二氧化碳中燃烧的化学方程式及现象还有碳还原氧化铁的现象和方程式:
3H2+Fe2O3=(Δ)3H2O+2Fe 有小液滴
H2+CuO=Cu+H2O(Δ)有小液滴,黑色固体逐渐变为红色固体
2Mg+CO2=2MgO+C(点燃) 镁条上剩余白色和黑色粉末
3C+Fe2O3=(高温)2Fe+3CO
注:一般氢气还原金属只需加热,其余的还原剂(C、CO等)一般需高温。