二甲醚燃烧效率分析
- 格式:doc
- 大小:27.50 KB
- 文档页数:5

二甲醚燃料的燃烧性能研究摘要:将二甲醚用作替代能源,是我国抑制高油价影响的重要措施之一。
制取二甲醚的工艺主要有二步法和一步法,其中,对煤深加工并采用二步法制取DME 是我国较为现实、合理的工艺路线。
二甲醚因为本身含氧的缘故,具有燃烧效率高的特点,通过对其燃烧机理进行研究分析发现,同等热量条件下,与天然气、液化石油气等其它燃气相比较,二甲醚燃烧效率提高3.0~5.0%左右,而由于其十六烷值较高,特性与柴油相近的原因,可作为理想的柴油发动机洁净燃料,排放性能优越,因此,推广应用前景十分广阔。
而需要注意的是,由于二甲醚具有富氧燃烧特性,燃烧温度较高,必须关注其氮氧化物的排放情况。
关键词:二甲醚;燃烧机理;富氧燃烧;二步法工艺;一步法;替代;低排放;氮氧化物;能源。
1、引言实施替代能源战略是我国抑制高油价影响的重要国策。
二甲醚作为一种优质、现实的替代能源,产业发展前景十分广阔,从战略的高度,全面、系统、深入地研究二甲醚生产及其利用技术,符合我国能源发展方向,对于我国经济发展、环境保护与生态平衡具有重要意义。
2、二甲醚特性二甲醚分子式为C2H6O,分子量46.07,常压下是一种无色气体,具有与液化石油气(LPG)相似的特性,二甲醚与其它燃料特性比较如下表1。
表1:二甲醚与其它燃料特性比较3、二甲醚的制取与生产物耗二甲醚(DME)可以用天然气和煤作为原料来生产。
中国煤炭储藏量十分丰富,通过对煤深加工办法得到DME是合理途径。
目前国内外DME的生产工艺主要有三种。
(1)二步法以煤炭为原料,先制甲醇,再由甲醇脱水得到DME,该工艺在国内外均已十分成熟。
按目前的工艺条件,一般是2.5吨煤炭(劣质煤)可以合成1吨DME。
a) 先由煤氧吹气化以后得到合成气,其主要组分是CO + H2 ;b) CO + 2H2→CH3OH (甲醇生产)c) CO2 + 3H2→CH3OH+ H2O (甲醇生产)d) CO + H2O→CO2 + H2e) 2CH3OH→CH3OCH3 + H2O (二甲醚生产)(2)一步法据报道,一步法工艺已在美国、日本、丹麦等国开发成功,并进入中试阶段,预期不久将可建设工业化装置。


新燃料——二甲醚(DME)一、引言二甲醚(DME)是一种新型的燃料,被广泛认为是未来的替代能源。
它由甲醇通过催化剂转化而来,具有高能量密度、低排放和可再生等优点。
随着全球能源危机的逐渐加剧,对于寻找替代传统化石燃料的燃料源的需求日益迫切。
二甲醚作为一种可持续发展的替代能源,在环保和经济效益方面具有巨大潜力。
本文将对二甲醚的特性、生产工艺及应用领域进行详细介绍。
二、二甲醚的特性1. 高能量密度二甲醚的能量密度较高,与传统燃料相当。
它的单位体积能输出更多的能量,使其在燃料领域具有广泛的应用前景。
2. 低排放与传统燃料相比,二甲醚的低排放是其最大的优势之一。
燃烧二甲醚产生的废气几乎不含硫、苯等有害物质,大大减少了对环境的污染。
3. 可再生二甲醚是一种可再生能源,它能够通过再生甲醇和二氧化碳等原料进行生产。
与化石燃料相比,二甲醚的生产对环境的影响更小,有助于减少温室气体的排放。
三、二甲醚的生产工艺二甲醚的生产通常需要经过以下几个步骤:1. 甲醇合成甲醇合成是二甲醚生产的关键步骤之一。
通常使用合成气(一氧化碳和氢气的混合物)通过催化剂的作用,在适当的温度和压力条件下进行反应,生成甲醇。
2. 甲醇脱水甲醇脱水是将甲醇转化为二甲醚的重要步骤。
一般采用固体酸催化剂,在适当的温度和压力条件下进行反应,甲醇分子之间的水分子被去除,生成二甲醚。
3. 产品净化二甲醚生产后,还需要进行净化处理。
主要包括蒸馏、过滤和吸附等步骤,以去除其中的杂质和不纯物质,提高产品的纯度和质量。
四、二甲醚的应用领域1. 汽车燃料二甲醚作为一种可替代传统燃料的燃料源,已经在某些国家和地区开始用于汽车燃料。
相比传统汽油和柴油,使用二甲醚作为燃料可以减少尾气排放,降低空气污染。
2. 工业燃料二甲醚还可以作为工业燃料使用。
由于其高能量密度和低排放特性,二甲醚在一些工业领域,如焊接、热处理等方面有着广泛的应用。
3. 化工原料二甲醚可以作为化工原料,用于生产一些化学产品,如气体、液体和固体化学品等。

第29卷第4期Vo l 29,No 4西华大学学报(自然科学版)Journa l o fX i h ua Uni v ersity N atural Sc i e nce2010年7月Ju.l 2010文章编号:1673-159X (2010)04-0039-04收稿日期:2009-11-03基金项目:四川省教育厅资助科研项目(2006ZD028)作者简介:魏远文(1963-),男,教授,硕士,主要研究方向为内燃机替代燃料及排放控制技术。
柴油机燃用不同比例二甲醚/柴油混合燃料性能研究魏远文,袁方恩,张 杨(西华大学交通与汽车工程学院,四川成都610039)摘 要:对柴油机燃用不同比例的二甲醚/柴油混合燃料的燃烧性能进行研究。
研究结果表明:柴油机掺烧二甲醚后,气缸内的压力和温度都有很大程度的降低,燃烧柔和,滞燃期缩短;随着二甲醚比例的提高,柴油机的排放性能有明显改善,NO x 和碳烟排放均下降。
关键词:二甲醚;燃烧;模拟;混合燃料 中图分类号:TK421+.26文献标识码:ASimul ation of Co mbusi on Perfor m ance for D iesels Fueled w ithB l ended Fuel of D iesel/D M E w ith D ifferent R atiosW E I Yuan -w en,YUAN Fang -en ,Z HANG Yang(School of T ransp ortation and A uto m oti ve Engineer i ng,X i hua Uni versity,Chengdu 610039China)Abstract :In t h i s paper ,the co m bustion perfor m ance of diesel eng i ne f ue l ed w ith d ifferent propo rti on of DM E -diese lm i x ture was re -searched .The res u lt show s t hat t he pressure and the te mpera t ure of the cyli nder dec line sharpl y and the co mbusti on beco m es moderatewh ile the eng i ne is fueled w ith the ad m ixture o f D M E and diese.l T he i gnition de l ay per i od is reduced .A nd the e m issi on perfor m ance is si gnificantl y i m proved w ith t he i ncrease i n t he proporti on of DM E content i n the fue ,l f o r exa m ple ,NO x and soot e m issi on decrease .K ey word s :DM E ;co m busti on ;si m ulation ;b l ended fue l二甲醚在常温下是气态且含氧达34.8%,有利于提高柴油机缸内混合气质量和改善燃烧,减少NO X 和微粒排放。

二甲醚燃烧效率分析二甲醚用作燃料替代液化石油气被市场看好,被誉为“二十一世纪的新能源”。
究其主要原因,一方面在于能源价格飙升下二甲醚的价格优势,而另一方面则是其燃烧效率高和燃烧产物排放洁净的显著特点。
将清洁能源二甲醚用作替代能源,是我国抑制高油价影响的重要措施之一。
二甲醚的主要性质与液化石油气相类似,可以替代液化石油气用作城镇燃气。
二甲醚自身含氧,具有燃烧效率高的特点,从二甲醚的燃烧机理研究中发现,同等热量条件下,与天然气、液化石油气等相比,二甲醚燃烧效率提高5%左右,推广应用前景十分广阔。
1.二甲醚的特性二甲醚(DME)分子式为C2H60,分子量46.07,二甲醚是一种比较惰性的非腐蚀性有机物,其主要的理化性质见表1。
在常温、常压下二甲醚是一种无色易燃有轻微醚香味的气体,在空气中的允许浓度为400×10-6。
它具有与液化石油气(LPG)相似的特性。
二甲醚具有一般醚类的性质,二甲醚对金属无腐蚀性,不刺激人体皮肤,不致癌,对大气臭氧层无破坏作用,在对流层中易于降解,长期暴露于空气中,不会形成过氧化物。
所以,二甲醚是一种优良的绿色化工产品。
在同等温度条件下,二甲醚的饱和蒸气压低于液化石油气,其存储、运输、使用等均比液化石油气安全。
二甲醚在空气中的爆炸下限比液化石油气高一倍,因此,在使用过程中,二甲醚作为燃料比液化石油气安全。
虽然二甲醚的热值比液化石油气低,但由于二甲醚自身含氧,在燃烧过程中所需空气量远低于液化石油气,从而使得二甲醚的预混气热值和理论燃烧温度都高于液化石油气。
二甲醚具有优良的混溶性,可以同大多数极性和非极性的有机溶剂混溶,例如汽油、四氯化碳、丙酮、氯苯和乙酸乙酯。
较易溶于丁醇,对多醇类的溶解度不佳。
常压下在100mL水中可溶解3700mL二甲醚,但是加入少量的助剂后就可与水以任意比例互溶。
二甲醚燃烧时火焰略带亮光。
常温下二甲醚难于活化,但长期储存或受日光直接照射,可形成不稳定过氧化物,这种过氧化物能自燃或自发的爆炸或受热后爆炸。
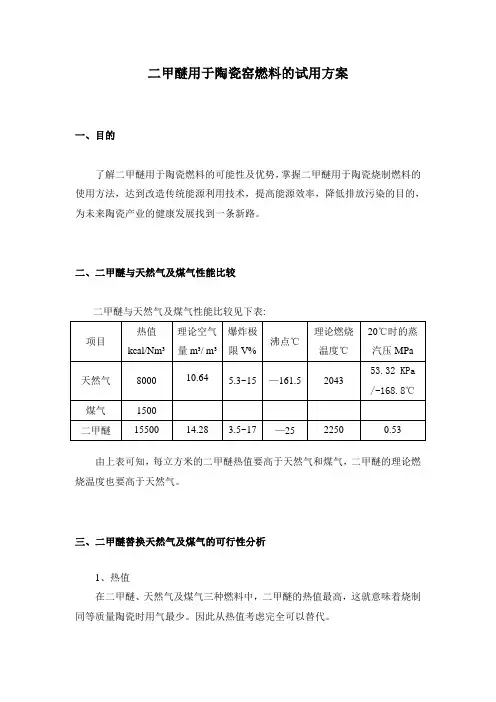
二甲醚用于陶瓷窑燃料的试用方案一、目的了解二甲醚用于陶瓷燃料的可能性及优势,掌握二甲醚用于陶瓷烧制燃料的使用方法,达到改造传统能源利用技术,提高能源效率,降低排放污染的目的,为未来陶瓷产业的健康发展找到一条新路。
二、二甲醚与天然气及煤气性能比较二甲醚与天然气及煤气性能比较见下表:由上表可知,每立方米的二甲醚热值要高于天然气和煤气,二甲醚的理论燃烧温度也要高于天然气。
三、二甲醚替换天然气及煤气的可行性分析1、热值在二甲醚、天然气及煤气三种燃料中,二甲醚的热值最高,这就意味着烧制同等质量陶瓷时用气最少。
因此从热值考虑完全可以替代。
2、气体压力20℃时二甲醚饱和蒸汽压为0.53MPa,高于目前皇冠陶瓷所使用的燃气压力,调整后完全可以利用目前的燃料供给系统。
3、所需空气量在等热值情况下,二甲醚的耗氧量要低于天然气及煤气,因此完全可以替换。
4、燃烧温度二甲醚的理论燃烧温度要高于天然气和煤气,完全可以保证陶瓷烧制所需要的温度。
因此,从燃料的燃烧性能考虑,二甲醚完全可以替代目前所使用的陶瓷烧制燃料。
四、烧嘴问题国内外均把燃气分为三大类。
第一类是人工燃气,包括①固体燃料干馏煤气,如焦炉煤气、连续式直立炭化炉煤气、立箱炉煤气; ②固体燃料气化煤气,如发生炉煤气、水煤气、压力气化煤气; ③两段式完全气化炉煤气,如水煤气型两段炉煤气、发生炉型两段炉煤气; ④油煤气,如重油蓄热催化裂解煤气、重油蓄热热裂解煤气、重油部分氧化法煤气;⑤高炉煤气。
第二类是天然气,包括气田气、油田伴生气、凝析气田气、矿井气。
第三类是液化石油气。
从理论上讲,不同类燃气更换时,要更换或重新调整烧嘴。
这主要是从下述原因考虑:(1) 热输入太高或太低。
(2) 预混烧嘴回火、预混或非预混烧嘴离焰。
为使燃气烧嘴能安全正常运行,需保持燃烧火焰的稳定性。
(3) 不完全燃烧、析炭。
为了使燃气烧嘴能节省燃料,燃气替换后,燃气燃烧过程中不应有析炭或燃烧产物中CO 含量过高的情况,这不仅有利于节约能源,降低生产成本,而且也利于防止CO 中毒,保护环境不被污染。


液化石油气、天然气、甲醇、乙醇、二甲醚五种车用燃料的对比分析前言我国是一个富煤、贫油、有气的国家,随着经济的飞速发展,国内石油供需矛盾日显突出,对进口的依存度逐年增加,2000年净进口7000万吨,2001年达到8000万吨,2003年净进口石油达到创记录的9779万吨,占我国能源需求总量的40%以上。
但是,我国天然气总储量为38万亿立方米、煤炭总储量为1145亿吨。
因此推广应用清洁替代燃料,作为石油资源的补充,对我国已具有非常重要的战略意义。
就针对车用燃料而言,目前国际国内车用清洁燃料主要有以下五种:液化石油气、天然气、甲醇汽油、乙醇汽油、二甲醚。
它们各有自己的特性和优劣式,但归根结底谁是现阶段发展的主题、谁是今后发展的趋势以及使用情况怎样、现有哪些企业在运作此类项目等等,这都是我们应该也是很有必要了解的。
下面就从燃料的基本介绍、优缺点、使用效果、发展情况、运作企业、经济分析六个方面加以阐述和分析:一、液化石油气液化石油气(Liquefied Petroleum Gas ,简称LPG)是以三个或四个碳原子的烃类(如丙烷、丙烯、丁烷、丁烯)为主的混合物,常温常压下是无毒、无色、无味的气体,具有辛烷值高、抗爆性能好、热值高、储运压力低等优点,是一种性能优良的汽车代用燃料。
1、基本介绍液化石油气是一种干净高效的汽车燃料,它具有如下优点:①比汽油便宜;②国际国内丰富的储量;③丁烷和丙烷混合可以形成一定量的辛烷,使液化气有较好的抗爆性。
液化气还有许多操作优点:①几乎可以完全充分地燃烧;②和汽油车的尾气排放量相比,对环境污染小;③可满足各国的排放标准;④引擎部件的碳沉淀极小,因此液化气引擎运转更自如、寿命更长,比汽油机和柴油机需要更少的日常维修保养;⑤由于燃料是气态,寒冷天气更易启动;⑥专用天然气引擎或两用燃料汽油机等各种火花塞引擎都能以液化气为燃料;⑦液化气在注入引擎气缸前是气态并与空气混合,所以寒冷天气启动时,气缸壁的润滑薄膜不会被洗掉,发动机油不会出现稀释现象;液化气的缺点:①相对较高的更换费用;②若用一些低质的液化气,系统需要定期调试以维持恰当的混合状态,并易发生气阻现象;③极度寒冷天气下启动受到液化气混合中所需丁烷含量的限制(因为燃料中丁烷含量增加,原有压力下降,在摄氏零度时,丁烷就不能转变成气态,而液化气在气态状态下才能燃烧);2、液化气汽车(LPGV)的优缺点液化气汽车的优点:①可以替代十分短缺的汽、柴油随着我国国民经济的飞速发展,汽车保有量急剧增长;同时,我国的石油产储量不足,因此大力发展液化石油气汽车是一条石油资源补充的可行之路。

二甲醚理化性质及用途二甲醚(CH3OCH3),是一种无色、易挥发的液体,具有甜味,是醚类化合物中最简单的一种。
下面将详细介绍二甲醚的理化性质及其常见的用途。
1.理化性质:1.1.外观:二甲醚是一种无色透明液体,具有特殊的气味,类似于乙醚。
1.2.熔点和沸点:二甲醚的熔点为-138.6°C,沸点为-23°C。
1.3. 密度:二甲醚的密度为0.79 g/cm³。
1.4.溶解性:二甲醚在水中的溶解度较低,可溶于乙醇、醚、苯等有机溶剂。
1.5.燃烧性:二甲醚是易燃液体,其燃烧产生的火焰呈蓝色,剧烈燃烧时容易爆炸。
1.6.化学性质:二甲醚的化学属性较为稳定,不与空气中的氧气发生反应,但可以被氧化剂如酸性高锰酸钾氧化。
2.用途:2.1.麻醉剂:二甲醚可以作为麻醉剂使用,其麻醉作用较强,使人体迅速陷入无痛无感的状态。
然而,由于其易燃性和低爆炸限制浓度,二甲醚已很少被用作麻醉剂,而被更安全的醚类和氟化碳类替代。
2.2.燃料组分:二甲醚是一种优良的燃料组分,可以与汽油混合使用,以提高汽油的辛烷值,增加燃烧效率。
目前,二甲醚作为清洁能源的替代品,被广泛应用于汽油和柴油发动机中,以减少有害废气的排放,并改善空气质量。
2.3.化工原料:二甲醚是许多化工合成的重要原料。
它可作为溶剂、反应介质以及一些有机合成的催化剂。
例如,二甲醚可用于制备酯类、醚类化合物、胺类化合物等,广泛应用于有机合成工业中。
2.4.医药领域:二甲醚也被用作一些药物的溶剂或质量控制试剂,同时也有一些药物是以二甲醚为主要成分制成的。
例如,一些药物的口服液、喷雾剂等制剂中含有二甲醚。
2.5.实验室用途:二甲醚是常见的实验室溶剂之一,可用于溶解或洗涤溶解性高分子化合物,在有机合成实验中常用作反应溶剂。
此外,二甲醚还可以用作提取剂、浸渍剂等。
总结:二甲醚具有许多重要的理化性质和广泛的应用领域。
它是一种无色、易挥发的液体,在麻醉剂、燃料组分、化工原料、医药领域和实验室等方面都有着重要的用途。

一、概况介绍(一)二甲醚又称甲醚,简称DME,在常压下是一种无色气体或压缩液体,具有轻微醚香味。
相对密度(20℃)0.666,熔点-141.5℃,沸点-24.9℃,室温下蒸气压约为0.5MPa,与石油液化气(LPG)相似。
溶于水及醇、乙醚、丙酮、氯仿等多种有机溶剂。
易燃,在燃烧时火焰略带光亮,燃烧热(气态)为1455kJ/mol。
常温下DME具有惰性,不易自动氧化,无腐蚀、无致癌性,但在辐射或加热条件下可分解成甲烷、乙烷、甲醛等。
表1.2 不同温度下二甲醚蒸气压二甲醚是醚的同系物,但与用作麻醉剂的乙醚不一样,毒性极低;能溶解各种化学物质;由于其具有易压缩、冷凝、气化及与许多极性或非极性溶剂互溶特性,广泛用于气雾制品喷射剂、氟利昂替代制冷剂、溶剂等,另外也可用于化学品合成,用途比较广泛。
(二)二甲醚的毒性健康危害:对中枢神经系统有抑制作用,麻醉作用弱。
吸入后可引起麻醉、窒息感。
对皮肤有刺激性。
毒理学资料及环境行为毒性:二甲醚的毒性很低,气体有刺激及麻醉作用的特性,通过吸入或皮肤吸收过量的此物品,会引起麻醉,失去知觉和呼吸器官损伤。
表1.3 二甲醚的毒性吸入对象吸入量不良反应甲醚复合燃料小鼠吸入 225.72g/ m3 麻醉浓度猫吸入 1658.85g/ m3 深度麻醉人吸入 154.24g/ m3×30min 轻度麻醉人吸入 940.50g/ m3 有极不愉快的感觉、有窒息感急性毒性:LC50308000mg/m3(大鼠吸入);人吸入154.24g/m3×30分,轻度麻醉。
危险特性:易燃气体。
与空气混合能形成爆炸性混合物。
接触热、火星、火焰或氧化剂易燃烧爆炸。
接触空气或在光照条件下可生成具有潜在爆炸危险性的过氧化物。
气体比空气重,能在较低处扩散到相当远的地方,遇明火会引着回燃。
若遇高热,容器内压增大,有开裂和爆炸的危险。
二甲醚的安全及处理措施(三)泄漏应急处理迅速撤离泄漏污染区人员至上风处,并进行隔离,严格限制出入。

「液化石油气天然气甲醇乙醇二甲醚五种车用燃料的对比分析」液化石油气、天然气、甲醇、乙醇和二甲醚是目前常用的车用燃料。
这五种燃料在燃烧效果、环境友好性以及经济性等方面存在一定的差异。
下面将对它们进行比较分析。
首先是燃烧效果。
液化石油气和天然气都是相对较高能量的燃料,其能量密度较高,燃烧效率也相对较高。
甲醇和乙醇的燃烧效果相对较低,它们的能量密度较低,并且在燃烧过程中产生较多的水蒸气,影响燃烧效率。
二甲醚的燃烧效果介于液化石油气和醇类燃料之间。
其次是环境友好性。
液化石油气和天然气都是较为环保的燃料,其燃烧过程中几乎不产生颗粒物和硫化物,燃烧产物中的二氧化碳含量也较低。
甲醇和乙醇虽然可以降低碳排放,但是它们在燃烧过程中会产生甲醛等有害物质,并且乙醇的生产也会对粮食资源造成一定的压力。
二甲醚燃烧产物中含有一定量的一氧化碳,对环境也有一定的影响。
再次是经济性。
液化石油气和天然气价格相对较低,且市场覆盖范围广,加之石油市场较为成熟,因此使用成本比较低。
甲醇、乙醇和二甲醚的价格相对较高,其中甲醇和乙醇的生产成本较高,且市场发展相对较新,因此使用成本较高。
综合比较以上几个方面,对于车用燃料的选择,液化石油气和天然气是较为理想的选择。
它们具有较高的燃烧效率和较低的排放,价格相对较低,市场覆盖广。
对于醇类燃料,由于其价格较高以及对环境和粮食资源的影响,使用成本相对较高。
对于二甲醚燃料,虽然其燃烧效果介于液化石油气和醇类燃料之间,但是其二氧化碳排放量较高,对环境没有明显的优势。
总结来说,液化石油气和天然气是较为理想的车用燃料,它们在燃烧效果、环境友好性和经济性方面具有优势。
而甲醇、乙醇和二甲醚的使用成本较高,对环境和粮食资源有一定的影响。
因此,在选择车用燃料时要综合考虑上述因素。
燃烧科学与技术Journal of Combustion Science and Technology 2017,23(2):130-134DOI 10.11715/rskxjs.R201601010收稿日期:2016-04-15.基金项目:国家自然科学基金资助项目(51576201);广东省自然科学基金资助项目(2015A030312007;2015A030313716). 作者简介:郭常青(1978— ),男,博士,副研究员. 通讯作者:郭常青,guocq@.Pt 基催化剂二甲醚催化燃烧性能郭常青1,叶 文1,李青山2,闫常峰1,伊立其1(1. 中国科学院广州能源研究所,广州 510640;2. 中国电力工程顾问集团东北电力设计院有限公司,长春 130021)摘 要:利用二甲醚催化燃烧作为二甲醚重整制氢的热源可有效简化系统和提高效率,通过对比不同载体、不同Pt 负载量以及不同助剂对Pt 催化剂的性能影响,筛选出了最适合二甲醚低温起燃催化燃烧的催化剂.研究发现,HZSM-5型分子筛作为二甲醚催化燃烧载体具有较好的起燃特性,同时加入助剂Ce 可以显著提高催化剂活性,起燃温度相对Pt/HZSM-5降低了58,℃.Pt-Ce/HZSM-5催化剂的二甲醚起燃特性实验表明,在过量空气系数为1.1时具有最佳的起燃特性.对Pt-Ce/HZSM-5催化剂进行了稳定性实验,100,h 内催化剂性能稳定.关键词:二甲醚;催化燃烧;Pt-Ce/HZSM-5中图分类号:TK91 文献标志码:A 文章编号:1006-8740(2017)02-0130-05Performance of Pt -Based Catalysts for Dimethyl EtherCatalytic CombustionGuo Changqing 1,Ye Wen 1,Li Qingshan 2,Yan Changfeng 1,Yi Liqi 1(1.Guangzhou Institute of Energy Conversion ,Chinese Academy of Science ,Guangzhou 510640,China ; 2.Northeast Electric Power Design Institute Co.,Ltd .of China Power Engineering Consulting Group ,Changchun 130021,China )Abstract :Exo thermic dimethyl ether (DME )co mbustio n can be thermally co upled with endo thermic steam re-fo rming to decrease reacto r size and increase energy efficiency .In this study ,Pt-based catalysts (with different carriers ,Pt lo adings ,and co -catalysts )were prepared ,and the dimethyl ether light-o ff characterirstics at lo w temperature were investigated .The experimental results sho wed that the catalyst suppo rts o f HZSM-5 exhibited better light-off performance than others ,and the co-catalysts of Ce can improve the catalytic activity by reducing the ignition temperature by 58℃ compared with Pt/HZSM-5 catalyst .In addition ,the experiment on DME cata-lytic combustion over Pt-Ce/HZSM-5 demonstrated that higher combustion efficiency can be achieved at the excess air ratio of 1.1,and the catalyst Pt-Ce/HZSM-5 maintained good activity and stability after 100h in the stability test.Keywords :d imethyl ether (DME );catalytic combustion ;Pt-Ce/HZSM-5氢燃料电池高效环保,不仅具有发电效率高、启动迅速、产生噪音小和携带方便等优点,而且可以减郭常青等:Pt 基催化剂二甲醚催化燃烧性能 燃烧科学与技术— 131 —少温室气体的排放[1].二甲醚(DME )是一种常温下为气体的惰性、无色、无毒、无腐蚀性的物质,具有高H/C 比,其物理性质与液化石油气非常相似,便于利用现有设备储运,因而被视为一种较理想的重整制氢原料气.二甲醚水蒸气重整本身是一种强吸热反应,需要外部提供热量,采用二甲醚作为燃料燃烧供热将简化重整制氢系统,提高能量利用率,并且符合氢燃料电池中对安全性能的要求.因此研究二甲醚的催化燃烧特性,寻求一种高效稳定的二甲醚催化燃烧催化剂对二甲醚制氢系统有着重要的意义.在作为汽车发动机燃料方面,二甲醚被认为是最有发展潜力的清洁燃料之一.研究表明,二甲醚常规火焰燃烧过程中起燃温度高于400℃,燃烧温度在600℃以上[2].其燃烧温度高于二甲醚水蒸气重整的反应温度,同时在该温度下燃烧产物除了CO 2、CO 和H 2O 外,还会生成甲醛、甲酸、甲酸甲酯等对环境有害的污染物.催化燃烧是典型的气-固相催化反应,具有以下优势:①通过催化剂的作用降低了反应的活化能,起燃温度低,燃烧温和稳定,安全性高;②污染物排放水平低.目前在各类重整制氢系统中,甲烷、甲醇和氢气的催化燃烧的研究较为广泛,所采用的催化剂包括贵金属类催化剂、钙钛矿型氧化物、掺杂六铝酸盐和过渡金属氧化物等,而关于二甲醚的催化燃烧研究相对较少.Ishikawa 等[3-5]比较了贵金属Pt 、Pd 、Ru 上的二甲醚催化燃烧反应,其催化活性为Pt >Pd >Ru ;Tang 等[6]通过TPR 、XPS 等一系列表征发现,采用改进的多元醇法制备的Pt/CeO 2催化剂对二甲醚催化燃烧相对于甲醛液相还原法制备的催化剂有着更好的催化活性.王圆媛等[7]通过考察不同贵金属负载量的Pd/Al 2O 3和Pt/Al 2O 3催化剂的活性以及浸渍顺序对Pd-Pt/Al 2O 3双金属负载催化剂活性的影响,并测试了贵金属负载摩尔比不同的双金属负载催化剂的活性,其认为综合考虑经济性和制备过程,Pt 负载量为0.025%的催化剂在175℃左右即可将DME 完全催化燃烧.Yu 等[8-10]合成了以一维纳米为主的氧化锰八面体分子筛进行二甲醚催化燃烧.在制备的OMS-2催化剂上,二甲醚催化燃烧的起燃温度T 10为180℃,而完全燃烧温度T 90为190℃,反应产物仅有CO 2和H 2O ,实现了低温清洁燃烧.基于以上研究,本文以Pt 催化剂为基础,采用浸渍法研究不同的载体、Pt 负载量和不同过渡金属助剂对催化燃烧性能的影响,寻求负载量低、起燃温度低、稳定性能好的高活性二甲醚燃烧催化剂.1 实验部分1.1 材料与试剂本实验所使用的催化剂载体分别为HZSM-5(南开大学催化剂有限公司)、MCM-41(南开大学催化剂有限公司)、γ-Al 2O 3(国药集团化学试剂有限公司,经过筛分得到40~60目(对应粒径0.250~0.425mm )粉末待用)和ZrO 2(国药集团化学试剂有限公司). H 2(PtCl 6)PtC 2O (分析纯,百赛勒化学技术有限公司)配制为水溶液,溶液质量浓度(以Pt 计)为0.0376g/mL . 1.2 实验装置与分析仪器二甲醚催化燃烧的催化剂活性评价在固定床反应器装置中进行,实验装置如图1所示,包括温度控制系统、反应器、原料供给系统、数据采集仪器及分析设备.其中反应器为管式固定床反应器,内径8mm ,长200mm ,采用电加热炉加热并通过温度控制器控制炉内温度,数据采集卡(ADAM-4018)实时记录温度变化曲线.反应产物首先通过放置在冷水浴内的孟氏洗瓶以冷凝气体中的水蒸气,再通过装有干燥剂的U 形管,U 形管内放置变色硅胶,通过观察其颜色以确认气体被充分干燥.干燥后的气体进皂膜流量计测量流量后,送入气相色谱仪(型号:GC522)进行在线检测,检测反应产物组分含量,色谱柱为Porapak T 填充柱和TDX-01填充柱.图1 二甲醚催化燃烧催化剂性能评价实验装置1.3 催化剂制备方法首先分别将计量的添加剂X (X 为Cr 、Co 、Ce 或Fe )的硝酸盐溶液等体积浸渍于计量的HZSM-5 (SiO 2和Al 2O 3质量比为25)分子筛上,充分拌匀后超声处理0.5h ,再于室温下存放12h ,之后经过110℃烘箱中干燥12h ,550℃马弗炉中焙烧5h ,即得到改性载体X /HZSM-5.然后将计量的氯铂酸溶液等体积分别浸渍于HZSM-5和X /HZSM-5载体上,经过燃烧科学与技术第23卷 第2期— 132 —上述相同的操作步骤即得到负载型Pt 催化剂.为了比较负载Pt/HZSM-5催化剂与其他不同载体的Pt 催化剂在相同的测试条件下二甲醚催化燃烧的活性,Pt/ZrO 2、Pt/MCM-41和Pt/Al 2O 3催化剂也按照上述实验程序和参数制得. 1.4 催化剂活性评价二甲醚催化燃烧反应首先在管式固定床反应器中进行转化性能测试,催化剂的填装量为50mg (采用FA2204B 电子天平测量),为了避免管式炉稳态性能实验中出现温度梯度和浓度梯度造成“飞温”,催化剂需要用石英砂进行稀释,石英砂与催化剂的稀释比例(质量比)为50∶1,二甲醚在反应气体中的体积分数为2%,在爆燃极限之下[11].反应前通入流量为150mL/min 的H 2/N 2混合气(ϕ(H 2)=5%),450℃还原2h ,再通入二甲醚与氧气/氩气混合气(体积分数分别为ϕ(DME )=2%、ϕ(O 2)=19.6%、ϕ(Ar )=78.4%),在一定温度下进行反应,反应稳定1h 后进行采样分析.二甲醚催化燃烧性能测试实验中,二甲醚的转化率为考察催化剂性能的主要评价指标.二甲醚转化率为DME,in DME,outDME DME,in100%Q Q y Q −=×为了能够更直观地显示催化剂催化燃烧二甲醚的性能,本文引入T 10(起燃温度)、T 50(中转温度)作为特征温度来表示二甲醚转化率分别达到10%和50%时的燃烧温度,特征温度越低,其催化剂催化二甲醚燃烧的活性也就越高.二甲醚燃烧特性的实验中,催化剂填装量为0.2g ,加入少量石英砂以平稳气流.反应前仍通入还原气还原催化剂2h ,再通入二甲醚与空气,二甲醚与空气的比例由过量空气系数决定,气体流量由北京七星华创电子股份有限公司D-07气体质量流量控制器控制.反应全程由ADAM-4018数据采集卡实时记录温度变化曲线.2 结果与讨论2.1 不同载体对Pt 催化剂二甲醚催化燃烧的影响图2为不同载体的Pt 催化剂催化燃烧二甲醚的性能(空速为77000mL/(g ·h )),表1为不同催化剂载体、Pt 负载量及助剂的二甲醚特征温度,由图2和表1可以看出,本文制备的各种催化剂的起燃温度和中转温度均明显低于非催化燃烧的相应温度.在所对比的4种载体中,Pt/Al 2O 3的T 10和T 50最高,分别为185℃和215℃,Pt/ZrO 2和Pt/MCM-41载体的特征温度较低,相对于Al 2O 3载体有一定的促进作用,而Pt/HZSM-5的T 10和T 50值最低,其起燃温度和中转温度分别为139℃和157℃,与Pt/Al 2O 3相比分别降低了46℃和58℃.这表明HZSM-5载体相对于Al 2O 3而言具有比较明显的促进作用.图2 不同载体的Pt 催化剂催化燃烧二甲醚的性能 表1不同催化剂载体、Pt 负载量及添加剂的二甲醚特征温度比较催化剂 T 10/℃ T 50/℃Pt/ZrO 2 144 165Pt/MCM-41 174 171 Pt/Al 2O 3 185 215 Pt/HZSM-5 139 157 0.5%,Pt/HZSM-5 151 166 1.0%,Pt/HZSM-5 139 157 1.5%,Pt/HZSM-5 135 154 Pt-Ce/HZSM-5 81 86 Pt-Fe/HZSM-5 111 116 Pt-Co/HZSM-5 115 118Pt-C r /HZSM-5 132 1412.2 Pt 负载量对二甲醚催化燃烧的影响采用HZSM-5分子筛作为载体时,不同Pt 负载量(质量分数)对二甲醚催化燃烧反应性能的影响见图3(空速77000mL/(g ·h )).随着Pt 负载量从0.5%增大到1.5%,对应的特征温度逐渐减小,催化剂的催化二甲醚燃烧活性逐渐升高.通过仔细比较不同Pt 负载量的特征温度,可以发现当Pt 负载量从0.5%增加到1.0%时,T 10和T 50分别从151℃、166℃降至139℃、157℃.但随着Pt 负载量由1.0%增加到1.5%时,上述各个温度则下降有限,T 10和T 50分别下降了4℃和3℃.这可能是由于当催化剂中Pt 负载量从0.5%增加至1.0%时,催化剂表面Pt 在分子筛上能够得到较好的分散,金属分散度也明显增大,而当Pt 负载量从1.0%增加至1.5%时,催化剂表面Pt 过分堆积,金属分散度又有所下降,使其活性位未能充分暴露在表面上.2.3 助剂对Pt/HZSM -5催化剂进行二甲醚催化燃烧的影响选择合适的助剂可显著提高催化剂活性,本文制郭常青等:Pt 基催化剂二甲醚催化燃烧性能 燃烧科学与技术— 133 —图3 不同Pt 负载量的Pt/HZSM -5催化剂催化燃烧二甲醚的性能备了分别添加质量分数为1.0% Ce 、Fe 、Co 、Cr 的Pt/HZSM-5催化剂,考察其对Pt/HZSM-5催化活性的影响.由图4可以看出,在添加了不同过渡金属之后,Pt/HZSM-5催化剂的活性均得到了一定的提高.特别是当添加助剂Ce 后,T 10和T 50分别从139℃、157℃降低到81℃、86℃.从二甲醚起燃到完全转变的过程中,Pt-Ce/HZSM-5表现出了最高的催化活性.与CO 催化燃烧类似,Ce 可以作为燃烧型催化剂的助催剂,是由于Ce 具有变价性质,使得Ce 化合物的氧化-还原状态容易转化[12].Ce 的氧化物主要以CeO 2和Ce 2O 3形态存在,Ce 2O 3不稳定,易氧化为CeO 2.CeO 2中的晶格氧有传递表面氧的能力,可为催化体系提供活性氧,同时体相中氧物种会不断地向其表面迁移,使CeO 2具有供氧-储氧能力[13-14].Ce 的存在有效延缓了反应过程中催化剂金属分散度和金属比表面积的下降,抑制了活性组分的烧结及表面活性位的减小,提高了催化剂的热稳定性.因此可以认为Ce 的加入虽然降低了Pt 总比表面积,但却促进了活性组分在载体表面富集,提高了催化剂的有效活性表面积[15].通过以上分析可以看出Ce 对二甲醚催化燃烧的作用是非常明显的.图4 添加不同助剂的Pt/HZSM -5催化剂催化燃烧二甲醚性能曲线2.4 过量空气系数对Pt -Ce/HZSM -5二甲醚催化燃烧的影响图5考察了不同过量空气系数时二甲醚的起燃特性,其中热电偶采集点在催化剂的表层,催化剂取0.2g 在固定床反应器中进行反应.实验空速随着过量空气系数的改变而改变,不同过量空气系数对应的实验空速如表2所示.图5 过量空气系数对Pt -Ce/HZSM -5二甲醚催化燃烧影响表2 不同过量空气系数对应的实验空速过量空气系数空速(mL ·g -1·h -1)1.0 48,000 1.1 52,5001.2 57,000 1.3 61,500 1.4 66,000 1.5 70,500由图5可以看出,在过量空气系数为1.0时,燃烧稳定后的温度相对较低,这可能是由于在理论配比的情况下,部分二甲醚没有与氧气混合均匀而造成了部分二甲醚燃烧不完全.过量空气为1.1时,燃烧稳定后温度最高,这时候空气过量,二甲醚得到了充分的燃烧.继续增加过量空气系数,温度开始逐步降低,这是由于反应空速进一步增加,导致不参加反应的空气量增加,被气流带走的无效热量增多,当过量空气系数升至1.5时,燃烧温度甚至低于过量空气系数为1.0时的温度.因此综合分析后可知,过量空气系数在1.1时可以达到最佳的供热效率. 2.5 催化剂稳定性分析图6是催化剂Pt-Ce/HZSM-5的稳定性测试 (T =300℃,空速为5250mL/(g ·h ),过量空气系数为1.1),为了避免由于气体分布不均产生催化剂局部温度过高,导致催化剂局部烧结,反应气体空速控制在一个较低水平.由图可知该催化剂在反应100h 后图6 Pt -Ce/HZSM -5催化燃烧二甲醚的稳定性分析燃烧科学与技术第23卷 第2期— 134 —仍然表现出较好的稳定性,二甲醚转化率一直保持在95%以上.3 结 论(1) 在所选用的4种催化剂载体中,HZSM-5载体负载的Pt 催化剂起燃温度最低,具有最高的二甲醚低温燃烧性能.Pt/ HZSM-5的起燃温度(T 10)和中转温度(T 50)分别为139℃和157℃.(2) Pt 的负载量从0.5%提升至1.0%时催化性能有明显提升,但进一步提高Pt 负载量至1.5%时,效果则不明显. (3) Co 、Ce 、Fe 、Cr 等金属添加剂均有助于进一步提升催化剂性能,其中添加Ce 对Pt/HZSM-5的性能提升有着显著作用.(4) 过量空气系数在1.1时可达到最佳供热效率,Pt-Ce/HZSM-5在100h 内催化活性无明显降低. 参考文献:[1] Deluga G A ,S alge J R ,S chmidt L D ,et al. Renew-able hydrogen from ethanol by autothermal reform-ing [J ]. Science ,2004,303(5660):993-997.[2] Japar S M ,Wallington T J ,RichertJ F O ,et al. Theatmospheric chemistry of oxygenated fuel additives :t-butyl alcohol ,dimethyl ether and methyl t-butyl ether [J ]. Int ernat ional Journal of Chemical Kinet ics ,1990,22(12):1257-1269.[3] Ishikawa A ,Iglesia E. Dimethyl ether combustion cata-lyzed by supported Pd ,Rh ,and Pt clusters :S ite re-quirements and reaction pathways [J ]. Journal of Cataly-sis ,2007,252(1):49-56.[4] Ishikawa A ,Iglesia E. Bifunctional pathways mediatedby Pt clusters and Al 2O 3 in the catalytic combustion of dimethyl ether [J ]. Chemical Communica t ions ,2007(28):2992-2993.[5] Ishikawa A ,Neurock M ,Iglesia E. S tructural require-ments and reaction pathways in dimethyl ether combus-tion catalyzed by supported Pt clusters [J ]. Journal of the American Chemical Socie y ,2007,129(43):13201-13212.[6] Tang Xiaolan ,Zhang Baocai ,Li Yong ,et al. S truc-tural features and catalytic properties of Pt/CeO 2 catalysts prepared by modified reduction-deposition tech-niques [J ]. Catalysis Letters ,2004,97(3/4):163-169.[7] 王圆媛,徐 航,冯冬梅,等,低负载贵金属催化剂对二甲醚催化燃烧的催化活性[J ]. 过程工程学报,2011,11(1):148-152.Wang Yuanyuan ,Xu Hang ,Feng Dongmei ,et al. Catalytic activity of low-loading Pd and Pt supported catalysts for combustions of dimethyl ether [J ]. The Chi-nese Journal of Process Engineering ,2011,11(1):148-152(in Chinese ).[8] Na X H ,Yu L ,S un M ,et al. Preparation of OMS -2/cordierite monolithic catalysts and their catalytic per-formance for dimethyl ether combustion [J ]. Chinese Journal of Catalysis ,2010,31(8):1019-1024.[9] Yu L ,Diao G Q ,Ye F ,et al. Dimethyl ether catalyticcombustion over manganese oxides with different struc-tures [J ]. Advanced Materials Research ,2011(146/147):1482-1485.[10] Yu L ,Diao G Q ,Ye F ,et al. Promoting effect of Ce inCe/OMS-2 catalyst for catalytic combustion of dimethyl ether [J ]. Catalysis Letters ,2011,141(1):111-119.[11] 陈 欣,毕胜山,吴江涛. 二甲醚、甲烷及二甲醚/甲烷混合物的爆炸极限实验研究[J ]. 工程热物理学报,2009,30(8):1267-1270.Chen Xin ,Bi S hengshan ,Wu Jiangtao. The explosion limit of dimethyl ether ,methane and their mixture [J ]. Journal of Engineering Thermophysics ,2009,30(8):1267-1270(in Chinese ).[12] Oh S H ,Eickel C C. Effects of cerium addition on COoxidation-kinetics over alumina-supported rhodium cata-lysts [J ]. Journal of Ca alysis ,1988,112(2):543-555.[13] 赫崇衡,朱 明,金国林,等. 氧化铈对Pd 催化剂氧化活性和热稳定性的影响[J ]. 应用化学,2004,21(2):154-158.He Chongheng ,Zhu Ming ,Jin Guolin ,et al. Effects of cerium oxide on the oxidation activity and thermal stability of Pd/Al 2O 3 catalysts [J ]. Chinese Journal of Applied Chemis t ry ,2004,21(2):154-158(in Chi-nese ).[14] Zhu H Q ,Qin Z F ,Shan W J ,et al. Low-temperatureoxidation of CO over Pd/CeO 2-TiO 2 catalysts with differ-ent pretreatments [J ]. Journal of Ca t alysis ,2005,233(1):41-50.[15] 王 帆. Ce 对Pd-Pt/Al 2O 3催化剂甲烷催化燃烧性能的影响[J ]. 科技传播,2013(18):117-118.Wang Fan. The influence of Ce addition of Pd-Pt/Al 2O 3 catalyst on the performance of catalytic methane combus-tion [J ]. Public Communica ion of Science & Techno-logy ,2013(18):117-118(in Chinese ).。
二甲醚燃烧效率分析二甲醚用作燃料替代液化石油气被市场看好,被誉为“二十一世纪的新能源”。
究其主要原因,一方面在于能源价格飙升下二甲醚的价格优势,而另一方面则是其燃烧效率高和燃烧产物排放洁净的显著特点。
将清洁能源二甲醚用作替代能源,是我国抑制高油价影响的重要措施之一。
二甲醚的主要性质与液化石油气相类似,可以替代液化石油气用作城镇燃气。
二甲醚自身含氧,具有燃烧效率高的特点,从二甲醚的燃烧机理研究中发现,同等热量条件下,与天然气、液化石油气等相比,二甲醚燃烧效率提高5%左右,推广应用前景十分广阔。
1.二甲醚的特性二甲醚(DME)分子式为C2H60,分子量46.07,二甲醚是一种比较惰性的非腐蚀性有机物,其主要的理化性质见表1。
在常温、常压下二甲醚是一种无色易燃有轻微醚香味的气体,在空气中的允许浓度为400×10-6。
它具有与液化石油气(LPG)相似的特性。
二甲醚具有一般醚类的性质,二甲醚对金属无腐蚀性,不刺激人体皮肤,不致癌,对大气臭氧层无破坏作用,在对流层中易于降解,长期暴露于空气中,不会形成过氧化物。
所以,二甲醚是一种优良的绿色化工产品。
在同等温度条件下,二甲醚的饱和蒸气压低于液化石油气,其存储、运输、使用等均比液化石油气安全。
二甲醚在空气中的爆炸下限比液化石油气高一倍,因此,在使用过程中,二甲醚作为燃料比液化石油气安全。
虽然二甲醚的热值比液化石油气低,但由于二甲醚自身含氧,在燃烧过程中所需空气量远低于液化石油气,从而使得二甲醚的预混气热值和理论燃烧温度都高于液化石油气。
二甲醚具有优良的混溶性,可以同大多数极性和非极性的有机溶剂混溶,例如汽油、四氯化碳、丙酮、氯苯和乙酸乙酯。
较易溶于丁醇,对多醇类的溶解度不佳。
常压下在100mL水中可溶解3700mL二甲醚,但是加入少量的助剂后就可与水以任意比例互溶。
二甲醚燃烧时火焰略带亮光。
常温下二甲醚难于活化,但长期储存或受日光直接照射,可形成不稳定过氧化物,这种过氧化物能自燃或自发的爆炸或受热后爆炸。
二甲醚掺混燃烧特性的研究与应用我国能源资源的特征是:富煤,少油,有气。
到2007年中国已成为世界第二大能源生产国和第二能源消费国,仅次于美国。
中国经济的高速发展及人民生活水平的不断提高,使得中国能源需求的增长速度长期居高不下。
2007年我国石油进口量占消费总量的比重达到50%,液化石油气和柴油的进口量分别为162万吨和405万吨,能源安全性受到极大挑战。
此外,2007年,煤在我国一次能源消费结构中占到70%以上,其中80%是通过直接燃烧消费。
大量地消耗煤炭给我国带来了能源效率低、效益差、环境污染严重的后果。
在能源安全与环境保护的双重压力下,二甲醚(DME)作为一种重要的清洁能源和环保产品脱颖而出,它作为车用燃料和民用燃料替代柴油和液化石油气引起国内外的广泛关注。
二甲醚燃料已经在部分省市大量使用,效果良好。
二甲醚作为替代燃料的主要优势在于:①广泛的可获得性。
二甲醚可以由煤和天然气制取,这对于煤炭储量丰富的中国,可以就地取材。
截止2008年底,我国二甲醚产能已经达到400万吨/年。
②燃烧排放污染小。
二甲醚燃烧后的各项排放指标达到甚至大大低于目前世界上最严格的欧Ⅲ标准,被誉为21世纪的绿色燃料。
③良好的可替代性。
二甲醚与液化石油气在物理性质上极其相似,完全可以利用现有的液化石油气储运设施进行运输和储配。
作为民用燃料燃烧时,二甲醚与天然气的华白数与燃烧势都十分接近,二者可以互换,二甲醚与液化石油气的掺混燃料也在部分省市开始使用。
作为车用燃料,二甲醚可以很好地替代柴油。
因而,二甲醚开发与利用对于我国资源利用和环境保护的协调发展有着极为重要的意义。
本文主要研究天然气和液化石油气掺混二甲醚后在原有燃气具上的燃烧特性。
二甲醚在天然气中的体积掺混比为0、25%、50%、75%和100%,在液化石油气中的体积掺混比为0、10%、20%、30%和40%。
在不对现有燃气具进行调整的情况下,深入研究二甲醚以不同的比例掺入天然气和液化石油气后的燃烧火焰特性,热效率,热负荷及烟气成份。
醚类燃烧特点
一、二甲醚类燃烧性能
1、燃烧性能良好:二甲醚可以被两种物质代谢,一种是氧,另一种是氮气。
当二
甲醚在正确的条件下燃烧时,发生的氧气和氮气的比例可以非常接近理想的完全燃烧的比例。
因此,燃烧的比热可以接近理想的完全燃烧的比热,更有利于节能。
2、高活性:二甲醚比其他汽油或柴油更具活性,能够比其他油品提供更多的能量。
这也是它成为发动机燃料的主要原因之一。
3、发射排放……甲烷下少:二甲醚燃烧后发射的甲烷含量比燃料油的发射甲烷含
量要低,这使得排放的环境压力更小,也更有利于保护环境。
4、抗吸附能力强:由于其形式简单,二甲醚有较强的抗吸附能力,这使得吸附在
燃烧腔壁和叶轮腔内表面的油尘更容易滑落,减少机燃吞吐风险,也有助于消除燃烧器受热面上的新陈代谢作用。
二、二甲醚类燃烧限制
1、使用温度低:由于其引燃温度较低,二甲醚的使用温度也要相应的设置得较低,这可能会影响燃料的点火性能。
2、点火延迟:二甲醚的点火延迟比燃料油的点火延迟要大,这可能会影响发动机
启动性能。
3、碱基特性:由于其碱基特性,二甲醚会使发动机表面的酸性消除,使得抗腐蚀
性能减弱,影响发动机的使用寿命和可靠性。
4、统计性不稳定:二甲醚不是一种具有苛刻的质量控制标准的燃料,不同的产品中,其所包含的元素含量也有所差异,这可能会影响燃烧的可靠性。
总结:二甲醚具有燃烧性能良好、高活性、发射甲烷量低和抗吸附能力强等优点,但同时也存在使用温度低、点火延迟、碱基特性和统计性不稳定等问题。
[Article]物理化学学报(Wuli Huaxue Xuebao )Acta Phys.鄄Chim.Sin .,2010,26(1):23-28January Received:July 14,2009;Revised:September 22,2009;Published on Web:November 3,2009.∗Corresponding author.Email:zhaodq@;Tel:+86⁃20⁃87057765.The project was supported by the National Natural Science Foundation of China (50806079)and Natural Science Foundation of Guangdong Province,China (8151007006000014).国家自然科学青年基金(50806079)和广东省自然科学基金(8151007006000014)资助项目ⒸEditorial office of Acta Physico ⁃Chimica Sinica二甲醚和乙醇低压层流预混火焰的对比研究高健1,3赵黛青1,∗汪小憨1蒋利桥1杨浩林1袁涛2杨玖重2(1中国科学院广州能源研究所,广州510640;2中国科学技术大学国家同步辐射实验室,合肥230029;3中国科学院研究生院,北京100049)摘要:利用分子束质谱结合真空紫外同步辐射光电离技术对相同燃烧条件下的低压层流预混二甲醚/氧气/氩气和乙醇/氧气/氩气火焰进行研究.通过测量光电离效率曲线,识别了二甲醚和乙醇火焰的中间物种,得到相应的火焰质谱;通过测量火焰中各物种在燃烧炉炉膛各位置的电离信号强度,得到了各物种的摩尔分数分布曲线.结合两种燃料分子不同的化学结构及详细的燃烧化学反应机理,分析了两火焰中间物种生成特性的异同.研究结果表明:甲醛为两火焰中最主要的C 1中间物种;二甲醚火焰趋向于生成C 1中间物种,C 2物种摩尔分数较低;乙醇火焰中乙醛、乙烯、乙炔和乙烯酮等C 2中间物种的摩尔分数明显高于二甲醚火焰中的值.关键词:同步辐射;单光子电离;二甲醚;乙醇;层流预混火焰中图分类号:O643Comparative Study of Dimethyl Ether and Ethanol Premixed Laminar Flames at Low PressureGAO Jian 1,3ZHAO Dai ⁃Qing 1,∗WANG Xiao ⁃Han 1JIANG Li ⁃Qiao 1YANG Hao ⁃Lin 1YUAN Tao 2YANG Jiu ⁃Zhong 2(1Guangzhou Institute of Energy Conversion,Chinese Academy of Sciences,Guangzhou 510640,P.R.China ;2National Synchrotron Radiation Laboratory,University of Science and Technology of China,Hefei 230029,P.R.China ;3Graduate University of Chinese Academy of Sciences,Beijing 100049,P.R.China )Abstract :Low pressure premixed laminar dimethyl ether (DME)/oxygen/argon and ethanol/oxygen/argon flames (equivalence ratio:1.0)were studied by molecular ⁃beam sampling mass spectrometry (MBMS)combined with the tunable synchrotron radiation photoionization bustion intermediates were identified by measuring photoionization efficiency (PIE)spectra,and the mole fraction profiles of these species at different flame positions were presented.Similarities and differences of main intermediate formation characteristics between the two flames were analyzed based on derived reaction mechanisms.Experimental results show that both flames contain the same intermediates such as CH 3,CH 4,C 2H 2,C 2H 4,CH 2O,CH 3OH,CH 2‗C ‗O,CH 3CHO,and CH 2CHOH.In the DME flame,the concentration of the C 1species is much higher than that of the C 2species,i.e.,C 1intermediates tend to form rather than C 2intermediates in a DME flame.In addition,formaldehyde is the dominant C 1species in each flame.The concentrations of C 2species like ethylene,acetaldehyde,acetylene,and ketene in the ethanol flame are remarkably higher than that found in the DME flame.Key Words :Synchrotron radiation;Single ⁃photon ionization;Dimethyl ether;Ethanol;Premixed laminar flame23Acta Phys.鄄Chim.Sin.,2010Vol.26随着石油资源的日益短缺和排放法规的日益严格,替代燃料燃烧特性的研究已经成为当今的一个热点.二甲醚和乙醇均可由煤、生物质等燃料通过热化学方法制取,来源广泛且产生的常规污染物排放低,且能够与现有大部分油品掺混使用.在工业领域,可替代或部分替代柴油、汽油等动力燃料,且对发动机等燃烧设备的改动要求不高;在民用领域,也可作为液化石油气等民用燃料的替代品使用.因此,两者均被认为是具较大发展潜力的含氧替代燃料[1,2].二甲醚(CH3OCH3)沸点为-24.9℃,常温常压下是一种无色有轻微醚香味的气体,密度0.66g·mL-1 (20℃),与乙醇(C2H5OH)互为同分异构体,相对分子质量同为46,含氧34.8%,但二甲醚分子结构中没有C—C键,只有C—H和C—O键,其低位热值为27.60MJ·kg-1,略高于乙醇(26.75MJ·kg-1)[2].当前对二甲醚和乙醇燃烧的化学反应机理的研究已经深入开展,同步辐射真空紫外光电离结合分子束质谱技术作为燃烧诊断的一种新方法,因其能够探测各种燃烧中间体和重要自由基,为二甲醚和乙醇燃烧动力学反应机理研究的发展提供了有价值的实验数据:Cool等[3]对富燃料的二甲醚低压层流预混火焰进行了实验研究,并与其之前修正的二甲醚高温氧化机理[4]进行了对比,实验结果与反应动力学模型符合较好;Kasper等[5,6]分别利用电子轰击电离和同步辐射单光子电离结合分子束质谱技术对乙醇及乙醇/丙烯的低压层流预混平面火焰进行了实验研究,比较认为两套装置的实验结果总体上一致,苯的生成随乙醇掺混量的增大而减少,为芳香烃及醛类物种生成路径的研究提供了重要的实验数据;Wang等[7]同样利用电子轰击和单光子电离结合分子束质谱技术对二甲醚/丙烯和乙醇/丙烯火焰进行了实验研究,结合相关化学反应机理[6,8-10]的重要反应路径对实验进行了指导和分析,结果表明,二甲醚和乙醇的掺混降低了火焰中苯的浓度,二甲醚掺混使得火焰中的甲醛浓度明显增大.目前国内较多集中于对两种燃料及其与汽油、柴油掺混后的内燃机燃烧特性的研究[11-16].当前,对由于两者分子结构的不同导致的燃烧路径、中间产物的差异性分析尚未见系统报道,本文利用分子束质谱结合真空紫外同步辐射光电离技术对两种燃料的燃烧特性尤其是火焰中间物种的生成特性进行深入的对比研究,并结合前人相同或相近实验条件下的重要实验结论[3,7]及适用的二甲醚和乙醇的氧化反应机理[4,6,8-10,17-19],对其中的部分实验结果进行了分析.定量分析的结果对于掌握含氧燃料的燃烧机理,掌握醛酮等潜在污染物的排放特性,完善和优化燃烧技术均具有重要的参考价值.1实验装置实验在中国科学技术大学国家同步辐射实验室的燃烧实验站进行.实验装置主要由燃烧室、差分室、电离室和反射式飞行时间质谱仪组成,详细介绍参见文献[20].燃料、氧气、氩气流量通过质量流量控制器精确控制,混合后进入一直径60mm燃烧炉形成圆盘状的层流预混火焰.通过计算机控制步进马达实现燃烧器在火焰传播方向上的移动,这样就可以改变火焰与取样喷嘴的相对位置,从而探测火焰中物种的空间摩尔分布.实验中,燃烧室压力通过节流阀来调节,燃烧室压力稳定在4.0kPa.首先,定义燃空比准=(n f/n a)/(n f/n a)st,其中,n f和n a分别表示燃料和空气的物质的量,下标st表示等化学计量.进口燃空比控制为1.0,燃料(分别为二甲醚和乙醇)、氧气和氩气流量分别为0.429、1.286和1.286L·min-1.实验主要分为两个部分:一是固定燃烧炉的位置,扫描光子能量,从而得到不同质荷比的离子信号强度随光子能量的变化曲线,即光电离效率谱(PIE),通过光电离效率谱得到分子的电离能,与文献中电离能相比较以确定物种成分;二是固定光子能量,扫描燃烧炉位置,得到火焰中各物种成分的空间摩尔分数分布曲线.实验中测得火焰中各物种的光电离信号强度,应用文献[21]的方法根据光电离信号强度计算出各物种在各位置的摩尔分数.2实验结果及分析2.1火焰光电离质谱比较图1、2分别为在燃烧室压力4.0kPa下的二甲醚、乙醇火焰质谱图,取样位置距离燃烧器表面2.0 mm,光子能量为11.80eV.质谱图中每一信号强度峰值对应一种质荷比的燃烧产物,通过扫描光子能量得到每个燃烧产物的光电离效率谱,结合文献中物种电离能值可确定每种产物并区分同分异构体,具体方法参见文献[22].以上火焰质谱图中质荷比为15、26、28、30、31、32、42、44、46、60的电离信号分别对应甲基(CH3)、乙炔(C2H2)、乙烯(C2H4)、甲醛(CH2O)、甲氧基(CH3O)、甲醇(CH3OH)、乙烯酮(H2C‗C‗O)、24No.1高健等:二甲醚和乙醇低压层流预混火焰的对比研究乙醛(CH 3CHO)和乙烯醇(CH 2‗CHOH)、二甲醚(CH 3OCH 3)或乙醇(C 2H 5OH)、甲基乙基醚(CH 3OC 2H 5).乙醛和乙烯醇质荷比同为44,且电离能分别为10.23和9.62eV,在11.80eV 的光子能量下均被电离,因此这里对应于质荷比44的信号强度事实上是两种同分异构体的电离信号强度之和.虽然甲醇和氧气质荷比同为32,但由于氧气的电离能为12.07eV,氧气在11.80eV 的光子能量下并未发生电离,因此对应于质荷比32的信号强度仅由甲醇电离产生.对比二甲醚和乙醇火焰质谱,在二甲醚火焰中探测到甲基乙基醚信号,乙醇火焰中并未出现;乙醇火焰中出现甲氧基信号,而在二甲醚火焰中,甲氧基信号极弱.这里需要特别指出,由于不同实验工况下光强不同且不同物种光电离截面不同,因此,信号的强弱并不能直接说明物质的量的多少,不同物种的定量分析将通过下文的摩尔分数曲线进行详细分析.2.2火焰中的主要物种摩尔分数分布比较图3、4分别为二甲醚、乙醇火焰主要产物摩尔分数曲线.燃料(二甲醚或乙醇)在距离燃烧炉表面3mm 内已经消耗完全.比较两火焰中CO 和CO 2的生成情况,相对于二甲醚,乙醇的燃烧生成了较多的CO 2,较少的CO.二甲醚火焰中水的摩尔分数在距离燃烧炉表面5.5mm 处出现峰值,之后下降直到稳定值0.36,而对于乙醇,这一峰值并不明显,但最终的稳定值几乎与二甲醚相等,同为0.36.两火焰中有少量的氢气产生,相对于乙醇火焰,二甲醚火焰中产生氢气的摩尔分数峰值更为明显,这可能是因为二甲醚分子中所有的H 原子通过C —H 键连接在C 原子上,而乙醇分子中其中一个H 原子通过O —H 键连接在O 原子上,由于O —H 键平均键能高于C —H 键,二甲醚分子的脱氢反应更易发生造成其氢气生成量略多于乙醇.图1二甲醚火焰质谱图Fig.1Mass spectrum of the DME flame(1)CH 3,(2)C 2H 2,(3)C 2H 4,(4)CH 2O,(5)CH 3OH,(6)CH 2‗C ‗O,(7)CH 3CHO and CH 2‗CHOH,(8)CH 3OCH 3,(9)CH 3OC 2H 5图2乙醇火焰质谱图Fig.2Mass spectrum of the ethanol flame(1)CH 3,(2)C 2H 2,(3)C 2H 4,(4)CH 2O,(5)CH 3O,(6)CH 3OH,(7)CH 2‗C ‗O,(8)CH 3CHO and CH 2‗CHOH,(9)C 2H 5OH图3二甲醚火焰主要物种摩尔分数曲线Fig.3Mole fraction profiles for the majorspecies of the DMEflame图4乙醇火焰主要物种摩尔分数曲线Fig.4Mole fraction profiles for the majorspecies of the ethanol flameequivalence ratio:1.0pressure:4.0kPaequivalence ratio:1.0pressure:4.0kPa25Acta Phys.鄄Chim.Sin.,2010Vol.262.3火焰中的中间物种摩尔分数分布比较图5、6分别为二甲醚、乙醇火焰中主要C1中间物种的摩尔分数分布曲线,包括甲基、甲烷、甲醇和甲醛四种物质.两火焰中,甲醛为最主要的C1中间物种,其摩尔分数明显高于其它C1物种.二甲醚和乙醇火焰中甲醛的生成机理基本一致[3,4,7,9,10,17],主要经过以下反应路径生成,其中含有“M”的基元反应为三体(3⁃rd body)反应:CH3OCH3(CH3CH2OH)+R➝CH3OCH2(CH3CH2O)+RH(R=O2,H,OH,CH3)CH3OCH2(CH3CH2O)➝CH3+CH2O和CH3+HO2➝CH3O+OHCH3O(+M)➝CH2O+H(+M)可见,两种火焰中的甲醛生成基本都是通过(i)燃料脱氢➝β裂解➝甲醛及(ii)甲基加氧➝甲氧基脱氢➝甲醛两个过程,另外,甲醛的消耗机理在两火焰中也基本相同[3,4,7,9,10,17]:CH2O+R➝HCO+RH(R=O2,H,OH,CH3)HCO+R➝CO+RH(R=O2,H,OH,CH3)因此,如图5、6中所示,两火焰中甲醛的0mm 取样位置摩尔分数和摩尔分数峰值及其出现位置都比较接近,但乙醇火焰中甲醛完全耗尽的位置略滞后于二甲醚,二甲醚火焰中甲醛的消耗更为迅速.甲烷通过甲基夺取其他分子中的H原子生成,两火焰中甲烷摩尔分数曲线的上升阶段皆较为平缓,二甲醚火焰中甲基、甲烷生成量高于乙醇火焰.在乙醇火焰中,探测到了甲醇摩尔分数先上升后下降直至完全耗尽的过程;而在二甲醚火焰中,在取样位置0mm处甲醇的摩尔分数已经达到峰值,随后下降直到耗尽,这说明,乙醇火焰中甲醇生成反应的发生略滞后于二甲醚火焰.二甲醚火焰C1中间物种在3.0mm处几乎完全耗尽,而乙醇火焰C1物种耗尽位置在4.0mm处,略滞后于二甲醚火焰,乙醇火焰反应区域略宽于二甲醚火焰.总的说来,二甲醚主要C1物种摩尔分数曲线峰值出现位置较靠近燃烧炉,且峰值略高于乙醇火焰,这可能是因为相对于乙醇分子的C—C键,二甲醚分子的C—O键更易断裂,形成C1中间物种较为容易.图7、8分别为二甲醚、乙醇火焰中主要C2中间物种摩尔分数分布,主要包括乙炔、乙烯、乙醛和乙烯酮.乙醇火焰中的C2物种摩尔分数峰值分别为7.0×10-3(CH3CHO)、4.8×10-3(C2H4)、1.9×10-3(CH2CO)、0.7×10⁃3(C2H2),其中乙醛为生成量最高的C2中间物种;二甲醚火焰中生成量最高的C2中间物种为C2H4,其摩尔分数峰值仅为0.96×10-3,可见乙醇火焰中各C2中间物种的生成量明显高于二甲醚火焰.图5二甲醚火焰C1物种摩尔分数曲线Fig.5Mole fraction profiles for the C1species ofthe DMEflame图6乙醇火焰C1物种摩尔分数曲线Fig.6Mole fraction profiles for the C1species ofthe ethanol flame图7二甲醚火焰C2物种摩尔分数曲线Fig.7Mole fraction profiles for the C2species ofthe DMEflame26No.1高健等:二甲醚和乙醇低压层流预混火焰的对比研究在二甲醚火焰中,乙烯由甲基的复合反应生成[3,4,17]:CH 3+CH 3➝C 2H 5+HC 2H 5+R ➝C 2H 4+RH(R=H,O 2)甲基是一种极其活泼的基团,参与众多基元反应,二甲醚火焰中乙烯的生成依赖于甲基的复合,决定了乙烯的生成量必然极少;而在乙醇火焰中,乙烯主要通过两条路径生成[7,9,10]:C 2H 5OH+OH ➝C 2H 4OH+H 2O C 2H 4OH ➝C 2H 4+OH 和C 2H 5OH(+M)➝C 2H 4+H 2O(+M)乙醇分子经脱氢+脱羟基的过程即可生产乙烯,因此,乙醇火焰中乙烯摩尔分数明显高于二甲醚火焰.两火焰中乙炔的生成路径基本相同:乙烯与羟基等反应脱氢形成乙烯基,乙烯基继续脱去氢原子即生成乙炔[9,17].相对来讲,乙炔比较稳定,因此其摩尔分数分布曲线上升和下降较为平缓.乙炔的生成几乎全部来源于乙烯,因此其摩尔分数低于乙烯的,且峰值出现位置滞后于乙烯.乙醛是乙醇火焰中最重要的C 2中间物种,乙醇分子在H 或OH 的作用下脱氢生成乙烯醇,再在氧气的氧化作用下脱去羟基氢生成乙醛[7,9,10]:C 2H 5OH+R ➝CH 3CHOH+RH (R=H,OH)CH 3CHOH+O 2➝CH 3CHO+HO 2另有少量乙醛会通过先脱羟基氢生成:C 2H 5OH+OH ➝CH 3CH 2O+H 2O CH 3CH 2O+M ➝CH 3CHO+H+M乙醇燃烧的乙醛生成特性决定了乙醛为乙醇火焰中摩尔分数最高的中间物种,且摩尔分数峰值位置最为接近燃烧炉表面.而在二甲醚火焰中,我们仅探测到极少量的乙醛,其摩尔分数峰值仅为1.0×10-4.另外,二甲醚火焰中乙烯酮摩尔分数较低,峰值仅为7.5×10-5.结合两种燃料分子化学结构,二甲醚本身并不含有C —C 键,生成一个含有C —C 键的C 2中间产物必定要经过碳氧键断裂➝C —C 键聚合的过程,而这在燃空比为1.0的预混火焰中并不容易发生,因此,二甲醚C 2中间产物摩尔分数远低于乙醇.3结论通过测试燃空比均为1.0的二甲醚和乙醇低压层流预混火焰质谱、光电离效率曲线及摩尔分数分布曲线,分析了两火焰中主要C 1、C 2中间物种的生成特性的异同.(1)燃空比同为1.0的二甲醚和乙醇火焰中间物种种类相近,区别在于:在前者中探测到了甲基乙基醚,而在后者中有甲氧基出现,乙醇火焰反应区域略宽于二甲醚火焰.(2)甲醛是两火焰最主要的C 1中间物种,其摩尔分数明显高于其他C 1物种,两火焰中甲醛摩尔分数峰值接近,乙醇火焰中甲醛存在区域略宽于二甲醚火焰.相对于二甲醚火焰,乙醇火焰中甲基、甲烷摩尔分数较低,甲醇的生成反应略滞后于二甲醚火焰.(3)二甲醚火焰趋向于生成C 1中间物种,C 2中间物种摩尔分数较低,乙烯、乙醛分别为二甲醚、乙醇火焰中摩尔分数最高的C 2中间物种.乙醇火焰中,包括乙醛、乙烯、乙炔和乙烯酮在内的C 2中间物种摩尔分数明显高于二甲醚火焰.致谢:本工作得到国家同步辐射实验室资助.感谢国家同步辐射实验室燃烧与火焰实验站所有老师、同学对实验工作的支持和指导.References1Semelsberger,T.A.;Borup,R.L.;Greene,H.L.J.Power Sources ,2006,156(2):4972Jiang,D.M.;Huang,bustion science of internal ⁃combustion engine substitute fuel.Xi ′an:Xi ′an Jiaotong University Press,2007:3-12[蒋德明,黄佐华.内燃机替代燃料燃烧学.图8乙醇火焰C 2物种摩尔分数曲线Fig.8Mole fraction profiles for the C 2species ofthe ethanol flame27Acta Phys.鄄Chim.Sin.,2010Vol.26西安:西安交通大学出版社,2007:3-12]3Cool,T.A.;Wang,J.;Hansen,N.;Westmoreland,P.R.;Dryer,F.L.;Zhao,Z.;Kazakov,A.;Kasper,T.;Kohse⁃Höinghaus,K.bust.Inst.,2007,31(1):2854Zhao,Z.;Chaos,M.;Kazakov,A.;Dryer,F.L.Int.J.Chem.Kinet., 2008,40(1):15Kasper,T.S.;Oßwald,P.;Kamphus,M.;Kohse⁃Höinghaus,K.Combust.Flame,2007,150(3):2206Kohse⁃Höinghaus,K.;Oßwald,P.;Struckmeier,U.;Kasper,T.;Hansen,N.;Taatjes,C.A.;Wang,J.;Cool,T.A.;Gon,S.;Westmoreland,bust.Inst.,2007,31(1):11197Wang,J.;Struckmeier,U.;Yang,B.;Cool,T.A.;Osswald,P.;Kohse⁃Hoeinghaus,K.;Kasper,T.;Hansen,N.;Westmoreland,P.R.J.Phys.Chem.A,2008,112(39):92558Song,K.H.;Nag,P.;Litzinger,T.A.;Haworth,bust.Flame,2003,135(3):3419Nick,M.M.Int.J.Chem.Kinet.,1999,31(3):18310Norton,T.S.;Dryer,F.L.Int.J.Chem.Kinet.,1992,24(4):319 11Zhu,C.J.;Li,J.;Gao,Y.;Yang,T.Transactions of the Chinese Society for Agricultural Machinery,2008,39(9):6[朱昌吉,李君,高莹,杨涛.农业机械学报,2008,39(9):6]12Zhang,J.J.;Qiao,X.Q.;Guan,B.;Wang,Z.;Xiao,G.F.;Huang, Z.Transactions of CSICE,2008,26(3):193[张俊军,乔信起,管斌,王真,肖广飞,黄震.内燃机学报,2008,26(3):193] 13Chang,G.F.;Guo,Y.N.;Zhang,J.P.;Wang,Y.K.;Liu,X.J.;Xu,S.C.Journal of Combustion Science and Technology,2008,14(4):305[常国峰,郭英男,张纪鹏,王有坤,刘巽俊,许思传.燃烧科学与技术,2008,14(4):305]14Yao,C.D.;Liu,X.Y.;Li,J.;Wang,J.;Tian,Z.Y.;Li,Y.Y.Transactions of CSICE,2007,25(5):390[姚春德,刘士钰,李菁,王晶,田振玉,李玉阳.内燃机学报,2007,25(5):390] 15Xing,Y.;Yao,M.F.;Zhang,F.G.;Zheng,Z.Q.Transactions of CSICE,2007,25(1):24[邢元,尧命发,张福根,郑尊清.内燃机学报,2007,25(1):24]16Zhang,B.;Fu,W.B.;Gong,J.S.Fuel,2006,85(5-6):77817Curran,H.J.;Pitz,W.J.;Westbrook,C.K.;Dagaut,P.;Boettner,J.C.;Cathonnet,M.Int.J.Chem.Kinet.,1998,30(3):22918Fischer,S.L.;Dryer,F.L.;Curran,H.J.Int.J.Chem.Kinet., 2000,32(12):71319Rosado⁃Reyes,C.M.;Francisco,J.S.;Szente,J.J.;Maricq,M.M.;Ostergaard,L.F.J.Phys.Chem.A,2005,109(48):1094020Qi,F.;Yang,R.;Yang,B.;Huang,C.Q.;Wei,L.X.;Wang,J.;Sheng,L.S.;Zhang,Y.W.Rev.Sci.Instrum.,2006,77(8):084101 21Cool,T.A.;Nakajima,K.;Taatjes,C.A.;McIlroy,A.;Westmoreland,P.R.;Law,M.E.;Morel,bust.Inst., 2005,30(1):168122Cool,T.A.;Nakajima,K.;Mostefaoui,T.A.;Qi,F.;McIlroy,A.;Westmoreland,P.R.;Law,M.E.;Poisson,L.;Peterka,D.S.;Ahmed,M.J.Chem.Phys.,2003,119(16):835628。
二甲醚燃烧效率分析
二甲醚用作燃料替代液化石油气被市场看好,被誉为“二十一世纪的新能源”。
究其主要原因,一方面在于能源价格飙升下二甲醚的价格优势,而另一方面则是其燃烧效率高和燃烧产物排放洁净的显著特点。
将清洁能源二甲醚用作替代能源,是我国抑制高油价影响的重要措施之一。
二甲醚的主要性质与液化石油气相类似,可以替代液化石油气用作城镇燃气。
二甲醚自身含氧,具有燃烧效率高的特点,从二甲醚的燃烧机理研究中发现,同等热量条件下,与天然气、液化石油气等相比,二甲醚燃烧效率提高5%左右,推广应用前景十分广阔。
1.二甲醚的特性
二甲醚(DME)分子式为C2H60,分子量46.07,二甲醚是一种比较惰性的非腐蚀性有机物,其主要的理化性质见表1。
在常温、常压下二甲醚是一种无色易燃有轻微醚香味的气体,在空气中的允许浓度为400×10-6。
它具有与液化石油气(LPG)相似的特性。
二甲醚具有一般醚类的性质,二甲醚对金属无腐蚀性,不刺激人体皮肤,不致癌,对大气臭氧层无破坏作用,在对流层中易于降解,长期暴露于空气中,不会形成过氧化物。
所以,二甲醚是一种优良的绿色化工产品。
在同等温度条件下,二甲醚的饱和蒸气压低于液化石油气,其存储、运输、使用等均比液化石油气安全。
二甲醚在空气中的爆炸下限比液化石油气高一倍,因此,在使用过程中,二甲醚作为燃料比液化石油气安全。
虽然二甲醚的热值比液化石油气低,但由于二甲醚自身含氧,在燃烧过程中所需空气量远低于液化石油气,从而使得二甲醚的预混气热值和理论燃烧温度都高于液化石油气。
二甲醚具有优良的混溶性,可以同大多数极性和非极性的有机溶剂混溶,例如汽油、四氯化碳、丙酮、氯苯和乙酸乙酯。
较易溶于丁
醇,对多醇类的溶解度不佳。
常压下在100mL水中可溶解3700mL二甲醚,但是加入少量的助剂后就可与水以任意比例互溶。
二甲醚燃烧时火焰略带亮光。
常温下二甲醚难于活化,但长期储存或受日光直接照射,可形成不稳定过氧化物,这种过氧化物能自燃或自发的爆炸或受热后爆炸。
二甲醚毒性很低,气体有刺激及麻醉作用的特性,通过吸入或皮肤吸收过量的二甲醚,会引起麻醉、失去知觉和呼吸器官损伤。
小鼠吸人225.72 g/m3有麻醉作用;猫吸入1658.85 g/m3会深度麻醉;人吸入154.24 g/m3有轻度麻醉,吸入940.50 g/m3有极不愉快的感觉,有窒息感。
2.二甲醚燃烧效率分析
二甲醚易燃,燃烧时火焰略带光亮,气态低位热值为58.50 MJ/m3,同等质量条件下,理论热值约为汽柴油的64%。
以质量计,二甲醚本身含氧量高达34.8%,理论燃烧温度可达2250℃(液化气理论燃烧温度可达2050℃),燃烧性能较好,热效率也较高。
2.1本身含氧,需要添加的理论空气量相应减少
A.燃烧过程
二甲醚燃烧过程:C2H6O十3O22CO2+3H2O
丙烷燃烧过程:C3H8十5O23CO2+4H2O
丁烷燃烧过程:C4H10十6.5O24CO2+5H2O
由上述反应方程式可知,以相同摩尔体积二甲醚与丙烷或丁烷的燃烧过程比较,丙烷或丁烷所需要的氧气量较二甲醚多2.0mol或3.5mol。
液化气组分按C3H830%、C4H1070%计算。
二甲醚气态低位热值为58.50MJ/m3,液化气气态低位热值为92.83MJ/m3。
B.我们知道,空气中1.0mol O2附带3.76mol的N2和其它惰性气体,因此,上述二甲醚及丙烷或丁烷完整的燃烧反应方程式应为: C2H60+3(02+3.76N2)2C02+3H20+3×3.76N2
C3H8+5(02+3.76N2)3C02+3H20+5×3.76N2
C4H10+6.5(02+3.76N2)4C02+3H20+6.5×3.76N2
上叁式表明,在燃烧温度不太高的情形下,反应前后N2的摩尔数不变。
N2虽然进入燃烧区,但并未参加氧化反应,相反,它带走二甲醚或丙烷或丁烷部分燃烧热,进而影响热效率。
因此,降低不参与反应的N2量(空气量),则减少了热损失,相当与提高了二甲醚的热效率。
C.1m3二甲醚燃烧时需14.28m3空气,产生烟气16.28m3。
1m3丙烷燃烧时需23.80m3空气,产生烟气26.80m3。
1m3丁烷燃烧时需30.94m3空气,产生烟气34.94m3。
D.1m3液化气燃烧时需0.3×23.80+0.7×30.94m3=28.80m3空气,
产生烟气0.3×26.80+0.7×34.94m3=32.50m3
E.按当量热值计算1m3液化气与1.58m3二甲醚燃烧时需要的空气量比值为:
1m3液化气:1.58m3二甲醚=28.80m3:1.58×14.28m3=1:0.78
即:1m3液化气比1.58m3二甲醚需多增加空气27.65%。
F.按当量热值计算1m3液化气与1.58m3二甲醚燃烧时产生的烟气量比值为:
1m3液化气:1.58m3二甲醚=32.50m3:1.58×16.28m3=1:0.79
即:1m3液化气比1.58m3二甲醚需多产生烟气26.35%。
2.2燃烧状况改善,过剩空气系数降低
一般情况下,燃烧装置空气系数α控制范围为:工业燃烧装置α=1.05~1.20;民用α=1.30~1.80。
从提高燃烧效率方面讲,理想情况
下,α=1.0时,如果能确保空气与燃气混合充分、燃烧完全,燃烧效率最高。
实际燃烧过程中,取α>1.0的原因是为了避免不完全燃烧情况发生,而付出的代价则是需加热不参与反应剩余的O2、N2,导致热效率降低。
二甲醚自身含氧,由于改善了燃气与空气的混合效果,且氧气与氮气之比较普通空气大,属“富氧燃烧”工况,因而改善了燃烧状况;而另一方面,氧气与二甲醚混合情况趋好,除混入的空气总量可以相应降低外,还可以将空气系数控制在较低位置,α适当朝1.0方向降低,即减少剩余空气量,减少不参与燃烧的O2、N2量,自然这是二甲醚燃烧效率提高的另一个原因。
2.3燃具燃烧效率分析
对于燃具,假定α由1.20降为1.05,不参与燃烧的O2、N2量减少,1.0摩尔体积的二甲醚燃烧时减少的O2、N2量为:
(1.20-1.05)×[O2+(0.79÷0.21)N2] mol
经计算,与同等热值的丙烷或丁烷(或其他燃气)比较,减少的这部分热损失为3.0%~5.0%左右。
2.4火焰传热能力增加
二甲醚燃烧时,火焰温度增加,烟气温度也随之升高,增加了分解热,当遇到低温表面时,将放出大量的分解热,这就是富氧燃烧火焰具有较大传热能力的原因之一。
2.5燃烧装置内有效利用热得以提高
由于富氧燃烧火焰温度高,燃烧装置内温压增大,辐射换热量增强,提高了装置内有效利用热。
3.二甲醚排放性能分析
二甲醚是一种清洁燃料,燃烧过程中无残渣、无黑烟,CO、CO2及烟气排放量降低,具有富氧燃烧的火焰特性。
由于其燃烧温度提高,
氧气浓度相应增加,因此,必须特别重视其氮氧化物生成量情况。
亦即,假定燃烧效率相同,获得相同的燃烧热量,1.0mol的二甲醚燃烧时,混入的氧气量较丙烷或丁烷可降低2.0mol或3.5mol。
3.1民用燃具
燃烧温度不会太高,不会出现氮氧化物生成量显著增加的情况。
3.2工业燃烧装置
燃烧装置内燃烧温度相当高时,部分氮气会分解,生成氮原子,继而与氧结合成氮的氧化物NO和NO2,这两者通称为NOx,是极有害的产物。
在太阳紫外线照射下,NOx与碳氢化合物可发生反应生成具有强氧化能力的有害物质,并形成光化学烟雾。
此外,NOx 生成硝酸也是酸雨的主要组分。
燃烧生成NOx的浓度,随燃烧温度、O2浓度和停留时间增加而增加,因此,二甲醚燃烧时,氮氧化物生成量有增加的趋势,要引起注意。
综上所述,从二甲醚的燃烧机理分析,同等热量条件下,与天然气、液化石油气等其它燃气相比较,二甲醚燃烧效率提高5%左右,而由于其十六烷值较高,特性与柴油相近的原因,可作为理想的柴油发动机洁净燃料,排放性能优越,因此,推广应用前景十分广阔。
而需要注意的是,由于二甲醚具有富氧燃烧特性,燃烧温度较高,必须关注其氮氧化物的排放情况。