铂族金属的主要原子特性和物理化学常数
- 格式:pdf
- 大小:165.62 KB
- 文档页数:2

铂系元素化学性质2016-04-19 12:28来源:内江洛伯尔材料科技有限公司作者:研发部铂系元素铂系元素包括钌、铑、钯、锇、铱、铂6 铂系元素。
其中钌、铑、钯的密度约为12 g.cm-3,称为轻铂系金属;锇、铱、铂的密度约为22 g.cm-3金属称为重铂系金属。
铂系元素在自然界几乎完全以单质状态存在,高度分散于各种矿石之中,并共生在一起。
铂系元素都是稀有金属,它们在地壳中的含量都很小。
铂系金属价格昂贵,它们和银、金被称为贵金属。
铂系金属的化学性质表现在以下几个方面:1、铂系金属对酸的化学稳定性比所有其它各族金属都高。
钌和锇,铑和铱对酸的化学稳定性最高,不仅不溶于普通强酸,也不溶于王水中。
例如:3Pt+4HNO3+18HCl→3H2[PtCl6]+4NO+8H2O钯和铂都能溶于王水,钯还能溶于浓硝酸和热硫酸中。
例如:Pd+4HNO3→Pd(NO3)2+2NO2+2H2O2、在有氧化剂存在时,铂系金属与碱一起熔融,都可以转变成可溶性的化合物。
例如:Ru+2KOH+KClO3→ K2RuO4+KCl+H2O3、铂系金属不和氮作用。
室温下对空气、氧等非金属都是稳定的,不作用。
高温下才能与氧、硫、磷、氟、氯等非金属作用,生成相应的化合物。
室温下只有粉状的锇在空气中会慢慢地被氧化,生成挥发性的四氧化锇OsO4,OsO4的蒸气化,生成挥发性的四氧化锇OsO4,OsO4的蒸气没有颜色,对呼吸道有剧毒,尤其有害于眼睛,会造成暂时失明。
4、铂系金属都有一个特性,即很高的催化活性,金属细粉的催化活性尤其大。
大多数铂系金属能吸收气体,特别是氢气。
锇吸收氢气的能力最差,钯吸收氢气的能力最强。
常温下,钯溶解氢的体积比为1700,在真空中常温下,钯溶解氢的体积比为1:700,在真空中把金属加热到373K,溶解的氢就完全放出。
氢在把金属加热到373K,溶解的氢就完全放出。
氢在铂中的溶解度很小,但铂溶解氧的本领比钯强,钯吸收氧的体积比为1:0.07,而铂溶解氧的体积钯吸收氧的体积比为1:0.07,而铂溶解氧的体积比为1:70。

铂族(PGM )金属简介铂族金属简介(PGM Introduce)2008-03-17 22:081、矿产性质:1)物理性质。
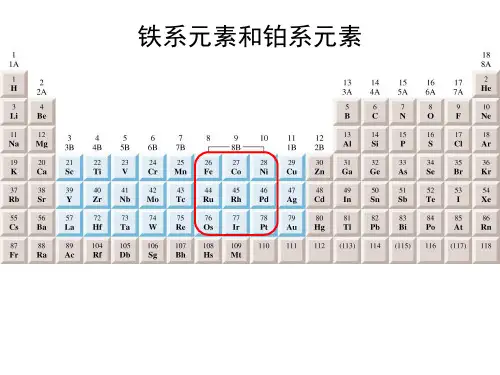
铂族金属包括铂(pt),钯(Pd),铑(Rh),铱(10,锇(Os)、钌(Ru)六个元素位于元素周期表中第VIII副族。
它们具有类似的性质,如高熔点、高强度、耐腐蚀、良好的催化活性和电热性。
铂、钯、铑、铱为银白色,锇、钌(周期表中上下排列)为钢灰色。
钌、铑在有氧存在和强热下,容易与氧化合为四氧化物,具有挥发性,钌的挥发速度较慢,锇则较快。
铂(大于1000℃时)、铱和铑(大于2000℃时)能形成挥发性氧化物。
铂族金属密度大。
轻铂金属密度大于12 g/cm},重铂金属密度大于21 g/cm3。
铂族金属的沸点都很高。
按元素周期表顺序,从左向右逐渐降低.从上向下逐渐提高。
其中钯的沸点最低,锇的沸点最高。
锇、钌和铑的特点是硬度高并且脆,故能研磨成细粉末,它们都很难机械加工。
铂和钯具有延展性,可以辗制和拉丝。
纯净的铂具有高度的可塑性,将铂冷轧可以制得厚度为0.0025 mm的箔。
铱仅当升温至红热时才能承受机械加工。
铂族金属的特殊性质是其表面具有吸附气体(特别是氢气)的性能,呈粉末和胶体状态时其吸附能力大为增强。
钯对氢的吸附能力最强.常温下1个体积的钯能吸附901个体积以上的氢。
钯中吸附的氢易全部放出。
按照钯、铱、铑、铂、钌、锇的次序,它们吸附氢的性能依次降低。
2)化学性质。
铂族金属电离电位很高,在常温下对许多化学试剂(如酸、碱和最活泼的非金属)有很高的抗腐蚀能力。
但在一定条件下,它们可与酸、碱、氧和卤素反应。
铂族金属在热处理过程中被钝化,这是由于在金属表面形成一层稳定的氧化薄膜。
以金属细粉(铂黑)形式存在的铂族金属最容易溶解。
海绵状和粉末状的铂族金属不易溶解,致密状态的金属更难溶。
铂族金属有一种特殊的性质:当它们与比较活泼的金属熔融成合金时,就有可能用无机酸溶解。
容易与铂族金属形成合金的金属有铅、锡、铋和锌。

铂金及其特性自然铂的矿物学特性铂族元素包括铂、钯、铑、钌、铱和锇这6种金属元素。
在自然界中,它们经常一起产出,与金、银一起通称为贵金属元素。
在矿物分类中,铂族元素矿物属自然铂亚族,包括铱、铑、钯和铂的自然元素矿物。
铂族元素矿物均为等轴晶系,单晶体极少见,偶尔呈立方体或八面体的细小晶粒产出。
一般呈不规则粒状、树枝状、葡萄状或块状集合体形态。
颜色和条痕均为银白色至钢灰色;金属光泽,不透明。
无解铂单质理,锯齿状断口,具延展性。
为电和热的良导体。
自然元素铂是地壳中一种稀有的贵重金属元素,元素符号为Pt。
天然铂金的矿物学名为自然铂。
它是自然元素铂的单质矿物,其化学式为Pt。
自然铂比重为15.5~21.5;折光率为56.5~60.0。
铂金与白金的概念目前,对铂金饰品有两大消费误区。
一是把铂金误认为白金,二者混淆不清。
二是不懂得利用“Pt” 标志来识别铂金饰品。
其实,铂金与白金完全是两码事。
1、铂金的概念铂金的名字来源于西班牙语“Platina del Pinto”,译意为Pinto河中类似银的白色金属。
由铂族元素矿物熔炼而成的金属,有钯金、铱金、铂金、铑金等。
通常,铂金是由自然铂、粗铂矿等铂矿石熔炼而成的。
它是一种主要含铂或全部由铂组成的稀有贵重金属,与黄金、白银等同属贵重金属。
2、白金的概念一般所说的白金,其全称应为“白色K金”。
它是由黄金与其它白色金属一起熔炼而成的一种不含铂的白色合金。
其中,黄金的百分含量最多为75%。
因为这种合金呈现白色,所以叫做白金。
[编辑本段]铂金的物理化学特性铂族金属色泽美丽;延展性强;耐熔、耐摩擦、耐腐蚀;在高温下化学性稳定。
因此,它们有着广泛的用途。
在铂族金属中,人们最熟悉、用得最多的是铂金。
它比贵金属中的黄金、白银等更加稀少和贵重。
纯净的铂金呈银白色;具金属光泽。
铂金的颜色和光泽是自然天成的,历久不变。
硬度为4~4.5度。
相对密度为21.45,比重为15~19或21.4。


金属铂是一种稀有的、白色的过渡金属元素,具有高度的稳定性和催化活性。
它在自然界中以铂矿的形式存在,其化学符号为Pt,原子序数为78。
金属铂的结构对于理解其性质和应用具有重要意义。
金属铂的晶体结构属于面心立方结构(Face-Centered Cubic, FCC),与铁、镍等金属的晶体结构相似。
在这种结构中,每个晶胞包含4个铂原子,它们位于立方体的8个顶点和6个面的中心。
每个铂原子的配位数为12,即与12个相邻的铂原子形成共价键。
这种紧密堆积的结构使得金属铂具有较高的熔点(约为1769摄氏度)和密度(约为21.45克/立方厘米)。
金属铂的电子结构是其独特性质的基础。
在周期表中,铂位于第6周期、d区,其原子序数较高,因此具有较高的电负性。
铂原子的最外层电子构型为5d9 6s1,其中6s轨道上的1个电子离域在5d轨道上,形成一个五配位的几何构型。
这种构型使得铂原子具有较高的稳定性,不易发生化学反应。
金属铂的催化活性与其特殊的电子结构和表面性质密切相关。
首先,铂原子的最外层电子构型使其具有接受电子对的能力,从而促进氧化还原反应的发生。
其次,铂原子的表面存在一层吸附氧分子,形成所谓的“吸附氧物种”,这些物种可以进一步与反应物发生相互作用,提高催化活性。
此外,铂原子表面的几何构型也对其催化活性产生影响。
例如,在Pt(111)表面上,由于五配位的几何构型,反应物分子更容易接近铂原子表面,从而提高催化活性。
金属铂在许多领域都有广泛的应用,如石油化工、汽车尾气处理、燃料电池等。
在这些应用中,金属铂主要作为催化剂使用,通过降低化学反应的活化能来提高反应速率。
此外,金属铂还具有良好的导电性和热稳定性,因此在一些特殊环境下也有重要应用,如高温电阻器、红外探测器等。
总之,金属铂的结构对其性质和应用具有重要意义。
其面心立方晶体结构、五配位的电子构型以及特殊的表面性质使其具有高度的稳定性和催化活性。
在未来的研究和应用中,金属铂有望在更多领域发挥重要作用。

pt的化学元素名称
摘要:
1.Pt是什么的化学元素名称
2.Pt的元素符号是什么
3.Pt在元素周期表中的位置
4.Pt的物理性质
5.Pt的化学性质
6.Pt在工业中的应用
正文:
Pt是铂(Platinum)的化学元素名称。
它的元素符号是Pt,源自于拉丁文的“Platinum”,意为“白银”。
Pt属于过渡金属元素,原子序数为78,位于元素周期表的第六周期第Ⅷ族。
Pt是一种白色金属,具有很高的延展性和抗腐蚀性。
它的密度为21.45克/立方厘米,熔点为1768.3摄氏度,沸点为3827摄氏度。
Pt在室温和高温下都具有很高的化学稳定性,不与氧气反应。
Pt的化学性质表现为亲电性较弱,不容易失去电子。
它在化合物中通常呈+2和+4价态。
Pt可以与许多金属形成金属间化合物,例如与金、银、铜等。
此外,Pt还可以与非金属元素形成共价化合物,例如与氧、氮、硫等。
Pt在工业中具有广泛的应用,主要包括以下几个方面:
1.电子工业:Pt具有优良的电接触性能,常用于制造电极、触点等电子元件。
2.化工催化剂:Pt具有很高的催化活性,可用于生产氨、脱氢、氧化等化学反应。
3.汽车尾气净化器:Pt和钯等贵金属可以有效地降低汽车尾气中的有害物质,被广泛应用于汽车尾气净化器。
4.医疗领域:Pt-based合金具有良好的生物相容性和催化活性,被用于制造人工器官、医疗设备等。
5.珠宝首饰:Pt作为贵金属,因其抗氧化性和美观性而被用于制造珠宝首饰。
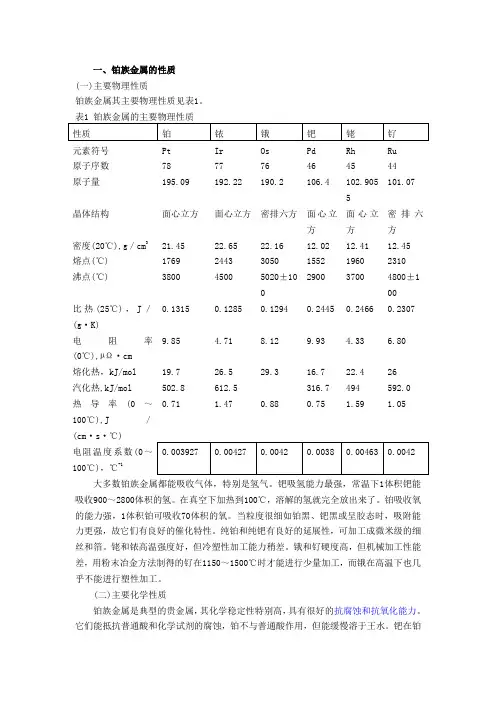
一、铂族金属的性质(一)主要物理性质铂族金属其主要物理性质见表1。
表1 铂族金属的主要物理性质性质铂铱锇钯铑钌元素符号Pt Ir Os Pd Rh Ru原子序数787776464544原子量195.09192.22190.2106.4102.9055101.07晶体结构面心立方面心立方密排六方面心立方面心立方密排六方密度(20℃),g/cm321.4522.6522.1612.0212.4112.45熔点(℃)176924433050155219602310沸点(℃)380045005020±100290037004800±100比热(25℃),J/(g·K)0.13150.12850.12940.24450.24660.2307电阻率(0℃),µΩ·cm9.85 4.718.129.93 4.33 6.80熔化热,kJ/mol19.726.529.316.722.426汽化热,kJ/mol502.8612.5316.7494592.0热导率(0~100℃),J/(cm·s·℃)0.71 1.470.880.75 1.59 1.05电阻温度系数(0~100℃),℃-l0.0039270.004270.00420.00380.004630.0042大多数铂族金属都能吸收气体,特别是氢气。
钯吸氢能力最强,常温下1体积钯能吸收900~2800体积的氢。
在真空下加热到100℃,溶解的氢就完全放出来了。
铂吸收氧的能力强,1体积铂可吸收70体积的氧。
当粒度很细如铂黑、钯黑或呈胶态时,吸附能力更强,故它们有良好的催化特性。
纯铂和纯钯有良好的延展性,可加工成微米级的细丝和箔。
铑和铱高温强度好,但冷塑性加工能力稍差。
锇和钌硬度高,但机械加工性能差,用粉末冶金方法制得的钌在1150~1500℃时才能进行少量加工,而锇在高温下也几乎不能进行塑性加工。

铂族(PGM )金属简介铂族金属简介(PGM Introduce)2008-03-17 22:081、矿产性质:1)物理性质。
铂族金属包括铂(pt),钯(Pd),铑(Rh),铱(10,锇(Os)、钌(Ru)六个元素位于元素周期表中第VIII副族。
它们具有类似的性质,如高熔点、高强度、耐腐蚀、良好的催化活性和电热性。
铂、钯、铑、铱为银白色,锇、钌(周期表中上下排列)为钢灰色。
钌、铑在有氧存在和强热下,容易与氧化合为四氧化物,具有挥发性,钌的挥发速度较慢,锇则较快。
铂(大于1000℃时)、铱和铑(大于2000℃时)能形成挥发性氧化物。
铂族金属密度大。
轻铂金属密度大于12 g/cm},重铂金属密度大于21 g/cm3。
铂族金属的沸点都很高。
按元素周期表顺序,从左向右逐渐降低.从上向下逐渐提高。
其中钯的沸点最低,锇的沸点最高。
锇、钌和铑的特点是硬度高并且脆,故能研磨成细粉末,它们都很难机械加工。
铂和钯具有延展性,可以辗制和拉丝。
纯净的铂具有高度的可塑性,将铂冷轧可以制得厚度为0.0025 mm的箔。
铱仅当升温至红热时才能承受机械加工。
铂族金属的特殊性质是其表面具有吸附气体(特别是氢气)的性能,呈粉末和胶体状态时其吸附能力大为增强。
钯对氢的吸附能力最强.常温下1个体积的钯能吸附901个体积以上的氢。
钯中吸附的氢易全部放出。
按照钯、铱、铑、铂、钌、锇的次序,它们吸附氢的性能依次降低。
2)化学性质。
铂族金属电离电位很高,在常温下对许多化学试剂(如酸、碱和最活泼的非金属)有很高的抗腐蚀能力。
但在一定条件下,它们可与酸、碱、氧和卤素反应。
铂族金属在热处理过程中被钝化,这是由于在金属表面形成一层稳定的氧化薄膜。
以金属细粉(铂黑)形式存在的铂族金属最容易溶解。
海绵状和粉末状的铂族金属不易溶解,致密状态的金属更难溶。
铂族金属有一种特殊的性质:当它们与比较活泼的金属熔融成合金时,就有可能用无机酸溶解。
容易与铂族金属形成合金的金属有铅、锡、铋和锌。

pt的化学元素名称摘要:一、前言二、pt 的化学元素名称1.元素周期表中的位置2.元素名称的来源三、pt 的性质与应用1.物理性质2.化学性质3.主要应用领域四、pt 与其他元素的关联五、结论正文:一、前言本文将为您介绍pt 这个化学元素的名称、性质以及应用。
首先,让我们从pt 的化学元素名称开始。
二、pt 的化学元素名称1.元素周期表中的位置pt(铂)是一种属于过渡金属元素,原子序数为78。
在元素周期表中,它位于第18 族(Ⅷ族),即8、9、10 列。
2.元素名称的来源铂的英文名为Platinum,源自于西班牙语“platina”,意为“小银”。
这是因为pt 的外观与银相似,但比银更坚硬。
三、pt 的性质与应用1.物理性质pt 是一种银白色金属,具有较高的密度(21.45 g/cm)和熔点(1772°C)。
它具有很高的延展性和抗腐蚀性,可以拉成细丝或轧成薄片。
2.化学性质pt 在常温常压下不易与氧气发生反应,具有很高的化学稳定性。
在高温下,它可以与氧气反应生成ptO2。
此外,pt 具有催化活性,可用作催化剂。
3.主要应用领域pt 广泛应用于以下领域:(1)电子行业:pt 具有良好的电性能,可用作电接触器、电极等电子元器件。
(2)化工催化剂:pt 具有高催化活性,可用作催化剂,促进化学反应的进行。
(3)医疗领域:pt 具有无毒性,可用作医疗植入材料,如人工关节等。
(4)首饰制品:pt 具有高硬度和抗氧化性,被广泛用于制作首饰,如铂金戒指、项链等。
四、pt 与其他元素的关联pt 的同族元素包括钌(Ru)、铑(Rh)、钯(Pd)和银(Ag)。
这些元素在性质和用途上具有一定的相似性和差异性。
五、结论pt 作为一种具有高稳定性和催化活性的化学元素,在多个领域具有广泛的应用。

铂族金属知识简介铂族金属知识简介铂族金属包括铂(Pt)、钯(Pd)、锇(Os)、铱(Ir)、钌(Ru)、铑(Rh)六种金属。
铂族金属以其特别可贵的性能和资源珍稀而著称;与金、银合称“贵金属”。
但其发现与利用相对于金、银来说要晚得多。
金、银饰品在人类纪元之前的墓葬中就有发现,而人类对铂族金属的了解和利用,不过两百多年的历史。
其中铂发现最早,1735 年由尤尔洛(A.De.Ulloa)发现,其余几种元素都迟至19世纪才陆续有所了解,如钯是1804年由沃拉斯顿(W.H.Wollaston)发现,钌是1845 年科劳斯(K.Claus)发现。
虽然发现较晚,但很快了解到它们有一些可贵的功能,因而被广泛应用于现代工业和尖端技术中。
因此被称为“现代贵金属”。
据报道,从公元前4000年到19世纪末,全球累计产金2.9万t,19世纪世界均年产金123t;到1973~1980年,世界平均年产金量达1375t。
铂族金属的世界产量从1969年开始超过100t,80年代末便翻了一番,达到200t,90年代初年产近300t。
从这些数据不难体会出“贵金属”与“现代贵金属”深层的涵义:二者都是珍稀而贵重,而铂族元素虽然绝对数量比不上金、银,但其发展的速度深刻体现出“现代”的涵义。
一、矿物原料特点铂族金属既具有相似的物理化学性质,又有各自的特性。
它们的共同特性是:除了锇和钌为钢灰色外,其余均为银白色;熔点高、强度大、电热性稳定、抗电火花蚀耗性高、抗腐蚀性优良、高温抗氧化性能强、催化活性良好。
各自的特性又决定了不同的用途。
例如铂还有良好的塑性和稳定的电阻与电阻温度系数,可锻造成铂丝、铂箔等;它不与氧直接化合,不被酸、碱侵蚀,只溶于热的王水中;钯可溶于浓硝酸,室温下能吸收其体积350~850倍的氢气。
铑和铱不溶于王水,能与熔融氢氧化钠和过氧化钠反应,生成溶解于酸的化合物;锇与钌不溶于王水,却易氧化成四氧化物。
目前已发现200余种铂族元素矿物。
pt和过渡金属氮化物-概述说明以及解释1.引言1.1 概述概述是文章的开篇部分,用来介绍文章的主题和背景。
在本文中,我们将讨论有关PT和过渡金属氮化物的性质和应用。
PT是指铂(Platinum)元素,它是一种常见的过渡金属,在许多领域都有广泛的应用。
过渡金属氮化物则是指由过渡金属和氮元素组成的化合物,具有多种优良的物理和化学性质。
通过研究PT和过渡金属氮化物之间的关系,可以深入了解它们的特性,并为未来的科学研究和工程应用提供指导。
在本文中,我们将首先介绍PT的性质和应用。
铂是一种稀有而贵重的金属,具有优异的耐腐蚀性和高的催化活性。
它被广泛应用于化学工业、电子技术、医学以及能源领域。
然后,我们将讨论过渡金属氮化物的合成方法和特性。
过渡金属氮化物由于其特殊的晶体结构和优良的导电性、磁性等性质,在催化剂、电子器件以及文化遗产保护等领域具有重要的应用价值。
最后,我们将探讨PT和过渡金属氮化物之间的关联性,并展望它们的未来发展。
通过研究PT与过渡金属氮化物的相互作用和协同效应,可以进一步提高它们的性能和应用范围。
同时,对于PT和过渡金属氮化物的未来发展,我们也可以探索更多的合成方法和应用领域,以满足不断增长的科技和社会需求。
综上所述,本文将系统地介绍PT和过渡金属氮化物的性质和应用,并分析它们之间的关联性。
通过深入研究这些材料,我们可以为未来的科学研究和工程应用提供重要的参考和基础。
1.2 文章结构本文将围绕着PT和过渡金属氮化物展开,旨在探讨它们的性质、应用、合成方法和特性以及它们之间的关联性。
文章分为引言、正文和结论三个部分。
在引言部分,我们将对PT和过渡金属氮化物进行概述,并介绍文章的结构和目的。
首先,我们将简要介绍PT和过渡金属氮化物的定义、组成和基本性质。
随后,我们将阐述本文的整体架构,包括每个章节的主要内容和研究方法。
最后,我们将明确文章的目的,即深入探讨PT和过渡金属氮化物之间的关联性,以及它们在未来的发展前景。
铂元素基本物化数据
2016-05-30 12:40来源:内江洛伯尔材料科技有限公司作者:研发部
铂元素基本物化数据铂(Platinum)是一种化学元素,俗称白金。
其化学符号为Pt,原子序为78。
铂是一种密度高、延展性高、反应性低的灰白色贵金属,属于过渡金属。
铂同属于铂系元素和10族元素。
它共有六种自然产生的同位素。
铂是地球地壳中最罕见的元素之一,平均丰度大约为5 μg/kg。
它一般出现在某些镍和铜矿石中,位于原生元素矿藏,主要分布在南非,因此当地的铂产量占全球的80%。
铂的年产量只有几百吨,应用亦十分重要,因此铂是一种非常贵重的物质和主要的贵金属贸易商品。
铂是反应性最低的金属之一。
即便在高温下,它也有极强的抗腐蚀性,因此属于抗腐蚀金属。
在自然中,铂有时以纯金属状态出现,不与其他元素结合。
铂自然出现
在河流的冲积层中,所以前哥伦布时期的南美原住民最早用铂制造工艺品。
欧洲早在16世纪就有记载铂的使用;1748年,安东尼奥•乌略亚发表了一篇报告,描述来自哥伦比亚的一种新金属,这时科学家才开始研究铂元素。
铂的应用包括:催化转换器、实验室器材、电触头和电极、电阻温度计、牙科器材及首饰等。
由于铂是一种重金属,它的盐会对健康造成危害;但铂的抗腐蚀性强,所以其毒性比一些其他金属较低。
一些含铂化合物,特别是顺铂,可用于化学疗法以治疗某些癌症。
铂概况(Survey):铂(Platinum)是一种化学元素,俗称白金。
它的化学符号是Pt,原子序数是78。
性状(Character):铂是一种过渡金属,密度大,可延展,色泽银白,金属光泽,硬度4-4.5,相对密度为21.45。
熔点高为1773℃。
富延展性,可拉成很细的铂丝,轧成极薄的铂箔。
化学性质极稳定,不溶于强酸强碱,在空气中不氧化。
物理性质(Physical property):状态:固体密度(接近室温):21.45 g²cm−3熔点时液体密度:19.77 g²cm−3熔点:2041.4 K,1768.3 °C,3214.9 °F 沸点:4098 K,3825 °C,6917 °F熔化热:22.17 kJ²mol−1汽化热:469 kJ²mol−1比热容:25.86 J²mol−1²K−1原子性质(Atomic properties):氧化态:6, 5, 4, 3, 2, 1, −1, −2, −3(微碱性氧化物)电负性:2.28(鲍林标度)原子半径:139 pm共价半径:136±5 pm范德华半径:175 pm名称规格尺寸纯度铂丝(Pt)Φ0.001mm—1.0mm 99.99% 99.995% 99.999% 铂丝(Pt)Φ1.0mm—3.0mm 99.99% 99.995% 99.999% 铂粒(Pt)Φ2*5mm or Φ2*10mm 99.99% 99.995% 99.999% 铂粒(Pt)Φ3*3mm or Φ3*5mm 99.99% 99.995% 99.999% 铂片(Pt)T 0.10mm—T 2mm. 99.99% 99.995% 99.999% 铂粉(Pt)0.01um—1.0um 1-5um -200目-325目99.99%。
黄金、铂金、白银物理化学性质贵金属有金(Au)、银(Ag)、铂(Pt)、锇(Os)、铱(Ir)、钌(Ru)、铑(Rh)、钯(Pd)等8种。
其中首饰行业最常见的还是白银、黄金、铂金,下面简单介绍一下这三种金属的物理化学性质。
一,黄金材料1 . 黄金的主要物理性质(1) 密度大;20℃时, 金的密度是19. 32 g/ cm3 ; 1064℃熔化时的密度是17. 3 g/ cm 。
(2) 良好的导电和导热性能,黄金的导电性仅次于白银和铜而位居第三。
黄金的导热性仅次于白银。
(3) 极好的延展性,其莫氏硬度为2.5-3 。
(4) 挥发性很小; 在1000-1300℃之间, 黄金挥发量是微乎其微的, 其挥发速度与周围的气体有关。
2 . 黄金的化学性质 (1) 化学稳定性强硝酸、硫酸、盐酸、硒酸和碱溶液及酒石酸、柠檬酸、醋酸、硫化氢、水和空气等试剂或气体都不能与它相互作用。
但某些单酸、混酸、卤素气体、盐溶液及有机酸等却具有溶金性能, 例如我们平常用得较多的王水。
在一定的条件下, 某些酸、碱、溶化的各种盐类及卤素介质等也会对黄金产生腐蚀。
(2) 可以形成多种化合物, 并在化合物中呈一价或三价 (3) 黄金的化合物很容易还原为单质 (4) 黄金具有 22 个放射性同位素3 . 黄金的成色和计量纯黄金或其合金制品中含金量的多少称作黄金的成色或纯度, 表示黄金成色的方法有两种。
(1)百分制在我国民间常从色泽上判断黄金的成色, 很早就有“七成者青, 八成者黄, 九成者紫, 十成者赤”的说法, 其意思是说, 黄金呈青色时的含金量是 70%; 呈黄色时的含金量为 80%; 呈紫色时的含金量为 90%; 赤色则为纯金, 并不是平常所说的越黄成色越高。
(2)) K 制,这是国际上通常用来衡量黄金成色的方法, 即把纯金分成 24 份, 叫做 24 K。
如果含金制品中占1/ 24份纯金, 就叫做1 K金; 占14/ 24份纯金, 就叫做14 K; 占18/ 24份纯金,就叫做18 K金。