第3章-紫外-可见分光光度法
- 格式:doc
- 大小:246.50 KB
- 文档页数:8







紫外-可见分光光度法1 简述紫外-可见分光光度法是在190-800nm 波长范围内测定物质的吸光度,用于鉴别、杂质检查和含量测定的方法。
定量分析通常选择物质的最大吸收波长处测出吸光度,然后用对照品或吸收系数求算出被测物质的含量,多用于制剂的含量测定;对已知物质定性可用吸收峰波长或吸光度比值作为鉴别方法;若该物质本身在紫外光区无吸收,而其杂质在紫外光区有相当强度的吸收,或杂质的吸收峰处该物质无吸收,则可用本法作杂质检查。
物质对紫外辐射的吸收是由于分子中原子的外层电子跃迁所产生,因此,紫外吸收主要决定于分子的电子结构,故紫外光谱又称电子光谱。
有机化合物分子结构中如含有共轭体系、芳香环等发色基团,均可在紫外区(200~400nm )或可见光区(400~850nm )产生吸收。
通常使用的紫外-可见分光光度计的工作波长范围为190~900nm 。
紫外吸收光谱为物质对紫外区辐射的能量吸收图。
朗伯-比尔(Lambert-Beer )定律为光的吸收定律,它是紫外-可见分光光度法定量分析的依据,其数学表达式为: A=logT1=ECL 式中 A 为吸光度;T 为透光率;E 为吸收系数;C 为溶液浓度;L 为光路长度。
如溶液的浓度(C )为1%(g/ml ),光路长度(L )为lcm ,相应的吸光度即为吸收系数以%11cm E 表示。
如溶液的浓度(C )为摩尔浓度(mol/L ),光路长度为lcm 时,则相应有吸收系数为摩尔吸收系数,以ε表示。
2 仪器紫外-可见分光光度计主要由光源、单色器、样品室、检测器、记录仪、显示系统和数据处理系统等部分组成。
为了满足紫外-可见光区全波长范围的测定,仪器备有二种光源,即氘灯和碘钨灯,前者用于紫外区,后者用于可见光区。
单色器通常由进光狭缝、出光狭缝、平行光装置、色散元件,聚焦透镜或反射镜等组成。
色散元件有棱镜和光栅二种,棱镜多用天然石英或熔融硅石制成,对200~40Onm波长光的色散能力很强,对600nm以上波长的光色散能力较差,棱镜色散所得的光谱为非匀排光谱。

课后部分练习答案第3章紫外-可见分光光度法Ui-visP503.1分子光谱如何产生?与原子光谱的主要区别它的产生可以看做是分子对紫外-可见光光子选择性俘获的过程,本质上是分子内电子跃迁的结果。
区别:分子光谱法是由分子中电子能级、振动和转动能级的变化产生的,表现形式为带光谱;原子光谱法是由原子外层或内层电子能级的变化产生的,它的表现形式为线光谱。
3.2说明有机化合物紫外光谱产生的原因,其电子跃迁有那几种类型?吸收带有那几种类型?有机化合物的紫外-可见光谱决定于分子的结构和分子轨道上电子的性质。
有机化合物分子的特征吸收波长(λmax)决定于分子的激发态与基态之间的能量差跃迁类型与吸收带σ→σ* 发生在远紫外区,小于200nmn →σ* 吸收峰有的在200nm附近,大多仍出现在小于200nm 区域π→π* 一般在200nm左右,发生在任何具有不饱和键的有机化合物分子n →π* 一般在近紫外区,发生在含有杂原子双键的不饱和有机化合物中。
3.3在分光光度法中,为什么尽可能选择最大吸收波长为测量波长?因为在实际用于测量的是一小段波长范围的复合光,由于吸光物质对不同波长的光的吸收能力不同,就导致了对Beer定律的负偏离。
吸光系数变化越大,偏离就越明显。
而最大吸收波长处较平稳,吸光系数变化不大,造成的偏离比较少,所以一般尽可能选择最大吸收波长为测量波长。
3.5分光光度法中,引起对Lambert-Beer定律偏移的主要因素有哪些?如何让克服这些因素的影响偏离Lambert-Beer Law的因素主要与样品和仪器有关。
样品:(1)浓度(2)溶剂(3)光散射的影响;克服:稀释溶液,当c <0.01mol/L时, Lambert-Beer定律才能成立仪器:(1)单色光(2)谱带宽度;克服:Lambert-Beer Law只适用于单色光,尽可能选择最大吸收波长为测量波长3.9 按照公式A=-lgT计算第5章分子发光分析法P1085.3(b)的荧光量子率高,因为(b)的化合物是刚性平面结构,具有强烈的荧光,这种结构可以减少分子的振动,使分子与溶剂或其他溶质分子的相互作用减少,即减少了碰撞失活的可能性5.4苯胺的荧光在10时更强,苯胺在酸性溶液中易离子化,单苯环离子化后无荧光;而在碱性溶液中以分子形式存在,故显荧光。

紫外-可见分光光度法是在190~800nm波长范围内测定物质的吸光度,用于鉴别、杂质检查和定量测定的方法。
当光穿过被测物质溶液时,物质对光的吸收程度随光的波长不同而变化。
因此,通过测定物质在不同波长处的吸光度,并绘制其吸光度与波长的关系图即得被测物质的吸收光谱。
从吸收光谱中,可以确定最大吸收波长λmax和最小吸收波长λmin。
物质的吸收光谱具有与其结构相关的特征性。
因此,可以通过特定波长范围内样品的光谱与对照光谱或对照品光谱的比较,或通过确定最大吸收波长,或通过测量两个特定波长处的吸收比值而鉴别物质。
用于定量时,在最大吸收波长处测量一定浓度样品溶液的吸光度,并与一定浓度的对照溶液的吸光度进行比较或采用吸收系数法求算出样品溶液的浓度。

第3章紫外-可见分光光度法习题(一)选择题单选题1.在吸收光度法中,I t /I0定义为透过光强度与入射光强度之比,称为()A 吸光度B 透光率C 百分透光率D 消光度2.某吸光物质在一定条件下,表现出强吸光能力,其摩尔吸光系数为()A ε>104B 104>ε>103C 103>ε>102D ε<101 3.符合Beer定律的有色溶液稀释时,其最大吸收峰()A 波长位置向长波方向移动,峰高值增加B 波长位置向短波方向移动,峰高值降低C 波长位置不移动,但峰高值降低D 波长位置不移动,但峰高值增加4.符合朗伯定律的有色溶液,其吸光物质液层厚度增加时,最大吸收峰()A 波长位置向长波方向移动,峰高值增加B 波长位置向短波方向移动,峰高值降低C 波长位置不移动,但峰高值降低D 波长位置不移动,但峰高值增加5.有两个完全相同的1cm厚度的比色皿,分别盛有甲、乙两种不同浓度同一有色物质的溶液,在同一波长下测得的吸光度分别为甲0.260,乙0.390,若甲的浓度为4.40×10-3 mo l/L,则乙的浓度为()A 2.20×10-3mol/LB 3.30×10-3mol/LC 4.40×10-3mol/LD 6.60×10-3 mol/L6.分光光度法中,要使所测量的物质其浓度相对误差ΔC/C较小,宜选用的吸光度读数范围为()A 0~0.1B 0.1~0.2C 0.2~0.7 D 0.7~1.07.某显色剂在pH3~6时显黄色,pH6~12时显橙色,pH大于13时,呈红色,该显色剂与某金属离子配合后呈现红色,则该显色反应应在()A 弱酸溶液中进行B 弱碱溶液中进行C 强酸溶液中进行D 强碱溶液中进行8.制备一条标准曲线,通常要测定()A 3个点B.3~4个点C.5~7个点D.8~10个点9.结构中含有助色团的分子是()A CH3OHB CH3COCH3C C2H6D C6H5NO210.下列化合物中,其紫外光谱上能同时产生K带、R带的是()A CH3COCH3B CH2=CHCH2CH2COCH3C CH≡C—CHOD CH3CH2CH2CH2OH11.对200~400nm范围内的辐射没有吸收的物质是()A BCD CH2=CHCH=CH212.吸光物质紫外-可见吸收光谱的峰位(λmax、λmin等)取决于()A 电子跃迁几率B 光程C 入射光强度D 电子跃迁能级差13.摩尔吸光系数的大小取决于()A 电子跃迁几率B 光程C 入射光强度 D 电子跃迁能级差14.下列各种类型的电子跃迁,所需能量最大的是()A n→π*B π→π*C n→σ*D σ→σ*15.下列各种类型的电子跃迁,所需能量最小的是()A σ→σ*B π→σ*C π→π*D n→π*16.下列各基团,不属于助色团的是()A —OHB —BrC —NHR D —NO217.下列各基团,不属于发色团的是()A C=CB C=OC —OH D —NO218.可见分光光度法中要求显色剂与产物最大吸收波长的差别要大于等于()A 20nm B 30nm C 40n m D 60nm19.光电管的阴极内部涂层是()A 碱金属B 碱土金属C 非金属D 过渡金属20. 相同条件下只是不加试样,依次加入各种试剂和溶剂所得到的溶液称为()A 溶剂空白B 试剂空白C 试样空白D平行操作空白21. 光学分析法中,lgI0/I t称为()A 透光率B 吸光度C 百分透光率D 消光度22.测定浓度所产生的相对误差为最小的百分透光率为()A 0.434%B 28.4%C 35. 6%D 36.8%23.当吸光度A值为多少时,测定浓度所产生的相对误差为最小()A 0.368B 0.434C 4.34 D 36.824.吸收强度增加的现象为()A 蓝移B 红移C 淡色效应D 浓色效应25.可见—紫外分光光度法中配对的两只吸收池百分透光率的差值应小于()A 0.5%B 1.0% C1.5% D2.0%26.双波长分光光度法测定的关键是选择()A 肩峰波长B 最大吸收波长C 最小吸收波长D 等吸收波长27.紫外光谱中,引起K带的跃迁方式是()A σ→σ*B n→σ*C n→π*D π→π*28.由n→π*跃迁所产生的吸收带为()A K带B R带C B 带D E带29.在CH3COCH3分子中,其跃迁方式是()A π→π*;n→π*B π→π*;n→σ*C n→σ*;n→π* Dπ→π*30.某共轭二烯烃在正已烷中的λmax为219nm,若改在乙醇中测定,吸收峰将()A 红移B 蓝移C 峰高降低D 峰高变高31. CH2CHCHCH2分子中具有的吸收带是()A R带B K带C B带D E带多选题32.分光光度计的种类和型号繁多,并且在不断发展和改进,但都离不开以下几个主要部件()A 光源B 单色器C 吸收池D 检测器 E 信号显示系统33.可见分光光度计的光源可用()A.钨丝灯B.卤钨灯C.低压氢灯D.氘灯E.氦灯34.分光光度法测定中,使用比色皿时,以下操作正确的是()A.比色皿的外壁有水珠 B.手捏比色皿的毛面 C.手捏比色皿的磨光面D.用卫生棉擦去比色皿外壁的水珠 E.待测液注到比色皿的2/3高度处35.标准曲线法在应用过程中,应保证的条件有()A.至少有5~7个点; B.所有的点必须在一条直线上;C.待测样品浓度应包括在标准曲线的直线范围之内;D.待测样品必须在与标准曲线完全相同的条件下测定,并使用相同的溶剂和显色系统E.测定条件变化时,要重新制作标准曲线。
第3章 紫外-可见分光光度法一、内容提要1、电子跃迁类型 σ→σ*跃迁、π→π*跃迁、n →π*跃迁、n →σ*跃迁、电荷迁移跃迁、配位场跃迁。
2、常用术语1)最大吸收波长:曲线上的峰(吸收峰)所对应的波长,以m ax λ表示。
2)最小吸收波长:曲线上的谷(吸收谷)所对应的波长,以m in λ表示。
3)肩峰:在吸收峰旁边存在一个曲折,对应的波长以sh λ表示。
4)末端吸收:在200nm 附近,吸收曲线呈现强吸收却不成峰形的部分。
5)生色团:分子中可以吸收光子而产生电子跃迁的原子基团。
有机化合物的生色团主要是含有π→π*或n →π*跃迁的基团(>C =C <、>C =O 、>C =S 、—N =N —、—N =O 等)。
6)助色团:含有非键电子的杂原子饱和基团(如—OH 、—SH 、—OR 、—SR 、—NH 2、—Cl 、—Br 、—I 等),它们本身不能吸收波长大于200nm 的光,但当它们与生色团相连时,能使该生色团的吸收峰向长波长方向移动,并使吸收强度增强。
7)红移和蓝移:化合物常因结构的变化(发生共轭作用、引入助色团等)或溶剂的改变而导致吸收峰的最大吸收波长m ax λ发生移动。
m ax λ向长波长方向移动称为红移;m ax λ向短波长方向移动称为蓝移。
8)增色效应和减色效应:因化合物的结构改变或其他原因而导致吸收强度增强的现象称为增色效应,有时也称为浓色效应;反之,导致吸收强度减弱的现象称为减色效应,有时也称为淡色效应。
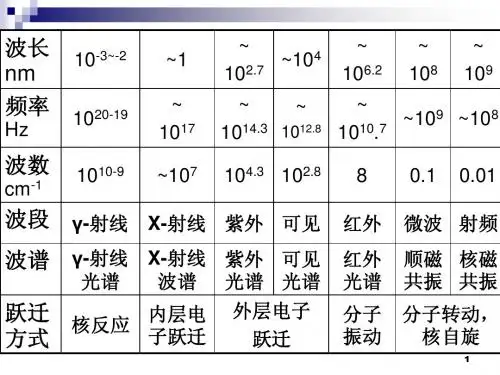
9)吸收带:不同类型的电子跃迁在紫外-可见光谱中呈现的不同特征的吸收峰。
10)强带和弱带:摩尔吸收系数大于104的吸收带为强带;摩尔吸收系数小于102的吸收带为弱带。
3、吸收带1)R 带:跃迁类型为n →π*,波长范围为250~500nm ,吸收强度ε<102。
溶剂极性增大时蓝移。
R 带是杂原子的不饱和基团(>C =O 、-NO 、-NO 2、-N =N -等)的特征。
2)K 带:跃迁类型为π→π*(共轭),波长范围为210~250nm ,吸收强度ε>104。
共轭双键延长时红移,且吸收强度增大。
溶剂极性增大时红移。
3)B 带:跃迁类型为苯环的骨架伸缩振动与苯环内的π→π*跃迁,波长范围为230~270nm ,吸收强度ε≈200。
蒸气状态下可呈现精细结构。
B 带是芳香族(包括杂芳香族)化合物的特征吸收带之一4)E带:E1带的跃迁类型为苯环上孤立乙烯基的π→π*跃迁,E2带的跃迁类型为苯环上共轭二烯基的π→π*跃迁,E1带波长约为180nm,E2带波长为200nm以上,吸收强度ε≈104(E1带),ε≈103(E2带)。
5)影响吸收带的因素4、测量条件的选择1)测量波长的选择最大吸收原则吸收最大、干扰最小2)吸光度范围的选择为了减小吸光度或浓度测定结果的相对误差,应控制吸光度在0.2~0.7范围内,最好为0.434。
3)参比溶液的选择包括溶剂空白、试剂空白、试样空白等。
5、显色反应本身无吸收或只有弱吸收的物质,在一定条件下加入试剂,经过适当的化学反应定量转变为有色化合物后再行测定。
这种选用适当的试剂与不吸收紫外-可见光的被测物质定量反应生成对紫外-可见光有较大吸收的物质的反应称为显色反应,反应中所加试剂称为显色剂。
对显色反应的要求包括:灵敏度较高、定量关系确定、选择性好、显色产物稳定性好、显色剂与显色产物之间应有显著的颜色差别(显色产物与显色剂的最大吸收波长的差别应在60nm 以上)。
6、显色条件的选择影响显色反应的主要因素有显色剂用量、溶液酸度、反应时间、温度、溶剂等。
通常采用单因素变化法确定各影响因素的最佳取值范围。
7、紫外-可见分光光度计1)主要部件光源:钨灯或卤钨灯(可见光区)、氢灯或氘灯(紫外光区)。
单色器:常用的色散元件有棱镜和光栅。
吸收池:玻璃吸收池只能用于可见光区;而石英吸收池既适用于紫外光区,也适用于可见光区。
检测器:包括光电池、光电管、光电倍增管、光二极管阵列检测器。
2)类型3)分光光度计的校正波长的校正、吸光度的校正、比色皿的校正(在测定波长处比较盛有空白溶液的各比色皿的百分透光率,要求相互间不应超过0.5%)。
8、分析方法1)定性分析对比法:在相同条件下分别测得未知试样和标准样品的紫外-可见吸收光谱,将两者进行对照、比较,如果它们完全相同,则待测试样与标准样品可能是同一种化合物;反之,如果存在明显差别,则肯定不是同一种化合物。
计算法:Woodward-Fieser 规则可用于计算共轭体系和α, β-不饱和醛酮类化合物的最大吸收波长;Scott 规则可用于计算芳香族羰基的衍生物在乙醇中的最大吸收波长。
2)单组分的定量分析吸收系数法:bE A c ⋅=%11cm 样样 或 b A c ⋅=ε样样。
对照法:对对样样A c A c =。
标准曲线法:配制一系列不同浓度c 的对照品溶液,在相同条件下分别测定吸光度A ,利用最小二乘法计算A -c 线性回归方程,根据回归方程对被测物质进行定量分析。
3)多组分的定量分析 解线性方程组法:y y x x y x y x C E C E A A A 11111+=+=+y y x x y x y x C E C E A A A 22222+=+=+双波长分光光度法——等吸收法:()b c E E A A A A A x x1x 2x1x212-=-=-=∆4)结构分析不饱和有机化合物分子的π→π*和n →π*跃迁的吸收谱带处于紫外-可见光区,因此,紫外-可见吸收光谱可以提供这些化合物的共轭体系和某些生色团、助色团的特征信息,从而用来推断化合物的骨架结构和官能团、判断异构体等。
二、重点和难点本章重点:电子跃迁类型、吸收带、测量条件的选择、定量分析方法。
本章难点:影响吸收带的因素、显色条件的选择、多组分定量分析方法。
三、思考题与习题选解10. 某有色溶液在1cm 比色皿中测得吸光度为0.500。
将该溶液稀释到原浓度的一半,并转移至3cm 的比色皿中,试计算在相同波长下测得的吸光度和透光率。
解221121c b c b A A = 750.0500.01213111222=⨯⨯==A c b c b A%18=T11. 测定电镀废水中的铬(Ⅵ),取500mL 水样,经浓缩及预处理后,转移至100mL 容量瓶中定容,移取20mL 试液,调节酸度后,加入二苯碳酰二肼溶液显色,并定容为25mL 。
在5.00cm 比色皿中于540nm 波长处测得吸光度为0.680。
已知)cm m ol /(L 102.44⋅⨯=ε。
求水样中铬(Ⅵ)的质量浓度。
解L /mol 1024.3L /mol 00.5102.4680.064-⨯=⨯⨯==b Ac ε L /m g 042.0L /m g 105000.10020259961.511024.336)VI (Cr =⨯⨯⨯⨯⨯=-ρ12. 用硅钼蓝比色法测定钢中硅的含量。
根据下列数据绘制标准曲线 硅标准溶液的浓度(mg/mL )0.050 0.100 0.150 0.200 0.250 吸光度A0.2120.4190.6300.8411.011测定试样时,称取钢样0.500g ,溶解后转移至50mL 容量瓶中,用与标准溶液相同的测量条件测得吸光度为0.521。
求试样中硅的质量分数。
解以最小二乘法进行线性回归,得0166.0040.4+=ρAAρ将521.0=A 代入上式,得mL /mg 125.0=ρ%25.1%10010500.00.50125.03Si =⨯⨯⨯=w 13. 用磺基水杨酸比色法测铁,以1.000g 铁铵矾(NH 4Fe(SO 4)2·12H 2O )溶于500mL 水制成铁的标准溶液。
取6.0mL 该标准溶液,于50mL 容量瓶中显色,测得吸光度为0.480。
吸取5.00mL 待测试液,稀释至250mL ,移取2.00mL 至50mL 容量瓶中,与标准溶液同样显色,测得吸光度为0.500。
求试液中铁的质量浓度。
解由题意可知,铁标准溶液的浓度为L /g 2316.0L /g 22.482845.5510500000.13Fe =⨯⨯=-ρ显色液中铁的浓度为L /g 02779.0L /g 0.500.62316.0Fe=⨯='ρ 因此,L /g 02895.0L /g 02779.0480.0500.0=⨯=⋅=标标样样ρρA A试液中铁的浓度为L /g 2.36L /g 00.525000.25002895.0=⨯⨯=x ρ14. 称取维生素C 试样0.0500g ,溶于100mL 0.02mol/L H 2SO 4溶液中,精密吸取此溶液2.00mL ,定容至100mL ,以1cm 石英比色皿于243nm 波长下测得吸光度为0.551。
已知维生素C 的吸收系数560%1cm 1=E 。
求维生素C 的质量分数。
解m L 100/g 1084.9m L 100/g 1560551.04%1cm 1VC -⨯=⨯=⋅=bE Aρ%4.98%1000500.000.21001084.94VC =⨯⨯⨯=-w15. 甲基红的酸式体(HIn )和碱式体(In −)的最大吸收波长分别为528nm 和400nm ,在不同实验条件下以1cm 比色皿测得吸光度如下表,求甲基红的浓度c x 。
浓度(mol/L ) 酸度 A 528 A 400 1.22×10−5 0.1mol/L HCl 1.783 0.077 1.09×10−50.1mol/L NaHCO 30.00 0.753 c xpH = 4.181.4010.166解)cm mol /(L 1046.1)cm mol /(L 1022.1783.155528,HIn ⋅⨯=⋅⨯=-ε )cm mol /(L 1031.6)cm mol /(L 1022.1077.035400,HIn ⋅⨯=⋅⨯=-ε 0528,In =-ε )cm mol /(L 1091.6)cm mol /(L 1009.1753.045400,In⋅⨯=⋅⨯=--ε 根据吸光度的加和性,得0HIn 528,HIn 528+=c A ε--+=In 400,In HIn 400,HIn 400c c A εε代入数据,得L /mol 1060.9L /mol 1046.1401.165HIn -⨯=⨯=c L/mol 1053.1L /mol 1091.61060.91031.6166.06463400,InHIn400,HIn 400In --⨯=⨯⨯⨯⨯-=-=--εεc A c L /mol 1011.1L /mol )1053.11060.9(566In HIn ---⨯=⨯+⨯=+=-c c c x16. 某药物浓度为1.0×10−3mol/L ,在270nm 波长下测得吸光度为0.400,在345nm 波长下测得吸光度为0.010。