铁的氢氧化物
- 格式:xls
- 大小:19.00 KB
- 文档页数:96


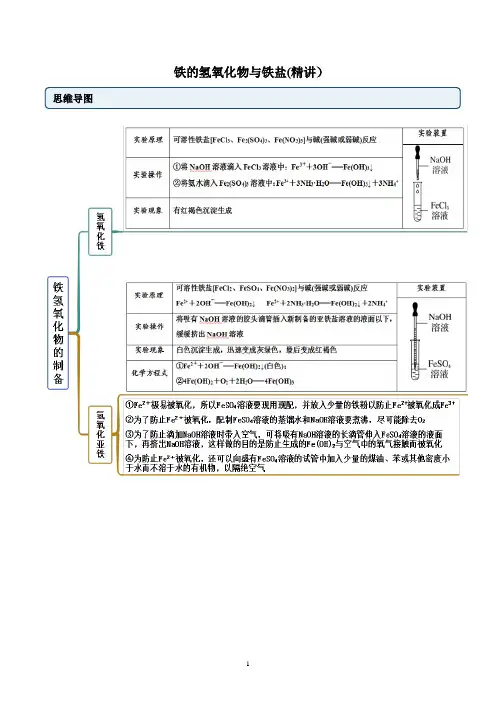
铁的氢氧化物与铁盐(精讲)思维导图常见考点考点一铁的氢氧化物【例1】有关铁的氢氧化物的说法中,错误的是A.Fe(OH)2是一种黑色固体,不稳定,在空气中易被氧化转变为红褐色固体B.Fe(OH)2具有还原性,在空气中易被氧化为Fe(OH)3C.Fe(OH)2、Fe(OH)3都具有不稳定性,受热能分解D.Fe(OH)3胶体呈红褐色、透明,能产生丁达尔现象【答案】A【解析】A.Fe(OH)2是一种白色固体,不稳定,在空气中易被氧化转变为红褐色固体Fe(OH)3:4Fe(OH)2+O2+2H2O=4Fe(OH)3,故A错误;B.Fe(OH)2具有还原性,在空气中易被氧化为Fe(OH)3,故B正确;C.Fe(OH)2、Fe(OH)3都具有不稳定性,受热能分解为相应的氧化物和水,故C正确;D.Fe(OH)3胶体呈红褐色、透明,能产生丁达尔现象,故D正确;故选A。
【例1-2】(2022·山西太原·高一期末)在实验室里用以下方法制备并较长时间保存Fe(OH)2,能成功的是A.B.C.D.【答案】C【解析】A.NaOH溶液加入时会带入氧气,会氧化氢氧化亚铁变为氢氧化铁,不能成功得到氢氧化亚铁,故A不符合题意;B.氯化铁和氢氧化钠溶液反应生成氢氧化铁沉淀,不能得到氢氧化亚铁沉淀,故B不符合题意;C.装置是利用铁和稀硫酸现制FeSO4,并用产生的H2赶走试管和溶液中的氧气,故C符合题意;D.氯化亚铁和氢氧化钠溶液反应生成氢氧化亚铁沉淀,胶头滴管伸入到液面以下,暂时隔绝氧气,但是不能较长时间保存Fe(OH)2,故D不符合题意。
综上所述,答案为C。
【一隅三反】Fe(OH)沉淀,下列说法不正确的是1.(2022·河北邯郸·高一期末)用如图装置可以制备2A.该实验应该先打开C,一段时间后再关闭CB.实验完成时,在A容器中得到白色沉淀FeSO溶液中,最终得到红褐色沉淀C.如果将NaOH溶液直接滴入4D.本实验制备的氢氧化亚铁可以相对较长时间保持白色状态【答案】B【解析】铁和稀硫酸反应生成硫酸亚铁和氢气,生成的氢气排出装置内的空气,关闭止水夹后,利用产生气体的压强将生成的硫酸亚铁压入到B容器中生成白色沉淀。


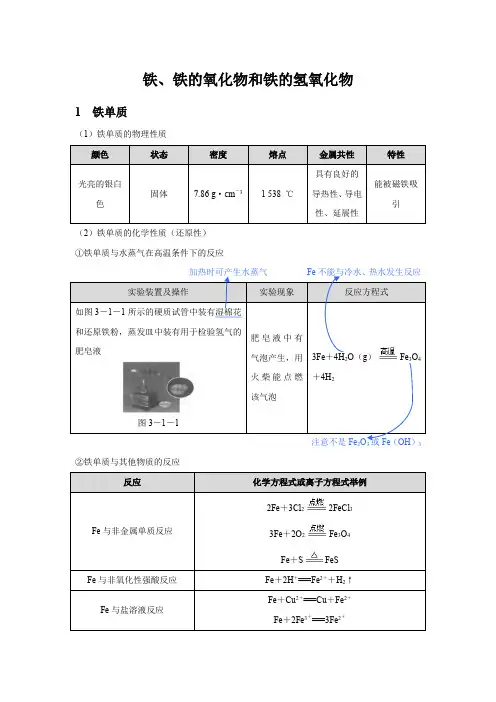
铁、铁的氧化物和铁的氢氧化物1 铁单质(1)铁单质的物理性质(2)铁单质的化学性质(还原性)①铁单质与水蒸气在高温条件下的反应如图3-1-1所示的硬质试管中装有湿棉花和还原铁粉,蒸发皿中装有用于检验氢气的肥皂液图3-1-13Fe+4H2O(g)Fe3O4+4H2②铁单质与其他物质的反应2Fe+3Cl22FeCl33Fe+2O2Fe3O4Fe+S FeS教材延伸(1反应生成Fe 3O 4和H 2CO 和H 2。
(2)从铁与Cl 2、O 2、S 的反应中铁元素化合价的变化情况可以比较Cl 2、O 2、S 的氧化性强弱,即氧化性:Cl 2>O 2>S 。
2 铁的氧化物(1)铁的常见氧化物的性质及用途名师提醒(1)FeO 不稳定,在空气里受热,能迅速被氧化成Fe 3O 4。
(2)“朱门酒肉臭”中的“朱门”是指以Fe 2O 3为原料制备的油漆漆制的门。
(3)Fe 3O 4有固定的组成,属于纯净物,不是混合物。
Fe 3O 4可看成FeO ·Fe 2O 3,所以在书写其与硝酸的反应方程式时可看成硝酸将其中的二价铁氧化成三价铁。
(4)在高温条件下,Fe 与Fe 2O 3可以发生反应,当铁足量时发生反应Fe +Fe 2O 33FeO ,当铁不足时发生反应Fe+4Fe2O33Fe3O4。
(2)铝热反应【实验操作】①把两张圆形滤纸分别折叠成漏斗状套在一起,使四周都是四层。
把内层“纸漏斗”取出,在底部剪一个小孔,用水润湿,再与另一“纸漏斗”套在一起,架在铁架台的铁圈上,干燥使反应完全②把5 g炒干的三氧化二铁粉末和2 g铝粉混合均匀,放在“纸漏斗”中,在混合物上面加③用燃着的木条点燃镁条,观察现象。
【实验记录】热,火星四射;③“纸漏斗”Al与Fe2O3反应,置换出铁,反应方程式为2Al +Fe2O3Al2O3+2Fe教材延伸铝热反应3 铁的氢氧化物(1)Fe (OH )2与Fe (OH )3的性质比较不稳定[比Fe (OH )2稳定],受热易分解,2Fe (OH )3Fe 2O 3+3H 2O(2)Fe (OH )2在空气中转化为Fe (OH )3Fe (OH )2中铁元素的化合价为+2,具有还原性。
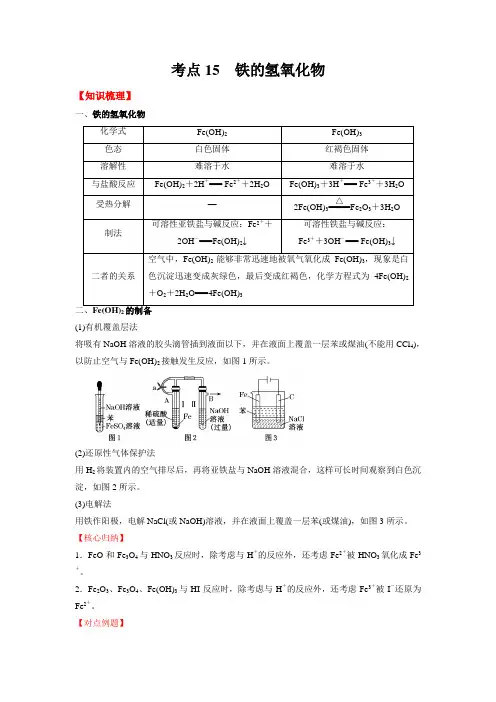
考点15 铁的氢氧化物【知识梳理】一、铁的氢氧化物化学式Fe(OH)2Fe(OH)3色态白色固体红褐色固体溶解性难溶于水难溶于水与盐酸反应Fe(OH)2+2H+=== Fe2++2H2O Fe(OH)3+3H+=== Fe3++3H2O受热分解—2Fe(OH)3=====△Fe2O3+3H2O制法可溶性亚铁盐与碱反应:Fe2++2OH-===Fe(OH)2↓可溶性铁盐与碱反应:Fe3++3OH-=== Fe(OH)3↓二者的关系空气中,Fe(OH)2能够非常迅速地被氧气氧化成Fe(OH)3,现象是白色沉淀迅速变成灰绿色,最后变成红褐色,化学方程式为4Fe(OH)2+O2+2H2O===4Fe(OH)3二、Fe(OH)2的制备(1)有机覆盖层法将吸有NaOH溶液的胶头滴管插到液面以下,并在液面上覆盖一层苯或煤油(不能用CCl4),以防止空气与Fe(OH)2接触发生反应,如图1所示。
(2)还原性气体保护法用H2将装置内的空气排尽后,再将亚铁盐与NaOH溶液混合,这样可长时间观察到白色沉淀,如图2所示。
(3)电解法用铁作阳极,电解NaCl(或NaOH)溶液,并在液面上覆盖一层苯(或煤油),如图3所示。
【核心归纳】1.FeO和Fe3O4与HNO3反应时,除考虑与H+的反应外,还考虑Fe2+被HNO3氧化成Fe3+。
2.Fe2O3、Fe3O4、Fe(OH)3与HI反应时,除考虑与H+的反应外,还考虑Fe3+被I-还原为Fe2+。
【对点例题】例1.(2023·河南河南·高一阶段练习)下列各图示中能较长时间看到Fe(OH)2白色沉淀的是()A.①②③B.①②④C.①②③④D.②③④【答案】B【解析】Fe(OH)2在空气中很容易被氧化为红褐色的Fe(OH)3,发生4Fe(OH)2+O2+2H2O = 4Fe(OH)3。
要较长时间看到Fe(OH)2白色沉淀,就要排除装置中的氧气或空气。
①、②原理一样,都是先用氢气将装置中的空气排尽,并使生成的Fe(OH)2 处在氢气的保护中;③无法避免氧气与氢氧化亚铁的反应;④中液面加苯阻止了空气进入,能较长时间看到白色沉淀,选B。



铁的氢氧化物及其盐(一)铁的氢氧化物化学式 Fe(OH)2 Fe(OH)3 色态 白色固体 红褐色固体 溶解性 难溶于水难溶于水与盐酸 反应 Fe(OH)2+2H +===Fe 2++2H 2OFe(OH)3+3H +===Fe 3++3H 2O受热 分解 —2Fe(OH)3=====△Fe 2O 3+3H 2O制法 可溶性亚铁盐与强碱溶液反应:Fe 2++2OH -===Fe(OH)2↓可溶性铁盐与强碱溶液反应:Fe 3++3OH -===Fe(OH)3↓[注意] ①空气中,Fe(OH)2能够非常迅速地被氧气氧化成Fe(OH)3,现象是白色沉淀迅速变成灰绿色,最后变成红褐色,化学方程式为4Fe(OH)2+O 2+2H 2O===4Fe(OH)3。
①制备Fe(OH)2时要避开O 2的环境。
(二)亚铁盐和铁盐 1.亚铁盐 (1)氧化性与还原性含有Fe 2+的溶液呈浅绿色,Fe 2+既有氧化性,又有还原性,Fe 2+与Zn 、Cl 2反应的离子方程式分别为Fe 2++Zn===Fe +Zn 2+、2Fe 2++Cl 2===2Fe 3++2Cl -。
(2)可水解 保存或配制FeSO 4时常加入少量H 2SO 4的理由是(写离子方程式)Fe 2++2H 2OFe(OH)2+2H +。
2.铁盐 (1)氧化性 含有Fe 3+的溶液呈棕黄色,Fe 3+具有氧化性,Fe 3+与Fe 、Cu 反应的离子方程式分别为2Fe 3++Fe===3Fe 2+、2Fe 3++Cu===2Fe 2++Cu 2+。
(2)特性含有Fe 3+的盐溶液遇到KSCN 时变成红色。
(3)可水解①利用Fe 3+易水解的性质,实验室可将FeCl 3饱和溶液滴入沸水中制取氢氧化铁胶体,反应的化学方程式:FeCl 3+3H 2O=====△Fe(OH)3(胶体)+3HCl 。
②利用Fe 3+易水解的性质,工业上常用调节pH 方法除去溶液中的铁离子。
