乙炔的分子结构和物理性质
- 格式:ppt
- 大小:847.00 KB
- 文档页数:5


《乙炔》教学设计一、教学目标1、知识与技能目标(1)学生能够了解乙炔的分子结构和物理性质。
(2)掌握乙炔的化学性质,包括氧化反应、加成反应等。
(3)学会乙炔的实验室制取方法和实验操作要点。
2、过程与方法目标(1)通过实验探究,培养学生的观察能力、分析问题和解决问题的能力。
(2)通过对乙炔化学性质的学习,提高学生的逻辑思维能力和知识迁移能力。
3、情感态度与价值观目标(1)培养学生严谨的科学态度和实事求是的精神。
(2)激发学生学习化学的兴趣,增强学生对化学与生活密切联系的认识。
二、教学重难点1、教学重点(1)乙炔的化学性质,特别是加成反应。
(2)乙炔的实验室制取方法和实验操作。
2、教学难点(1)加成反应的原理和反应方程式的书写。
(2)实验室制取乙炔时的实验装置和操作要点。
三、教学方法讲授法、实验法、讨论法、多媒体辅助教学法四、教学过程1、导入新课通过展示生活中常见的塑料制品、橡胶制品等,引出有机化合物在生活中的广泛应用。
提问学生:“这些有机化合物是如何制取的呢?”从而引出本节课的主题——乙炔。
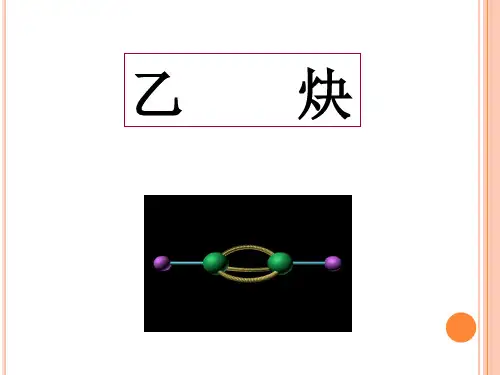
2、新课讲授(1)乙炔的分子结构展示乙炔的球棍模型和比例模型,引导学生观察并分析乙炔的分子结构。
讲解乙炔分子中碳原子的成键方式(sp 杂化),以及碳碳三键的特点。
(2)乙炔的物理性质通过展示实物、图片或视频等资料,让学生了解乙炔的颜色、状态、气味、密度、溶解性等物理性质。
强调乙炔是一种无色、无味、密度比空气略小、微溶于水、易溶于有机溶剂的气体。
(3)乙炔的化学性质①氧化反应演示乙炔在空气中燃烧的实验,让学生观察火焰的颜色(明亮的火焰,伴有浓烈的黑烟)。
讲解产生黑烟的原因(乙炔含碳量高,燃烧不充分)。
写出乙炔燃烧的化学方程式:2C₂H₂+ 5O₂ → 4CO₂+2H₂O。
演示乙炔通入酸性高锰酸钾溶液的实验,观察溶液颜色的变化(紫红色褪去),说明乙炔具有还原性。
②加成反应讲解加成反应的概念,以乙炔与溴水的反应为例,演示实验并写出化学方程式:CH≡CH + 2Br₂ → CHBr₂CHBr₂。

CCHHH CCC F 3120o180O煤化工和乙炔一、乙炔的组成和结构:分子式:C 2H 2 电子式:结构式:H —C ≡C —H 结构简式:CH ≡CH 乙炔:直线型,键角180°[例题] CH 3—CH==CH —C ≡C —CF 3分子结构的下列叙述中,正确的是( B C ) A 、6个碳原子有可能都在一条直线上B 、6个碳原子不可能都在一条直线上C 、6个碳原子都在同一平面上D 、6个碳原子不可能都在同一平面上解析:该物质空间结构可表示为:注:该物质并不是所有原子均共面,如—CH 3中的3个氢原子,—CF 3中的3个氟原子均类CH 4中氢原子,是空间的。
甲烷、乙烯、乙炔结构的比较结构简式 CH 3—CH 3CH 2==CH 2 HC ≡CH 键角 109°28′(约) 120° 180° 碳碳键长(m ) 1.54×10--10 1.33×10--10 1.20×10--10碳碳键能(KJ/mol )384615812乙炔的键能812<3×384,也比C —C 单键和C==C 双键键能之和小,所以说明乙炔的C ≡C 中有两个键易断裂。
三键中一个为C —C δ键,两个为π键。
二、乙炔的实验室制法:1、原料:电石(CaC 2中常含CaS 、Ca 3P 2)、饱和食盐水电石来源:CaCO 3一一→CaO + CO 2↑ CaO + 3C 一一→CaC 2 + CO ↑(电炉中进行)2、反应原理:CaC 2 + 2H 2O Ca(OH)2 + C 2H 2↑ 离子型碳化物,与水的反应相当于水解 [解释]乙炔为无色、无味气体,常因含有H 2S 、PH 3等杂质而有特殊难闻的臭味。
副反应: Ca 3P 2 + 6H 2O 3Ca(OH)2 + 2PH 3↑ CaS +2H 2O Ca(OH)2 + H 2S ↑H 2S 、PH 3气体具有还原性,会影响C 2H 2的检验,应注意除杂(用CuSO 4除H 2S ,PH 3,CuSO 4可氧化PH 3。


乙炔是易燃易爆气体乙炔,化学式为C2H2,是一种无色、有刺激性味道的易燃易爆气体。
乙炔在常温下为无色气体,易燃,能和空气形成爆炸性混合气体,是危险的化学物质之一。
下面将对乙炔的性质、危险性和安全措施等进行介绍。
乙炔的性质乙炔的物理性质如下:•分子量:26.02•熔点:-80.8℃•沸点:-84℃•密度:0.91 g/cm³•闪点:-18℃•爆炸极限:2.5%-82.5%乙炔是一种电负性很强的分子,且其分子形态使得分子中的所有碳-碳键角度都是180度,因此其化学性质非常活泼。
乙炔和氧气在特定条件下能够发生剧烈的反应,产生强烈的热量和光能。
由于其易燃性和爆炸性,乙炔常被用于焊接和切割金属,也用于化工和制药行业的生产过程中。
乙炔的危险性由于乙炔是一种易燃易爆的气体,因此其存在许多危险性。
主要包括以下方面:爆炸危险乙炔能与空气形成一种可燃混合物,具有一定的爆炸性。
当混合物浓度介于2.5%至82.5%之间时,就有可能发生爆炸。
由于乙炔的密度比空气小,所以在室内存在乙炔时,乙炔会浮在空气上方,这进一步增加了爆炸的危险性。
窒息危险乙炔在空气中的浓度超过其燃点时,会产生一定等量的一氧化碳,一氧化碳是无色、无味的毒气,能抑制人体对氧气的吸入。
长时间暴露在高浓度的一氧化碳下,会对身体造成严重损害,甚至危及生命。
刺激性危险乙炔在一定浓度下会对人体眼睛、皮肤和呼吸道造成刺激。
长时间暴露在高浓度的乙炔下,会对健康造成不良影响。
安全措施由于乙炔的危险性较高,它应该在使用前进行充分的安全措施。
主要包括以下内容:储存乙炔需要在封闭、阴凉、干燥的环境下储存。
储存容器应该符合相应的标准,并能够有效地避免乙炔和空气接触。
运输运输时,乙炔应该在安全的储存容器内进行,必须保证储存容器牢固而不会破裂。
焊接和切割在焊接和切割乙炔前,应该对周围环境进行检查,清除有可能引火的物品,并保证使用安全的防护措施。
废弃物处理在使用完乙炔后,需要将容器清洗干净,并对废弃的乙炔进行妥善处理。


乙炔的知识点总结1. 物理性质乙炔是一种无色、有毒、易燃的气体,味道刺激性。
乙炔的密度为0.911g/L,比空气轻,易上升并扩散,容易形成爆炸性的混合物。
乙炔可以在-80℃下液化,也可以通过加压制成液态。
2. 化学性质乙炔具有高度的活性,容易与氧气、氯气等发生反应,产生大量的热能。
乙炔与氧气在适当条件下可以发生爆炸性反应,因此在存储和使用时需要特别注意安全。
乙炔还可以与卤素发生加成反应,生成相应的卤代烃。
3. 制备方法工业上的乙炔主要是通过电石法制备,即将石灰石和焦炭煅烧成石灰,再用石灰和焦炭进行电石反应得到电石。
然后用水解反应将电石分解成乙炔和氢氧化钙。
此外,乙炔还可以通过乙烷脱氢、甲基汞分解等方法来制备。
4. 应用领域乙炔在工业领域有广泛的应用,主要用于乙炔焊接和切割。
乙炔气体和氧气在适当条件下可以燃烧,生成高温的火焰,可以用于焊接和切割各种金属。
此外,乙炔还可以用于有机合成,如合成乙炔醇、乙烯、乙酰乙烯等有机化合物。
乙炔的火焰温度高达3300℃,因此还可以用于金属熔炼和玻璃加工等领域。
另外,乙炔还可以用于照明和燃料,但由于其高度的活性和危险性,照明和燃料方面的应用已经逐渐减少。
5. 安全注意事项乙炔是一种有毒、易燃的气体,使用时需要特别注意安全。
首先,乙炔需要专门的储存和输送设施,并严格控制乙炔的浓度,以防止爆炸事故的发生。
其次,乙炔的气态火焰非常明亮,并且在室内可燃气体泄漏时,容易发生爆炸,因此需要密切注意通风和防爆措施。
另外,在乙炔的应用过程中也需要注意防止与氧气、氯气等发生危险反应,以及避免乙炔的毒性对人体的危害。
因此,在乙炔的生产和使用过程中,需要严格遵守相关的安全标准和规定,以确保生产和使用的安全。
总之,乙炔是一种重要的工业气体,具有广泛的应用前景。
但是,由于其高度的活性和危险性,生产和使用过程中需要特别注意安全,以免发生爆炸和中毒等意外事件。
希望今后能够在乙炔的生产和使用中,进一步完善安全标准和技术手段,以提高乙炔的生产和使用安全性。



《烯烃炔烃》炔烃的结构与性质在有机化学的世界里,烯烃和炔烃是两类非常重要的不饱和烃。
今天,咱们就专门来聊聊炔烃的结构与性质,一起揭开它神秘的面纱。
先来说说炔烃的结构。
炔烃的分子中含有碳碳三键(C≡C),这是它最显著的结构特征。
以最简单的炔烃——乙炔(C₂H₂)为例,两个碳原子之间通过一个三键相连,每个碳原子还分别与一个氢原子结合。
碳碳三键是由一个σ 键和两个π 键组成的。
这σ 键比较“坚强”,键能较大,而两个π 键则相对“脆弱”一些。
由于三键的存在,炔烃分子中的碳原子采取 sp 杂化。
这种杂化方式使得碳原子的两个 sp 杂化轨道在同一直线上,分别与氢原子或其他原子形成σ 键,而未参与杂化的两个p 轨道则相互垂直,与另一个碳原子的两个p 轨道“肩并肩”重叠,形成两个π 键。
接下来看看炔烃的物理性质。
通常情况下,随着碳原子数的增加,炔烃的沸点和熔点逐渐升高。
不过,总体来说,炔烃的沸点和熔点比相同碳原子数的烷烃和烯烃要低一些。
在常温常压下,含四个碳原子以下的炔烃大多是气态,从五个碳原子开始逐渐变为液态和固态。
再来说说炔烃的化学性质。
由于碳碳三键的存在,炔烃具有一些独特的化学反应。
首先是加成反应。
这就像是炔烃的“好客”特性,它很愿意与其他物质结合。
比如,与氢气发生加成反应,可以生成相应的烯烃或烷烃。
如果是和卤素(如氯气、溴气)加成,会分步进行,先加成一个卤素原子,形成二卤代烯烃,然后再继续加成,得到四卤代烷烃。
和卤化氢的加成也类似,遵循马氏规则。
其次是氧化反应。
炔烃在一定条件下可以被氧化,比如在高锰酸钾等强氧化剂的作用下。
不过,炔烃的氧化反应比烯烃要复杂一些,产物会因反应条件的不同而有所差异。
然后是聚合反应。
就像小伙伴们手拉手组成一个团队一样,炔烃分子也可以相互连接起来,形成高分子化合物。
比如,乙炔在特定条件下可以聚合成聚乙炔。
还有金属炔化物的生成。
这是炔烃的一个有趣的性质。
比如,乙炔与银氨溶液或亚铜氨溶液反应,可以生成白色的乙炔银沉淀或红棕色的乙炔亚铜沉淀。
乙炔•乙炔的结构:结构式:球棍模型:比例模型:空间构型为:直线型•乙炔的物理性质和化学性质:(1)乙炔的物理性质乙炔是无色、无味的气体,比空气稍轻,微溶于水,易溶于有机溶剂。
由电石产生的乙炔因混有PH3、H2S 等杂质而有特殊难闻的臭味。
(2)乙炔的化学性质乙炔分子中键有两个键易断裂,因此也能发生加成反应,而使溴的四氯化碳溶液褪色;能被酸性KMnO4氧化,而使KMnO4溶液褪色。
①加成反应(1,2-二溴乙烯)(1,1,2,2-四溴乙烷)(分部反应,先生成乙烯,后生成乙烷)②氧化反应燃烧时,火焰明亮且带有浓烈的黑烟,并放出大量的热。
产生温度很高的氧炔焰(温度可达3000℃以上),可以用来切割或焊接金属。
•甲烷、乙烯、乙炔燃烧的比较见下表:炔烃的通性•炔烃:炔烃随分子碳原子数的增加,相对分子质量的增加,熔沸点逐渐升高,相对密度逐渐增大;炔烃中n≤4时,常温常压下位气态,其他未液态或固态;炔烃的相对密度一般小于水的密度;炔烃不溶于水,易溶于有机溶剂。
可以发生加成反应、加聚反应、氧化反应。
•烃类燃烧规律总结:1.烃完全燃烧时的耗氧量规律(1)等物质的量的烃(CxHy)完全燃烧时,其耗氧量的大小取决于(x+)的值,其值越大,耗氧量越大。
(2)等质量的烃完全燃烧时,其耗氧量的大小取决于该烃分子中氢的质量分数(或氢原子数与碳原子数的比值),其值越大,耗氧量越大。
(3)实验式相同的烃,不论它们以何种比例混合,只要总质量一定,完全燃烧时所消耗的氧气以及燃烧后生成的二氧化碳和水的量均为定值。
满足该条件的烃有C2H2和C6H6、烯烃与环烷烃等。
说明:在计算烃的衍生物的耗氧量时可将其改写成CxHy·(CO2)m·(H2O)n,耗氧量仅由CxHy 决定。
2.质量相同的烃CxHy,越大,生成的CO2越多;若两种烃的相等,则生成的CO2和H2O的质量均相等。
3.碳的质量分数ω(c)相同的有机物(最简式可以相同也可以不同),只要总质量一定,以任意比混合,完全燃烧后产生的CO2的量总是一个定值。
炔、苯及其同系物的性质1. 乙炔的结构分子式为22H C 、结构式为H C C H -≡-、结构简式为CH HC ≡、电子式为C H :⋅⋅⋅⋅⋅⋅H C :。
乙炔是直线型分子,键角为︒180,属非极性分子。
2. 乙炔的物理性质纯的乙炔是无色、无味的气体,密度比空气略小,微溶于水,易溶于有机溶剂。
3. 乙炔的化学性质(1)氧化反应:−−→−+点燃22252O H C O H CO 2224+,还可使酸性4KMnO 溶液褪色。
(2)加成反应: 2222CHBr CHBr Br CH CH -−→−+≡HCl CH CH +≡−−−→−催化剂CHCl CH =2CHCl nCH =2−−−→−催化剂---n CHCl CH ][2。
(3)加聚反应:−→−≡Fe CH CH 3,CH nCH ≡−−−→−催化剂---=n CH CH ][。
4. 乙炔的实验室制法(1)药品:电石与饱和食盐水(2)原理:↑≡+−→−+CH CH OH Ca O H CaC 222)(2(3)装置:固+液−→−气(有别于制氢气的装置) (4)收集:排水集气法5. 炔烃(1)概念:分子里含有碳碳叁键的一类链烃,其通式为22-n n H C (2≥n )。
(2)物理性质:炔烃的物理性质一般随着分子里碳原子数的增多而呈现规律性的变化,如沸点随碳原子数的增加而升高,相对密度逐渐增大。
(3)化学性质:与乙炔相似。
能发生:① 氧化反应;② 加成反应;③ 加聚反应。
(4)完全燃烧的化学方程式:222213O n H C n n -+-−−→−点燃O H n nCO 22)1(-+ [例2]1mol 某烃最多能与2mol 氯化氢发生加成反应,生成氯代烃。
1mol 该氯代烃能和6mol 氯气发生取代反应,生成只含碳元素和氯元素的氯代烃。
求该烃的分子式及可能的结构简式。
解析:设该有机物的化学式为C x H y ,则有:C x H y +2HCl →C x H y +2Cl 2;C x H y +2Cl 2+6Cl 2→C x Cl 8+6HCl ,由此可得:2x +2=8,2+y =6,解得:x =3,y =4,则该烃的化学式为:C 3H 4,结构简式为:CH 3-C ≡CH答案:C 3H 4、CH 3-C ≡CH[例3] 由两种气态烃组成的混合气体20 mL ,跟过量氧气混合后进行完全燃烧。