烷烃的物理性质
- 格式:ppt
- 大小:507.50 KB
- 文档页数:44

烷烃的性质知识点总结1. 直链烷烃直链烷烃是指所有碳原子通过单键直接连接成一条直链的烷烃,其通式为CnH2n+2,n为碳原子数。
直链烷烃是最简单的烷烃类别,包括甲烷、乙烷、丙烷、丁烷等。
直链烷烃的物理性质取决于其分子大小和分子间作用力。
一般来说,较小的直链烷烃是气态的,而随着分子大小的增加,直链烷烃的物理状态逐渐转变为液态和固态。
2. 支链烷烃支链烷烃是指在碳原子链中有一个或多个分支的烷烃。
支链烷烃的结构具有多样性,因此其物理性质与直链烷烃有所不同。
支链烷烃也称为异构烷烃,是由于分支的存在而使得同一分子式的化合物的碳骨架有多种连接方式。
支链烷烃在空间构型上的不同,导致了它与直链烷烃在物理性质、化学性质和应用领域上的差异。
性质的差异主要表现在以下方面:1. 沸点和熔点:支链烷烃的沸点和熔点一般比相应的直链烷烃低,这是由于分支结构减小了分子间作用力,使得分子内部的相互作用变得较弱。
2. 空间构型:支链烷烃分子的空间构型比直链烷烃更加复杂,这使得支链烷烃分子的空间取向更加多样,对其物理性质和化学性质产生了影响。
3. 化学性质:支链烷烃的化学性质也受到其分支结构的影响。
由于支链烷烃比直链烷烃的分子结构更为复杂,支链烷烃在燃烧和反应中的行为往往更加复杂。
总的来说,烷烃具有以下的一些共性性质:1. 易燃性:烷烃是易燃的化合物,它们通常可以和氧气发生反应,放出大量的热量。
2. 化学惰性:烷烃中的碳碳和碳氢键都是非极性的,因此烷烃在很多常见的化学条件下是比较稳定的。
3. 溶解性:烷烃是非极性化合物,因此它们通常会溶解在非极性溶剂中,例如苯、甲苯等,而在极性溶剂中溶解性较差。
4. 燃烧性:烷烃易于燃烧,只需有适当的点火源或者高温,就能够和氧气反应,放出大量的热量,并产生二氧化碳和水。
5. 聚合性:烷烃可以通过聚合反应,形成高聚物,例如聚乙烯、聚丙烯等。
在聚合过程中,烷烃分子中的碳碳键和碳氢键将参与到聚合反应中,形成高分子结构。

第2课时 烷烃的性质[核心素养发展目标] 1.了解烷烃的主要物理性质和化学性质,培养变化观念与平衡思想的素养。
2.熟练掌握甲烷的主要性质,提高证据推理与模型认知能力。
3.认识取代反应的概念及特点,培养微观探析及变化观念。
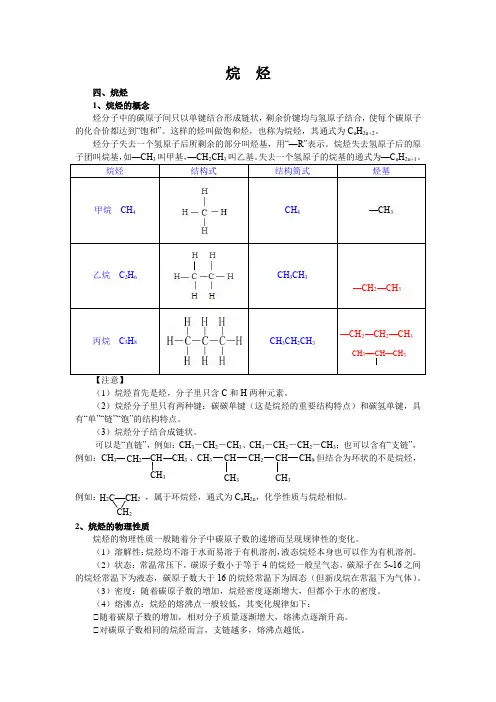
一、烷烃的物理性质及可燃性1.烷烃的物理性质2.烷烃的稳定性及可燃性(1)稳定性:通常情况下,烷烃与 、 或高锰酸钾等 不发生反应。
(2)可燃性:烷烃都能燃烧。
CH 4燃烧的化学方程式: C 3H 8燃烧的化学方程式: 链状烷烃燃烧通式: (3)烷烃在 下会发生分解。
(1)常温常压下,CH 4、C 2H 6和C 3H 8为气体,C 4H 10、C 6H 14呈液态( )(2)在通常条件下,烷烃和硫酸、氢氧化钠不反应,和酸性KMnO 4溶液也不反应( ) (3)在做甲烷、乙烷燃烧实验前,气体一定要验纯( )(4)使用天然气(主要成分为CH 4)的燃气灶,改用液化石油气(主成分为C 4H 10),应减小进气量或增大进风量( ) (5)烷烃都能燃烧,且完全燃烧的产物一定是CO 2和H 2O( )1.有两种气态烷烃的混合物,在标准状况下其密度为1.15 g·L -1,则关于此混合物的组成说法不正确的是( ) A.一定有甲烷 B.一定不存在乙烷C.可能是甲烷和乙烷的混合物D.不可能为乙烷和丙烷的混合物 2.标准状况下,0.1 mol 某链状烷烃完全燃烧生成11.2 L CO 2。
(1)写出该链状烷烃的分子式:____ ____。
(2)写出该链状烷烃燃烧的化学方程式:______________________________。
(3)该链状烷烃的同分异构体有多种,写出分子中含有4个甲基(—CH3)的结构简式:________。
二、烷烃的典型性质——取代反应1.烷烃的取代反应实验探究(以CH4与Cl2的反应为例)A装置:试管内气体颜色逐渐;试管内壁有出现,2.取代反应概念:有机物分子里的某些原子或原子团被其他所替代的反应。

烷烃与环烷烃区别
一、结构不同
1、烷烃:是开链的饱和链烃(saturated group),分子中的碳原子都以单键相连,其余的价键都与氢结合而成的化合物。
2、环烷烃:含有脂环结构的饱和烃。
有单环脂环和稠环脂环。
含有1个脂环且环上无取代烷基的环烷烃,分子通式为CnH₂n。
二、范围不同
烷烃包括环烷烃,环烷烃是烷烃的一种。
三、性质不同
1、烷烃:低沸点(boiling point)的烷烃为无色液体,有特殊气味;高沸点烷烃为黏稠油状液体,无味;烷烃的物理性质随分子中碳原子数的增加,呈现规律性的变化;烷烃中的氢原子被卤原子(即第七主族元素)取代的反应称为卤化反应(halogenation)。
2、环烷烃:环烷烃有很高的发热量,凝固点低,抗爆性介于正构烃和异构烃之间。
化学性质和烷烃相似。
其中以五碳脂环和六碳脂环的性质较稳定。
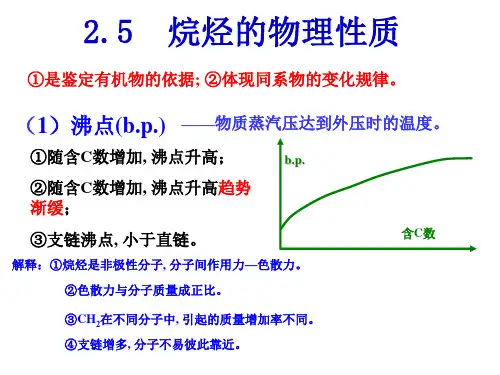




化合物的物理性质《烷烃的物理性质》一. 物质的状态室温下,C1-C4为气体,C5-C16为液体,C17以上是固体。
二.熔点和沸点烷烃的熔点和沸点都很低,并且熔点和沸点随分子量的增加而升高。
但值得注意的是:(1)对同数碳原子的烷烃来说,结构对称的分子熔点高。
因为结构对称的分子在固体晶格中可紧密排列,分子间的色散力作用较大,因而使之熔融就必须提供较多的能量。
(2)含偶数碳原子的正烷烃比奇数碳原子的熔点高。
这主要取决于晶体中碳链的空间排布情况。
X光证明,固体正烷烃的碳链在晶体中伸长为锯齿形,奇数碳原子的链中两端的甲基处在同一边,而偶数碳原子的链中,两端的甲基处在相反的位置,从而使这种碳链比奇数碳链的烷烃可以彼此更为靠近,于是它们之间的色散力就大些。
烷烃的沸点上升比较有规则,每增加一个CH2基,上升20-30℃,越到高级系列上升越慢。
在相同碳原子数的烷烃中,直链的沸点比带支链的高,这是由于在液态下,直链的烃分子易于相互接近,而有侧链的烃分子空间阻碍较大,不易靠近。
三. 比重、溶解度、折光率(略)环烷烃的物理性质在常温常压下环丙烷及环丁烷为气体,环戊烷为液体,高级环烷烃为固体。
环烷烃的熔点较同数碳原子的直链烷烃高,因为环烷烃比直链烷烃在晶格中排列更紧密。
环烷烃的密度为0.688~0.853g•c m-3 。
环烷烃不溶于水。
一些环烷烃的熔点和沸点见表3-2。
表3.2 环烷烃的熔点、沸点、张力能(kJ·mol-1)和每一个-CH2-单元的燃烧热(kJ·mol-1 )《芳烃的物理性质》苯及其同系物大多为液体,故有特殊的香气,但它们的蒸气有毒。
高浓度的苯蒸气作用于中枢神经,引起急性中毒。
长期接触低浓度的苯蒸气能损害造血器官。
因此,应尽量注意少接触苯。
有时可以用甲苯代替苯作溶剂,因少量甲苯在人体中可以与甘氨酸作用被人体中酶催化形成马尿酸(C6H5CONHCH2CO2H)而排出体外,故甲苯毒性相对较小。


烷烃与烯烃的性质与应用烷烃和烯烃是有机化学中两类重要的碳氢化合物。
它们在化学结构上有所区别,以及在性质和应用上也有一些显著差异。
本文将介绍烷烃和烯烃的基本性质,并探讨它们在日常生活和工业中的一些重要应用。
一、烷烃的性质与应用烷烃是一类碳氢化合物,其分子由碳原子和氢原子组成,采用碳原子之间的共价键连接。
烷烃的通式为CnH2n+2,其中n为非负整数。
烷烃分子中的碳原子之间由于共价键的存在,使得烷烃分子相对比较稳定。
烷烃可以分为直链烷烃和支链烷烃两种类型。
直链烷烃的碳原子按照线性排列,支链烷烃则是在直链烷烃的基础上通过碳原子的空位连接其他的碳原子。
直链烷烃和支链烷烃具有不同的物理和化学性质。
在物理性质方面,烷烃是无色、无味、无臭的化合物,大多数烷烃是液体或气体,在常温下难以溶于水。
烷烃的密度较小,熔点和沸点随着碳原子数目的增加而增加。
在化学性质方面,烷烃是相对稳定的化合物,需要高温或者催化剂的作用下才会参与化学反应。
常见的烷烃化学反应包括燃烧反应、加氢反应和卤代反应等。
烷烃的燃烧反应是指烷烃与氧气在适当条件下发生反应,生成二氧化碳和水。
加氢反应是指烷烃与氢气在存在催化剂的条件下反应,生成饱和度更高的烃类化合物。
卤代反应是指烷烃中的氢原子被氯、溴等卤素取代的反应。
烷烃在生活中和工业中有许多重要的应用。
例如,甲烷是天然气的主要成分,被广泛用于燃料和热源。
乙烷是石油和天然气的组分,它也被用作燃料和热源。
丙烷和丁烷等烷烃被用作液化石油气和煤气,用于家用燃烧和热源。
此外,烷烃还可以作为溶剂和合成有机化合物的原料,广泛应用于化工、制药、农药、橡胶等行业。
二、烯烃的性质与应用烯烃也是一类碳氢化合物,其分子中含有碳碳双键。
烯烃的通式为CnH2n,其中n为非负整数。
烯烃的碳碳双键赋予了它更多的化学反应性和结构变化的可能性。
烯烃可以分为直链烯烃和支链烯烃两种类型,它们的命名和烷烃相似。
直链烯烃的碳原子按照线性排列,支链烯烃则是在直链烯烃的基础上通过碳原子的空位连接其他的碳原子。