化学同步鲁科版必修2课时跟踪检测:(三)元素周期律Word版含解析
- 格式:doc
- 大小:63.04 KB
- 文档页数:5
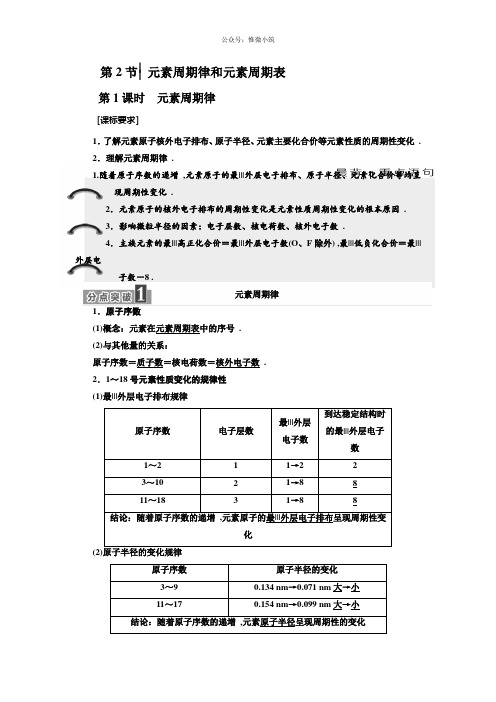
第2节⎪⎪元素周期律和元素周期表第1课时元素周期律[课标要求]1.了解元素原子核外电子排布、原子半径、元素主要化合价等元素性质的周期性变化.2.理解元素周期律 .1.随着原子序数的递增,元素原子的最|||外层电子排布、原子半径、元素化合价等均呈现周期性变化.2.元素原子的核外电子排布的周期性变化是元素性质周期性变化的根本原因 .3.影响微粒半径的因素:电子层数、核电荷数、核外电子数.4.主族元素的最|||高正化合价=最|||外层电子数(O、F除外) ,最|||低负化合价=最|||外层电子数-8 .元素周期律1.原子序数(1)概念:元素在元素周期表中的序号.(2)与其他量的关系:原子序数=质子数=核电荷数=核外电子数.2.1~18号元素性质变化的规律性(1)最|||外层电子排布规律原子序数电子层数最|||外层电子数到达稳定结构时的最|||外层电子数1~2 1 1→2 23~10 2 1→8 811~18 3 1→8 8结论:随着原子序数的递增,元素原子的最|||外层电子排布呈现周期性变化原子序数原子半径的变化3~9 0.134 nm→0.071 nm大→小11~17 0.154 nm→0.099 nm大→小结论:随着原子序数的递增,元素原子半径呈现周期性的变化[特别提醒](1)氢原子的半径在所有原子半径中最|||小.(2)稀有气体元素原子半径的测量依据与其他原子半径的测量依据不同,数据没有比拟的价值.(3)化合价变化规律3.元素的性质随着原子序数的递增而呈周期性的变化的规律.1.元素呈现正价、负价、零价与什么有关?提示:与原子核外最|||外层电子数有关.2.主族元素的最|||高正化合价一定等于原子核外最|||外层电子数吗?提示:不一定,如F为最|||活泼的非金属元素,只有0价和-1价,无最|||高正化合价.1.元素的性质与最|||外层电子数的关系(1)一般来说,当最|||外层电子数少于4个时,易失去电子显正价,当最|||外层电子数多于4个时,易得到电子显负价 .(2)当最|||外层为8个电子(He为2个电子)时,原子处于稳定结构,化学性质稳定,化合价为0 .2.元素的主要化合价与最|||外层电子数的关系(1)主族元素最|||高正化合价=最|||外层电子数(O、F除外)最|||低负化合价=最|||外层电子数-8|最|||高正化合价|+|最|||低负化合价|=8(2)常见元素化合价的特点①H元素:+1、-1、0价,如H2O、NaH、H2 .②F元素-1,0价,如NaF ,F2 .③O元素常见有-2、-1、0价,如CaO、Na2O2、O2 ,氧无最|||高正价.④金属元素只有正价 .⑤非金属元素既有正价又有负价(F除外) .1.元素的以下变化随着原子序数的递增不呈现周期性变化的是()A .化合价B .原子半径C .原子的最|||外层电子排布D .相对原子质量解析:选D 元素的相对原子质量随着原子序数的递增呈增大的趋势 ,不呈现周期性变化 .2.A 元素的最|||高正价和最|||低负价绝|||对值之差为6 ,A 与B 形成的化合物在水溶液中电离出电子层结构相同的离子 ,那么A 和B 形成的化合物可能是( )A .CaCl 2B .Na 2SC .MgCl 2D .NaF解析:选A 由A 元素的最|||高正价和最|||低负价绝|||对值之差为6可推得A 的最|||高正化合价为+7价 ,A 为Cl 、Br 、I 等元素 ,又因A 、B 离子具有相同的电子层结构 ,仅有A 项符合题意 .3.以下递变情况中 ,正确的选项是( )A .Na 、Mg 、Al 原子的最|||外层电子数依次减少B .Si 、P 、S 元素的最|||高正价依次降低C .C 、N 、O 的原子半径依次增大D .Li 、Na 、K 的核外电子层数依次增加解析:选D A 项 ,Na 、Mg 、Al 原子的最|||外层电子数依次增多;B 项 ,S i +4、P +5、S +6元素的最|||高正价依次升高;C 项 ,原子半径:C>N>O .微粒半径大小的比拟1.电子层数相同时最|||外层电子数越多 ,原子半径越小 .如r (Na)>r (Mg)>r (Al)>r (Si)>r (P)>r (S)>r (Cl) .2.最|||外层电子数相同时 ,电子层数越多 ,原子半径越大 .如r (I)>r (Br)>r (Cl)>r (F) .3.同种元素的微粒半径比拟 ,核外电子数越多 ,微粒半径越大 .(1)阳离子半径小于相应原子半径:如r (Na +)<r (Na) .(2)阴离子半径大于相应原子半径:如r (Cl -)>r (Cl) .(3)不同价态的离子 ,价态越高 ,离子半径越小:如r (Fe 2+)>r (Fe 3+) .4.电子层结构相同的不同粒子 ,核电荷数越大 ,半径越小 .如r (O 2-)>r (F -)>r (Na +)>r (Mg 2+)>r (Al 3+) .1.以下离子中半径最|||大的是( )A .Na +B .Mg 2+C.O2-D.F-解析:选C选项中的离子都具有相同的电子层结构,对于电子层结构相同的离子来说,核电荷数越大,离子半径就越小,应选C .2.以下微粒半径大小比拟正确的选项是()A.Na+<Mg2+<Al3+<O2-B.S2->Cl->Na+>Al3+C.Na<Mg<Al<SD.Cs<Rb<K<Na解析:选B A项,电子层数相同,核电荷数越大离子半径越小:Al3+<Mg2+<Na+<O2-;C项,电子层数相同,核电荷数越大原子半径越小:Na>Mg>Al>S;D项,最|||外层电子数相同时,电子层数越多,原子半径越大:Cs>Rb>K>Na .[三级|||训练·节节过关]1.原子序数3~10的元素,随着核电荷数的递增而逐渐增大的是()A.电子层数B.电子数C.原子半径D.化合价解析:选B原子序数3~10的元素,原子的电子层数都为两层,A错误;除了10号稀有气体元素原子外,3~9号元素原子的核电荷数越大,原子半径越小,C错误;因氧无最|||高正价、氟无正价,D错误.2.以下各组元素中,按最|||高正价递增的顺序排列的是()A.C、N、O、F B.K、Mg、C、SC.H、He、Li、Be D.P、S、Cl、Ar解析:选B根据元素的最|||高化合价在数值上一般等于其最|||外层电子数及特殊元素的化合价来分析各选项.A项,C +4价,N +5价,O、F无最|||高正价;B项,K +1价,Mg +2价,C +4价,S +6价;C项,H +1价,He无最|||高正价,Li +1价,Be +2价;D 项,P +5价,S +6价,Cl +7价,Ar无最|||高正价.3.以下4种微粒中,半径按由大到小的顺序排列的是()①②③④A.①>②>③>④B.③>④>①>②C.③>①>②>④D.①>②>④>③解析:选C①为S原子,②为Cl原子,③为S2-,④为F原子.①②电子层数相同,比拟核电荷数,核电荷数越大半径越小,故原子半径:S>Cl;①③核电荷数相同,比拟核外电子数,电子数越多半径越大,故半径:S2->S;②④最|||外层电子数相同,比拟电子层数,电子层数越多半径越大,故原子半径:Cl>F .4.在原子序数11~18的元素中:(1)原子半径最|||小的是________(填元素符号,下同);只有正化合价的是________;最|||高正化合价与最|||低负化合价绝|||对值之差为4的元素是________ .(2)与冷水剧烈反响生成H2的物质是________(填名称) .与水反响能生成具有漂白性物质是________(填名称) ,反响的离子方程式是___________________________________ .(3)化学性质最|||稳定的物质是____________(填化学式) .解析:(1)在11~18号元素中,原子半径最|||小的是Cl;金属元素Na、Mg、Al只有正化合价;S元素最|||高正化合价是+6 ,最|||低负化合价是-2 ,绝|||对值之差是4;(2)金属钠与冷水剧烈反响生成H2和NaOH;Cl2和水反响生成HCl和HClO ,其中HClO 有漂白性;(3)稀有气体元素Ar原子最|||外层8个电子,是稳定结构,通常不与其他物质发生反响,化学性质稳定.答案:(1)Cl Na、Mg、Al S(2)钠氯气Cl2+H2O = = =H++Cl-+HClO(3)Ar1.以下关于元素周期律的表达正确的选项是()A.随着元素原子序数的递增,原子最|||外层电子数总是从1到8重复出现B.元素的性质随着原子序数的递增而呈周期性变化C.随着元素原子序数的递增,元素的最|||高化合价从+1到+7 ,最|||低化合价从-7到-1重复出现D.元素性质的周期性变化是指原子核外电子排布的周期性变化、原子半径的周期性变化及元素主要化合价的周期性变化解析:选B K层为最|||外层时,原子最|||外层电子数只能从1到2 ,而不是从1到8 ,A 项错误;最|||低化合价一般是从-4到-1 ,而不是从-7到-1 ,C项错误;D项核外电子排布的周期性变化是元素性质周期性变化的根本原因,而不是内容.2.以下元素的原子半径依次增大是()A.Na、Mg、Al B.Na、O、FC.P、Si、Al D.C、Si、P解析:选C比拟元素原子半径的大小有两条规律:①具有相同电子层数的元素,随着原子序数的递增,原子半径递减;②具有相同最|||外层电子数的元素,随着电子层数的增加,原子半径增大.A项,r(Na)>r(Mg)>r(Al);B项,r(Na)>r(O)>r(F);D项,r(Si)>r(P) .3.以下元素的常见化合价从+1至|||+3依次增大的是()A.H、He、Li B.Na、Mg、AlC.Al、Be、Na D.N、O、F解析:选B A项中He为零价;C项的变化顺序为+3、+2、+1 ,与题目要求恰好相反;D项中F无正价.4.X元素最|||高价氧化物对应的水化物为H3XO4 ,那么它对应的气态氢化物为() A.HX B.H2XC.XH4D.XH3解析:选D X元素的最|||高正价是+5价,那么其最|||低化合价为-3 ,故X元素氢化物的化学式为XH3 .5.关于H+、H、H-的半径由大到小的顺序是()A.H+、H、H-B.H、H+、H-C.H-、H、H+D.H-、H+、H解析:选C核电荷数相同的粒子,核外电子数越多半径越大.6.以下说法中正确的选项是()A.非金属元素呈现的最|||低化合价,其绝|||对值等于该元素原子的最|||外层电子数B.非金属元素呈现的最|||高化合价不超过该元素原子的最|||外层电子数C.最|||外层有2个电子的原子都是金属原子D.金属元素只有正价和零价,而非金属元素既有正价又有负价和零价解析:选B非金属元素最|||低化合价的绝|||对值等于8减去最|||外层电子数,A错误;非金属元素的最|||高正价等于该元素原子的最|||外层电子数,不会超过该数值,B正确;氦原子最|||外层有2个电子,C错误;并非所有非金属元素都有正价,如F无正价,D错误.7.原子序数小于20的X元素能形成H2X和XO2两种化合物,该元素的原子序数是()A.13 B.14C.15 D.16解析:选D X元素在H2X中呈-2价,在XO2中呈+4价,一般在氢化物中呈现最|||低负价,该元素的最|||高正价为+6 ,即最|||外层电子数为6 ,只有原子序数为16时符合条件.8.元素X、Y、Z的原子序数依次增大,以下表达一定正确的选项是()A.X、Y、Z原子的核内质子数依次增大B.X、Y、Z的最|||高正化合价依次升高C.X、Y、Z原子的原子半径依次增大D.X、Y、Z单质的金属活动性依次增大解析:选A元素的原子序数等于原子核内的质子数,A正确.根据元素性质周期性递变的含义,B和C不一定正确 .X、Y、Z中可能含有非金属,仅据此即可断定D不正确.9.有以下四种微粒:①18 8O②2311Na③2412Mg④14 7N .(1)按原子半径由大到小的顺序排列为____________(只填序号,下同) .(2)按离子半径由大到小的顺序排列为____________ .(3)微粒中质子数小于中子数的是____________ .(4)能形成X2Y2型化合物的是____________ .(5)通常情况下,化合价有0价、正价和负价的是________ .解析:2311Na与2412Mg具有相同的电子层数,最|||外层电子数分别为1、2 ,18 8O与14 7N具有相同的电子层数,最|||外层电子数分别为6、5;原子半径大小为23Na>24Mg>14N>18O;四种离子Na+、Mg2+、N3-和O2-核外电子排布相同,半径大小为r(Mg2+)<r(Na+)<r(O2-)<r(N3-) .四种核素质子数和中子数分别是:18 8O→8、10;2311Na→11、12;2412Mg→12、12;14 7N→7、7 .通常情况下O元素不显正价,Na、Mg不显负价,只有N元素有0价、正价和负价 .答案:(1)②③④①(2)④①②③(3)①②(4)①②(5)④10.X、Y为1~18号元素中的两种元素,原子序数X>Y ,且X、Y的最|||高正化合价与其最|||低负化合价绝|||对值相等,那么(用元素符号或化学式填空):(1)X是________ ,Y是________ ,原子半径X____Y(填">〞或"<〞) .(2)X、Y的氢化物的化学式分别为________________;最|||高价氧化物的化学式分别为________________ .解析:X、Y的最|||高化合价等于其最|||低化合价的绝|||对值,据最|||高化合价+|最|||低化合价|=8可知X、Y的最|||高化合价为+4 ,即二者原子最|||外层电子数均为4 ,那么为C、Si;由原子序数X>Y ,可知X为Si元素,Y为C元素.答案:(1)Si C>(2)SiH4、CH4SiO2、CO21.以下微粒半径的比拟中,正确的选项是()A.r(Na+)>r(Na) B.r(Cl-)>r(Cl)C.r(Ca2+)>r(Cl-) D.r(Mg)>r(Na)解析:选B同一种元素:r阳离子<r原子<r阴离子,故A错误,B正确.Ca2+和Cl-核外电子排布相同,因原子序数Ca>Cl ,那么半径r(Ca2+)<r(Cl-) ,C错误.Na和Mg两种原子核外电子层数相同,因原子序数Mg>Na ,故半径r(Mg)<r(Na) ,D错误 .2.元素X形成的离子与钙离子的核外电子排布相同,且X的离子半径小于负二价硫离子的半径.X元素可能为()A.Al B.PC.Ar D.K解析:选D由X形成的离子与Ca2+核外电子排布相同,可排除Al、Ar;由X的离子半径小于S2-的半径,可排除P(半径:P3->S2-) .3.元素M、N的原子序数不超过18 ,M的最|||高化合价为+1 ,N比M原子序数大1 ,以下表达正确的选项是()A.M的原子最|||外电子层上只有1个电子B.M一定是金属元素C.N可能是活泼的非金属元素D.N的最|||高化合价一定是+2解析:选A M的原子序数不超过18 ,最|||高化合价为+1 ,那么M一定在氢、锂、钠的范围内.N比M原子序数大1 ,那么N一定在氦、铍、镁的范围内.4.X元素的阳离子和Y元素的阴离子具有与氩离子相同的电子层结构,以下表达正确的选项是()A.X原子序数比Y的小B.X原子最|||外层电子数比Y的多C.X的原子半径比Y的大D.X元素的最|||高正价比Y的大解析:选C X n+、Y m-和Ar具有相同的电子层结构,其原子序数:X>Ar>Y ,A项错误;X原子最|||外层电子数比Y的少,B项错误;X的原子半径比Y的大,C项正确;X元素的最|||高正价比Y的小,D项错误.5.原子序数小于18的元素的离子a A2+、b B+、c C2-、d D-都具有相同的电子层结构,那么以下表达正确的选项是()A.原子半径:A>B>D>CB.离子半径:C2->D->B+>A2+C.原子序数:d>c>b>aD.原子的最|||外层电子数目:A>B>D>C解析:选B由4种离子具有相同的电子层结构可得a-2=b-1=c+2=d+1 ,a>b>d>c 故C项错误;原子的最|||外层电子数目为D>C>A>B ,故D项错误;原子半径B>A>C>D ,故A项错误.6.某元素R的最|||高化合价与最|||低化合价的绝|||对值之差为2 ,其气态氢化物中含氢的质量分数为8.8% ,试推断该元素是()A.N B.PC.S D.O解析:选B由题意可知,最|||高化合价-|最|||低化合价|=2 ① ,而最|||高化合价+|最|||低化合价|=8 ②,将②-①得:|最|||低化合价|=3 ,该元素的最|||低化合价为-3价.元素R的气态氢化物的化学式是RH3,氢元素的质量分数为3M(H)M(R)+3M(H)×100%=8.8% ,解得M(R)≈31 ,查表可知,R是磷元素.7.X和Y两元素的阳离子具有相同的电子层结构,X元素的阳离子半径大于Y元素的阳离子半径;Z和Y两元素的原子核外电子层数相同,Z元素的原子半径小于Y元素的原子半径.X、Y、Z三种元素原子序数的关系是()A.X>Y>Z B.Y>X>ZC.Z>X>Y D.Z>Y>X解析:选D电子层结构相同的阳离子,核电荷数多的那么半径小,具有相同电子层数的原子,随着原子序数增大,原子半径减小.根据题意,X和Y两元素的阳离子具有相同的电子层结构,X元素的阳离子半径大于Y元素的阳离子半径,那么X的原子序数小于Y的原子序数;Z和Y元素的原子核外电子层数相同,且Z元素的原子半径小于Y元素的原子半径,那么Z的原子序数大于Y的原子序数 .由此得出三种元素原子序数的关系为Z>Y>X .8.局部1~18号元素的原子半径及主要化合价如下表所示,那么以下说法中正确的选项是()BC.M与T形成的化合物具有两性D.L2+与R2-的核外电子数相等解析:选C由表格中的原子半径和主要化合价首|||先判断出T为O ,R为S ,然后根据L、M、Q的化合价以及原子半径与O和S的大小比拟可以判断出Q为Be ,M为Al ,L为Mg .Al和Be均为金属元素;Mg的金属性比Be强,与稀盐酸反响的速率Mg>Be;Al2O3是两性氧化物;Mg2+、S2-的核外电子数分别为10、18 .9.元素A、B、C、D的简单离子,核外都有10个电子,A的氯化物中,电子总数为28 ,A 和B的化合物分子A2B中共有30个电子,B与C的化合物为C2B3型;C与D的化合物为CD3型.(1)试根据有关元素的化合物的分子构成确定其化合物的化学式.ACl____________;A2B____________;C2B3____________;CD3____________ .(2)四种离子半径大小关系:______________________ .(3)A元素最|||高价氧化物对应水化物与C元素最|||高价氧化物对应水化物反响的离子方程式_______________________________________________________________________ .解析:由元素A、B、C、D的离子核外都有10个电子,可知A、B、C、D是C、N、O、F、Na、Mg、Al中的四种元素.设A的氯化物分子式为ACl x ,因其电子总数为28 ,只有x=1时合理,可确定A为Na元素.A与B元素形成的化合物为Na2B ,两者的电子总数为30 ,可得B有8个电子,B是O元素.B与C元素形成的化合物为C2O3 ,可知C为Al元素 .C与D元素形成的化合物为AlD3,可得D为F .四种离子核外电子排布相同,核电荷数越大,离子半径越小,故r(O2-)>r(F-)>r(Na+)>r(Al3+) .Na、Al最|||高价氧化物对应水化物分别是NaOH和Al(OH)3 ,反响的离子方程式是OH-+Al(OH)3 = = =[Al(OH)4]-.答案:(1)NaCl Na2O Al2O3AlF3(2)O2->F->Na+>Al3+(3)OH-+Al(OH)3 = = =[Al(OH)4]-。

姓名,年级:时间:第2节元素周期律和元素周期表第1课时元素周期律课后篇巩固探究A组1.随着核电荷数的递增,元素性质呈周期性变化的原因是( )A。
相对原子质量逐渐增大B.元素的原子半径呈周期性变化C.核外电子排布呈周期性变化D。
元素的主要化合价呈周期性变化解析:元素性质的周期性变化是由原子核外电子排布的周期性变化引起的。
答案:C2.下列关于同一种元素的原子或离子叙述正确的是( )A。
原子半径比阴离子半径小B。
原子半径比阴离子半径大C.原子半径比阳离子半径小D。
带正电荷数多的阳离子半径比带正电荷数少的阳离子半径大解析:同一元素的阴离子半径大于原子半径,如r(Cl—)〉r(Cl),A项正确,B项错误;同一元素的原子半径大于阳离子半径,如r(Na)〉r(Na+),C项错误;带正电荷少的阳离子半径大于带正电荷多的阳离子半径,如r(Fe2+)〉r(Fe3+),D项错误。
答案:A3.以下有关元素化合价的说法不正确的是()A.元素的化合价主要取决于元素原子的最外层电子数B.非金属元素的最高正价等于原子所能失去或偏移的最外层电子数C。
稀有气体元素化学性质很不活泼,很难与其他物质反应,通常把它们的化合价看作零D.第2、3周期元素的化合价都是正价从+1价→+7价,负价从-4价→—1价解析:第2周期中的O元素的最高正价不是+6价,而F元素无正价。
答案:D4.下列各组微粒半径之比大于1的是()A.r(Na+)r(Na)B。
r(Mg)r(Na)C。
r(Cl)r(P)D.r(P)r(N)解析:A项中,r(Na+)〈r(Na);B项中,r(Mg)〈r(Na);C项中,r(Cl)〈r(P),只有D项符合题意.答案:D5。
原子序数从3~10的元素,随着核电荷数的递增而逐渐增大的是( )A.电子层数B。
电子数C.原子半径D.化合价解析:原子序数从3~10的元素,原子的电子层数都为两层,A错误;除了10号稀有气体元素原子外,从3~9号元素原子的核电荷数越大,原子半径越小,C错误;因氧无最高正价、氟无正价,D 错误。

2019-2020学年鲁科版高中化学必修二同步跟踪训练1.2.1元素周期律1、下列关于元素周期律的叙述正确的是()A.随着元素原子序数的递增,原子最外层电子数总是从1到8重复出现B.元素的性质随着原子序数的递增而呈周期性变化C.随着元素原子序数的递增,元素的最高化合价从+1到+7,最低化合价从-7到-1重复出现D.元素性质的周期性变化是指原子核外电子排布的周期性变化、原子半径的周期性变化及元素主要化合价的周期性变化2、元素周期律的实质是( )A.原子核外电子排布的周期性变化 B.原子半径的周期性变化C.元素化合价的周期性变化 D.金属性和非金属性的周期性变化3、元素的以下性质随着原子序数的递增不呈周期性变化的是( )A.化合价B.原子半径C.元素原子的最外层电子排布D.相对原子质量4、下列离子中半径最大的是( )A.Na+B.Mg2+C.O2-D.F-5、某元素R的最高价氧化物的水化物分子式是H n RO2n-2,则在气态氢化物中R元素的化合价是( )A.3n-12B.12-3nC.3n-4D.3n-106、某元素R的最高正化合价与最低负化合价的绝对值之差为2,其气态氢化物中含氢的质量分数为8.8%,试推断该元素是( )A.NB.PC.SD.O7、某元素(原子序数小于18)的最高正化合价与最低负化合价的代数和为4,则该元素原子的最外层电子数为( )A.4B.5C.6D.78、下列有关元素化合价的说法正确的是( )A.原子核外最外层电子数相同的元素,最高化合价一定相等B.元素的最高化合价一定等于其原子核外最外层电子数C.所有元素的最高化合价与最低化合价的绝对值之和都等于8D.随着核电荷数的递增,主族元素的最高正化合价和最低负化合价呈现周期性变化9、短周期元素W、X、Y和Z在周期表中的相对位置如下表所示,这四种元素原子的最外层电子数之和为21。
下列关系正确的是( )W XY ZA.氢化物沸点:W<ZB.氧化物对应水化物的酸性:Y>WC.化合物熔点:Y X<YZ D.简单离子的半径:Y<X23310、图中曲线表示短周期元素的原子序数(按递增顺序连续排列)及其常见最高化合价的关系,下列叙述不正确的是( )A.单核简单离子半径:②<③B.①③可以按原子个数比1:1形成化合物C.②③形成的化合物是两性物质D.①②形成的化合物的摩尔质量可能是44g/mol11、元素A的阳离子a A m+与元素B的阴离子b B n-具有相同的电子层结构。

2019-2020 学年鲁科版高中化学必修二同步追踪训练1.3 元素周期表的应用1、以下说法正确的选项是 ( )A.同一主族元素的最外层电子数必定同样B.原子核外最外层电子数同样的元素族数必定同样C.同一主族的元素最高化合价必定同样D.同一主族的元素最低化合价必定同样2、某元素X 的原子序数为52, 以下表达正确的选项是( )A.X 的最高价氧化物对应水化物的酸性比HBrO4的酸性强B.X 形成的气态氢化物比H2S 稳固C.X 原子的得电子能力比碘原子的得电子能力强D.X 的主要化合价是-2 、 +4、+63、a、b、c、d 为 1~18 号元素 ,a 的原子中只有1 个电子 ,b2+和 c+的电子层构造同样 ,d 与 b 最外层电子数同样。
以下表达错误的选项是( )A.a 与其余三种元素形成的二元化合物中其化合价均为-1B.b 与其余三种元素均可形成起码两种二元化合物C.c 的单质能够与水发生反响放出气体D.d 与 a 形成的化合物的溶液呈弱酸性4、五种短周期元素X、 Y、 Z、 M、 W的原子序数与其常有化合价的关系以下图,以下关系不正确的选项是 ( )A.元素 X可能为锂C. X2W中各原子均达B8 电子稳固构造 D.原子半径大小:r(M)>r(w).元素气态氢化物的稳固性:YH3>MH35、114 号元素符号为Fl, 名称为“鈇”, 这是为了纪念苏联原子物理学家乔治·弗洛伊洛夫。
以下对“鈇”的表达正确的选项是()A. 能做半导体资料B. 它是一种非金属元素C.主要化合价为-4 价、 +4 价D. 位于元素周期表的第七周期6、砷为第周围期ⅤA族元素,依照它在周期表中的地点, 推测砷不行能拥有的性质是()A.砷在往常情况下是固体B.砷常有的化合价有 -3 、 +3、+5C.砷的最高价氧化物的水化物砷酸(H3AsO4) 的酸性比磷酸(H3PO4 ) 弱D.砷化氢(AsH3 ) 不稳固, 复原性比氨NH3弱7、 W、 X、 Y、 Z 是原子序数挨次增大的短周期主族元素,W 的氢化物水溶液能刻蚀玻璃,X、Y处于相邻地点,Y 的最高化合价与最低化合价的代数和为零,W、X 原子的最外层电子数之和与Y、 Z 原子的最外层电子数之和相等。

2019-2020学年鲁科版高中化学必修二同步跟踪训练1.2.2元素周期表1、X和Y属于短周期元素,X原子的最外层电子数是次外层电子数的一半,Y位于X的前一周期,且最外层只有一个电子,下列说法正确的是( )A.X可能是第二周期非金属元素B.Y可能与X同主族C.X可能是第三周期金属元素D.Y一定是金属元素2、某元素的原子最外层有2个电子,该元素( )A.一定是金属元素B.最高化合价一定为+2价C.一定是ⅡA族元素或是HeD.无法确定属于哪类元素3、对于核电荷数为1~18的元素,下列有关元素性质与原子结构的理解正确的是( )A.原子最外层电子数小于4的元素一定是金属元素B.原子最外层电子数大于4的元素一定是非金属元素C.原子最外层电子数与该元素的常见化合价的绝对值一定相等D.原子最外层电子数与其电子层数相等的元素一定是金属元素Y、Z在周期表中的相对位置如下图所示。
下列判断正确的是( )A.是最活泼的非金属元素B.Y的最高化合价为+7C.Z原子的最外层电子数是6D.3种元素的单质分子都是双原子分子5、下列叙述中正确的是( )A.除零族元素外,短周期元素的最高化合价在数值上等于该元素所属的族序数B.ⅦA族元素其简单阴离子的核外电子层数等于该元索所在的周期数C.除短周期外,其他周期均有18种元素D.X2+的核外电子致目为18,则X在第三周期第ⅡA族6、砷(As)为第4周期ⅤA族元素,根据元素周期表和元素周期律的知识,下列有关推测不正确的是( )A.砷可以有-3、+3、+5等多种化合价B.砷原子的第3电子层含有18个电子C.H3AsO4的酸性比H3PO4弱D.砷的氢化物的稳定性比磷化氢的强7、某元素X的气态氢化物与该元素最高价氧化物的水化物反应生成盐,则该元素( )A.在周期表中处于第三周期ⅦA族B.在周期表中处于第二周期ⅤA族C.氢化物稳定性比PH3弱D.常见化合价只有-3、+2、+3、+5价8、下图为元素周期表中短周期的一部分,四种元素均为非稀有气体元素。

鲁科版高中化学必修二全册同步训练(共20套含解析)第1章原子结构与元素周期律第1节原子结构第1课时原子核核素课时训练1 原子核核素基础夯实 1.任何原子都具有的粒子是( ) A.质子、中子和电子 B.质子和中子 C.质子和电子 D.中子和电子答案:C 2.(2017湖北宜昌期中)下表符号中“2”的含义正确的一组是( ) H 2He Cl2 Ca2+ A 质量数中子数质子数电荷数 B 质量数质子数原子数电荷数 C 质子数中子数原子数电子数 D 质量数质子数分子数电荷数答案:B 解析: H中“2”代表质量数,2He中“2”代表质子数,Cl2中“2”代表原子数,即1个氯气分子中含有2个氯原子,Ca2+中“2”表示电荷数。
3. H、H+、H2是( ) A.氢的五种同位素 B.氢的五种同素异形体 C.五种氢元素 D.氢元素的五种不同微粒答案:D4.(2016广东深圳模拟)对于下列几种化学符号,有关说法正确的是( ) ①N②Na+③+12 ④P2O5⑤KClO3 A.表示物质组成的化学式有①④⑤ B.表示阳离子的有②③ C.④中数字“5”表示五氧化二磷中有5个氧原子D.⑤中各元素的质量比为1∶1∶3 答案:B 解析:A项,氮气的化学式为N2,故表示物质组成的化学式为④⑤,A项错误;C项,P2O5中“5”表示1个P2O5分子中含有5个氧原子,C项错误;D项,KClO3中钾、氯、氧元素的质量比为39∶35.5∶48,D项错误。
5.下列说法不正确的是( ) ①质子数相同的微粒一定属于同一种元素②同一元素的核素种数由中子数决定③同位素的化学性质几乎相同④质子数相同、电子数也相同的两种微粒,不可能一种是分子另一种是离子⑤Cl2中35Cl与37Cl两种核素的个数之比与HCl 中35Cl与37Cl的个数之比相等A.③ B.④ C.②⑤ D.① 答案:D 解析:元素的定义中有两个要点:①质子数相同,②是原子,将定义中的“原子”改为“微粒”是错误的,如Ne与HF其质子数均为10,但二者不是同一元素,①错误。
2019-2020 学年鲁科版高中化学必修二同步追踪训练元素周期律1、以下对于元素周期律的表达正确的选项是()A. 跟着元素原子序数的递加,原子最外层电子数老是从 1 到 8 重复出现B.元素的性质跟着原子序数的递加而呈周期性变化C.跟着元素原子序数的递加,元素的最高化合价从+1 到+7,最低化合价从-7 到 -1 重复出现D.元生性质的周期性变化是指原子核外电子排布的周期性变化、原子半径的周期性变化及元素主要化合价的周期性变化2、元素周期律的本质是( )A.原子核外电子排布的周期性变化B.原子半径的周期性变化C.元素化合价的周期性变化D.金属性和非金属性的周期性变化3、元素的以下性质跟着原子序数的递加不呈周期性变化的是()A. 化合价B. 原子半径C. 元素原子的最外层电子排布D. 相对原子质量4、以下离子中半径最大的是 ()A.Na +B.Mg 2+C.O2-D.F -5、某元素R 的最高价氧化物的水化物分子式是H n RO2n-2 , 则在气态氢化物中R元素的化合价是()A.3n-12B.12-3nC.3n-4D.3n-106、某元素 R 的最高正化合价与最低负化合价的绝对值之差为2,其气态氢化物中含氢的质量分数为8.8%, 试推测该元素是 ()A.NB.PC.SD.O7、某元素 (原子序数小于18)的最高正化合价与最低负化合价的代数和为4,则该元素原子的最外层电子数为()A.4B.5C.6D.78、以下相关元素化合价的说法正确的选项是()A. 原子核外最外层电子数同样的元素, 最高化合价必定相等B. 元素的最高化合价必定等于其原子核外最外层电子数C.全部元素的最高化合价与最低化合价的绝对值之和都等于8D.跟着核电荷数的递加 , 主族元素的最高正化合价和最低负化合价体现周期性变化9、短周期元素W 、X 、Y 和 Z 在周期表中的相对地点以下表所示,这四种元素原子的最外层电子数之和为 21。
元素周期律与元素周期表 同步练习基础卷(15分钟)1.元素性质呈周期性变化的原因是( ) A .相对原子质量逐渐增大 B .核电荷数逐渐增大 C .核外电子排布周期性变化 D .元素的化合价呈周期性变化2.分别比较以下(1)~(3)题中前后两个值的大小、用A 、B 、C 、D 表示前者和后者的关系。
( )(1)N 和F 的原子半径 A .大于 B .小于 C .等于 D .不能确定(2)O 178和O 168原子的核外电子数( )A .大于B .小于C .等于D .不能确定(3)原子核外M 电子层和L 电子层最多可容纳的电子数( ) A .大于 B .小于 C .等于 D .不能确定3.A 原子在M 层上有3个电子,B 原子在L 层上有6个电子,它们组成稳定化合物的化学式是( )A .B A 2 B .ABC .23B AD .32B A4.元素R 的最高价含氧酸分子式为22-n n RO H ,则在气态氢化物中R 元素的化合价为( )A .-10+3nB .-6+3nC .-12+3nD .-4+2n5.某元素原子的最外层电子数是次外层的a 倍(a>1),则该原子核内质子数是( )A .2aB .a+2C .2a+10D .2a+26.某元素X 的气态氢化物化学式为X H 2,下面的叙述不正确的是( ) A .该元素的原子最外电子层上有6个电子 B .该元素最高正价氧化物的化学式为2XO C .该元素是非金属元素D .该元素最高正价氧化物对应水化物的化学式为42XO H7.电子层数相同的3种元素X 、Y 、Z ,已知最高价氧化物对应水化物的酸性43424ZO H YO H HXO >>则下列判断错误的是( )A .原子半径X>Y>ZB .气态氢化物稳定性32ZH Y H HX >>C .非金属性X>Y>ZD .气态氢化物还原性32ZH Y H HX <<8.原子序数从11依次增加到17的元素,下列递变关系错误的是( ) A .电子层数逐渐增多 B .原子半径逐渐增大 C .最高正价数值逐渐增大 D .从硅到氯负价从-4→-19.在1~18号元素中,除稀有气体元素外,选择化学用语填空: (1)原子半径最大的元素是____________;(2)原子半径最小的元素是____________,其次是____________; (3)单质的还原性最强的元素是____________; (4)单质的氧化性最强的元素是____________; (5)单质为有色气体的元素是____________; (6)与水反应最剧烈的非金属单质是____________;(7)某元素的原子既能形成阳离子,也能以原子团形式形成阴离子,该两种离子在溶液中反应的离子方程式为____________。
第2节元素周期律和元素周期表第1课时元素周期律课时训练3 元素周期律基础夯实1.以下关于原子序数的说法中,正确的是( )A.原子序数与原子的核电荷数一定相等B.原子序数与离子的核外电子数一定相等C.原子序数相同的原子是同一种原子D.原子序数为16,核外电子数也为16的原子,其质量数为32答案:A解析:B项错误,因为对于阳离子而言,原子序数>核外电子数;对于阴离子而言,原子序数<核外电子数。
C项错误,如1H和2H原子序数相同,但不属于同一种原子。
D项错误,因为质量数=质子数+中子数,只知质子数为16,不知中子数,则无法确定质量数。
2.下列关于元素周期律的说法错误的是( )A.Li、Na、K元素的原子核外电子层数随着核电荷数的增加而增多B.第二周期元素从Li到F,非金属性逐渐增强C.因为Al在反应中失去3个电子而Mg失去2个电子,故金属性Al>MgD.元素周期表中随着元素原子序数的递增,每周期元素原子最外层电子并不总是从1到8重复出现答案:C解析:反应中失去电子的多少与元素的金属性强弱无关,金属性Mg>Al;第一周期只有两种元素,最外层电子数为1到2。
3.某元素原子的最外层有2个电子,关于该元素的推断一定正确的是( )A.是金属元素B.是化学性质活泼的元素C.是稀有气体元素D.无法确定答案:D解析:最外层电子数为2的元素有He、Be、Mg、Ca、Sr、Ba、Ra,7种元素中既有金属元素,也有稀有气体元素,因此无法确定是哪一种元素。
4.下列各组元素性质的递变情况错误的是( )A.Li、Be、B原子最外层电子数依次增多B.P、S、Cl元素最高正价依次升高C.N、O、F原子半径依次增大D.Na、K、Rb的电子层数逐渐增多答案:C解析:A项中Li、Be、B的最外层电子数分别为1、2、3,依次增多;B项中P、S、Cl最高正价分别为+5、+6、+7,依次升高;D项中Na、K、Rb电子层数分别为3、4、5,逐渐增多;而C项中N、O、F原子半径依次减小。
课时素养评价三元素周期律(30分钟50分)一、选择题(本题包括4小题,每小题5分,共20分)1.(2019·济南高一检测)结合元素周期律的知识分析下列说法,其中正确的是( )A.原子序数为15的元素的最高化合价为+5B.随着元素原子序数的递增,原子最外层电子数总是从1到8重复出现C.随着元素原子序数的递增,元素的最高化合价从+1到+7,最低化合价从-7到-1重复出现D.B、C、N、O、F最高正价依次增加【解析】选A。
A项,磷原子最外层为5个电子,最高化合价为+5,正确;B 项,H、He电子由1个到2个,错误;C项,F无正价,负价从-4到-1,错误;D 项,O无最高正价,F无正价,错误。
2.(2019·滨州高一检测)如图是部分1~18号元素化合价与原子序数的关系图,下列说法正确的是( )A.原子半径:Z>Y>XB.离子半径:Z>Y>XC.元素W的最高价和最低价代数和为4D.Y和Z两者最高价氧化物对应的水化物不能相互反应【解析】选C。
根据随原子序数递增化合价变化特点分析知,X为O,Y 为Na,Z为Al。
电子层数相同时,原子序数越大,半径越小;同纵列自上而下原子半径逐渐增大,则半径:Na>Al,Al>B,B>O,则Na>Al>O,A项错误;Na、O、Al形成的离子核外电子排布相同,核电荷数越大,半径越小,故离子半径:O2->Na+>Al3+,B项错误;Na与Al的最高价氧化物对应的水化物分别为NaOH、Al(OH)3,两者能够反应,D项错误;根据化合价知W为S,其最高价和最低价代数和为4,C项正确。
3.磷元素的常见单质有白磷和红磷两种,生活中常见的火柴头中就含有一定量的红磷。
已知下列元素的原子半径:原子N S O Si半径r/×10-10 m 0.75 1.02 0.73 1.11根据以上数据判断,磷原子的半径可能是 ( )A.1.06×10-10 mB.0.80×10-10 mC.0.70×10-10 mD.1.20×10-10 m【解析】选A。
课时跟踪检测(三)元素周期律1.下列关于元素周期律的叙述正确的是()A.随着元素原子序数的递增,原子最外层电子数总是从1到8重复出现B.元素的性质随着原子序数的递增而呈周期性变化C.随着元素原子序数的递增,元素的最高化合价从+1到+7,最低化合价从-7到-1重复出现D.元素性质的周期性变化是指原子核外电子排布的周期性变化、原子半径的周期性变化及元素主要化合价的周期性变化解析:选B K层为最外层时,原子最外层电子数只能从1到2,而不是从1到8,A 项错误;最低化合价一般是从-4到-1,而不是从-7到-1,C项错误;D项核外电子排布的周期性变化是元素性质周期性变化的根本原因,而不是内容。
2.下列元素的原子半径依次增大是()A.Na、Mg、Al B.Na、O、FC.P、Si、Al D.C、Si、P解析:选C比较元素原子半径的大小有两条规律:①具有相同电子层数的元素,随着原子序数的递增,原子半径递减;②具有相同最外层电子数的元素,随着电子层数的增加,原子半径增大。
A项,r(Na)>r(Mg)>r(Al);B项,r(Na)>r(O)>r(F);D项,r(Si)>r(P)。
3.下列元素的常见化合价从+1至+3依次增大的是()A.H、He、Li B.Na、Mg、AlC.Al、Be、Na D.N、O、F解析:选B A项中He为零价;C项的变化顺序为+3、+2、+1,与题目要求恰好相反;D项中F无正价。
4.X元素最高价氧化物对应的水化物为H3XO4,则它对应的气态氢化物为()A.HX B.H2XC.XH4D.XH3解析:选D X元素的最高正价是+5价,则其最低化合价为-3,故X元素氢化物的化学式为XH3。
5.关于H+、H、H-的半径由大到小的顺序是()A.H+、H、H-B.H、H+、H-C.H-、H、H+D.H-、H+、H解析:选C核电荷数相同的粒子,核外电子数越多半径越大。
6.下列说法中正确的是()A.非金属元素呈现的最低化合价,其绝对值等于该元素原子的最外层电子数B.非金属元素呈现的最高化合价不超过该元素原子的最外层电子数C.最外层有2个电子的原子都是金属原子D.金属元素只有正价和零价,而非金属元素既有正价又有负价和零价解析:选B非金属元素最低化合价的绝对值等于8减去最外层电子数,A错误;非金属元素的最高正价等于该元素原子的最外层电子数,不会超过该数值,B正确;氦原子最外层有2个电子,C错误;并非所有非金属元素都有正价,如F无正价,D错误。
7.原子序数小于20的X元素能形成H2X和XO2两种化合物,该元素的原子序数是()A.13 B.14C.15 D.16解析:选D X元素在H2X中呈-2价,在XO2中呈+4价,一般在氢化物中呈现最低负价,该元素的最高正价为+6,即最外层电子数为6,只有原子序数为16时符合条件。
8.元素X、Y、Z的原子序数依次增大,下列叙述一定正确的是()A.X、Y、Z原子的核内质子数依次增大B.X、Y、Z的最高正化合价依次升高C.X、Y、Z原子的原子半径依次增大D.X、Y、Z单质的金属活动性依次增大解析:选A元素的原子序数等于原子核内的质子数,A正确。
根据元素性质周期性递变的含义,B和C不一定正确。
X、Y、Z中可能含有非金属,仅据此即可断定D不正确。
9.有下列四种微粒:①188O②2311Na③2412Mg④147N。
(1)按原子半径由大到小的顺序排列为____________(只填序号,下同)。
(2)按离子半径由大到小的顺序排列为____________。
(3)微粒中质子数小于中子数的是____________。
(4)能形成X2Y2型化合物的是____________。
(5)通常情况下,化合价有0价、正价和负价的是________。
解析:2311Na与2412Mg具有相同的电子层数,最外层电子数分别为1、2,188O与147N具有相同的电子层数,最外层电子数分别为6、5;原子半径大小为23Na>24Mg>14N>18O;四种离子Na+、Mg2+、N3-和O2-核外电子排布相同,半径大小为r(Mg2+)<r(Na+)<r(O2-)<r(N3-)。
四种核素质子数和中子数分别是:18O→8、10;2311Na→11、12;2412Mg→12、12;147N→7、87。
通常情况下O元素不显正价,Na、Mg不显负价,只有N元素有0价、正价和负价。
答案:(1)②③④①(2)④①②③(3)①②(4)①②(5)④10.已知X、Y为1~18号元素中的两种元素,原子序数X>Y,且X、Y的最高正化合价与其最低负化合价绝对值相等,则(用元素符号或化学式填空):(1)X是________,Y是________,原子半径X____Y(填“>”或“<”)。
(2)X、Y的氢化物的化学式分别为________________;最高价氧化物的化学式分别为________________。
解析:X、Y的最高化合价等于其最低化合价的绝对值,据最高化合价+|最低化合价|=8可知X、Y的最高化合价为+4,即二者原子最外层电子数均为4,则为C、Si;由原子序数X>Y,可知X为Si元素,Y为C元素。
答案:(1)Si C>(2)SiH4、CH4SiO2、CO21.下列微粒半径的比较中,正确的是()A.r(Na+)>r(Na)B.r(Cl-)>r(Cl)C.r(Ca2+)>r(Cl-) D.r(Mg)>r(Na)解析:选B同一种元素:r阳离子<r原子<r阴离子,故A错误,B正确。
Ca2+和Cl-核外电子排布相同,因原子序数Ca>Cl,则半径r(Ca2+)<r(Cl-),C错误。
Na和Mg两种原子核外电子层数相同,因原子序数Mg>Na,故半径r(Mg)<r(Na),D错误。
2.元素X形成的离子与钙离子的核外电子排布相同,且X的离子半径小于负二价硫离子的半径。
X元素可能为()A.Al B.PC.Ar D.K解析:选D由X形成的离子与Ca2+核外电子排布相同,可排除Al、Ar;由X的离子半径小于S2-的半径,可排除P(半径:P3->S2-)。
3.元素M、N的原子序数不超过18,M的最高化合价为+1,N比M原子序数大1,下列叙述正确的是()A.M的原子最外电子层上只有1个电子B.M一定是金属元素C.N可能是活泼的非金属元素D.N的最高化合价一定是+2解析:选A M的原子序数不超过18,最高化合价为+1,则M一定在氢、锂、钠的范围内。
N比M原子序数大1,则N一定在氦、铍、镁的范围内。
4.X元素的阳离子和Y元素的阴离子具有与氩离子相同的电子层结构,下列叙述正确的是()A.X原子序数比Y的小B.X原子最外层电子数比Y的多C.X的原子半径比Y的大D.X元素的最高正价比Y的大解析:选C X n+、Y m-和Ar具有相同的电子层结构,其原子序数:X>Ar>Y,A项错误;X原子最外层电子数比Y的少,B项错误;X的原子半径比Y的大,C项正确;X元素的最高正价比Y的小,D项错误。
5.已知原子序数小于18的元素的离子a A2+、b B+、c C2-、d D-都具有相同的电子层结构,则下列叙述正确的是()A.原子半径:A>B>D>CB.离子半径:C2->D->B+>A2+C.原子序数:d>c>b>aD.原子的最外层电子数目:A>B>D>C解析:选B由4种离子具有相同的电子层结构可得a-2=b-1=c+2=d+1,a>b>d>c 故C项错误;原子的最外层电子数目为D>C>A>B,故D项错误;原子半径B>A>C>D,故A项错误。
6.某元素R的最高化合价与最低化合价的绝对值之差为2,其气态氢化物中含氢的质量分数为8.8%,试推断该元素是()A.N B.PC.S D.O解析:选B由题意可知,最高化合价-|最低化合价|=2 ①,而最高化合价+|最低化合价|=8 ②,将②-①得:|最低化合价|=3,该元素的最低化合价为-3价。
元素R的气态氢化物的化学式是RH3,氢元素的质量分数为3M(H)M(R)+3M(H)×100%=8.8%,解得M(R)≈31,查表可知,R是磷元素。
7.X和Y两元素的阳离子具有相同的电子层结构,X元素的阳离子半径大于Y元素的阳离子半径;Z和Y两元素的原子核外电子层数相同,Z元素的原子半径小于Y元素的原子半径。
X、Y、Z三种元素原子序数的关系是()A.X>Y>Z B.Y>X>ZC.Z>X>Y D.Z>Y>X解析:选D已知电子层结构相同的阳离子,核电荷数多的则半径小,具有相同电子层数的原子,随着原子序数增大,原子半径减小。
根据题意,X和Y两元素的阳离子具有相同的电子层结构,X元素的阳离子半径大于Y元素的阳离子半径,则X的原子序数小于Y的原子序数;Z和Y元素的原子核外电子层数相同,且Z元素的原子半径小于Y元素的原子半径,则Z的原子序数大于Y的原子序数。
由此得出三种元素原子序数的关系为Z>Y>X。
8.部分1~18号元素的原子半径及主要化合价如下表所示,则下列说法中正确的是()A.MB.单质与稀盐酸反应的速率为L<QC.M与T形成的化合物具有两性D.L2+与R2-的核外电子数相等解析:选C由表格中的原子半径和主要化合价首先判断出T为O,R为S,然后根据L、M、Q的化合价以及原子半径与O和S的大小比较可以判断出Q为Be,M为Al,L为Mg。
Al和Be均为金属元素;Mg的金属性比Be强,与稀盐酸反应的速率Mg>Be;Al2O3是两性氧化物;Mg2+、S2-的核外电子数分别为10、18。
9.元素A、B、C、D的简单离子,核外都有10个电子,A的氯化物中,电子总数为28,A和B的化合物分子A2B中共有30个电子,B与C的化合物为C2B3型;C与D的化合物为CD3型。
(1)试根据有关元素的化合物的分子构成确定其化合物的化学式。
ACl____________;A2B____________;C2B3____________;CD3____________。
(2)四种离子半径大小关系:______________________。
(3)A元素最高价氧化物对应水化物与C元素最高价氧化物对应水化物反应的离子方程式_______________________________________________________________________。