2014年沪教版九年级化学全册第六章:6.2《溶液组成的表示》教案
- 格式:doc
- 大小:66.50 KB
- 文档页数:1

第六章溶解现象第二节溶液组成的表示方法(第1课时)教学设计【教学目标:】知识与技能1.知道溶质、溶剂的概念,认识溶质、溶剂与溶液三者的关系;2.能够判断溶液的溶质与溶剂;3掌握溶液组成的表示方法;4.能进行溶质质量分数的简单计算;过程与方法通过溶质质量分数的简单计算,使学生掌握基本的解题方法,提高学生的解题能力。
情感、态度与价值观感受溶液组成的判定对工农业生产、生活中的重要作用,生活中离不开溶液。
【重点:】溶液的组成,溶液中溶质、溶剂的判断,溶质质量分数的简单计算。
【难点:】溶液中溶质、溶剂的判断,溶质质量分数的简单计算。
【教学过程:】复习1、物质溶解于水中明显放热有。
物质溶解于水中明显吸热的有。
2、固体物质溶于水使水溶液具有哪些性质?根据性质举例说明在日常生活中的应用?3、溶液导电的原因是什么?是否所有溶液都能导电?举两例说明。
引入新课在人类的生活、生产活动中处处离不开溶液。
投影几张图片,学生讨论[师生整理]一、溶液的组成1、溶液是由溶质和溶剂组成的。
溶质:被溶解的物质叫做溶质,溶质可以是固体、液体、或气体溶剂:溶解溶质的物质叫做溶剂。
水是最常用的溶剂,酒精、汽油也是常用的溶剂溶液的质量=溶质质量+溶剂质量(溶液质量有加和性)溶液的体积≠溶质体积 + 溶剂体积(溶液体积无加和性)[教师设疑]2.要如何判断溶液中的溶质和溶剂呢[师生整理](1)、当固体、气体和液体互溶时,一般是固体、气体作为溶质,液体作为溶剂。
(2)当两种液体互相溶解时,一般是量少的作为溶质,量多的作为溶剂。
(3)如果其中一种是水,不管水的量有多少,一般水是溶剂。
(4)如果溶液没有指明溶剂,一般指水作溶剂。
(5)一个溶液中,溶质可以有多种,溶剂通常只有一种[教师设疑]那么,要怎么给溶液命名呢[师生整理] 3.溶液的命名规律溶质名称+溶剂名称+溶液(溶质的溶剂溶液)水做溶剂的溶液通常不指明溶剂,就用溶质名称命名溶液,如碳酸钠的水溶液,简称碳酸钠溶液[学生活动]活动与探究(一)完成下表投影[教师设疑] 你知道下面瓶中标签是什么意思吗?投影出示一瓶浓盐酸标签下面我们就来学习溶液组成的表示方法。

6.2溶液组成的表示方法(第一课时)[教学目标]1、知道水是最重要的溶剂,能够指出某些溶液中溶质的状态。
2、认识溶液的组成,掌握一种溶液组成的表示方法。
3、初步学会配制一定质量分数的溶液。
4、通过探究活动了解溶液的质量关系,学习用质量分数表示溶液的组成。
5、通过学生的动手操作(称取、量取等)掌握一定质量分数溶液的配制方法。
[教学重点]1、溶液的组成,溶质、溶剂与溶液三者的关系。
2、用溶质的质量分数表示溶液的浓度。
【教学过程】生活情景导入。
问:它们是纯净物还是混合物?这三种混合物都是溶液吗?在糖水中有什么物质?在盐水中有什么物质?在糖水中还看见糖吗?它无缘无故消失了吗?它到哪里去了?(被水溶解了)展示标题和学习目标填表练习讲解:像糖这种被溶解的物质叫做溶质;像水这种溶解糖的物质叫做溶剂。
所有的溶液都是由溶质和溶剂组成的。
举例:盐水是一种溶液,盐水中溶质是什么?溶剂是什么?(小结:水是最常用的溶剂,因此一般人们所说的溶液都是指溶剂是水的水溶液。
)设问:糖水、盐水中的溶质是糖、盐,它们是什么状态的物质作溶质的?液体、气体是否可以作为溶质呢?活动探究1:用10毫升量筒量取8毫升酒精倒入烧杯中,然后用50毫升量筒量取20毫升水倒入烧杯中,搅拌得到的溶液中溶质是什么?是什么状态?让同学们拿出爱喝的碳酸饮料,看看饮料中有哪些物质?猜测:在溶质溶解于溶剂形成溶液的过程中,溶液的质量与溶质、溶剂的质量总和会相等吗?(投影)(得出结论)溶液质量=溶质质量+溶剂质量活动探究2:请同学们动手完成两个实验并填好实验报告实验1、称取3克蔗糖加到烧杯中,用量筒向烧杯中加入50毫升水,搅拌,使蔗糖完全溶解。
实验2、称取5克蔗糖加到烧杯中,用量筒向烧杯中加入50毫升水,搅拌使蔗糖完全溶解。
猜一猜:上述两个实验所得的溶液哪个更甜一些?哪个数据说明?讲解:我们把溶质质量与溶液质量的比值叫做溶质的质量分数,(投影)溶质质量分数=溶质质量/溶液质量x100%化学上常用溶质的质量分数来表示溶液的组成,除此之外,也可用其他方法来表示溶液的组成。

第六章第二节溶液组成的表示1.学习目标1.从日常生活经验和图例了解溶液的组成,溶质与溶剂的概念,并交流与讨论常见的溶液中溶质与溶剂。
2.通过探究活动了解溶液的质量关系,学习用质量分数表示溶液的组成。
3.通过例题学习溶液溶质质量分数的计算。
4.与同学协作配制一定质量分数的溶液。
2.【重点】1.溶液的组成,溶质、溶剂与溶液三者的关系。
2.掌握一种溶液组成的表示方法。
3.能进行溶质质量分数的简单计算。
4.初步学会配制一定溶质质量分数的溶液。
【难点】1.溶质与溶剂的辨证关系。
2.涉及体积的溶质质量分数的计算。
3.与化学反应方程式计算相结合的溶质质量分数的计算。
3.预习导航:一、溶液的组成;二、溶液组成的定量表示4.教学内容第1课时一、溶液的组成溶液的组成= 和。
溶质:。
溶剂:。
1.溶液的命名:前为溶质,后为溶剂,溶剂为水时一般读法中省略,如:白磷的二硫化碳溶液:溶质,溶剂;硫酸亚铁溶液:溶质,溶剂;碘酒:溶质,溶剂。
2.通常不指明溶剂的溶液均是指。
如:。
3.溶质与溶剂的相对划分:①固/气----液:固体、气体为;液体为。
如:。
②液----液:量少的液体为;量多的液体为。
③结晶水合物加到水中形成的溶液:如:。
④发生化学变化的:溶质为反应后稳定存在于溶液中的物质,即,而溶剂不变。
如:氧化钙放入水中,溶质,溶剂。
镁与过量的稀盐酸反应,溶质,溶剂。
过量的镁与稀硫酸反应,溶质,溶剂。
4.溶质可以是固、液、气态,溶剂通常是,或是、等。
5.一种溶液里可以有种或种溶质。
【练习】指出下列溶液中的溶质与溶剂(1)食盐水(2)碘酒(3)糖水(4)石灰水(5)稀硫酸(6)稀盐酸(7)硫酸铜溶液(8)酒精溶液(9)氯化钙溶液(10)氢氧化钠溶液(11)植物油的汽油溶液(12)硫酸亚铁溶液(13)一定量的锌和一定量的稀硫酸恰好完全反应后所得的溶液(14)一定量的锌和过量的稀盐酸完全反应后所得的溶液(15)足量的锌和一定量的稀硫酸完全反应后所得的溶液。

沪教版九年级化学第六章第二节:溶液组成的表示教学设计一
沪教版九年级化学第六章第二节:溶液组成的表示教学设计(一)查看全部教案请点击后面链接打开-->溶液的组成
一.溶液的组成
1.溶质、溶剂的判断(1)固体、气体溶于液体时,固体、气体为溶质,液体为溶剂;如:NaCl 固体溶于水中后形成氯化钠溶液,溶质为NaCl,溶剂为H2O;氯化氢气体溶于水后形成盐酸,溶质为HCl,溶剂为H2O;(2)两种液体相互溶解时,通常把量多的一种叫做溶剂,量少的一种叫做溶质;如:将90mL的汽油与10mL的植物油混合形成的溶液,汽油为溶剂,植物油为溶质(3)当溶液中有水存在时,无论水的量有多少,习惯把水看成溶剂,其他物质为溶质;如:将90mL的酒精与10mL的水相互混合而形成的溶液中,溶剂为水,溶质为酒精(4)当物质溶解时发生化学反应时,一定要判断准确溶质如:将CO2气体通入水中后得到的溶液,溶剂是水,溶质应该为碳酸。
(5)通常不指明溶剂的溶液,一般都是水溶液(四氯化碳、汽油、酒精等也是常见的溶剂)。

溶液组成的表示会配制一定质量的溶质质量分数的溶液。
教学过程:【创设情景】无土栽培的视频一、回顾、预习与交流【旧知回顾】Ca(N1.在某无土栽培种植基地,种植有番茄、甜瓜、茄子三种蔬菜。
种植人员现用64.62gKNO3固体和1000g水,若把它们配制成硝酸钾培养液,同学们参照投影中表格中的数据,看所配培养液适合哪种蔬菜。
2.和番茄所需的硝酸钾培养液相比,我们配制的培养液浓度大了。
若要把我们配制的培养液配成番茄培养液应该怎样配呢?3.如果我们要把原甜瓜的硝酸钾培养液配制成茄子的培养液,我们应该怎么办呢?【新知导学】:1、配制溶液的一般方法有哪些?二、合作、研讨与点拨活动一配制一定质量的溶质质量分数的溶液活动1、(1)农业生产上,有时用质量分数为10%~20%食盐溶液来选种。
现要配制50克15%食盐溶液,制溶液基本步骤……活动2、小组讨论:配置过程中出现溶质质量分数偏大的因素有哪些?配置过程中出现溶质质量分数偏小的因素有哪些?活动二:(2)用15%食盐溶液配制500ml生理盐水(生理盐水的溶质质量分数为0.9%,密度为1.0g/ml。
)液基本步骤活动2、小组讨论:配置过程中出现溶质质量分数偏大的因素有哪些?配置过程中出现溶质质量分数偏小的因素有哪些?三、总结、反思、提升1请找出下图中的错误:①;②;③。
2.总结:实验室配制溶液的一般步骤固体物质配置: _______、_________、_________浓溶液稀释配置:_______、________、__________3.提升:溶质质量分数偏大或偏小的因素。
四、自检、反馈与巩固【课堂作业】【课堂小结】学生总结,并完成导学案达标检测部分【作业布置】导学案课后训练部分【教学反思】。


溶液组成的表示1.知道溶质的浓度的概念2.掌握一种溶质浓度的表示方法:溶质的质量分数3.能进行溶质质量分数的简单计算一、溶质的质量分数(1)定义:溶液中溶质质量与溶液质量的比值叫做溶质的质量分数。
(2)数学表达式 %100%100⨯+=⨯=溶剂的质量溶质的质量溶质的质量溶液的质量溶质的质量溶质的质量分数符号:ω (3)理解:①溶质的质量分数只表示溶质质量与溶液质量之比,并不代表具体溶液质量和溶质质量。
②溶质的质量分数一般用百分数表示。
③溶质的质量分数计算式中溶质质量与溶液质量的单位必须统一。
④计算式中溶质质量是指被溶解的那部分溶质的质量,没有被溶解的那部分溶质质量不能计算在内。
⑤当溶剂中所溶解的溶质不止一种时,其中某溶质的质量分数,应是这种溶质质量占全部溶液质量的百分比。
⑥t ℃时,某物质的溶解度为Sg ,则t ℃,该物质饱和溶液中 %100100⨯+=S S溶质的质量分数(4)关于溶液中溶质的质量分数计算的具体情况①若溶质全部溶于水,且不与水发生化学反应,直接利用上述计算公式进行计算。
②若溶质虽不与水反应,但没有全部溶解,则溶质质量只计算溶解部分,未溶解部分不能参与计算。
③若溶质溶于水时与水发生了化学反应,则溶液中的溶质就为反应后的生成物了。
④若溶质为结晶水合物,溶于水后,其溶质的质量就不包括结晶水的质量。
因为结晶水合物溶于水时,结晶水就转化为溶液中的溶剂了。
(5)公式变形:溶质质量=溶液质量×溶质质量分数,溶液质量=溶质质量÷溶质质量分数,溶剂质量=溶液质量-溶质质量。
二、配制一定溶质质量分数溶液:实验仪器:烧杯、玻璃棒、量筒、托盘天平、药匙、胶头滴管实验步骤:计算、称量(对固体溶质)或量取(对液体物质)、溶解、装瓶,贴签。
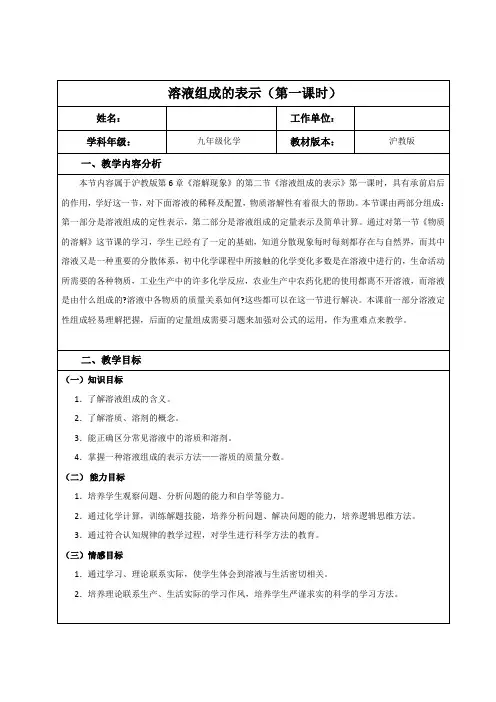
以配制50g 溶质质量分数为5%的蔗糖溶液为例说明。
(1)计算根据溶质质量分数的公式,计算配制50g溶质质量分数为5%的蔗糖溶液所需要的:①蔗糖质量:50g×5%=2.5g,②水的质量:50g-2.5g=47.5g 。

会配制一定质量的溶质质量分数的溶液。
【创设情景】
无土栽培的视频
一、回顾、预习与交流
【旧知回顾】
Ca(N O
3固体和1000g水,若把它们配制成硝酸钾培养液,同学们参照投影中表格中的数据,看所配培养液适合哪种蔬菜。
2.和番茄所需的硝酸钾培养液相比,我们配制的培养液浓度大了。
若要把我们配制的培养液配成番茄培养液应该怎样配呢?
3.如果我们要把原甜瓜的硝酸钾培养液配制成茄子的培养液,我们应该怎么办呢?
【新知导学】:
1、配制溶液的一般方法有哪些?
二、合作、研讨与点拨
活动一配制一定质量的溶质质量分数的溶液
活动1、(1)农业生产上,有时用质量分数为10%~20%食盐溶液来选种。
现要配制50配
……
、小组讨论:配置过程中出现溶质质量分数偏大的因素有哪些?
配置过程中出现溶质质量分数偏小的因素有哪些?
活动二:(2)用15%食盐溶液配制500ml生理盐水(生理盐水的溶质质量分数为0.9%,密度为1.0g/ml。
)
配制溶液基本步骤
配置过程中出现溶质质量分数偏小的因素有哪些?
三、总结、反思、提升
1请找出下图中的错误:①;
②;
③。
2.
总结:
实验
室配制溶液的一般步骤
固体物质配置: _______、_________、_________
浓溶液稀释配置:_______、________、__________
3.提升:溶质质量分数偏大或偏小的因素。
四、自检、反馈与巩固
【课堂作业】
【课堂小结】学生总结,并完成导学案达标检测部分
【作业布置】导学案课后训练部分
【教学反思】。
《溶液组成的表示》教案
一、教学目标
1、知识与技能
(1)知道水是最重要的溶剂,酒精、汽油等也是常见的溶剂(2)掌握溶质的质量分数的概念
(3)能进行溶质质量分数的简单计算
2、过程与方法
(1)会合作探究,讨论交流
(2)能找准各量的关系
3、情感态度与价值观
(1)学会严谨求实的进行化学计算
(2)培养具体问题具体分析的能力
重点溶质的质量分数的概念及简单计算
难点溶质的质量分数的有关计算
教学方法比较、归纳、练习、对比、活动探究
[归纳总结]
溶液质量=溶质质量+溶剂质
量
[板书] 溶液质量=溶质质量+
溶剂质量
[练习与实践]你能求出下列溶液中,溶质、溶剂、溶液
的质量吗?
[交流与讨论]这两杯氯化钠溶液有什么不同?[介绍]溶液浓度的表示方法[介绍]溶质质量分数
[板书]
二、溶液组成的表示
溶质质量分数
1、定义:溶质的质量与溶液
的质量之比
2、计算式:
[练习与实践]已知50g氯化钠溶液中含5g氯化钠,计算该溶液中氯化钠的质量分
数。
[练习与实践]你能计算出下列溶液的溶质质量分数吗?
板书设计:
第二节溶质组成的表示一、溶液的组成
溶质、溶剂
溶液质量=溶质质量+溶剂质量
二、溶质的质量分数
1、定义:溶质的质量与溶液的质量之比
2、计算式:。
溶液组成的表示课题 6.2溶液组成的表示教学时间教学目标1.使学生认识溶液组成,知道溶质、溶剂的概念。
2.使学生认识溶液的名称,能根据溶液的名称说出溶质、溶剂。
3.使学生知道溶液的质量、体积、密度之间的关系4.使学生会判定反应后溶液中溶质。
教学重点认识溶液组成说出溶质、溶剂教学难点认识溶液组成说出溶质、溶剂教学方法讨论比较归纳教学媒体教学过程:【创设情景】在上节课中我们已经讨论了溶液在人类的生活和生产中有着重要的作用。
而在使用溶液时,人们往往需要知道溶液的组成和溶液中各种物质的质量关系。
一、回顾、预习与交流【旧知回顾】:1.下列物质中,哪些属于溶液?① 少量面粉加入水中振荡后的液体② 澄清石灰水中通入适量的二氧化碳③生理盐水④ 稀盐酸⑤稀硫酸⑥ 冰溶于水⑦ 澄清的海水⑧ 液态氧⑨ 啤酒2.溶液是物,食盐水是和的混合物,所有的溶液都是由和组成的。
被溶解的物质叫,溶解溶质的物质叫做,在食盐水溶液中,是溶质,是溶剂。
【新知导学】:二、合作、研讨与点拨(一)溶液的组成溶液溶质溶剂蔗糖水氯化钠溶液澄清石灰水稀盐酸稀硫酸碘酒滴入几滴植物油的汽油体积分数为70%消毒酒精一定质量的铁与过量的稀盐酸充分反应后得到的溶液归纳:(1)溶质的状态可以是、、,溶剂状态一般是,最常见的溶剂是。
(2)溶质可以有种,溶剂只有种。
当固体、气体溶于液体时,固体、气体为溶质,液体为溶剂;当两种液体相互溶解时,把量多的物质叫溶剂,量少的物质为溶质;如果有水,不管量多量少,水是溶剂,另一种物质为溶质。
(二).溶液的命名:溶质的溶剂溶液,如果没有说明溶剂的名称,则溶剂为水(1)硫酸铜溶于水得到溶液,简称为(2)酒精溶于水得到溶液,简称为(3)碘溶于酒精得到溶液,简称为(4)白磷溶于二硫化碳中,得到溶液,氯化氢溶于水中,得到溶液,俗称。
(5)铁和硫酸铜溶液恰好完全反应后得到的溶液(三)溶液的质量和体积1.溶液质量= +溶液的体积≠+,为什么?溶液的质量===溶液的体积×当溶质和溶剂混合混合后,讨论下列有关量的关系?①.10克NaCl完全溶解在100克水中所得溶液质量 110克食盐水;②.10ml酒精和10ml水混合后所得溶液体积 20ml的酒精溶液;③.某食盐水的密度为1.04克/毫升,现取50毫升的该食盐水,则该溶液的质量克。
溶液组成的表示课堂探究第一课时有关溶液的简单计算点拨:1.当加入水中的固体没有完全溶解时,溶质只是溶解的那一部分,不溶解的不是溶质。
因此,在计算某一溶质的质量分数时,应用已溶解的固体质量除以已溶解的固体和水的质量之和,千万不能忘记乘以100%。
2.进行溶质质量分数的计算,各物理量都必须用质量表示,并且单位要统一。
3.有时不知道溶液的质量,可根据溶质和溶剂质量或溶液的体积和密度进行换算[m(溶液)=V(溶液)×ρ(溶液)]。
第二课时一、溶液配制点拨:配制一定溶质质量分数的溶液,是化学学习中一项基本的操作,必须熟练掌握。
(1)实验内容不同所用的实验仪器有所不同,如用食盐和水配制50 g 5%的食盐溶液,所需的仪器主要是托盘天平、量筒、烧杯、玻璃棒、药匙;而用37%的浓盐酸配制50 g 5%的稀盐酸,所用的主要实验仪器是量筒、玻璃棒、烧杯。
(2)在实验操作中要注意:瓶塞要倒放;用玻璃棒搅拌;在烧杯中溶解等。
二、溶液配制的误差分析点拨:实际配制过程中的误差分析:1.有以下几种原因可能会导致配制的溶质质量分数偏低:仰视量取水的体积(导致水的体积偏多);用托盘天平称量固体物质时,将物质与砝码放反,砝码放在左盘,且移动游码(导致称得固体质量偏小);烧杯内原来有水;固体溶质中含有杂质等。
2.导致配制的溶质质量分数偏高的原因可能是:俯视量取水的体积(导致水的体积偏少);将量取的水向烧杯中倾倒时洒在烧杯外等。
三、溶质质量分数计算与化学方程式计算的综合点拨:1.在根据化学方程式列出有关反应物、生成物的质量比时,要以溶质的质量列出比例,而不能用溶液的质量或体积;2.对于反应后所得溶液的质量有两种求法:(1)溶液质量=溶质质量+溶剂质量,其中溶剂水的质量在计算时应注意:若反应中不生成水时,溶剂水的质量等于参加反应的各溶液中溶剂质量之和;若反应中生成水,则还需要加上生成的水的质量。
(2)溶液质量=反应物质量总和-生成的气体(或沉淀的)质量,若气体和沉淀都生成,则溶液质量=反应物质量总和-生成的气体的质量-沉淀的质量。
化学初三沪教版 6.2 溶液构成的表示教课设计教课目的:知识与技术:知道水是最重要的溶剂 , 酒精 , 汽油也是常有的溶剂 , 可以指出某些溶液中溶质的状态,能进行溶质质量分数的简单计算。
过程与方法:经过实验使学生理解,有溶质质量分数,踊跃主动的与别人沟通,能清楚相关对溶质,溶剂的理解。
感情态度与价值观:经过对溶质,溶剂的理解,培育学生辨正地剖析问题。
学习重难点:溶质质量分数的计算课前准备教师:生理盐水或葡萄糖注射液的标签。
仪器:烧杯〔两个〕,托盘天平,量筒,玻璃棒药品:蔗糖,水教课过程:【一】创建情形引入新课:投影:生理盐水或葡萄糖注射液的标签设问:若是你是一名护士,尊医嘱给病人静脉输液,关于你手里拿着这瓶药液,你一定关注它的哪些方面。
【二】商讨溶液的构成1、溶质、溶剂的判断:被溶解的物质叫溶质,溶解溶质的物质叫溶剂。
沟通与与议论:填写表6-62、溶液、溶质、溶剂三者之间的关系溶液质量 =溶质质量 +溶剂质量,即溶液的质量就有加和性;溶液体积≠溶质体积 +溶剂体积,即溶液中体积不拥有加和性3、溶液构成的表示方法:〔1〕演示实验: P.161 上的实验 1、实验 2〔2〕大略的表达:浓溶液和稀溶液〔3〕较为精准的表示:溶液的溶质质量分数溶质质量与溶液质量之比叫做溶液的溶质质量分数溶液的溶质质量分数()溶质的质量溶质的质量100%溶质的质量100%溶液的质量溶剂的质量【三】解说例题:P.162 例题【四】教师小结:1、小结本课主要知识点2、指出当溶液体积和密度时,可用公式“质量=密度×体积”求得溶液的质量【五】部署作业:P.164 练习与实践T.1 、 2、 6、7。
第二节溶液组成的表示
一、学习目标
1、知识与技能:
①从日常生活经验和图例了解溶液的组成,溶质与溶剂的概念,并交流与讨论常见的溶液中溶质与溶剂
②通过探究活动了解溶液的质量关系,学习用质量分数表示溶液的组成。
③通过例题学习溶液溶质质量分数的计算
④与同学协作配置一定质量分数的溶液。
2、过程与方法:通过活动和探究,培养学生之间的合作
3、情感、态度与价值观:溶液在使用过程中要了解溶液的组成才能使用,培养严谨的科学态度。
二、任务分析
1、起点能力:学生对日常生活中的溶解现象有所了解
2、教学重点:
①溶液的组成,溶质、溶剂与溶液三者的关系。
②掌握一种溶液组成的表示方法。
③能进行溶质质量分数的简单计算。
④初步学会配制一定溶质质量分数的溶液。
3、教学难点:
①溶质与溶剂的辨证关系。
②涉及体积的溶质质量分数的计算。
③与化学反应方程式计算相结合的溶质质量分数的计算。
4、课型:探究、讨论、练习
5、课时安排:4课时
教学过程
第一课时溶液的组成、溶液组成的定量表示
【引入】高锰酸钾水溶液是高锰酸钾溶于水后形成的混合物,蔗糖水溶液是蔗糖溶于水后形成的混合物。
所以的溶液都是由溶质和溶剂组成的。
像高锰酸钾、蔗糖这样被溶解的物质叫做溶质。
像水这样溶解溶质的物质叫做溶剂。
【交流讨论】常见溶液的组成
【说明】
1、水是常用的溶剂,但不是所有的物质都能溶解在水里。
2、溶质可以是气体:O2、H2、CO、CH4、HCl
溶质也可以是液体,则产生问题:哪种物质是溶剂?
判断标准是两个“通常”、一个“习惯”:
通常把量多的是溶剂,通常不指明溶剂的,溶剂是水;
习惯上不论水有多少,水是溶剂。
如溶质和溶剂两名称都写,则前面是溶质。
例如:水的酒精溶液,水是溶质,酒精是溶剂。
【活动与探究】课本161页实验1、2
【思考】猜一猜,哪个更甜一些?为什么?
【阅读】课本162页例题
【教后小结】。