常见酸碱的电离常数(2)
- 格式:doc
- 大小:194.00 KB
- 文档页数:6

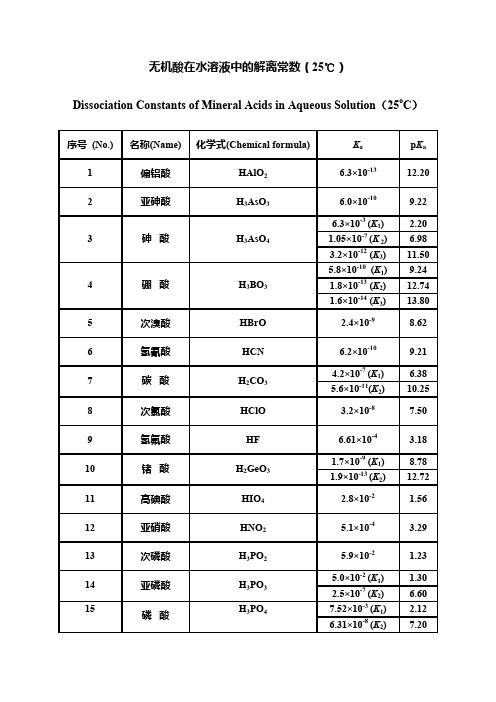
无机酸在水溶液中的解离常数(25℃)Dissociation Constants of Mineral Acids in Aqueous Solution (25o C )序号 (No.)名称(Name) 化学式(Chemical formula)K a p K a 1 偏铝酸 HAlO 2 6.3×10-13 12.20 2亚砷酸H 3AsO 36.0×10-10 9.22 6.3×10-3 (K 1)2.20 1.05×10-7 (K 2) 6.98 3砷 酸H 3AsO 43.2×10-12 (K 3) 11.50 5.8×10-10 (K 1)9.24 1.8×10-13 (K 2) 12.74 4硼 酸H 3BO 31.6×10-14 (K 3)13.80 5 次溴酸 HBrO 2.4×10-9 8.62 6 氢氰酸 HCN 6.2×10-10 9.21 4.2×10-7 (K 1) 6.38 7 碳 酸 H 2CO 3 5.6×10-11(K 2) 10.25 8 次氯酸 HClO 3.2×10-8 7.50 9 氢氟酸 HF 6.61×10-4 3.18 1.7×10-9 (K 1) 8.78 10 锗 酸 H 2GeO 3 1.9×10-13 (K 2) 12.72 11 高碘酸 HIO 4 2.8×10-2 1.56 12 亚硝酸 HNO 2 5.1×10-4 3.29 13 次磷酸 H 3PO 2 5.9×10-2 1.23 5.0×10-2 (K 1) 1.30 14 亚磷酸 H 3PO 3 2.5×10-7 (K 2) 6.60 7.52×10-3 (K 1) 2.12 15磷 酸H 3PO 46.31×10-8 (K 2)7.204.4×10-13 (K3)12.363.0×10-2 (K1) 1.524.4×10-3 (K2) 2.36 16焦磷酸H4P2O72.5×10-7 (K3) 6.605.6×10-10 (K4)9.251.3×10-7 (K1) 6.88 17氢硫酸H2S7.1×10-15 (K2)14.151.23×10-2 (K1) 1.91 18亚硫酸H2SO36.6×10-8 (K2)7.181.0×103 (K1)-3.0 19硫酸H2SO41.02×10-2 (K2) 1.992.52×10-1 (K1)0.60 20硫代硫酸H2S2O31.9×10-2 (K2) 1.721.3×10-4 (K1) 3.89 21氢硒酸H2Se1.0×10-11(K2)11.02.7×10-3 (K1) 2.57 22亚硒酸H2SeO32.5×10-7 (K2) 6.601×103 (K1)-3.0 23硒酸H2SeO41.2×10-2 (K2) 1.921.7×10-10 (K1)9.77 24硅酸H2SiO31.6×10-12 (K2)11.802.7×10-3 (K1) 2.57 25亚碲酸H2TeO31.8×10-8 (K2)7.74Dissociation Constants of Mineral Bases in Aqueous Solution (25o C)序号(No.)名称(Name)化学式 (Chemical formula)K b p K b 1氢氧化铝Al(OH)3 1.38×10-9(K3)8.86 2氢氧化银AgOH 1.10×10-4 3.963.72×10-3 2.433氢氧化钙Ca(OH)23.98×10-2 1.404氨水NH3+H2O 1.78×10-5 4.759.55×10-7(K1) 6.025肼(联氨)N2H4+H2O1.26×10-15(K2)14.96羟氨NH2OH+H2O9.12×10-98.049.55×10-4(K1) 3.027氢氧化铅Pb(OH)23.0×10-8(K2)7.528氢氧化锌Zn(OH)29.55×10-4 3.02Dissociation Constants of Organic Bases in Aqueous Solution (25oC)序号(No.)名称(Name)化学式(Chemical formula)K b p K b 1甲胺CH3NH2 4.17×10-4 3.38 2尿素(脲)CO(NH2)2 1.5×10-1413.82 3乙胺CH3CH2NH2 4.27×10-4 3.37 4乙醇胺H2N(CH2)2OH 3.16×10-5 4.508.51×10-5(K1) 4.075乙二胺H2N(CH2)2NH27.08×10-8(K2)7.156二甲胺(CH3)2NH 5.89×10-4 3.23 7三甲胺(CH3)3N 6.31×10-5 4.20 8三乙胺(C2H5)3N 5.25×10-4 3.28 9丙胺C3H7NH2 3.70×10-4 3.432 10异丙胺i-C3H7NH2 4.37×10-4 3.362.95×10-4(K1)3.53111,3-丙二胺NH2(CH2)3NH23.09×10-6(K2) 5.515.25×10-5(K1) 4.28121,2-丙二胺CH3CH(NH2)CH2NH24.05×10-8(K2)7.39313三丙胺(CH3CH2CH2)3N 4.57×10-4 3.34 14三乙醇胺(HOCH2CH2)3N 5.75×10-7 6.24 15丁胺C4H9NH2 4.37×10-4 3.36 16异丁胺C4H9NH2 2.57×10-4 3.59 17叔丁胺C4H9NH2 4.84×10-4 3.31518己胺H(CH2)6NH2 4.37×10-4 3.3619辛胺H(CH2)8NH2 4.47×10-4 3.35 20苯胺C6H5NH2 3.98×10-109.40 21苄胺C7H9N 2.24×10-5 4.65 22环己胺C6H11NH2 4.37×10-4 3.36 23吡啶C5H5N 1.48×10-98.83 24六亚甲基四胺(CH2)6N4 1.35×10-98.87 252-氯酚C6H5ClO 3.55×10-6 5.45 263-氯酚C6H5ClO 1.26×10-5 4.90 274-氯酚C6H5ClO 2.69×10-5 4.575.2×10-5 4.28 28邻氨基苯酚(o)H2NC6H4OH1.9×10-5 4.727.4×10-5 4.13 29间氨基苯酚(m)H2NC6H4OH6.8×10-5 4.172.0×10-43.70 30对氨基苯酚(p)H2NC6H4OH3.2×10-6 5.50 31邻甲苯胺(o)CH3C6H4NH2 2.82×10-109.55 32间甲苯胺(m)CH3C6H4NH2 5.13×10-109.29 33对甲苯胺(p)CH3C6H4NH2 1.20×10-98.928-羟基喹啉8-HO—C9H6N 6.5×10-5 4.19 34(20℃)35二苯胺(C6H5)2NH7.94×10-1413.15.01×10-10(K1)9.30 36联苯胺H2NC6H4C6H4NH24.27×10-11(K2)10.37有机酸在水溶液中的解离常数(25℃)Dissociation Constants of Organic Acids in Aqueous Solution(25oC)序号(No.)名称(Name)化学式 (Chemical formula)K a p K a1甲酸HCOOH 1.8×10-4 3.75 2乙酸CH3COOH 1.74×10-5 4.76 3乙醇酸CH2(OH)COOH 1.48×10-4 3.835.4×10-2(K1) 1.27 4草酸(COOH)25.4×10-5(K2) 4.27 5甘氨酸CH2(NH2)COOH 1.7×10-109.78 6一氯乙酸CH2ClCOOH 1.4×10-3 2.86 7二氯乙酸CHCl2COOH 5.0×10-2 1.30 8三氯乙酸CCl3COOH 2.0×10-10.70 9丙酸CH3CH2COOH 1.35×10-5 4.87 10丙烯酸CH2═CHCOOH 5.5×10-5 4.26 11乳酸(丙醇酸)CH3CHOHCOOH 1.4×10-4 3.861.4×10-3(K1)2.85 12丙二酸HOCOCH2COOH2.2×10-6(K2) 5.66 132-丙炔酸HC≡CCOOH 1.29×10-2 1.89 14甘油酸HOCH2CHOHCOOH 2.29×10-43.64 15丙酮酸CH3COCOOH 3.2×10-3 2.49 16α-丙胺CH3CHNH2COOH 1.35×10-109.87酸 17β-丙胺酸CH 2NH 2CH 2COOH4.4×10-1110.3618 正丁酸 CH 3(CH 2)2COOH 1.52×10-5 4.82 19 异丁酸 (CH 3)2CHCOOH 1.41×10-5 4.85 20 3-丁烯酸 CH 2═CHCH 2COOH 2.1×10-5 4.68 21异丁烯酸 CH 2═C(CH 2)COOH2.2×10-5 4.66 9.3×10-4(K 1)3.0322反丁烯二酸(富马酸) HOCOCH═CHCOOH 3.6×10-5(K 2)4.441.2×10-2(K 1)1.9223顺丁烯二酸(马来酸)HOCOCH═CHCOOH5.9×10-7(K 2)6.231.04×10-3(K 1)2.98 24 酒石酸 HOCOCH(OH)CH(OH)COOH4.55×10-5(K 2) 4.34 25 正戊酸 CH 3(CH 2)3COOH 1.4×10-5 4.86 26 异戊酸 (CH 3)2CHCH 2COOH 1.67×10-5 4.78 27 2-戊烯酸 CH 3CH 2CH═CHCOOH 2.0×10-5 4.70 28 3-戊烯酸 CH 3CH═CHCH 2COOH 3.0×10-5 4.52 29 4-戊烯酸 CH 2═CHCH 2CH 2COOH 2.10×10-5 4.677 1.7×10-4(K 1) 3.77 30 戊二酸HOCO(CH 2)3COOH 8.3×10-7(K 2) 6.08 31谷氨酸 HOCOCH 2CH 2CH(NH 2)COOH7.4×10-3(K 1)2.134.9×10-5(K2) 4.314.4×10-10 (K3)9.358 32正己酸CH3(CH2)4COOH 1.39×10-5 4.8633异己酸(CH3)2CH(CH2)3—COOH 1.43×10-5 4.85(E)-2-己34H(CH2)3CH═CHCOOH 1.8×10-5 4.74烯酸(E)-3-己35CH3CH2CH═CHCH2COOH 1.9×10-5 4.72烯酸3.8×10-5(K1)4.42 36己二酸HOCOCH2CH2CH2CH2COOH3.9×10-6(K2) 5.417.4×10-4(K1) 3.13 37柠檬酸HOCOCH2C(OH)(COOH)CH2COOH1.7×10-5(K2) 4.764.0×10-7(K3) 6.40 38苯酚C6H5OH 1.1×10-109.963.6×10-109.45 39邻苯二酚(o)C6H4(OH)21.6×10-1312.83.6×10-10(K1)9.30 40间苯二酚(m)C6H4(OH)28.71×10-12(K2)11.06 41对苯二酚(p)C6H4(OH)2 1.1×10-109.96 2,4,6-三2,4,6-(NO2)3C6H2OH 5.1×10-10.29 42硝基苯酚43葡萄糖酸CH2OH(CHOH)4COOH 1.4×10-4 3.8644苯甲酸C6H5COOH 6.3×10-5 4.201.05×10-3(K1)2.98 45水杨酸C6H4(OH)COOH4.17×10-13(K2)12.38邻硝基苯46(o)NO2C6H4COOH 6.6×10-3 2.18甲酸。

电离常数ka1ka2全文共四篇示例,供读者参考第一篇示例:电离常数是描述溶液中酸或碱的强度的重要参数,它可以帮助我们了解溶液中的离子平衡及化学反应过程。
电离常数通常用Ka表示,Ka越大表示酸或碱越强,反之则越弱。
在强酸和强碱中,电离常数非常大,而在弱酸和弱碱中则较小。
电离常数又分为两种,分别是一元酸或碱的电离常数(Ka1)和二元酸或碱的第二个电离常数(Ka2)。
一元酸或碱在水中的电离反应是比较简单的,只有一个质子或氢离子被释放,而二元酸或碱在水中的电离反应则会释放两个质子或氢离子,因此其电离常数会有所不同。
对于一元酸来说,其电离反应可以用以下方程式表示:HA ⇌ H+ + A-HA代表未电离的酸分子,H+代表质子或氢离子,A-代表酸根离子。
一元酸的电离常数Ka1可以通过以下公式求得:Ka1 = [H+][A-] / [HA][H+]、[A-]分别代表质子和酸根离子的浓度,[HA]代表未电离的酸分子的浓度。
举例来说,对于强酸盐酸(HCl)来说,其电离反应是非常完全的,几乎所有的HCl都会电离为H+和Cl-离子,所以其电离常数Ka1非常大,接近无穷大。
而对于弱酸如乙酸(CH3COOH),其电离反应并不完全,只有一小部分乙酸会电离为H+和CH3COO-离子,所以其电离常数Ka1则比较小。
对于二元酸或碱来说,其电离反应会涉及到两个质子或氢离子的释放。
以硫酸(H2SO4)为例,其电离反应可以表示为:H2SO4 ⇌ H+ + HSO4-HSO4- ⇌ H+ + SO4^2-对于第一个电离反应,可以求得第一个电离常数Ka1,而对于第二个电离反应,可以求得第二个电离常数Ka2。
一般来说,第一个电离常数Ka1会比第二个电离常数Ka2大很多,因为第一个质子的释放相对容易一些。
第二篇示例:电离常数ka1ka2是化学中重要的物理量之一,它是描述酸或者碱在水溶液中电离的程度的指标。
它是一个衡量溶液中电离平衡的重要参数,是求解溶液的酸碱特性和计算pH值的基础。




电离平衡常数表介绍电离平衡常数是描述化学反应中离子生成和解离的平衡程度的指标。
它是指在一定温度下,反应物和产物的浓度之比的平衡常数。
电离平衡常数表是一个记录了各种化合物的电离平衡常数的表格,它对于研究溶液中的离子反应和平衡具有重要的意义。
电离平衡常数的定义电离平衡常数(Ka)是指在特定温度下,酸性溶液中酸和水的反应生成氢离子和对应的酸根离子的平衡常数。
它的表达式为: Ka = [H+][A-] / [HA] 其中[H+]表示氢离子的浓度,[A-]表示酸根离子的浓度,[HA]表示酸的浓度。
电离平衡常数的意义电离平衡常数反映了化学反应中离子生成和解离的平衡程度。
它可以用来判断酸性溶液的强弱,以及在溶液中是否存在可溶性盐。
电离平衡常数的大小与酸的强度有关,较大的电离平衡常数表示酸更强,反之则表示酸较弱。
电离平衡常数表的内容电离平衡常数表通常包含了各种化合物的电离平衡常数。
这些化合物可以是酸、碱或盐。
常见的化合物包括无机酸(如硫酸、盐酸)、有机酸(如乙酸、柠檬酸)、强碱(如氢氧化钠、氢氧化钾)等。
电离平衡常数表按照化合物的名称或公式的字母顺序排列,方便查找和比较。
电离平衡常数表的应用电离平衡常数表在化学实验和研究中有广泛的应用。
它可以用来计算溶液中各种离子的浓度,帮助研究者了解溶液中的离子反应和平衡。
通过比较不同化合物的电离平衡常数,可以评估它们的酸碱性质和溶解度。
电离平衡常数表还可以用于计算酸碱滴定的终点和中和曲线。
电离平衡常数表的局限性电离平衡常数表虽然提供了大量化合物的电离平衡常数数据,但它也存在一定的局限性。
首先,电离平衡常数是在特定温度下测定的,不同温度下的电离平衡常数可能不同。
其次,电离平衡常数只是一个理论值,实际情况可能受到其他因素的影响。
最后,电离平衡常数只能描述溶液中离子生成和解离的平衡程度,不能完全反映溶液中其他化学反应的平衡。
总结电离平衡常数表是一个记录了各种化合物的电离平衡常数的表格。


第1篇一、引言酸是化学中一类重要的物质,它们在水溶液中能够释放出氢离子(H+)。
酸的电离平衡常数(Ka)是衡量酸强弱的一个重要指标,它反映了酸在水溶液中电离的程度。
本文将列举一些常见酸的电离平衡常数,以便于读者查阅和参考。
二、强酸的电离平衡常数1. 盐酸(HCl)Ka = 1.3×10^62. 硫酸(H2SO4)Ka1 = 1.99×10^3Ka2 = 2.0×10^-23. 硝酸(HNO3)Ka = 4.0×10^34. 氢溴酸(HBr)Ka = 1.0×10^95. 氢碘酸(HI)Ka = 1.0×10^10三、中等强度的酸的电离平衡常数1. 乙酸(CH3COOH)Ka = 1.8×10^-52. 乳酸(C3H6O3)Ka = 4.3×10^-53. 丙酸(C2H5COOH)Ka = 1.4×10^-54. 苹果酸(C4H6O5)Ka = 1.7×10^-45. 乳酸(C3H6O3)Ka = 4.3×10^-5四、弱酸的电离平衡常数1. 氢氟酸(HF)Ka = 6.6×10^-42. 氢氰酸(HCN)Ka = 4.9×10^-103. 氢亚硫酸(H2SO3)Ka1 = 1.6×10^-2Ka2 = 1.3×10^-74. 氢亚磷酸(H3PO3)Ka1 = 7.5×10^-3Ka2 = 6.2×10^-8Ka3 = 4.6×10^-135. 氢硫酸(H2S)Ka1 = 1.0×10^-7Ka2 = 1.3×10^-13五、非常弱的酸的电离平衡常数1. 氨水(NH3)Ka = 1.8×10^-52. 氢硫化氢(H2S)Ka = 1.0×10^-73. 氢亚硫酸(H2SO3)Ka = 1.6×10^-24. 氢亚磷酸(H3PO3)Ka = 7.5×10^-35. 氢氰酸(HCN)Ka = 4.9×10^-10六、总结本文列举了常见酸的电离平衡常数,包括强酸、中等强度酸、弱酸和非常弱的酸。

酸碱中的化学平衡与电离常数化学平衡是化学反应中物质浓度达到一定比例时的状态,酸碱反应也不例外。
在酸碱反应中,酸和碱之间的化学平衡与电离常数密切相关。
本文将探讨酸碱中的化学平衡以及电离常数的重要性。
1. 酸碱反应中的化学平衡酸碱反应是指酸和碱之间发生的化学反应。
在酸碱反应中,酸和碱分别会发生电离反应,产生氢离子(H+)和氢氧根离子(OH-)。
这些离子会在溶液中相互结合,形成水分子(H2O),从而达到化学平衡的状态。
例如,当盐酸(HCl)与氢氧化钠(NaOH)反应时,产生的氢离子和氢氧根离子会结合成水分子,同时生成氯化钠(NaCl)。
HCl + NaOH → NaCl + H2O在这个反应中,酸和碱的浓度决定了反应的进行程度。
当酸和碱的浓度相等时,反应会达到化学平衡,不再发生明显的反应。
这时,溶液中的氢离子和氢氧根离子的浓度达到一定比例,维持着化学平衡的状态。
2. 电离常数与酸碱反应电离常数是描述溶液中酸碱电离程度的指标,用Kw表示。
对于酸碱反应,电离常数与酸碱的强弱有关。
强酸和强碱的电离常数较大,而弱酸和弱碱的电离常数较小。
电离常数的计算可以通过酸碱溶液中的氢离子和氢氧根离子的浓度来确定。
在水中,水分子也会发生电离,产生氢离子和氢氧根离子。
水的电离常数(Kw)等于氢离子浓度([H+])和氢氧根离子浓度([OH-])的乘积。
Kw = [H+][OH-]在中性溶液中,氢离子浓度等于氢氧根离子浓度,即[H+] = [OH-]。
因此,中性溶液的电离常数为Kw = [H+]^2。
3. pH和pOH的概念pH是描述溶液酸碱性的指标,它表示溶液中氢离子浓度的负对数。
pH的计算公式为pH = -log[H+]。
pOH则是描述溶液碱性的指标,表示溶液中氢氧根离子浓度的负对数。
pOH的计算公式为pOH = -log[OH-]。
根据水的电离常数(Kw = [H+][OH-]),可以得到pH和pOH之间的关系。
pH + pOH = 14,即当溶液的pH值增加时,pOH值减小,反之亦然。


常见酸碱的电离常数(解离常数)电离常数(ionization constant,又称解离常数)是生物化学中一个重要的概念,它表示了一种物质在溶液中的解离度和电荷的大小。
一般情况下,电离常数越大,表明溶液中放电离子越多,pH值越低。
以下是常见酸碱的电离常数信息:1. 氢氧化钠(NaOH):电离常数为1.40×10^-22. 氢氧化钙(Ca(OH)2):电离常数为2.12×10^-53. 氢氧化镁(Mg(OH)2):电离常数为1.06×10^-114. 氢氧化氢(H2O):电离常数为1.00×10^-145. 氢氧化氯(HCl):电离常数为1.00×10^-16. 氢氧化碳酸钙(CaCO3):电离常数为4.51×10^-97. 氢氧化锌(Zn(OH)2):电离常数为2.08×10^-168. 氢氧化硫酸(H2SO4):电离常数为1.20×10^-29. 氢氧化硅酸钙(SiO2.CaO):电离常数为1.14×10^-510. 氢氧化银氨(AgNH3):电离常数为4.90×10^-1011. 氫氧化銻(Sb(OH)3):电离常数为4.25×10^-512. 氢氧化镍(Ni(OH)2):电离常数为7.75×10^-1613. 氢氧化锂(LiOH):电离常数为2.50×10^-114. 氢氧化铁(Fe(OH)2):电离常数为5.26×10^-1615. 氢氧化锆(Zr(OH)4):电离常数为2.66×10^-616. 氢氧化碳酸铝(Al2(CO3)3):电离常数为1.25×10^-917. 氢氧化氯化钠(NaClO):电离常数为3.31×10^-118. 氢氧化氯化铵( NH4ClO):电离常数为4.92×10^-219. 氢氧化高氯酸钠(NaClO3):电离常数为2.05×10^-220. 氢氧化氯化钙(Ca(ClO)2):电离常数为8.37×10^-6。


化学平衡与酸碱中的电离常数计算方法化学平衡是指在反应物和生成物之间达到动态平衡的状态。
在酸碱反应中,电离常数是我们计算酸碱溶液中离子浓度的重要参数。
本文将介绍化学平衡的基本概念以及计算酸碱中的电离常数的方法。
一、化学平衡的基本概念在化学反应中,反应物会发生转化生成产物,产物同样也会再转化为反应物。
当反应物和生成物之间速度相等时,达到了动态平衡。
平衡常数K是描述反应物和生成物的浓度比例的一个值,与温度相关。
化学方程式中的反应物和生成物的浓度可以用K来表示。
二、酸碱中的电离常数计算方法在酸碱溶液中,酸和碱会电离产生离子,离子浓度的计算需要确定电离常数。
以下是计算酸碱中电离常数的几种常见方法。
1. 酸离子或碱离子的浓度已知当酸或碱的浓度已知时,可以使用浓度来计算电离常数。
根据酸碱离解方程式,化学方程式中的浓度比例可以用电离常数表示。
例如对于酸HA,可以使用以下方程式表示其电离过程:HA ↔ H+ + A-电离常数Ka的计算公式为:Ka = [H+][A-]/[HA]其中[H+]代表氢离子浓度,[A-]代表酸的阴离子浓度,[HA]代表酸的浓度。
2. pH值已知pH值是酸碱溶液中酸性或碱性程度的一种表达方式。
若已知溶液的pH值,可以通过反推计算电离常数。
pH值本质上是负对数表示氢离子浓度的单位。
例如,若已知溶液的pH值为4,则其氢离子浓度为10^-4mol/L。
进一步应用电离常数公式可以计算出具体的Ka值或Kb 值。
3. Henderson-Hasselbalch方程式Henderson-Hasselbalch方程式是计算酸碱溶液中pH值和电离常数之间关系的常用公式。
对于酸碱反应,该方程式为:pH = pKa + log([A-]/[HA])其中pH值为溶液的酸碱性程度,在已知pH值的情况下可以使用该方程式推导出对应的电离常数。
总结:化学平衡是反应物和生成物之间达到动态平衡的状态,通过平衡常数K来表示。
在酸碱反应中,电离常数是计算溶液中离子浓度的关键参数。

高中常见酸的电离常数
在化学学科中,酸碱的理论是非常重要的基础知识。
酸的电离常数是评价酸强弱的重要指标,也是理解酸碱反应机理的关键。
下面介绍一些高中化学中常见的酸的电离常数。
1. 盐酸(HCl)的电离常数为1.0×10^-1。
2. 硝酸(HNO3)的电离常数为2.3×10^-1。
3. 硫酸(H2SO4)的电离常数为1.2×10^-2。
4. 醋酸(CH3COOH)的电离常数为1.8×10^-5。
5. 碳酸(H2CO3)的电离常数为4.5×10^-7。
6. 硼酸(H3BO3)的电离常数为5.8×10^-10。
7. 硅酸(H4SiO4)的电离常数为2.4×10^-10。
需要注意的是,酸的电离常数与浓度有关,一般情况下,电离程度越大,酸的浓度越高,其电离常数也就越大。
在实际应用中,酸的电离常数是根据实验数据计算得出的,因此,不同文献中给出的数值可能存在些许差异。
以上是高中化学中常见的酸的电离常数,了解这些数据有助于加深对酸碱理论的理解,也是学习化学的基础。
- 1 -。


碳酸的二级电离常数【实用版】目录1.碳酸的电离过程2.二级电离常数的定义3.碳酸的二级电离常数与酸性关系4.影响二级电离常数的因素5.二级电离常数在实际应用中的意义正文碳酸是一种弱酸,它在水中会发生电离过程。
电离过程可以分为两步,其中第一步的电离常数被称为一级电离常数,第二步的电离常数被称为二级电离常数。
二级电离常数是指碳酸氢根离子(HCO3-)进一步电离成碳酸根离子(CO32-)的平衡常数。
由于碳酸是弱酸,它的二级电离程度相对较小,因此,碳酸的二级电离常数主要反映了碳酸的第一步电离程度。
碳酸的二级电离常数与酸性关系密切。
在常温下,碳酸的二级电离常数 Ka2 大约为 4.3×10^-7。
这个数值越小,表示碳酸的酸性越弱。
因此,通过测量碳酸的二级电离常数,可以了解其酸性强弱。
影响二级电离常数的因素主要有温度、压力和溶液中其他化学物质的浓度等。
首先,温度对二级电离常数有重要影响。
一般来说,温度越高,二级电离常数越大,酸性越强。
其次,压力也会影响二级电离常数。
压力增大会导致二氧化碳在水中的溶解度增大,从而促进碳酸的电离平衡正向移动,使二级电离常数增大。
此外,溶液中其他化学物质的浓度也会对二级电离常数产生影响。
例如,如果溶液中碳酸氢根离子的浓度增大,那么二级电离常数会减小,酸性减弱。
在实际应用中,二级电离常数具有重要意义。
它可以用来预测溶液的酸碱性,对环境监测、工业生产和生物医学等领域具有重要意义。
例如,在环境监测中,通过测量水体中碳酸的二级电离常数,可以了解水体的酸碱性,从而判断水体是否受到污染。
在工业生产中,二级电离常数可以用来控制生产过程中的酸碱度,以保证产品质量。