种子生活力的测定资料
- 格式:ppt
- 大小:792.00 KB
- 文档页数:13

实验四种子生活力测定一、实验目的和要求了解测定种子生活力的基本原理,并学会其操作程序。
种子生活力:种子潜在的发芽能力。
二、测定原理四唑:2,3,5-三苯基氯(溴)化四唑(C19H15N4Cl(Br))的简称为,为白色粉末,水溶液无色。
染色原理:种胚活细胞中的脱氢酶产生氢,与浸入种胚内的四唑发生作用,产生红色稳定而不扩散的三苯基甲(TPF)。
判断标准:凡种胚染成红色者表示有生活力,不染色的种子为无生活力的种子;不染色的部位为坏死的部位,根据坏死组织出现的部位及其分布可以判断种子的生活力。
三、材料及器具材料:刺槐器具及药品:烧杯、解剖刀、解剖针、镊子、培养皿、量筒、滤纸、手持放大镜、玻璃棒、取样匙、1%四唑等四、方法及步骤1. 测定样品的提取从净度测定后的纯净种子中随机提取50粒种子(四分法)。
3次重复。
同时准备部分种子作为后备。
2. 种子预处理(浸种,同发芽测定)3. 溶液配制溶液A:9.078g KH2PO4溶于1000mL水;溶液B:11.876g Na2HPO4·2H2O溶于1000mL水;缓冲液配制:溶液A:溶液B以2:3比例混合;1%的四唑溶液配制:称取四唑1g溶于100mL的缓冲溶液,现配现用。
4. 取种胚、染色处理剥除外种皮和内种皮,取出种胚后放入盛有清水的玻璃皿;记录空粒、腐烂粒及病虫害感染种粒。
如取胚时由于人为因素而破坏种胚,可从后备种子中补取;种胚剥取结束后一起放入四唑溶液,使溶液淹没种仁,上浮者要压沉。
置黑暗处,保持30~35℃染色2~3h。
5. 结果鉴定经过染色的种子分组放在潮湿的滤纸上,借助于手持放大镜或实体显微镜逐粒观察。
有生活力:种胚和胚乳完全着色;无生活力:种胚和胚乳完全不着色;根据种胚或胚乳上未着色的斑块的位置和大小判断种子有无生活力(种胚不染色的最大面积不超过1/4子叶末端)。
6. 种子生活力计算生活力的百分率根据3个重复组计算,不带小数,重复组间最大容许误差与发芽测定的规定相同,最后以3组生活力百分率的平均值为该种子批的生活力。



欢迎阅读种子生活力的测定一、氯化三苯基四氮唑(TTC)法【原理】凡有生活力的种子胚部在呼吸作用过程中都有氧化还原反应,而无生活力的种胚则无此反应。
当TTC溶液渗入种胚的活细胞内,并作为氢受体被脱氢辅酶(NADH或NADPH)还原时,可产生红色的三苯基甲(TTF),胚便染成红色。
当种胚生活力下降时,呼吸作用明显减弱,脱氢酶的活性亦大大下降,胚的颜色变化不明显,故可由染色的程度推知种子的生活力强弱。
TTC还原反应如下:TTC(无色)TTF(红色)【仪器与用具】培养皿2套;镊子1把;单面刀片1片;垫板(切种子用)1块;烧杯1个;棕色试剂瓶;解剖针1把;搪瓷盘1个;pH试纸。
【试剂】TTC溶液的配制:取1gTTC溶于1L蒸馏水或冷开水中,配制成0.1%的TTC 溶液。
药液pH应在6.5~7.5,以pH试纸试之(如不易溶解,可先加少量酒精,使其溶解后再加水)。
【方法】1.将玉米、小麦等作物的新种子、陈种子或死种子,用温水(30℃)浸泡2~6h,使种子充分吸胀。
2.随机取种子2份,每份50粒,沿种胚中央准确切开,取每粒种子的一半备用。
3.把切好的种子分别放在培养皿中,加TTC溶液,以浸没种子为度。
4.放入30~35℃的恒温箱内保温30min.也可在20℃左右的室温下放置40~60min.5.保温后,倾出药液,用自来水冲洗2~3次,立即观察种胚着色情况,判断种子有无生活力,把判断结果记入表32-1内。
表32-1染色法测定种子生活力记载表方法种子名称供试粒数有生活力种子粒数无生活力种子粒数有生活力种子占供式粒数的%【注意事项】1.TTC溶液最好现配现用,如需贮藏则应贮于棕色瓶中,放在阴凉黑暗处,如溶液变红则不可再用。
2.染色温度一般以25~35℃为宜。
3.判断有生活力的种子应具备:胚发育良好、完整、整个胚染成鲜红色;子叶有小部分坏死,其部位不是胚中轴和子叶连接处;胚根尖虽有小部分坏死,但其它部位完好。
4.判断无生活力的种子应具备:胚全部或大部分不染色;胚根不染色部分不限于根尖;子叶不染色或丧失机能的组织超过1/2;胚染成很淡的紫红色或淡灰红色;子叶与胚中轴的连接处或在胚根上有坏死的部分;胚根受伤以及发育不良的未成熟的种子。
种子生活力快速测定一、实验原理通过本实验,掌握种子生活力快速测定的原理和方法。
二、实验原理(1)活细胞染色:脱氢辅酶(NADH或NAFPH)存在于活的细胞内,当TTC渗透进入细胞内作为受体被脱氢辅酶上的氢还原,便由无色的TTC变为红色的三苯基甲(TTE)。
当细胞死亡后,NADH会迅速被降解,不会发生相应的颜色反应,故TTC染色法可显示细胞是否存活。
(2)死细胞染色:有生命力的细胞膜是一个半透性膜,因此对内渗透的物质有选择性;而无生命力的细胞,其细胞膜已经消失,因此有的有色物质(如品红)不能进入活的细胞内,但可以进入已经死亡的细胞,从而使细胞内出现该有色成分特有的颜色,故可以据此鉴别细胞是否死亡。
三、实验材料、药品和器具1、实验材料:花生、黄豆2、实验药品和器具:品红、TTC、培养皿、吸水纸、镊子、解剖针、刀片等四、试验方法1、分别取10颗红豆和黄豆的种子,沿种子的培从中切成两半,将带胚的部分放入培养皿中,加入TTC培养1h左右,观察胚染色的情况。
胚被染色的为有活力种子,未被染色的为无活力的种子。
2、别取10颗红豆和黄豆的种子,沿种子的培从中切成两半,将带胚的部分放入培养皿中,加入品红培养10-20min,倒掉品红溶液,冲洗数次,观察胚染色的情况。
胚被染色的为无活力种子,未被染色的为有活力的种子。
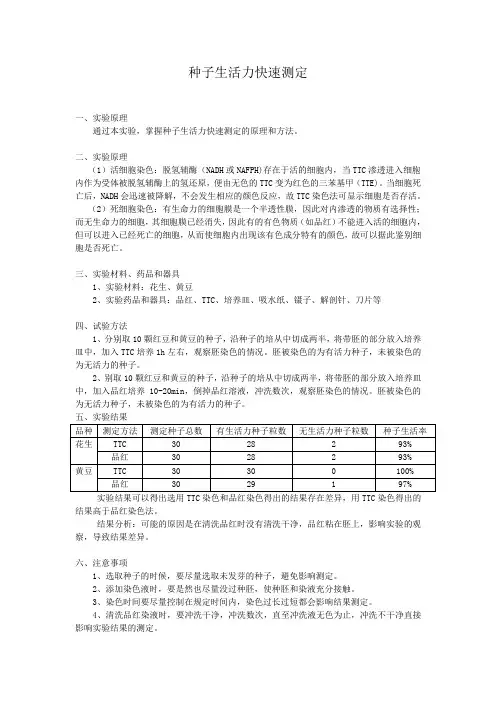
五、实验结果品种测定方法测定种子总数有生活力种子粒数无生活力种子粒数种子生活率花生TTC 30 28 2 93% 品红30 28 2 93%黄豆TTC 30 30 0 100% 品红30 29 1 97% 实验结果可以得出选用TTC染色和品红染色得出的结果存在差异,用TTC染色得出的结果高于品红染色法。
结果分析:可能的原因是在清洗品红时没有清洗干净,品红粘在胚上,影响实验的观察,导致结果差异。
六、注意事项1、选取种子的时候,要尽量选取未发芽的种子,避免影响测定。
2、添加染色液时,要是然也尽量没过种胚,使种胚和染液充分接触。





实验三十九种子生活力的快速测定种子发芽率是鉴定种子品质的重要标志,在确定播种量以及种子生理研究方面具有重要的作用,常需加以测定。
但一般测定发芽率的方法所需时间长,尤其是对处在深休眠状态的种子,根本无法应用,所以有必要根据活种子的生理特性建立起一套快速鉴定种子生活力的方法,以克服常规方法的缺点。
本实验介绍剥胚法,染色法和荧光法三类方法,可根据具体情况选用。
Ⅰ、剥胚法一、目的掌握用剥胚法测定种子生活力的原理和方法。
二.原理此法适于测定休眠状态的种子的生活力。
种子深休眠的原因很多,有些是因为果皮或种皮的束缚(如不透水、不透气)造成的;也有的在果皮、种皮、胚乳中存在着萌发抑制剂,这类障碍可以用除去果皮、种皮、胚乳或切去一部分子叶的办法克服。
当阻碍萌发的物理或化学因素被排除以后,胚就很快萌发。
三、材料与设备1. 材料:苹果、柑桔的成熟种子或玉米乳熟期籽粒。
2. 设备:培养皿;滤纸;刀片;镊子。
3. 试剂:0.1﹪升汞。
四、实验步骤1. 种子处理取刚从成熟果实中剥出的新鲜柑桔种子300粒,已晒干的柑桔种子100粒,乳熟期新鲜玉米种子200粒,经晒干的乳熟期玉米种子或贮存三年以上的玉米陈种子各100粒,用0.1%升汞消毒后再用水充分洗净,进行以下处理:1.1柑桔新鲜种子,不加处理,作为对照;1.2 柑桔新鲜种子,用镊子小心剥去种皮,留下完整的胚;1.3柑桔新鲜种子,用刀片把种子横切为二,留下带胚根的一半,注意切除部分应不少于种子全长的一半。
1.4晒干的柑桔种子*,处理同1.2;*柑桔种子经晒干后即失去发芽能力。
1.5新鲜乳熟期玉米粒,不加处理作为对照(新鲜乳熟玉米种子粒因胚乳中存在着萌发抑制剂,不能萌发)。
1.6新鲜乳熟期玉米子粒,用镊子小心地将胚剥出。
1.7 晒干的乳熟期玉米子粒,不加处理。
1.8 贮存三年以上的玉米陈子粒,不加处理。
2. 观察测定以上处理完毕,随即将种子或胚整齐地摆在铺有适当大小滤纸的培养皿里,用蒸馏水湿润滤纸,加盖后置30℃左右的温箱中培养,并注意随时补充水分(但不可加水过多,否则易因缺氧而霉烂),从第二天起每天统计发芽种子数,记入下表,连续观察二星期。

实验23种子生活力的快速测定种子生活力是指种子能够萌发的潜在能力或种胚具有的生命力。
它是决定种子品质和实用价值大小的主要依据,与播种时的用种量直接有关。
测定种子生活力常采用发芽实验,即在适宜条件下,让种子吸水萌发,在规定天数内统计发芽的种子占供试种子的百分数。
但是常规方法(直接发芽)测定种子生活力所需时间较长,特别是有时为了应急需要,没有足够的时间来测定发芽率,遇到休眠种子也无法知道。
而采用以下的化学方法,则能在较短时间内获得结果。
Ⅰ 氯化三苯基四氮唑法( TTC 法)一、原理凡有生命活力的种子胚部,在呼吸作用过程中都有氧化还原反应,在呼吸代谢途径中由脱氢酶催化所脱下来的氢可以将无色的 TTC 还原为红色、不溶性三苯基甲( TTF ),而且种子的生活力越强,代谢活动越旺盛,被染成红色的程度越深。
死亡的种子由于没有呼吸作用,因而不会将TTC 还原为红色。
种胚生活力衰退或部分丧失生活力,则染色较浅或局部被染色。
因此,可以根据种胚染色的部位以及染色的深浅程度来判定种子的生活力。
二、实验材料、试剂与仪器设备(一)实验材料玉米、小麦等种子。
(二)试剂0.5% TTC 溶液:称取 0.5 gTTC 放在烧杯中,加入少许 95% 乙醇使其溶解,然后用蒸馏水稀释至 100 mL 。
溶液避光保存,若变红色,即不能再用。
(三)仪器设备恒温箱,培养皿,刀片,烧杯,镊子,天平。
三、实验步骤1. 浸种将待测种子在 30 ~35 ℃温水中浸种(大麦、小麦 6 小时,玉米 5 小时左右),以增强种胚的呼吸作用。
2. 显色取吸胀的种子 200 粒,用刀片沿种子胚的中心线纵切为两半,将其中的一半置于 2 只培养皿中,每皿 100 个半粒,加入适量的 0.5% TTC 溶液,以覆盖种子为度。
然后置于30 ℃恒温箱中 1 h 。
观察结果,凡胚被染为红色的是活种子。
将另一半在沸水中煮 5 min 杀死胚,作同样染色处理,作为对照观察。
种子生活力的测定一、氯化三苯基四氮唑(TTC)法【原理】凡有生活力的种子胚部在呼吸作用过程中都有氧化还原反应,而无生活力的种胚则无此反应。
当TTC溶液渗入种胚的活细胞内,并作为氢受体被脱氢辅酶(NADH或NADPH)还原时,可产生红色的三苯基甲(TTF),胚便染成红色。
当种胚生活力下降时,呼吸作用明显减弱,脱氢酶的活性亦大大下降,胚的颜色变化不明显,故可由染色的程度推知种子的生活力强弱。
TTC还原反应如下:TTC(无色)TTF(红色)【仪器与用具】培养皿2套;镊子1把;单面刀片1片;垫板(切种子用)1块;烧杯1个;棕色试剂瓶;解剖针1把;搪瓷盘1个;pH试纸。
【试剂】TTC溶液的配制:取1g TTC溶于1L蒸馏水或冷开水中,配制成0.1%的TTC溶液。
药液pH应在6.5~7.5,以pH试纸试之(如不易溶解,可先加少量酒精,使其溶解后再加水)。
【方法】1.将玉米、小麦等作物的新种子、陈种子或死种子,用温水(30℃)浸泡2~6h,使种子充分吸胀。
2.随机取种子2份,每份50粒,沿种胚中央准确切开,取每粒种子的一半备用。
3.把切好的种子分别放在培养皿中,加TTC溶液,以浸没种子为度。
4.放入30~35℃的恒温箱内保温30min.也可在20℃左右的室温下放置40~60min.5.保温后,倾出药液,用自来水冲洗2~3次,立即观察种胚着色情况,判断种子有无生活力,把判断结果记入表32-1内。
【注意事项】1.TTC溶液最好现配现用,如需贮藏则应贮于棕色瓶中,放在阴凉黑暗处,如溶液变红则不可再用。
2.染色温度一般以25~35℃为宜。
3.判断有生活力的种子应具备:胚发育良好、完整、整个胚染成鲜红色;子叶有小部分坏死,其部位不是胚中轴和子叶连接处;胚根尖虽有小部分坏死,但其它部位完好。
4.判断无生活力的种子应具备:胚全部或大部分不染色;胚根不染色部分不限于根尖;子叶不染色或丧失机能的组织超过1/2;胚染成很淡的紫红色或淡灰红色;子叶与胚中轴的连接处或在胚根上有坏死的部分;胚根受伤以及发育不良的未成熟的种子。
实验六种子生活力的快速测定一、实验目的1.加深对种子作用的理解;2.掌握种子生活力的测定方法。
二、实验原理在播种、交换和调运种子之前,都要及时了解种子的发芽率,以确定是否作为播种材料或引种种源。
因此,快速而又准确地测定种子生活力,对于及时调种和播种后确保全苗、壮苗具有极其重要的意义。
种子生活力是指种子能够萌发的潜在能力或种胚具有的生命力。
有生活力的种子进行呼吸作用,呼吸代谢途径催化产生的氢(H)有生活力的种子进行呼吸作用,呼吸代谢途径催化产种子生活力越强,代谢活动越旺盛,被染成红色的程度越深;死亡种子没有呼吸作用,不会将TTC还原成红色;种胚生活力衰退或部分丧失生活力,染成较浅或局部被染色;三、实验材料及用品材料:绿豆种子实验器皿:恒温箱、小烧杯、镊子、刀片实验试剂:0.5%TTC溶液(避光保存)四、实验步骤1. 浸种:将待测种子在30 ~35 ℃温水中浸种,以增强种胚的呼吸作用。
2. 显色:a、种子处理:随即选取吸胀的种子40 粒,小心剥去种皮,勿伤及种胚。
b、实验组处理:将处理好的20粒种子置于小烧杯中,加入0.5%TTC溶液,以刚好浸没种子为宜,恒温(32℃)中保1h。
c、对照组处理:另取20粒种子,于沸水浴中煮5min后,加入0.5%TTC溶液,以刚好浸没种子为宜,恒温(32℃)中保温1h。
3. 统计:染色结束,马上鉴定;倒出TTC溶液,用清水将种子冲洗1-2次,观察种胚乳染色情况。
有生活力种子:种胚全部或大部分被染成红色;无生活力种子:不被染色。
生活力的种子数计算种子生活力的比率= ————————X 100%实验组测定种子数五、实验现象与结果保温1h后种子染色情况:被染色的数目未被染色的数目未煮沸的种子14 6煮沸的种子0 20表一种子染色情况记录表图1 未煮沸的种子染色情况图2 煮沸的种子染色情况生活力的种子数未煮沸的种子生活力的比率= ————————X 100% = 14/20 X 100% = 70%实验组测定种子数生活力的种子数煮沸的种子生活力的比率= ———————X 100% =0/20 X 100% = 0实验组测定种子数六、分析和讨论1.在实验中,去种皮时要小心防止伤及种胚,因为胚是种子中的活细胞,若损失可能使实验无法进行反应,造成实验的误差。
种子生活力的测定方法种子生活力的测定有以下几种方法:(一)氯化三苯基四氮唑法( TTC)1.将种子用温水(约30℃)浸泡2--6小时,使种子充分吸胀。
2.随机取种子100粒,红花、蓖麻等具有外壳的需要去掉外壳,豆类种子要去皮。
然后沿种胚中央准确切开,取一半备用。
3.将准备好的种子浸于2,3,5-三苯基氯化四氮唑(TTC)溶液中,于恒温箱( 30~35℃)中保温30分钟。
4.染色结束后要立即进行鉴定,因放久会褪色。
倒出TTC溶液,再用清水将种子冲洗1--2次,观察种胚被染色的情况,凡种胚全部或部分被染成红色的即为具有生命力的种子,种胚不被染色的为死种子。
如果种胚中非关键性部位(如子叶的一部分)被染色,而胚根或胚芽的尖端不染色,都属于不能正常发芽的种子。
(二)溴麝香草酚蓝法(BTB法)1.浸种:同上述 TTC 法。
2.BTB 琼脂凝胶的制备:取 0.1% BTB 溶液 100 mL 置于烧杯中,将 1 g 琼脂剪碎后加入,用小火加热并不断搅拌。
待琼脂完全溶解后,趁热倒在 4 个干洁的培养皿中,使成一均匀的薄层,冷却后备用。
3.显色:取吸胀的种子 200 粒,整齐地埋于准备好的琼脂凝胶培养皿中,种子胚朝下平放,间隔距离至少 l cm 。
然后将培养皿置于 30 ~ 35 ℃下培养1 ~2 小时,在蓝色背景下观察,如种胚附近呈现较深黄色晕圈是活种子,否则是死种子。
4.计算活种子百分率。
用沸水杀死的种子作同样处理,进行对比观察。
(三)靛红染色法步骤同TTC染色法。
注意事项1.染料的浓度要适当,染色时间不能太长(如用红墨水染色,只需要5~10分钟即可),否则不容易区别染色与否。
2.靛红染色法测定种子生活力,适用于豆类、麻类、瓜类、十字花科、果树、乔灌木种子的生活力测定。
(四)碘化钾反应法1.将种子在水中浸18小时。
2.取出种子放在垫有湿滤纸的培养皿内,将培养皿置30℃恒温箱中,不同植物种子放置时间不同,如松种子放48小时,落叶松放72小时。
第五章种子生活力和活力测定第五章种子生活力与活力测定本章讲2节§1、种子生活力测定原理及方法§2、种子活力测定原理及方法第一节种子生活力测定的原理与方法在种子贸易中,时常需要在短时间内掌握种子批的生活力状况,如果种子处于休眠状态难以通过发芽测定得到结果,种子生活力测定可以满足这一要求。
一、种子生活力概念:种子生活力(seed viability)指种子发芽的潜在能力或种胚具有的生命力;种子生活力和发芽具有不同的含义:一些休眠种子在发芽试验中不能发芽,但它是有生活力的,破除休眠后,能长成正常幼苗。
而生活力反映的是种子发芽率和休眠种子百分率的总和。
所以,种子生活力测定,反映的是种子批的最大发芽潜力。
二、种子生活力测定的意义1、测定休眠种子的生活力新收获的或在低温贮藏处于休眠状态的种子,正常发芽条件下,其发芽力很低,这种情况下,仅用发芽试验测定其发芽率,就不可能测出种子的最高发芽率。
必须进行生活力测定,了解种子的发芽潜力,合理利用种子。
(怎样利用?)播种之前对发芽率低而生活力高的种子,应进行适当处理后播种。
种子检验时,发芽试验末期有新鲜不发芽的种子或硬实种子,就应接着进行生活力测定;或破除休眠后做发芽试验。
2、快速预测种子的发芽力:休眠种子可借助于各种预处理打破休眠,进行发芽试验,但时间较长;而种子贸易中,因时间紧迫,不可能采用标准发芽试验来测定发芽力,因为发芽试验所需的时间较长。
如小麦8d,水稻14d,菠菜21d。
而多数林木种子则需要更长的时间(如月季15~25℃发芽,70d 计算发芽率)。
这时,可用生物化学法测定种子生活力作为参考;而林木种子可用生活力来代替发芽力。
种子生活力测定方法有四唑染色法、靛蓝染色法、红墨水染色法、软X射线造影法等。
本节将重点介绍四唑染色法,并简要介绍其他方法。
三、四唑测定法(GB)(一)四唑测定法概述1、发展简史四唑测定法于1942年由德国kon(莱康)教授发明,二战期间传人美国。