物质的分类和命讲义名 - 教育在线博客
- 格式:ppt
- 大小:1.26 MB
- 文档页数:26


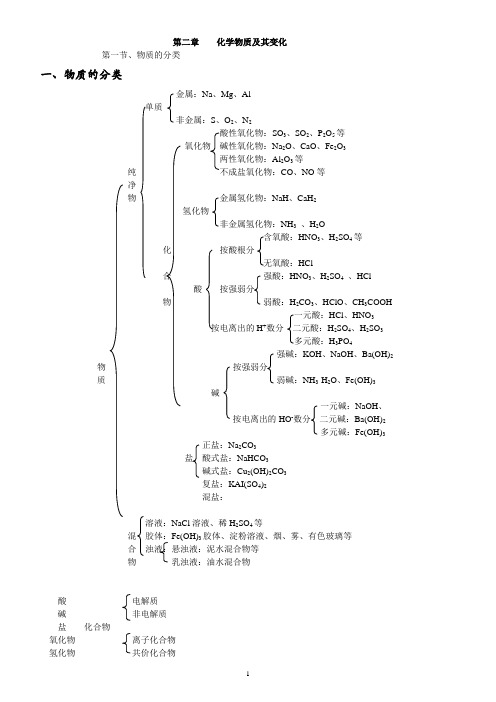
第二章化学物质及其变化第一节、物质的分类一、物质的分类金属:Na、Mg、Al单质非金属:S、O2、N2酸性氧化物:SO3、SO2、P2O5等氧化物碱性氧化物:Na2O、CaO、Fe2O3两性氧化物:Al2O3等纯不成盐氧化物:CO、NO等净物金属氢化物:NaH、CaH2氢化物非金属氢化物:NH3、H2OHNO3、H2SO4等化按酸根分HCl合强酸:HNO3、H2SO4、HCl酸按强弱分物弱酸:H2CO3、HClO、CH3COOH一元酸:HCl、HNO3按电离出的H+数分二元酸:H2SO4、H2SO3多元酸:H3PO4强碱:KOH、NaOH、Ba(OH)2物按强弱分质弱碱:NH3·H2O、Fe(OH)3碱一元碱:NaOH、按电离出的HO-数分二元碱:Ba(OH)2多元碱:Fe(OH)3正盐:Na2CO3盐酸式盐:NaHCO3碱式盐:Cu2(OH)2CO3复盐:KAI(SO4)2混盐:溶液:NaCl溶液、稀H2SO4等混胶体:Fe(OH)3胶体、淀粉溶液、烟、雾、有色玻璃等合浊液:悬浊液:泥水混合物等物乳浊液:油水混合物酸电解质碱非电解质盐化合物氧化物离子化合物氢化物共价化合物二、分散系相关概念1. 分散系:一种物质(或几种物质)以粒子形式分散到另一种物质里所形成的混合物,统称为分散系。
2. 分散质:分散系中分散成粒子的物质。
3. 分散剂:分散质分散在其中的物质。
4、分散系的分类:按照分散质粒子的大小可以把分散系分为:溶液、胶体和浊液。
(1nm==10-9m )分散质粒子直径小于1nm 的分散系叫溶液,在1nm -100nm 之间的为胶体,大于100nm 的叫做浊液。
⎢⎢⎢⎢⎢⎢⎢⎢⎣⎡⎩⎨⎧→→⎩⎨⎧→→→→⎥⎦⎤乳浊液悬浊液浊液胶气溶胶;液溶胶;固溶粒子胶体:分子胶体胶体溶液分散系分散剂分散质三、胶体:分散质粒子直径大小在10-9~10-7m 之间的分散系。
1、分类:⑴. 根据分散质微粒组成:如:3)(OH Fe 胶体胶粒是由许多3)(OH Fe 等小分子聚集一起形成的微粒,其直径在1nm ~100nm 之间,这样的胶体叫粒子胶体。

专题一物质的分类与变化(讲义)第1讲物质的分类知识点一物质的分类1.元素组成物质宏观上,任何物质都是由组成的。
微观上,构成物质的微粒有三种:、和。
2.混合物和纯净物3.单质和化合物[思考1]由同种元素组成的物质一定是纯净物吗?4.酸、碱、盐和氧化物[思考2]NaHSO4的水溶液显酸性,它是酸吗?[练习1]下列各组物质的分类正确的是()选项化合物单质氧化物A 空气氮气氧化钠B 生石灰白磷水C 氯化氢铁臭氧D 烧碱氯化钾二氧化氮A.A B.B C.C D.D[练习2]下列物质:①H2O②NaCl③H2SO4④Ca(OH)2⑤Fe3O4⑥HNO3⑦AgNO3⑧Fe(OH)3用序号填写;其中属于氧化物的是,属于酸的是,属于碱的是,属于盐的是。
1.元素组成物质的形式(1)每一种元素都可以形成单质。
①单质:由同一种元素形成的纯净物,分为单质和单质。
②同素异形体:由同一种元素形成的几种性质不同的单质,如O2和O3。
(2)绝大多数元素都能与其他元素形成化合物。
[练习3]研究人员在含有C70的溶液中混入癌细胞,再用可见光照射溶液,结果发现55%的癌细胞被杀灭。
下列有关C70的说法错误的是()A.C70和C60都属于碳单质 B.C70和金刚石互为同素异形体C.C70和金刚石的性质完全相同 D.C70在足量氧气中燃烧的产物是二氧化碳2.根据物质的组成分类根据物质的组成对物质进行分类的常用方法有两种,分别为和。
(1)树状分类法混合物物质金属单质非金属单质[思考3]尝试用树状分类法对碱进行分类。
[练习4]尝试用树状分类法对酸进行分类。
[思考4]酸分子中含有几个氢原子就是几元酸吗?[总结]树状分类法是一种层层分类的方法,每一层为一个分类标准,层与层之间的分类标准可能不同。
(2)交叉分类法从对物质进行分类。
Na2[练习5]人们在认识事物时往往需要采用多种分类方法,根据如图所提供的信息说明,该分类方法属于()A.树状分类法B.环状分类法析C.单一分类法D.交叉分类法[练习6]按照物质的树状分类法和交叉分类法,对于H 2SO 4的分类正确的是( ) ①酸 ②氧化物 ③氢化物 ④强酸 ⑤含氧酸 ⑥一元酸 ⑦化合物 ⑧混合物. A .①④⑤⑥⑧ B .①②④⑤⑥⑦⑧ C .①③④⑤⑥⑦D .①④⑤⑦3.根据物质的性质分类酸性氧化物:与碱反应生成盐和水的氧化物,如CO 2、Mn 2O 7等 氧化物 碱性氧化物;与酸反应生成盐和水的氧化物,如Na 2O 、Fe 2O 3等 两性氧化物:能与酸和碱反应均生成盐和水的氧化物,如AL 2O 3 不成盐氧化物 :如CO 、NO 等 [练习7]下列物质属于碱性氧化物的是( ) A .Na 2O 2B .MgOC .Al 2O 3D .CO 2[思考5]思考如下几种说法是否正确:(1)金属氧化物都是碱性氧化物( ) (2)非金属氧化物都是酸性氧化物( ) (3)碱性氧化物都是金属氧化物( ) (4)酸性氧化物都是非金属氧化物( )[归纳总结]非金属氧化物不一定是酸性氧化物,如CO ;酸性氧化物也不一定是非金属氧化物,如Mn 2O 7;金属氧化物不一定是碱性氧化物,如Mn 2O 7是金属氧化物但属于酸性氧化物;碱性氧化物一定是金属氧化物。


物质分类的方法一、按物质的组成分类根据物质的组成成分,可以将物质分为单质和化合物两大类。
1. 单质单质是由同一种元素组成的纯物质,它们具有相同的化学性质。
常见的单质有金属、非金属和惰性气体等。
金属是指一类具有金属光泽、导电性和延展性的物质。
常见的金属有铁、铜、铝等。
金属可以进一步分为贵金属和常金属。
非金属是指那些不具备金属特性的物质,如碳、氧、硫等。
非金属物质通常呈现出不同的颜色和形态。
惰性气体是指具有稳定的电子层结构的气体,如氦、氖等。
它们具有极低的反应性,不易与其他物质发生化学反应。
2. 化合物化合物是由两种或两种以上不同元素按照一定的比例结合而成的物质,具有新的物理和化学性质。
化合物可以分为无机化合物和有机化合物两大类。
无机化合物是由无机元素组成的化合物,如氧化物、酸、碱等。
无机化合物在自然界中广泛存在,具有多种用途。
有机化合物是由碳元素与其他元素结合而成的化合物,如糖类、脂肪类、蛋白质等。
有机化合物是生命体系中重要的组成部分。
二、按物质的状态分类根据物质的状态,可以将物质分为固体、液体和气体三大类。
1. 固体固体是物质的一种状态,具有固定的形状和体积。
常见的固体有金属、矿石、岩石等。
固体可以进一步分为晶体和非晶体。
晶体是由具有规则排列的晶格结构的固体,如钻石、盐等。
晶体具有明确的几何形状和独特的物理性质。
非晶体是由无规则排列的分子或原子组成的固体,如玻璃、橡胶等。
非晶体的物理性质与晶体有所不同。
2. 液体液体是物质的一种状态,具有流动性和固定的体积。
常见的液体有水、酒精、石油等。
液体可以进一步分为溶液和悬浊液。
溶液是由溶质和溶剂按一定比例混合而成的液体,如盐水、糖水等。
溶液是一种均匀透明的液体。
悬浊液是由悬浮物和溶液按一定比例混合而成的液体,如牛奶、果汁等。
悬浊液中的悬浮物可以通过过滤等方法分离出来。
3. 气体气体是物质的一种状态,具有可压缩性和无固定形状的特点。
常见的气体有氧气、氢气、二氧化碳等。

课题常见物质的分类教学目标重点区分金属和非金属之间的性质差异学会常见物质的分类方法,并能通过分类标准得出正确的分类结果重点、难点学会常见物质的分类方法,并能通过分类标准得出正确的分类结果考点及考试要求学会常见物质的分类方法,并能通过分类标准得出正确的分类结果,对于研究物质间的相互转化规律有重要意义教学内容知识框架一、常见物质:1、常见物质的分类:(1)物质根据组成种类不同可分为纯净物和混合物;(2)纯净物根据元素组成分为单质和化合物;(3)单质根据性质分为金属单质和非金属单质;(4)化合物根据是否含有碳元素分为无机化合物和有机化合物;(5)无机化合物根据性质又分为酸、碱、盐、氧化物。
2、常见物质分类图解:二、区别金属和非金属:1、组成不同:(1)金属是由金属元素组成的,如铁、铜、钠、镁、汞等。
(2)非金属是由非金属元素组成的,如碳、硫、溴、氧气、氢气等。
2、性质不同:(1)金属的性质:一般是银白色(铜为红色),延展性好,具有可锻性,硬度大,良好的导电性、导热性,密度大,熔点高。
(2)非金属的性质:有多种颜色,无延展性,无可锻性,硬度不一致,一般不导电、不导热,密度小,熔点低。
说明:金属和非金属的性质不是绝对的,如水银的熔点低,常温下为液体;石墨和金刚石的熔点极高,金刚石的硬度很大,石墨是良好的导电体。
3、列表对比金属和非金属的性质:金属非金属金属光泽,多数为银白色有多种颜色具有延展性没有延展性具有可锻性不具有可锻性硬度通常较大硬度不一致是良好的导电体一般不可以导电是良好的导热体导热性能差密度大密度小熔点高熔点低4、金属的用途:金属的特性决定它的用途,一般金属的使用还要考虑它的密度大小、含量多少、外表形态、价格高低等因素。
具体参见下表的例子:金属特性用途金(俗称黄金)质地较软,延展性是金属中最好的,价格昂贵,在空气中稳定,不易与水、二氧化碳、氧气反应加工首饰、作为硬货币银非常优良的导体,较柔软导体锡熔点低焊接材料考点一:常见物质的分类典型例题例1. 实验室的药品和仪器要分类摆放,下列是四个药品橱内存放的药品。

知识总结:1、物质的分类物质,指的是物理世界中所有存在的事物,是构成自然界的基本要素。
根据组成和性质的不同,物质可以分为多种类型,下面就分别进行介绍。
一、元素元素是指由同一种原子组成,具有独特的化学性质,无法用化学方法分解成更简单的物质的物质。
目前已知的元素有118个,它们分别以拉丁字母或其缩写命名。
元素在化学反应中可与其他元素结合形成化合物。
二、化合物化合物是由两种或两种以上不同元素通过化学反应结合而成的物质。
化合物具有独特的物理化学性质,它的化学式可以用化学符号表示。
例如,水(H2O)由氢元素和氧元素组成,具有比空气或氢气更大的密度和较高的沸点。
三、混合物混合物是由两种或两种以上不同物质通过物理方法混合在一起形成的物质。
混合物的物理和化学性质不固定,具体取决于组成混合物的各种物质,其由于组成比例和制备工艺不同而表现出不同的性质。
例如,饮料是一种混合物,由水,糖,柠檬汁等多种物质混合而成。
四、纯净物纯净物是指由同一种化学物质组成,具有确定的物理化学性质的物质。
这种物质是无法通过化学反应进一步分解的。
可以把化合物看做法纯净物,但事实上,即使是高纯度的化学物质,都存在着微量杂质。
例如,纯净的蒸馏水由H2O分子组成,不含其他物质。
五、离子化合物离子化合物是由正负电荷吸引而结合的化合物。
正离子是指失去一个或多个电子而带有正电荷的离子,常见的有Na+、K+、Mg2+等;负离子是指获得一个或多个电子而带有负电荷的离子,常见的有Cl-、SO42-、OH-等。
离子化合物在溶液中形成离子,表现出电解质特性,例如盐酸(HCl)溶于水可形成氢离子和氯离子。
总之,物质的分类根据物质的组成和性质不同而不同,分别为元素、化合物、混合物、纯净物和离子化合物。
了解这些物质的分类可以更好地理解自然界中的物质构成。



物质的分类标准物质是构成世界万物的基本元素,其种类繁多,属性各异。
为了更好地认识和理解物质,科学家们对物质进行了系统的分类。
物质的分类标准是多方面的,主要包括物质的化学性质、物质的物理性质、物质的组成结构等。
下面将从这几个方面来介绍物质的分类标准。
首先,物质的化学性质是最基本的分类标准之一。
根据物质的化学性质,可以将物质分为元素和化合物两大类。
元素是由同一种原子组成的纯净物质,具有独特的化学性质,如金属元素、非金属元素等;而化合物则是由不同种元素按照一定的化学组成比例结合而成,具有新的化学性质,如水、盐酸等。
其次,物质的物理性质也是物质分类的重要标准之一。
根据物质的物理性质,可以将物质分为固体、液体和气体三大类。
固体是指分子间距离较小,分子排列有序,具有一定的形状和体积,如金属、石英等;液体是指分子间距离较大,分子排列无序,具有一定的形状但没有固定的体积,如水、酒精等;气体是指分子间距离较大,分子排列无序,既没有固定的形状也没有固定的体积,如氧气、氮气等。
此外,物质的组成结构也是物质分类的重要标准之一。
根据物质的组成结构,可以将物质分为原子、分子和离子三大类。
原子是构成物质的最小单位,由质子、中子和电子组成,如氢原子、氧原子等;分子是由两个或更多个原子组成的化合物,如水分子(H2O)、二氧化碳分子(CO2)等;离子是由失去或获得电子而带电荷的原子或分子,如氯离子(Cl-)、氢离子(H+)等。
综上所述,物质的分类标准主要包括化学性质、物理性质和组成结构等方面。
通过对物质的分类,可以更好地认识和理解物质的特性和行为,为科学研究和工程应用提供了重要的理论基础。
希望本文所述能够对读者有所帮助,谢谢!。



《物质的分类》讲义一、物质分类的重要性在我们的日常生活和科学研究中,对物质进行分类是一项非常基础且重要的工作。
它就像是给不同的物品贴上标签,让我们能够更清晰、更有条理地认识和理解这个丰富多彩的物质世界。
通过分类,我们可以发现物质之间的相似性和差异性,从而更好地掌握它们的性质和用途。
想象一下,如果我们没有对物质进行分类,那么面对无数种不同的物质,我们将会感到无比的混乱和迷茫。
无论是在化学实验室里进行实验,还是在日常生活中选择材料和用品,都将变得异常困难。
二、物质分类的方法1、混合物和纯净物混合物是由两种或两种以上的物质混合而成的,它们之间没有发生化学反应,各自保持着原来的性质。
比如空气,它是由氮气、氧气、二氧化碳等多种气体混合而成的。
而纯净物则是由一种物质组成,具有固定的组成和性质。
像氧气、水等都是纯净物。
2、单质和化合物单质是由同种元素组成的纯净物,例如氧气(O₂)、铁(Fe)等。
化合物则是由不同种元素组成的纯净物,如水(H₂O)、二氧化碳(CO₂)等。
3、无机化合物和有机化合物无机化合物通常是指不含碳元素的化合物(但一些简单的含碳化合物,如一氧化碳、二氧化碳、碳酸盐等除外),像氯化钠(NaCl)、硫酸(H₂SO₄)等。
有机化合物则是指含碳元素的化合物(除一氧化碳、二氧化碳、碳酸盐等外),比如甲烷(CH₄)、乙醇(C₂H₅OH)等。
4、酸、碱、盐酸在水溶液中能解离出氢离子(H⁺)和酸根离子,像盐酸(HCl)、硫酸(H₂SO₄)等。
碱在水溶液中能解离出氢氧根离子(OH⁻)和金属离子,例如氢氧化钠(NaOH)、氢氧化钙Ca(OH)₂等。
盐是由金属离子(或铵根离子)和酸根离子组成的化合物,比如氯化钠(NaCl)、硫酸铜(CuSO₄)等。
三、物质分类的应用1、化学研究在化学研究中,对物质进行准确的分类是开展实验和理论研究的基础。
通过分类,科学家们能够预测物质的性质,设计实验方案,探索新的化学反应和物质的制备方法。