无机化学课件16-d区元素(一)
- 格式:ppt
- 大小:3.02 MB
- 文档页数:70



大学化学无机化学课件一、无机化学简介无机化学是研究无机物质及其性质、结构和变化规律的科学。
它是化学的一个重要分支领域,对于理解和应用化学知识都具有重要意义。
本课程主要介绍无机化学的基本概念、化学键、离子化合物、配位化合物、无机酸碱等内容,并涉及到无机化学在实际应用中的一些案例。
二、无机化学基本概念1. 原子和元素在无机化学中,原子是构成化学物质的基本单位。
元素是指由具有相同原子序数的原子组成的物质,不同的元素具有不同的性质和特征。
2. 化学键化学键是原子之间通过共用电子或转移电子而形成的连接。
常见的化学键包括共价键、离子键和金属键。
三、无机化合物的分类1. 离子化合物离子化合物是由带正电荷的阳离子和带负电荷的阴离子通过离子键结合而成的化合物。
离子化合物具有良好的溶解性,在水中可以形成电解质溶液。
2. 配位化合物配位化合物是由一个或多个配位体与一个中心金属离子形成的化合物。
配位体通过与金属离子之间的配位作用形成配位键。
配位化合物具有丰富的颜色和独特的物理性质。
四、无机酸碱1. 酸碱理论酸碱理论主要有三种:奥斯特酸碱理论、布朗酸碱理论和劳里亚-布来斯酸碱理论。
其中,奥斯特酸碱理论认为酸是能够释放H+离子的物质,碱是能够释放OH-离子的物质。
2. 酸碱反应酸碱反应是指酸和碱在一定条件下发生反应生成盐和水的化学反应。
常见的酸碱反应包括中和反应、水解反应等。
五、无机化学在实际应用中的案例1. 无机化学在药物研发中的应用无机化合物在药物研发中起到了重要作用,如抗癌药物顺铂和含铁的血红素。
通过研究无机化合物的性质和结构,可以设计出更有效的药物。
2. 无机化学在环境保护中的应用无机化学在环境保护领域中也扮演着重要角色。
例如,利用氧化剂高锰酸钾可以对水中的有机物进行氧化分解,净化水质。
利用催化剂沸石可以催化废气中的有害物质转化为无害的物质,减少大气污染。
六、总结无机化学是化学的重要分支,研究无机物质及其性质、结构和变化规律。

第十六章 d区元素(一) 习题解1.完成并配平下列反应方程式。
(1)2TiO2+ + Zn + 4H+→2Ti3+ + Zn2+ + 2H2O(2)2Ti3+ + 3CO32- + 3H2O →2Ti(OH)3(s) + 3CO2(g)(3)TiO2 + H2SO4(浓) →TiOSO4 + H2O(4)TiCl4 + 3H2O →H2TiO3(s) + 4HCl(5)TiCl4 + 2Mg →2MgCl2 + Ti(s)2.完成并配平下列反应方程式。
(1)V2O5 + 2Cl- + 6H+→2VO2+ + Cl2(g) + 3H2O(2)2NH4VO3→V2O5 + 2NH3(g) + H2O (加热)(3)2VO2+ + SO32- + 2H+→ 2VO2+ + SO42- + H2O(4)5VO2+ + MnO4- + H2O →5VO2+ + Mn2+ + 2H+3.已知下列电对的标准电极电势:VO2+ + 2H++ e-→VO2+ + H2O φθ = 0.9994VVO2+ + 2H++ e-→V3+ + H2O φθ = 0.337VV3+ + e-→V2+φθ = -0.255VV2+ + 2e-→V φθ = -1.2V在酸性溶液中分别用1mol·L-1Fe2+,1mol·L-1Sn2+和Zn还原1mol·L-1的VO2+时,最终得到的产物各是什么(不必计算)?解:查附表六可知:Fe3+ + e-→Fe2+φθ(Fe3+/ Fe2+) = 0.769VSn4+ + 2e-→Sn2+φθ(Sn4+/ Sn2+) = 0.1539VZn2+ + 2e-→Zn φθ(Zn2+/ Zn) = -0.7621V当用1mol·L-1 Fe2+还原1mol·L-1的VO2+时,只能得到VO2+离子;当用1mol·L-1 Sn2+Z 在酸性溶液中还原1mol·L-1的VO2+时,首先被还原为VO2+离子,可继续被被还原为V3+离子。

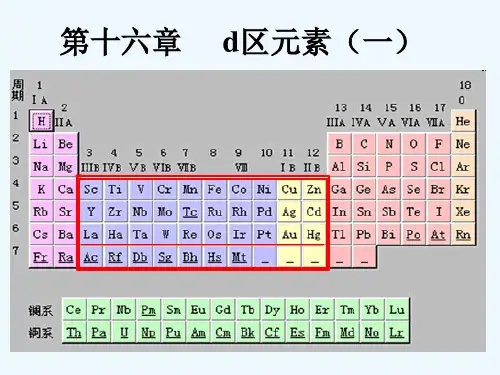

第16章 d 区元素(一)一是非题1.按照酸碱质子理论,[Fe(H2O)5(OH)]2+的共轭酸是[Fe(H2O)6]3+, 其共轭碱是[Fe(H2O)4(OH)2]+。
()2. 由Fe3+能氧化I-,而[Fe(CN)6]3-不能氧化 I-,可知[Fe(CN)6]3-的稳定常熟小于[Fe(CN)6]4-的稳定常数。
()3. 某溶液中共存有NO− , Cr O 2− , K + , Fe3+ , Cl −I 和I-,并无任何反应。
()GAGGAGAGGAFFFFAFAF4. 在[Ti(H2O)6]3+配离子中,Ti3+的d轨道在H2O的影响下发生能级分裂,d 电子可吸收可见光中的绿色光而发生d-d 跃迁,散射出紫红色光。
()5. 在 M n+ +ne ====M 电极反应中,加入M n+的沉淀剂,可使标准电极电势Eθ的代数值增大,同类型的难溶盐的K sp值越小,其Eθ的代数值越大。
()二选择题1. 下列过渡元素中能呈现最高氧化数的化合物是()⑴ Fe⑵ CoGAGGAGAGGAFFFFAFAF⑶ Ni⑷ Mn2. Fe3O4与盐酸作用的产物为()⑴ FeCl3+H2O ⑵ FeCl2+H2O⑶ FeCl3+FeCl2+H2O ⑷ FeCl3+Cl2GAGGAGAGGAFFFFAFAF3. Co3O4与盐酸作用的产物为()⑴ CoCl2+H2O ⑵ CoCl3+CoCl2+H2O ⑶CoCl2+Cl2+H2O ⑷ CoCl3+ H2O4. 欲除去 FeCI3中含有的少量杂质 FeCI2,应加入的物质是()⑴通 CI2⑵KMnO4⑶HNO3⑷ K2C r2O75. 下列哪个溶液中,当加入 NaOH 溶液后,仅有颜色发生变化而无沉淀生成的是()⑴ FeSO4⑵KMnO4⑶GAGGAGAGGAFFFFAFAFNiSO4⑷ K2 Cr2O76. 欲制备Fe2+的标准溶液,应选择的最合适的试剂是()⑴ FeCI2溶于水⑵硫酸亚铁铵溶于水⑶ FeCI3溶液中加铁屑⑷铁屑溶于稀酸7. 用来检验 Fe2+离子的试剂为()GAGGAGAGGAFFFFAFAF⑴ NH4SCN ⑵ K3[Fe(CN)6]⑶ K4[Fe(CN)6]⑷ H2S8. 用来检验 Fe3+离子的试剂为()⑴ KI ⑵NH4SCN ⑶ NaOH⑷ NH3·H2O9. [Co(CN)6]4-与[Co(NH3)6]2+的还原性相比较()⑴ [Co(NH3)6]2+还原性强⑵ [Co(CN)6]4-还原性强GAGGAGAGGAFFFFAFAF⑶两者都强⑷两者都不强10 CoCl3·4NH3用H2SO4溶液处理再结晶, SO 可取代化合物中的 Cl-,但NH3的含量不变,用过量AgNO3处理该化合物溶液,每摩尔可得到1mol的AgCl沉淀这种化合物应该是()⑴ [Co(NH3)4]Cl3⑵ [Co(NH3)4Cl]Cl2⑶ [Co(NH3)4Cl2]Cl⑷ [Co(NH3)4Cl3]GAGGAGAGGAFFFFAFAF11. 由 Cr2O3出发制备铬酸盐应选用的试剂是()⑴浓 HNO3⑵ KOH(s) +KCIO3(s) ⑶CI2⑷H2O212. 下列哪一种元素的氧化数为+ IV 的氧化物,通常是不稳定的()⑴ Ti ( IV ) ⑵V( IV ) ⑶Cr( IV ) ⑷ Mn ( IV ) 13. 镧系收缩的后果之一,是使下列哪些元素的性质相似()GAGGAGAGGAFFFFAFAF⑴ Sc 和 La ⑵Cr 和Mo ⑶ Fe、Co 和Ni ⑷ Nb 和 Ta14. 下列各组元素中最难分离的是()⑴ Li 和 Na ⑵ K 和Ca ⑶ Cu 和Zn ⑷ Zr 和 Hf15. 在酸性介质中,欲使 Mn2+氧化为 MnO4,采用的氧化剂应为()⑴ H2O2⑵王水⑶ K2C r2O7+ H2SO4⑷ NaBiO3GAGGAGAGGAFFFFAFAF16 . 向 FeCl3溶液中加入氨水生成的产物之一是()⑴Fe(NH)⑵Fe(OH)Cl2⑶Fe(OH)2Cl ⑷ Fe(OH)317. 下列物质不能在溶液中大量共存的是()⑴ Fe(CN)和OH-⑵Fe(CN)和I-⑶ Fe(CN)和I-⑷Fe3+和Br18. 下列新制出的沉淀在空气中放置,颜色不发生变化的是()GAGGAGAGGAFFFFAFAF⑴ Mg (OH)2⑵Fe(OH)2⑶Co(OH)2⑷ Ni(OH)219. 下列化合物中与浓盐酸作用没有氯气放出的是()⑴ Pb2O3⑵Fe2O3⑶ C o2O3⑷ Ni2O320. 酸性条件下 H2O2与 Fe2+作用的主要产物是()GAGGAGAGGAFFFFAFAF⑴ Fe, O2 和 H+⑵ Fe3+和H2O ⑶ Fe 和H2O ⑷ Fe3+和O2三填空题1. 在地壳中储量居前十位的元素中属于过渡金属的有2. 向 FeCl3溶液中加入KSCN溶液后,溶液变为色,再加入过量的NH4F溶液后,溶液又变为色,最后滴加NaOH溶液时,又有生成。



《元素化学》课程d区元素(一)教案任课专业、年级、班级2012级应用化学主讲教师主讲教师职称教授使用教材大连理工大学(高教第5版)学时安排12学时二o—•三年五月元素化学课程教案填表说明:1、每项页面大小可自行添减;2、教学内容与讨论、思考题、作业部分可合二为一。
授课对象应化1201B元素化学课程教案填表说明:1、每项页面大小可自行添减;2、教学内容与讨论、思考题、作业部分可合二为一。
元素化学课程教案教学方式讲授教学资源多媒体,网络教学目的、要求(分掌握、熟悉、了解三个层次):1.掌握:珞重要化合物的结构和性质。
2.熟悉:珞配合物及其异构现象。
3.了解:重珞酸钾生产。
教学过程设计(请打7):复习:5分钟授新课:85分钟安排讨论8分钟布置作业2分钟教学方式(请打7):讲授7 讨论口示教口指导口其他口教学资源(请打7):多媒体7 模型口实物口挂图口音像口其他口备注填表说明:1、每项页面大小可自行添减;2、教学内容与讨论、思考题、作业部分可合二为一。
元素化学课程教案教学过程设计(请打Q ):复习:8分钟授新课:82分钟安排讨论8分钟 布置作业2分钟 教学方式(请打P ):讲授7 讨论口 示教口 指导口 其他口教学资源(请打7):多媒体7 模型口 实物口 挂图口 音像口 其他口 备注填表说明:1、 每项页面大小可自行添减;2、 教学内容与讨论、思考题、作业部分可合二为一。
元素化学课程教案3.教学内容(包括基本内容、重点、难点):1.基本内容:铁系元素概述,铁,钻和線及其化合物。
2.重点:铁钻繰的氧化物、氢氧化物和配合物性质。
3.难点、:铁钻採炭基配合物的成键。
①《无机化学》,北京师范大学等校编,高等教育出版社,2002年8月第4版。
②《无机化学》,武汉大学等校编,高等教育出版社,1994年4月第3版。
③《无机化学》,孟庆珍,胡晶文,程泉寿等,北京师范大学出版社,1988年8月第1版④《无机化学学习指导》,大连理工大学无机化学教研室等编(配高教第5版),大大连理工大学出版社,2006年9月第5版.⑤《无机化学习题详解》(高教社•《无机化学•第4版•第三版》,大连理工),郭丽萍,雷家術,童辉编,华中科技大学出版社,2004年5月第1版.⑥《无机化学■■全析精解》(高教社•大连理工•第4版),许国根编,西北工业大学出版社,2007 年8月第1版.⑦《无机化学一辅导讲案》(高教社•大连理工•第5版),岳红编,西北工业大学出版社,2008 年1月第1版⑧《铀族金属矿冶学》,刘时杰编著,冶金工业出版社,2008年7月第1版。