华南理工大学热力学复习题(校内本科)答案
- 格式:doc
- 大小:691.96 KB
- 文档页数:19

一、请简单解释下面概念1、 孤立系统;2、 开口系统;3、 闭口系统;4、 绝热系统;5、 热源;6、 平衡状态;7、 工质;8、 可逆过程;9、 技术功;10、 体积功;11、 热力学能;12、 焓;13、 熵;14、 熵产;15、 理想气体;16、 实际气体;17、 多变过程;18、 热力学定律的两种说法;19、 卡诺定理;20、 熵增原理;21、 能量贬值原理;22、 火用 ;23、 火无 ;24、 冷量火用 ; 25、 自由能; 26、 自由焓; 27、 焦-汤系数; 28、 对应态原理; 29、 压缩因子; 30、 临界压力比; 31、 节流; 32、 能量损失系数; 33、 水的临界点; 34、 水的三相点; 35、 水热力参数的零点; 36、 干度; 37、 余隙容积比; 38、 压气机的定温效率; 39、 压气机的绝热效率; 40、 压气机的容积效率 41、 平均有效压力; 42、 热机的相对内部效率; 43、 压缩比、增压比、预胀比; 44、 耗汽率; 45、 湿空气的相对湿度; 46、 湿空气的露点; 47、 湿空气的饱和状态; 48、 湿空气的含湿量。
二、判断正误,并解释原因1、热力系统处于平衡状态时,和外界无任何作用发生,此时系统的状态是稳定均匀的。
2、理想气体的分子是没有大小和质量的,且其相互间的碰撞是弹性的。
3、从微观上讲,只要分子之间的作用力和分子自身体积可以忽略,则这种气体就可以视为理想气体。
高空大气层内气体十分稀薄,满足上述要求,故可以视为理想气体,可用经典热力学知识处理有关问题。
4、理想气体发生的任意可逆热力过程都能够用“常数 n pV ”来描述其过程特点。
5、如果从同一初始状态到同一终态有可逆和不可逆两个过程,则可逆过程的熵变小于不可逆过程的熵变。
6、根据热力学第二定律,自然界不可能有熵产为负的过程发生,所有自发过程都会导致能量品质的降低。
7、水在定压汽化过程中温度保持不变,则此过程中的吸热量等于其对外所做的膨胀功。

大学热学试题题库及答案一、选择题1. 热力学第一定律表明,能量守恒,即能量不能被创造或消灭,只能从一种形式转换为另一种形式。
以下哪项描述正确?A. 能量可以被创造B. 能量可以被消灭C. 能量可以在不同形式间转换D. 能量只能以一种形式存在答案:C2. 在绝热过程中,系统与外界没有热量交换。
以下哪项描述正确?A. 绝热过程中系统的温度不变B. 绝热过程中系统的压力不变C. 绝热过程中系统的温度和压力都不变D. 绝热过程中系统的温度和压力都可能变化答案:D二、填空题1. 理想气体状态方程为__________,其中P表示压强,V表示体积,n 表示摩尔数,R表示气体常数,T表示温度。
答案:PV = nRT2. 根据热力学第二定律,不可能从单一热源吸热使之完全转化为功而不产生其他效果。
该定律的表述是__________。
答案:不可能从单一热源吸热使之完全转化为功而不产生其他效果。
三、简答题1. 简述热力学第二定律的开尔文表述及其意义。
答案:热力学第二定律的开尔文表述是:不可能从单一热源吸热使之完全转化为功而不产生其他效果。
其意义在于指出了自然界中能量转换的方向性和不可逆性,即能量在转换过程中总是伴随着熵增,表明了热机效率的极限。
2. 描述热力学第三定律,并解释其对低温物理研究的意义。
答案:热力学第三定律指出,当温度趋近于绝对零度时,所有纯物质的完美晶体的熵都趋向于一个共同的值。
这一定律对低温物理研究的意义在于,它为低温下物质的熵和热力学性质的研究提供了理论基础,使得科学家能够更准确地预测和控制低温条件下物质的行为。
四、计算题1. 一个理想气体在等压过程中从状态A(P=100kPa, V=0.5m³)变化到状态B(V=1.0m³)。
已知气体常数R=8.314J/(mol·K),摩尔质量M=28g/mol,求气体在该过程中的温度变化。
答案:首先计算气体的摩尔数n,n = PV/RT =(100×10³×0.5)/(8.314×T)。

热力学复习题及答案1. 热力学的定义是什么?答:热力学是研究能量转化和能量传递规律的一个物理学分支。
2. 什么是热力学系统?答:热力学系统是指被选定的一部分物质或空间,用于研究热力学性质和过程的对象或范围。
3. 请简要解释热力学过程中的熵变。
答:热力学过程中的熵变指系统熵的变化,代表了系统无序度的改变。
熵增加表示系统的无序度增加,熵减少表示系统的无序度减少。
4. 热力学第一定律是什么?答:热力学第一定律,也称能量守恒定律,表示能量不会被创造或破坏,只能从一种形式转化为另一种形式,能量的总量保持不变。
5. 温度和热量有什么区别?答:温度是物体分子运动的程度,用来衡量热力学系统的热平衡状态。
热量是能量的传递形式,表示因温度差而引起的能量传递。
6. 请解释等温过程和绝热过程。
答:等温过程是指系统与外界保持恒定温度的热力学过程。
绝热过程是指系统与外界无能量交换的热力学过程。
7. 热力学循环是什么?答:热力学循环是指能量转化过程中系统从一个状态经过一系列过程最终回到原来状态的过程。
8. 请解释热力学可能性原理。
答:热力学可能性原理,也称热力学第二定律,表示任何孤立系统都不可能完全转化热能为有效的功。
9. 热力学第三定律是什么?答:热力学第三定律,也称绝对温标定律,指出在绝对零度(0K)下,所有物质的熵可以达到最低值,即熵的极限为零。
10. 请解释吉布斯自由能。
答:吉布斯自由能,简称G,是热力学系统在等温等压条件下的可用能量。
它在化学平衡时取最小值,可用于预测化学反应的方向。

热力学复习题答案1. 热力学第一定律表述了能量守恒的原理,其数学表达式为:\[ \Delta U = Q - W \]其中,\( \Delta U \) 表示内能的变化,\( Q \) 表示系统吸收的热量,\( W \) 表示系统对外做的功。
2. 热力学第二定律指出,热量不能自发地从低温物体传到高温物体,其数学表达式为:\[ \Delta S \geq \frac{Q}{T} \]这里,\( \Delta S \) 表示熵变,\( Q \) 表示热量,\( T \) 表示温度。
3. 理想气体的状态方程为:\[ PV = nRT \]其中,\( P \) 表示压强,\( V \) 表示体积,\( n \) 表示摩尔数,\( R \) 表示理想气体常数,\( T \) 表示温度。
4. 卡诺循环的效率公式为:\[ \eta = 1 - \frac{T_c}{T_h} \]这里,\( \eta \) 表示效率,\( T_c \) 表示冷源温度,\( T_h \)表示热源温度。
5. 热力学第三定律表述了绝对零度不可达到的原理,即:\[ \lim_{T \to 0} S = 0 \]其中,\( S \) 表示熵,\( T \) 表示温度。
6. 熵变可以通过以下公式计算:\[ \Delta S = \int \frac{\delta Q}{T} \]这里,\( \Delta S \) 表示熵变,\( \delta Q \) 表示微小的热量变化,\( T \) 表示温度。
7. 吉布斯自由能的变化可以用来判断反应的自发性,其表达式为:\[ \Delta G = \Delta H - T\Delta S \]其中,\( \Delta G \) 表示吉布斯自由能的变化,\( \Delta H \) 表示焓变,\( T \) 表示温度,\( \Delta S \) 表示熵变。
8. 热力学中的麦克斯韦关系可以通过以下公式表示:\[ \left( \frac{\partial S}{\partial V} \right)_T =\left( \frac{\partial P}{\partial T} \right)_V \]这里,\( S \) 表示熵,\( V \) 表示体积,\( P \) 表示压强,\( T \) 表示温度。

热工复习题答案一、单项选择题1. 热力学第一定律表明能量守恒,其表达式为:A. ∆U = Q + WB. ∆H = Q + WC. ∆S = Q/TD. ∆G = Q + W答案:A2. 理想气体状态方程为:A. PV = nRTB. PV = mRTC. PV = nRD. PV = RT答案:A3. 热传递的三种基本方式是:A. 导热、对流、辐射B. 导热、对流、扩散C. 导热、扩散、辐射D. 对流、扩散、辐射答案:A二、填空题4. 热力学第二定律表明,不可能从单一热源吸热使之完全转化为功而不产生其他影响,这是_______的表述。
答案:热力学第二定律5. 在绝热过程中,系统与外界没有热量交换,因此系统内能的变化等于对外做的功,即∆U = -W,其中W为系统对外做的功,∆U为系统内能的变化。
三、简答题6. 描述卡诺循环的四个阶段,并解释其效率。
答案:卡诺循环包括两个等温过程和两个绝热过程。
在等温膨胀阶段,系统从高温热源吸热并对外做功;在绝热膨胀阶段,系统对外做功,温度下降;在等温压缩阶段,系统向低温热源放热;在绝热压缩阶段,系统温度上升,准备下一次循环。
卡诺循环的效率由公式η = 1 - (Tc/Th)给出,其中Tc为低温热源的温度,Th为高温热源的温度。
7. 什么是热机?请简述其工作原理。
答案:热机是一种将热能转换为机械能的装置。
其工作原理基于热力学循环,通常包括四个阶段:吸热、做功、放热和压缩。
在吸热阶段,热机从高温热源吸收热量;在放热阶段,热机向低温热源排放热量;在这两个过程中,热机通过做功和压缩阶段将热能转换为机械能。
四、计算题8. 已知理想气体在等压过程中,压力P=100 kPa,体积从V1=2 m³变化到V2=4 m³,求该过程中气体吸收的热量Q。
答案:根据理想气体状态方程PV=nRT,可得Q = nRT ln(V2/V1)。
由于题目中未给出气体的摩尔数n和温度T,无法直接计算Q的具体数值,但公式为Q = nRT ln(2)。

热力学基础试题及答案一、选择题(每题2分,共20分)1. 热力学第一定律指出能量守恒,下列哪项描述是正确的?A. 能量可以被创造或消灭B. 能量可以从一个物体转移到另一个物体C. 能量可以在封闭系统中增加或减少D. 能量总是从高温物体流向低温物体答案:B2. 熵是热力学中描述系统无序度的物理量,下列哪项描述是正确的?A. 熵是一个状态函数B. 熵是一个过程函数C. 熵只与系统的温度有关D. 熵只与系统的压力有关答案:A3. 理想气体状态方程为PV=nRT,其中P代表压力,V代表体积,n代表摩尔数,R代表气体常数,T代表温度。
下列哪项描述是错误的?A. 理想气体状态方程适用于所有气体B. 在恒定温度下,气体的体积与压力成反比C. 在恒定压力下,气体的体积与温度成正比D. 在恒定体积下,气体的压力与温度成正比答案:A4. 热力学第二定律指出热量不能自发地从低温物体传递到高温物体,下列哪项描述是正确的?A. 热量总是从高温物体流向低温物体B. 热量可以在没有外界影响的情况下从低温物体流向高温物体C. 热量可以在外界做功的情况下从低温物体流向高温物体D. 热量可以在没有外界做功的情况下从低温物体流向高温物体答案:C5. 卡诺循环是理想化的热机循环,其效率只与热源和冷源的温度有关。
下列哪项描述是错误的?A. 卡诺循环的效率与工作介质无关B. 卡诺循环的效率与热源和冷源的温度差有关C. 卡诺循环的效率与热源和冷源的温度成正比D. 卡诺循环的效率在所有循环中是最高的答案:C6. 根据热力学第三定律,下列哪项描述是正确的?A. 绝对零度是可以达到的B. 绝对零度是不可能达到的C. 绝对零度下所有物质的熵为零D. 绝对零度下所有物质的熵为负值答案:B7. 热力学中的吉布斯自由能(G)是用来描述在恒温恒压条件下系统自发进行变化的能力。
下列哪项描述是错误的?A. 吉布斯自由能的变化(ΔG)是负值时,反应自发进行B. 吉布斯自由能的变化(ΔG)是正值时,反应非自发进行C. 吉布斯自由能的变化(ΔG)是零时,系统处于平衡状态D. 吉布斯自由能的变化(ΔG)与系统的温度和压力无关答案:D8. 相变是指物质在不同相态之间的转变,下列哪项描述是错误的?A. 相变过程中物质的化学性质不变B. 相变过程中物质的物理性质会发生变化C. 相变过程中物质的熵值不变D. 相变过程中物质的体积可能会发生变化答案:C9. 热力学中的临界点是指物质的气液两相在该点的物理性质完全相同。

大学热工考试题及答案解析一、选择题(每题5分,共40分)1. 热力学第一定律的数学表达式为:A. \(\Delta U = Q + W\)B. \(\Delta U = Q - W\)C. \(\Delta H = Q + P\Delta V\)D. \(\Delta G = Q - T\Delta S\)答案:A2. 在绝热过程中,下列哪一项是正确的?A. \(Q = 0\)B. \(\Delta S = 0\)C. \(\Delta U = 0\)D. \(\Delta H = 0\)答案:A3. 理想气体状态方程为:A. \(pV = nRT\)B. \(pV = mRT\)C. \(pV = \frac{nRT}{M}\)D. \(pV = \frac{mRT}{M}\)答案:A4. 热传导的基本定律是:A. 傅里叶定律B. 牛顿冷却定律C. 斯特藩-玻尔兹曼定律D. 普朗克定律答案:A5. 热机效率的计算公式为:A. \(\eta = \frac{W}{Q_H}\)B. \(\eta = \frac{Q_H - Q_C}{Q_H}\)C. \(\eta = \frac{Q_C}{Q_H - Q_C}\)D. \(\eta = \frac{Q_C}{Q_H}\)答案:B6. 热力学第二定律的开尔文表述是:A. 不可能从单一热源吸热全部转化为功而不产生其他效果B. 不可能使热量从低温物体自发地传递到高温物体C. 不可能实现热机的效率达到100%D. 所有选项都正确答案:D7. 根据热力学第二定律,下列哪一项是不可能实现的?A. 将热量从高温物体传递到低温物体B. 将热量从低温物体传递到高温物体而不产生其他效果C. 将热量从单一热源吸热全部转化为功D. 将热量从低温物体传递到高温物体同时产生其他效果答案:B8. 热辐射的强度与物体温度的关系是:A. 与温度成正比B. 与温度成反比C. 与温度的四次方成正比D. 与温度的平方成正比答案:C二、填空题(每题5分,共20分)1. 热力学系统与外界没有能量交换时,系统的_______为零。

大学热学题库及答案详解一、选择题1. 热力学第一定律的数学表达式是:A. ΔU = Q - WB. ΔH = Q + WC. ΔS = Q/TD. ΔG = Q - W答案:A2. 在等压过程中,系统与外界交换的热能等于:A. ΔUB. ΔHC. ΔSD. ΔG答案:B3. 理想气体的内能只与温度有关,这是因为:A. 理想气体分子间无相互作用力B. 理想气体分子间有相互作用力C. 理想气体分子的动能与温度无关D. 理想气体分子的势能与温度无关答案:A二、填空题4. 根据热力学第二定律,不可能制造一个循环动作,其唯一结果就是______。
答案:从单一热源吸热全部转化为功而不产生其他效果5. 熵是热力学系统无序程度的度量,其变化量总是______。
答案:不小于零三、简答题6. 简述热力学第二定律的克劳修斯表述和开尔文-普朗克表述。
答案:热力学第二定律的克劳修斯表述是:不可能实现一个循环过程,其唯一结果就是从一个单一热源吸热并将这热量完全转化为功。
开尔文-普朗克表述是:不可能从单一热源吸热使之完全转化为功而不产生其他影响。
7. 解释什么是卡诺循环,并说明其效率。
答案:卡诺循环是一种理想化的热机循环,包括两个等温过程和两个绝热过程。
其效率由下式给出:η = 1 - (Tc/Th),其中Tc是冷热源的绝对温度,Th是热热源的绝对温度。
四、计算题8. 已知理想气体的摩尔质量为M,气体的温度从T1升高到T2,求气体的内能变化量ΔU。
答案:对于理想气体,内能变化量仅与温度变化有关,与压力和体积无关。
内能变化量可以通过以下公式计算:ΔU = n * Cv * (T2 -T1),其中n是气体的摩尔数,Cv是摩尔定容热容。
9. 一个绝热容器内装有一定量的气体,气体经历一个绝热过程,其体积从V1减小到V2,求气体的温度变化。
答案:对于绝热过程,根据热力学第一定律,Q = ΔU,且W = -P *ΔV。
由于绝热过程Q = 0,所以ΔU = -W = P * (V1 - V2)。

热学大学考试题及答案一、选择题(每题2分,共20分)1. 温度是表示物体冷热程度的物理量,其单位是:A. 摄氏度B. 开尔文C. 华氏度D. 牛顿答案:A、B2. 热力学第一定律表明能量守恒,其数学表达式是:A. ΔU = Q + WB. ΔU = Q - WC. ΔH = Q + WD. ΔH = Q - W答案:A3. 在绝热过程中,下列哪一项是恒定的?A. 内能B. 温度C. 压力D. 体积答案:A4. 热传导、热对流和热辐射是热传递的三种基本方式,其中不需要介质的是:A. 热传导B. 热对流C. 热辐射D. 热对流和热辐射答案:C5. 理想气体状态方程为:A. PV = nRTB. PV = P1V1C. PV = nT/RD. P1V1/T1 = P2V2/T2答案:A二、填空题(每题3分,共30分)6. 热力学第二定律表明,不可能从单一热源吸热使之完全转化为________,并由此产生其他效果。
答案:功7. 在一定压力下,一定质量的理想气体的温度每升高(或降低)1摄氏度,气体的体积升高(或降低)的比例叫做________。
答案:热膨胀系数8. 热力学温标T与摄氏温标t之间的关系是 T = t + ________。
答案:273.159. 两个温度分别为T1和T2的物体发生热传递,最终达到热平衡时,它们的共同温度为________。
答案:T1 和 T2 的平均值10. 热机的效率η定义为________与________之比。
答案:有用功;输入热量三、简答题(每题10分,共20分)11. 解释什么是熵?熵增加原理有何意义?答案:熵是热力学系统的无序度的量度,通常用来描述系统的热力学状态。
熵增加原理表明,在孤立系统中,自发过程会导致系统熵的增加,这与时间的不可逆性有关,是热力学第二定律的一个表述。
12. 什么是相变?请举例说明。
答案:相变是指物质在一定条件下从一种相态转变为另一种相态的过程。

大学热力学试题及答案一、选择题(每题2分,共10分)1. 热力学第一定律的数学表达式是:A. ΔU = Q - WB. ΔH = Q + WC. ΔG = Q - WD. ΔS = Q/T答案:A2. 绝对零度是指:A. 温度的最低极限B. 物体内能为零的状态C. 物体分子运动停止的状态D. 物体分子运动速度为零的状态答案:A3. 在等压过程中,系统对外做功,内能的变化是:A. 增加B. 减少C. 不变D. 无法确定答案:B4. 理想气体状态方程为:A. PV = nRTB. PV = nRT + aC. PV = nRT - aD. PV = nT答案:A5. 熵变是一个状态函数,这意味着:A. 熵变只与系统的初始和最终状态有关B. 熵变与过程的路径有关C. 熵变与时间有关D. 熵变与温度有关答案:A二、填空题(每题2分,共10分)1. 根据热力学第二定律,_______不可能自发地从低温物体传到高温物体而不产生其他影响。
答案:热量2. 一个系统在绝热过程中,其熵值会_______。
答案:增加3. 热力学第三定律指出,当温度趋近于绝对零度时,所有纯物质的_______趋于一个常数。
答案:熵4. 根据吉布斯自由能的定义,ΔG = ΔH - TΔS,其中ΔG表示_______。
答案:吉布斯自由能变化5. 在一个封闭系统中,如果系统对外做功且吸收热量,则其内能_______。
答案:增加三、简答题(每题10分,共30分)1. 简述热力学第二定律的开尔文表述。
答案:不可能从单一热源吸热使之完全转化为功而不产生其他影响。
2. 什么是卡诺循环?请简述其效率的计算公式。
答案:卡诺循环是一种理想化的热机循环,由两个等温过程和两个绝热过程组成。
其效率η由公式η = 1 - (Tc/Th)计算,其中Tc是冷源温度,Th是热源温度,且温度以绝对温度(开尔文)表示。
3. 什么是热力学第三定律?它在实际应用中有何意义?答案:热力学第三定律指出,在绝对零度下,所有纯物质的完美晶体的熵值为零。
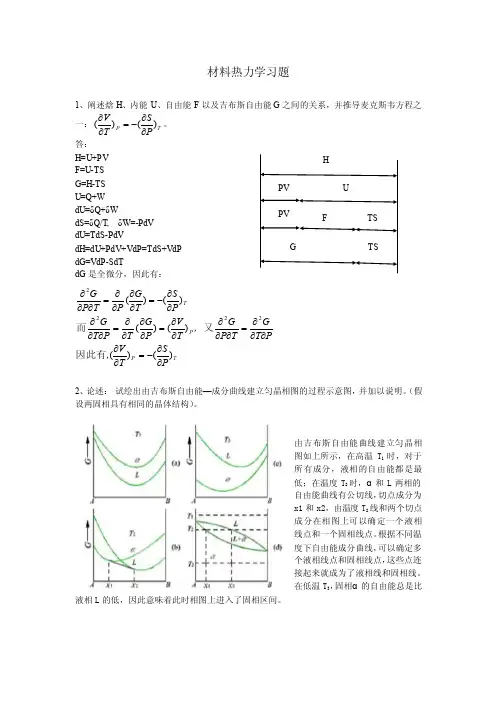
材料热力学习题1、阐述焓H 、内能U 、自由能F 以及吉布斯自由能G 之间的关系,并推导麦克斯韦方程之一:T P PST V )()(∂∂-=∂∂。
答: H=U+PV F=U-TS G=H-TS U=Q+W dU=δQ+δWdS=δQ/T, δW=-PdV dU=TdS-PdVdH=dU+PdV+VdP=TdS+VdP dG=VdP-SdTdG 是全微分,因此有:TP P TP ST V ,PT G T P G ,T V P G T P T G P S T G P T P G )()()()()()(2222∂∂-=∂∂∂∂∂=∂∂∂∂∂=∂∂∂∂=∂∂∂∂∂-=∂∂∂∂=∂∂∂因此有又而2、论述: 试绘出由吉布斯自由能—成分曲线建立匀晶相图的过程示意图,并加以说明。
(假设两固相具有相同的晶体结构)。
由吉布斯自由能曲线建立匀晶相图如上所示,在高温T 1时,对于所有成分,液相的自由能都是最低;在温度T 2时,α和L 两相的自由能曲线有公切线,切点成分为x1和x2,由温度T 2线和两个切点成分在相图上可以确定一个液相线点和一个固相线点。
根据不同温度下自由能成分曲线,可以确定多个液相线点和固相线点,这些点连接起来就成为了液相线和固相线。
在低温T 3,固相α的自由能总是比液相L 的低,因此意味着此时相图上进入了固相区间。
3、论述:通过吉布斯自由能成分曲线阐述脱溶分解中由母相析出第二相的过程。
第二相析出:从过饱和固溶体α中(x0)析出另一种结构的β相(xβ),母相的浓度变为xα. 即:α→β+ α1α→β+ α1 的相变驱动力ΔGm的计算为ΔGm=Gm(D)-Gm(C),即图b中的CD段。
图b中EF是指在母相中出现较大为xβ的成分起伏时,由母相α析出第二相的驱动力。
4、根据Boltzman方程S=kLnW,计算高熵合金FeCoNiCuCrAl和FeCoNiCuCrAlTi0.1(即FeCoNiCuCrAl各为1mol,Ti为0.1mol)的摩尔组态熵。
一、9选择题(共21分,每题3分)1、1.1mol理想气体从p-V图上初态a分别经历如图所示的(1)或(2)过程到达末态b.已知Ta<Tb,则这两过程中气体吸收的热量Q1和Q2的关系是[ A ](A) Q1>Q2>0; (B) Q2>Q1>0;(C) Q2<Q1<0; (D) Q1<Q2<0;(E) Q1=Q2>0.2、图(a),(b),(c)各表示连接在一起的两个循环过程,其中(c)图是两个半径相等的圆构成的两个循环过程, 图(a)和(b)则为半径不相等的两个圆.那么:[ C ](A) 图(a)总净功为负,图(b)总净功为正,图(c)总净功为零;(B) 图(a)总净功为负,图(b)总净功为负,图(c)总净功为正;(C) 图(a)总净功为负,图(b)总净功为负,图(c)总净功为零;(D) 图(a)总净功为正,图(b)总净功为正,图(c)总净功为负.3、如果卡诺热机的循环曲线所包围的面积从图中的abcda增大为ab’c’da,那么循环abcda与ab’c’da所做的净功和热机效率变化情况是:(A)净功增大,效率提高; [ D ](B)净功增大,效率降低;(C) 净功和效率都不变;(D) 净功增大,效率不变.4、一定量的理想气体分别由图中初态a经①过程ab和由初态a’经②过程初态a’cb到达相同的终态b, 如图所示,则两个过程中气体从外界吸收的热量Q1,Q2的关系为[ B ](A) Q1<0,Q1>Q2 ; (B) Q1>0, Q1>Q2 ;(C) Q1<0,Q1<Q2 ; (D) Q1>0, Q1<Q2 .5、根据热力学第二定律可知: [ D ](A) 功可以全部转换为热,但热不能全部转换为功;(B) 热可以从高温物体传到低温物体,但不能从低温物体传到高温物体;(C) 不可逆过程就是不能向相反方向进行的过程;(D) 一切自发过程都是不可逆的.6、对于理想气体来说,在下列过程中,哪个过程系统所吸收的热量、内能的增量和对外做的功三者均为负值? [ D ](A) 等容降压过程; (B) 等温膨胀过程; (C) 绝热膨胀过程; (D) 等压压缩过程.7、在下列各种说法中,哪些是正确的? [ B ](1) 热平衡过程就是无摩擦的、平衡力作用的过程.(2) 热平衡过程一定是可逆过程.(3) 热平衡过程是无限多个连续变化的平衡态的连接.(4) 热平衡过程在p-V 图上可用一连续曲线表示. (A) (1),(2); (B) (3),(4); (C) (2),(3),(4); (D) (1),(2),(3),(4).8、对于室温下的双原子分子理想气体,在等压膨胀的情况下,系统对外所做的功与从外界吸收的热量之比A/Q 等于: [ D ] (A) 1/3; (B) 1/4; (C) 2/5; (D) 2/7.9、在温度分别为 327℃和27℃的高温热源和低温热源之间工作的热机,理论上的最大效率为 [ B ] (A) 25% (B) 50% (C) 75% (D) 91.74%10、一定量的理想气体,从p -V 图上初态a 经历(1)或(2)过程到达末态b ,已知a 、b 两态处于同一条绝热线上(图中虚线是绝热线),则气体在 [ B ](A) (1)过程中吸热,(2) 过程中放热. (B) (1)过程中放热,(2) 过程中吸热. (C) 两种过程中都吸热. (D) 两种过程中都放热.二、填空题pV1、有1mol刚性双原子分子理想气体,在等压膨胀过程中对外做功A,则其温度变化ΔT=___ A/R ___;从外界吸收的热量Q p=__7A/2 ___.2、一个作可逆卡诺循环的热机,其效率为η,它的逆过程的致冷机致冷系数w = T2/(T1-T2),则η与w的关系为_____11Wη=-_____.3.一热机由温度为727℃的高温热源吸热,向温度为527℃的低温热源放热.若热机在最大效率下工作,且每一循环吸热2000J,则此热机每一循环做功__400________J. 4.热力学第二定律的克劳修斯叙述是_热量不能自动地从低温物体传向高温物体开尔文叙述是_不可能把从单一热源吸收的热量在循环过程中全部转变为有用的功,而不引起任何其他物体为生变化_________________________.5、下面给出理想气体状态方程的几种微分形式,指出它们各表示什么过程.(1)pdV=(m/M)RdT表示___等压_________过程;(2)Vdp=(m/M)RdT表示_____等体_________过程;(3)pdV+Vdp=0表示_______等温_______过程.6、如图,温度为T0,2T0,3T0三条等温线与两条绝热线围成三个卡诺循环:(1)abcda;(2)dcefd;(3)abefa,则其效率分别为:η1=___33.3%___;η2=___50% ___;η3=____ 66.7%___.7. 理想气体在如图所示a-b-c 过程中,系统的内能增量E =___0__8.已知一定量的理想气体经历p -T 图上所示的循环过程,图中过程1-2中,气体___吸热__(填吸热或放热)。
诚信应考,考试作弊将带来严重后果!华南理工大学本科生期末考试《物理化学》48学时A卷注意事项:1.开考前请将密封线内各项信息填写清楚;2.所有答案请直接答在试卷上;3.考试形式:闭卷;4.本试卷共三大题,满分100分,考试时间120分钟。
题号一二三总分121234567得分一、选择题(10题,每题2分,共20分)1.热力学第三定律完善的描述为()。
(A)凝聚系统在恒温过程中的熵变,随温度趋于0K而趋于0(B)凝聚系统在恒温过程中的熵变为0(C)纯物质完美晶体的熵,随温度趋于0K而趋于0(D)纯物质完美晶体的熵,0K时为02.工作在393K和293K的两个大热源的卡诺热机,其效率为()。
(A)83%(B)25%(C)100%(D)20%3.某理想气体从同一始态(p1,V1,T1)出发,分别经恒温可逆压缩和绝热可逆压缩至同一体积V2,若环境所做功的绝对值分别为W T和W A,则有()。
(A)W T>W A(B)W T<W A(C)W T=W A(D)W T和W A无确定关系4.不挥发的溶质溶于溶剂中形成稀溶液之后,相对于溶剂而言将会引起溶液的()。
(A)凝固点下降(B)沸点降低(C)蒸汽压升高(D)化学势不变5.某温度下,反应CH3OH(g)=HCHO(g)+H2(g)的K∃=8.283,假设体系为理想气体反应系统,则当p(CH3OH)=1kPa,p(HCHO)=5kPa,p(H2)=10kPa时,反应将()。
(A)向正反应方向进行(B)向逆反应方向进行(C)刚好处于平衡状态(D)不能判断其进行的方向6.MgCO3(s)与其分解产物MgO(s)和CO2(g)达到平衡,该情况下系统的组分数C、相数P和自由度数F分别为()。
(A)C=3,P=3,F=2(B)C=2,P=3,F=1(C)C=1,P=3,F=0(D)C=1,P=2,F=17.对于反应A+B→G+H,其动力学方程形式为()。
(A)υ =kc A c B(B)υ =kc Aαc Bβ(C)υ =kc A c B/(1+K A c A c B)(D)无法直接确定8.电解质溶液的电导率随浓度变化的规律为:()。
姓名 班级 序号热力学第一定律1. 定量理想气体,从同一初态出发,体积V 1膨胀到V 2,分别经历三种过程,(1)等压;(2)等温;(3)绝热。
其中吸收热量最多的是 [ ](A )等压;(B )等温;(C )绝热;(D )无法判断。
2.一圆柱形汽缸的截面积为222.510m -⨯,内盛有0.01kg的氮气,活塞重10kg ,外部大气压为5110Pa ⨯,当把气体从300K 加热到800K 时,设过程进行无热量损失,也不考虑摩擦,问(1)气体做功多少?(2)气体容积增大多少?(3)内能增加多少?3、 一定量的某种理想气体,开始时处于压强、体积、温度分别为60102.1⨯=p P a , 3301031.8m V -⨯=,K T 3000=的初态,后经过一等容过程,温度升高到K T 4501=,再 经过一等温过程,压强降低到0p p =的末态,已知该理想气体的定压摩尔热容量和定容摩尔热容量之比35=V P C C ,求:(1)该理想气体的定压摩尔热容量P C 和定容摩尔热容量V C ; (2)气体从始态变到末态的全过程中从外界吸收的热量。
4.汽缸内有单原子理想气体,若绝热压缩使体积减半,问气体分子的平均速率变为原来速率的 倍?若为双原子理想气体则为倍? 5.有ν摩尔理想气体,作如图所示的循环过程acba ,其中acb为半圆弧,ba 为等压过程,2c a p p =,在此循环过程中气体净吸收热量Q ()p b a C T T ν-。
(填“小于”、“大于”或“等于”)。
6.理想气体在图中的1-2-3过程中,吸收的热量Q 0(“小于”、“大于”或“等于”);1-2-3'过程中,吸收的热量Q 0(“小于”、“大于”或“等于”)。
7.一个可逆卡诺循环,当高温热源温度为127o C ,低温热源温度为27o C 时,对外做净功8000J ,今维持低温热源温度不变,使循环对外做功10000J ,若两卡诺循环都在两个相同的绝热线间工作,则第二个循环的高温热源的温度为 [ ](A )127K ; (B )300K ; (C )425K ; (D )无法判断。
1、孤立系统;热力学系统与外界既无能量交换也无物质交换时,称之为孤立系统1、 开口系统;热力学系统与外界既有能量交换也有物质交换2、 闭口系统;热力学系统与外界只有能量交换无物质交换3、 绝热系统;热力学系统与外界无能量交换4、 热源;工质从中吸收热能的物质5、 平衡状态;一个热力学系统,在不受外界影响的条件下系统状态能够始终保持不变6、 工质;实现热能与机械能相互转化的媒介物质8、可逆过程;是准平衡过程,应满足热的和力的平衡条件,同时过程中不应有任何耗散效应7、 技术功;技术上可资利用的功()()12212221z z g c c w w f f i t -+-+= 8、 体积功;是系统由于体积改变而与环境交换的能量称为体积功。
9、 热力学能;由内动能、内位能以及维持一定分子结构的化学能和原子核内部的原子能以及电磁场作用下的电磁能等构成。
10、 焓;热力学能与推动功之和pV U H += 11、 熵;表示物质系统状态的物理量。
TQ dS ∂= 12、 熵产;闭口系统内不可逆绝热过程中熵之所以增大,是由于过程中存在不可逆因素引起耗散效应,使损失的机械功转化为热能(耗散热)被工质吸收。
这部分有耗散产生的熵增量,叫做熵产13、 理想气体;理想气体分子是具有弹性的、不具体积的质点;分子间相互没有作用力。
14、 实际气体;不满足气体分子是具有弹性的、不具体积的质点;分子间相互没有作用力假设的气态物质15、多变过程;工质的状态参数p 、v 、T 等都有显著变化,与外界之间换热量也不可忽略不计,这是不能简化为四种基本热力过程,可用定值=npv16热力学定律的两种说法;克劳修斯说法:热不可能自发地、不付代价地从低温物体转至高温物体。
开尔文说法:凡有温差的地方都能产生动力15、 卡诺定理;定理一:在相同温度的高温热源和相同温度的低温热源之间工作的一切可逆循环,其热效率相等,与可逆循环的种类无关,与采用哪种工质无关。
模拟题一1. T 温度下的纯物质,当压力低于该温度下的饱和蒸汽压时,则气体的状态为( )A. 饱和蒸汽B. 超临界流体C. 过热蒸汽 2. T 温度下的过冷纯液体的压力P ( )A. >()T P sB. <()T P sC. =()T P s3. T 温度下的过热纯蒸汽的压力P ( )A. >()T P sB. <()T P sC. =()T P s4. 纯物质的第二virial 系数B ( )A 仅是T 的函数B 是T 和P 的函数C 是T 和V 的函数D 是任何两强度性质的函数 5. 能表达流体在临界点的P-V 等温线的正确趋势的virial 方程,必须至少用到( )A. 第三virial 系数B. 第二virial 系数C. 无穷项D. 只需要理想气体方程 6. 液化石油气的主要成分是( )A. 丙烷、丁烷和少量的戊烷B. 甲烷、乙烷C. 正己烷 7. 立方型状态方程计算V 时如果出现三个根,则最大的根表示( )A. 饱和液摩尔体积B. 饱和汽摩尔体积C. 无物理意义 8. 偏心因子的定义式( )A.0.7lg()1s r Tr P ω==-- B.0.8lg()1s r Tr P ω==--C.1.0lg()s r Tr P ω==-9. 设Z 为x ,y 的连续函数,,根据欧拉连锁式,有( )A. 1x y zZ Z x x y y ⎛⎫⎛⎫∂∂∂⎛⎫=-⎪ ⎪⎪∂∂∂⎝⎭⎝⎭⎝⎭B. 1y xZ Z x y x y Z ⎛⎫∂∂∂⎛⎫⎛⎫=- ⎪⎪ ⎪∂∂∂⎝⎭⎝⎭⎝⎭ C. 1y xZ Z x y x y Z ⎛⎫∂∂∂⎛⎫⎛⎫= ⎪⎪ ⎪∂∂∂⎝⎭⎝⎭⎝⎭D. 1y Z xZ y y x x Z ∂∂∂⎛⎫⎛⎫⎛⎫=-⎪ ⎪ ⎪∂∂∂⎝⎭⎝⎭⎝⎭ 10. 关于偏离函数M R ,理想性质M *,下列公式正确的是( )A. *R M M M =+B. *2R M M M =-C. *R M M M =-D. *R M M M =+ 11. 下面的说法中不正确的是 ( )(A )纯物质无偏摩尔量 。
1、孤立系统;热力学系统与外界既无能量交换也无物质交换时,称之为孤立系统1、 开口系统;热力学系统与外界既有能量交换也有物质交换2、 闭口系统;热力学系统与外界只有能量交换无物质交换3、 绝热系统;热力学系统与外界无能量交换4、 热源;工质从中吸收热能的物质5、 平衡状态;一个热力学系统,在不受外界影响的条件下系统状态能够始终保持不变6、 工质;实现热能与机械能相互转化的媒介物质8、可逆过程;是准平衡过程,应满足热的和力的平衡条件,同时过程中不应有任何耗散效应7、 技术功;技术上可资利用的功()()12212221z z g c c w w f f i t -+-+= 8、 体积功;是系统由于体积改变而与环境交换的能量称为体积功。
9、 热力学能;由内动能、内位能以及维持一定分子结构的化学能和原子核内部的原子能以及电磁场作用下的电磁能等构成。
10、焓;热力学能与推动功之和pV U H += 11、 熵;表示物质系统状态的物理量。
TQ dS ∂= 12、 熵产;闭口系统内不可逆绝热过程中熵之所以增大,是由于过程中存在不可逆因素引起耗散效应,使损失的机械功转化为热能(耗散热)被工质吸收。
这部分有耗散产生的熵增量,叫做熵产13、 理想气体;理想气体分子是具有弹性的、不具体积的质点;分子间相互没有作用力。
14、 实际气体;不满足气体分子是具有弹性的、不具体积的质点;分子间相互没有作用力假设的气态物质15、多变过程;工质的状态参数p 、v 、T 等都有显著变化,与外界之间换热量也不可忽略不计,这是不能简化为四种基本热力过程,可用定值=npv16热力学定律的两种说法;克劳修斯说法:热不可能自发地、不付代价地从低温物体转至高温物体。
开尔文说法:凡有温差的地方都能产生动力15、 卡诺定理;定理一:在相同温度的高温热源和相同温度的低温热源之间工作的一切可逆循环,其热效率相等,与可逆循环的种类无关,与采用哪种工质无关。
定理二:在温度同为1T 的热源和同为2T 的冷源间工作的一切不可逆循环,其热效率必小于可逆循环。
16、 熵增原理;孤立系统内部发生不可逆变化时,孤立系的熵增加;发生可逆变化时,熵不变;使孤立系统熵减小的变化不可能发生。
17、 能量贬值原理;孤立系统中进行热力学过程时火用 只会减少不会增加,可逆过程下火用 保持不变。
18、 火用 ;可无限转换的能量19、火无 ,不可能转换的能量,20、冷量火用 :温度低于环境温度的系统,吸入热量0Q 时所做出的最大有用功成为冷量火用 ,用0,Q x E19、自由能;即亥姆赫兹函数,是状态量。
TS U F -= 20、自由焓;即吉布斯函数,是状态量。
TS H G -= 21、焦-汤系数;h J p T ⎪⎪⎭⎫⎝⎛∂∂=μ 22、 对应态原理;对于满足同一对比状态方程式的同一类物质,如果它们的对比参数r p 、r v 、r T 中有两个相同,则第三个对比参数一定相同,物质也就处于对应状态中29、压缩因子;温度、压力相同时的实际气体比体积与理想气体比体积之比。
它反映了实际气体偏离理想气体的程度23、 临界压力比:24、 节流;流体在管道内流动时,有时经过阀门、孔板等设备,由于局部阻力,使流体压力降低,这种现象成为节流31能量损失系数;损失的动能与理论动能的比值222222'f f f c c c -=ζ32水的临界点:饱和水和饱和蒸汽不再有区别,此点的压力、温度和比体积分别成为临界压力、临界温度和临界比体积33水的三相点;三条相平衡曲线的交点,此点气、液、固三相平衡共存34水热力参数的零点;25、 干度;水蒸气的质量分数。
即1kg 湿蒸汽中含有xkg 饱和蒸汽35余隙容积比;余隙容积c V 与气缸排量h V 之比26、 压气机的定温效率;可逆定温压缩过程中消耗的功T c w ,与实际压缩过程中所消耗的功c w '之比27、 39、压气机的绝热效率;可逆绝热压缩过程中消耗的功s c w ,与不可逆绝热压缩过程中所消耗的功c w '之比28、 压气机的容积效率 压气机有效吸气容积V 与气缸排量h V 之比41、平均有效压力;因为制造公差、金属材料热膨胀及安装进、排气阀等零件需要,当活塞运动到上死点位置时,在活塞顶面与气缸盖间留有一定间隙,该间隙容积成为间隙容积41热机的相对内部效率;实际循环中所做的循环静功与循环中热源提供的热量的比值43压缩比:压缩过程中,压缩前体积1v 与压缩后体积2v 比值21v v =ε增压比:预胀比:气体压缩后比4v 体积与压缩前比体积3v 之比34v v =ρ4、耗汽率 装置每输出单位功量所消耗的蒸汽量45、湿空气的相对湿度;46、湿空气的露点;在一定的v P 下(指不与水或湿物料相接触的情况下),未饱和湿空气冷却到饱和湿空气,即将结出露珠时的温度47、湿空气的饱和状态;由干空气和饱和水蒸气组成的湿空气48、 湿空气的含湿量。
1kg 干空气所带有的水蒸气质量为含湿量(又称比湿度)二、判断正误,并解释原因1热力系统处于平衡状态时,和外界无任何作用发生,此时系统的状态是稳定均匀的。
错误。
因为均匀是相对于平衡状态下单相物系而言的。
气液两相并存的热力平衡系统,气相与液相密度不一样,并不均匀。
2理想气体的分子是没有大小和质量的,且其相互间的碰撞是弹性的。
错误。
理想气体是些弹性的、不具体积的质点,但存在质量3从微观上讲,只要分子之间的作用力和分子自身体积可以忽略,则这种气体就可以视为理想气体。
高空大气层内气体十分稀薄,满足上述要求,故可以视为理想气体,可用经典热力学知识处理有关问题。
正确。
高空大气密度小,比体积大,分子本身体积远小于分子活动空间,分子间平均距离远到作用力极其微弱,可看成是理想气体,用经典热力学知识处理。
4理想气体发生的任意可逆热力过程都能够用“n pv =常数”来描述其过程特点。
错误。
只有当n pv中的n为常数时才可以用来描述。
正确。
当考察的过程时微元过程时。
5如果从同一初始状态到同一终态有可逆和不可逆两个过程,则可逆过程的熵变小于不可逆过程的熵变。
错误。
熵是状态函数。
同一初始状态和终态的两个过程,熵变相等6根据热力学第二定律,自然界不可能有熵产为负的过程发生,所有自发过程都会导致能量品质的降低。
正确。
自然界所有自发过程都是不可逆过程,不可逆过程都会导致作功能力的下降,从而使能量品质降低。
7水在定压汽化过程中温度保持不变,则此过程中的吸热量等于其对外所做的膨胀功。
错误。
吸收的热量等于蒸汽分子的内位能增加以及比体积增加而对对外做出的膨胀功8水蒸汽图表中参数的零点选定为三相状态下的液态水的参数。
正确。
273.15K的液相水作为基准点9水处于三相状态时的压力、温度和比容都小于其临界状态下的相应值。
错误。
处在三相状态下的水由于存在着汽化潜热,则升高相同的温度所需热量更多,即比热容要大于临界状态下的相应值。
正确。
对于处在液相的水,其压力、温度和比容都小于其临界状态下的相应值。
10对于任一现成喷管,无论其形式如何,只要气体在喷管内部等熵流动,其流量都将随着背压的降低而增大,直至无穷大。
错误。
当背压下降至临界压力cr P 时,流量达最大。
若背压再下降,则流量保持不变。
如果气体能够在活塞式压气机的气缸内实现定温压缩,则没必要采用分级压缩了。
错误。
分级压缩主要是为了减小余隙容积对产气量的影响,提高容积效率;可以通过中间冷却的方式实现降温。
所以仍需要分级压缩。
气体压缩时采用分级压缩后对压缩气体的生产量没有影响。
错误。
因为分级压缩可以提高容积效率,即可以提高压缩气体的生产量。
可逆的压缩空气制冷循环采用理想回热后,会使得其制冷量和制冷系数都得到提高。
错误。
采用回热以后提高了制冷系数并没有提高制冷量。
压缩蒸汽制冷循环中,由于制冷剂流过节流阀后其焓和熵都会增大,所以会使制冷系数和制冷能力下降,因此最好用膨胀机代替之。
错误。
制冷剂流过节流阀焓保持不变。
并不用使用膨胀剂,目的在于简化装置,提高装置运行的可靠性。
湿空气处于饱和状态时的温度就是对应于某一水蒸气分压力下的露点。
正确。
在一定的v P 下(指不与水或湿物料相接触的情况下),未饱和湿空气冷却到饱和湿空气,即将结出露珠时的温度。
湿空气的相对湿度就是湿空气中水蒸气的分压力,与同一温度、同样总压力下的饱和湿空气中水蒸气分压力的比值。
正确。
sv p p =ϕ简答题1、一个门窗打开的房间,若房内空气压力不变而温度上升,请问房间内空气的总焓将如何 变化?为什么?(空气按理想气体定值比热考虑)。
焓保持不变。
gp p g p R pVc T c T R pV T mc mh H ====,房间的压力和体积不变,空气比热为定值,所以焓不变 3、过程量有什么特点?举例说明之。
描述物质系统状态变化过程的物理量。
如功,功是运动过程中所做的功,不能说某一刻物体有多少功。
4、什么是技术功? 它与容积功的有何关系?5、热力学第一定律和第二定律对能量转换过程的看法有什么不同?6、什么是理想气体的多变过程?多变指数在什么范围内时,工质温度增加却对外放热? 理想气体的多变过程是指气体参数满足常数=n pv 的可逆过程。
当()k n ,1=7、工质经过不可逆过程后,其熵还能否恢复到初值?为什么?8什么是压缩因子?其物理意义何在? 压缩因子是温度、压力相同的实际气体比体积与理想气体比体积的比值iv v Z =。
它表示实际气体对理想气体的偏离。
9湿空气的相对湿度和含湿量有什么不同? 相对湿度是湿空气中水蒸气分压力v p ,与同一温度同样总压力的饱和湿空气中水蒸汽分压力s p 的比值sv p p =ϕ。
含湿量是1kg 的干空气中所带有的水蒸气质量。
相对湿度是以湿空气为对象,含湿量是以干空气为对象10、压气机采用分级压缩中间冷却的作用是什么?这样做会有什么负面影响?提高等温效率和容积效率,减少余隙容积对容积效率的影响。
增加了气缸和冷却器等设备,使机构更加复杂,机械摩擦和流动阻力等不可逆损失增加,而且增加了投资。
11、从汽轮机排出的乏汽可以通过绝热压缩变成液态水吗?为什么?不可以。
从汽轮机排出的乏汽通过绝热压缩后将会变为过热蒸汽。
12能否通过在喷管内接近可逆的充分绝热膨胀,使离临界点不太远的过热蒸汽部分液化?为什么?可以。
因为在喷管内接近可逆的充分绝热膨胀,工质的温度和压力均下降,可以使离临界点不太远的过热蒸汽部分液化。
13湿空气的相对湿度是如何定义的?它有什么物理意义?湿空气的相对湿度ϕ是湿空气中水蒸气的分压力v p 与同一温度、同一总压力的饱和湿空气中水蒸气分压力s p 的比值。
物理意义:相对湿度表示湿空气离饱和湿空气的程度。
ϕ越小湿空气偏离饱和湿空气越远,空气越干燥,吸收水蒸气的能力越强;ϕ越大湿空气偏离饱和湿空气越小,空气越潮湿,吸收水蒸气的能力越弱。