验证主计划
- 格式:docx
- 大小:15.57 KB
- 文档页数:2
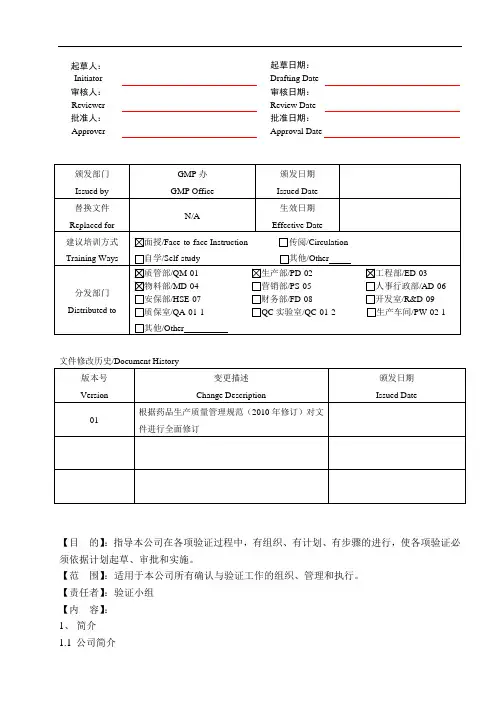
起草人:Initiator 起草日期:Drafting Date审核人:Reviewer 审核日期:Review Date批准人:Approver 批准日期:Approval Date文件修改历史/Document History【目的】:指导本公司在各项验证过程中,有组织、有计划、有步骤的进行,使各项验证必须依据计划起草、审批和实施。
【范围】:适用于本公司所有确认与验证工作的组织、管理和执行。
【责任者】:验证小组【内容】:1、简介1.1公司简介XXXXXXX在2008年12月年通过了GMP认证,生产地址为xxxxxx,由于2010年公司整体搬迁至xxxxxx,生产地址发生了变更,为新的xxxxx全厂搬迁项目一期联合厂房,建筑物为局部三层框架结构,厂房建成时间为2013年,总高度17.3m,建筑物占地面积为3782.8m2,建筑面积8110.1 m2。
厂区严格按照《药品生产质量管理规范》(2010版)总体设计,主要包括原料药车间、制剂车间、质检中心、成品库、原辅料、包材库。
公司生产品种包括原料药:甲硫氨酸、苏氨酸、丙氨酸、脯氨酸固体制剂:片剂、胶囊剂、颗粒剂1.2验证总计划范围1.2.1 厂房设施及公用系统确认;1.2.2 仪器校验与检验方法验证;1.2.3 设备确认;1.2.4 清洁验证;1.2.5 工艺验证。
2、生产区域概述2.1 厂房设施及公用系统说明:公司拥有原料药5个品种:甲硫氨酸、苏氨酸、丙氨酸、脯氨酸、乙酰谷酰胺;片剂:39个品种,51个品规;胶囊剂:14个品种,15个品规;颗粒剂:2个品种,5个品规。
公司现有厂房、设备能满足生产所需;质管部检验设备能满足生产品种的检测。
2.2 人流及物流说明:2.2.1 整个厂区分有人流和物流通道。
生产、行政、生活和辅助区已全部分开。
对厂区的环境进行了绿化,基本无露土。
2.2.2 生产按洁净区级别要求,划分了人流及物流通道。
人流通道分为一更、二更、缓冲间,再进入生产操作间。

完整的《计算机系统确认与验证流程》文/石头968?1、验证主计划(用户提供)计算机化系统的验证主计划可以作为《xxx企业验证主计划》或者《xxx项目验证主计划》的一个章节,说明计算机化系统的硬件、软件的分类原则、风险管理原则、确认与验证原则、确认与验证的控制策略,总之,规定好企业应该怎么开展计算机化系统的确认与验证工作。
当然,也可以单独制定《计算机化系统的验证主计划》,不过计算机系统通常作为设备的不可分割的一部分(管理类计算机系统除外),或者作为电气自控设备的一种,单独对待的必要性,也有待于商榷,大家看着办就行了。
?2、用户需求说明(URS)(用户提供)需要计算机帮我们做什么?(功能清单)每一个功能的控制方式,执行过程?(工艺流程图)每一个功能的传感器输入、执行信号输出(输入输出方式)操作人员对人机接口的操作要求?(人机接口输入输出方式)系统的安全性要求?(权限设置)安装空间、位置、所处的环境?硬件、软件的基本配置要求?测试、验证、培训、质量控制、变更控制、文件记录要求预算、货期、合约等商务要求?3、功能说明(供应商提供,用户审核)硬件及软件的系统供应商对企业URS的回复说明。
硬件配置方框图与功能说明。
软件流程方框图与功能说明。
?4、设计说明(供应商提供,用户审核)供应商对自己系统的设计思路与开发计划硬件整体框架与系统结构图、配置清单软件整体框架、模块化系统结构图IO清单与详细的配置说明、功能说明?5、系统工程设计(供应商的工作)包含硬件设计、软件设计用户可以不参与?6、设计审核(供应商提供,用户审核)设计审核一般由用户技术人员与QA完成,通过比较URS与FS、DS的一致性,检查系统是否满足需求,针对不能满足的部分,需要和供应商进行协商,尤其是涉及到GMP要求的地方要更加注意。
用户通常会审核到功能说明、设计说明、基本硬件配置清单、IO清单,但是通常不需要用户去审核更深入层次的硬件板卡、软件程序,当然你愿意做、有能力做,也可以去做审核。

验证主计划(V M P)模板验证主计划VALIDATIONMASTER PLAN项目编号Project Number---------- SystemBy验证主计划批准目录一.前言……………………………………4二.公司及工厂概况……………………………………4 ◆公司简介……………………………………4 ◆公司组织机构图……………………………………4 ◆公司产品……………………………………5 ◆项目描述……………………………………6 ◆操作流程图……………………………………7三.公司标准……………………………………8 ◆指南……………………………………8四.主计划目的……………………………………8五.部门职责……………………………………9◆运行(工程)部门XXX-设备工程师……………………………………9◆药品生产( 原料药)部 XXX –生产主管……………………………………9◆QA部门XXX- QA 主管……………………………………10◆验证部门XXX –验证&培训组织者……………………………………10六.验证方法……………………………………11七.设备、公用设施和系统的确认……………………………………11◆安装确认草案……………………………………11◆运行确认草案……………………………………12◆性能确认草案……………………………………14◆工艺验证……………………………………16◆总结报告 (16)…17 八.验证支持系统……………………………………◆校正…………………………………17…◆SOPs操作程序和SOPs书写程序…………………………………17…◆清洁验证…………………………………17…◆人员培训…………………………………17…九.修改、变更控制和再验证…………………………………17…18 附件1 工厂全面规划图……………………………………19 附件2 公司组织机构图……………………………………20 附件3 工艺流程图……………………………………21 附件4 设施及操作流程图……………………………………22 附件5 公司标准操作程序……………………………………23 附件6 需验证的设备设施系统……………………………………24 附件7 验证项目时间表……………………………………一.前言验证主计划所述方法,应验证用于控制工艺步骤的设备和公用系统。

验证主计划(2008年)Xxxxx有限责任公司目录第一章主验证方案的批准第二章公司介绍第三章生产区域概述第四章验证组织及职责第五章支持文件第六章验证内容第七章可接受标准第八章验证文件要求第九章时间进度和人员安排第十章附录第一章主验证方案的批准一、方案的起草二、方案的审核三、方案的批准第二章公司介绍一、制定此计划的目的-----验证指南二、概述主计划的范围-----厂房、设施、系统、工艺三、公司组织机构四、公司及设施,包括平面布置图五、公司产品六、项目描述第三章生产区域概述一、厂房设施及公用系统说明二、人流及物流说明三、设备说明---包括专用设备、多功能设备、实验室设备及辅助设备四、工艺说明---包括产品清单和工艺流程第四章验证组织及职责一、验证委员会----包括机构图和主要联系人(职务和姓名)二、工作职责----包括文件的准备、验证的执行、结果的确认、偏差的批准都应明确责任第五章支持文件一、文件管理程序----涉及验证的SOP二、预防维修程序----设备维修SOP三、计量校验程序----计量SOP四、清洁程序----清洁SOP五、偏差处理程序----偏差处理SOP六、变更控制程序----变更控制SOP七、人员培训程序----培训SOP第六章验证内容一、洁净厂房与设施验证1、空气净化系统2、水系统3、直接接触产品的介质,如压缩空气、氮气二、设备验证1、安装确认2、运行确认3、性能确认三、工艺验证四、分析方法验证五、设备清洁验证六、计算机系统验证七、再验证1、再验证周期2、采用的验证方法(如回顾性验证与同步验证等)八、验证项目清单,包括待验证设备、系统(列表)1、包括验证的设备或系统2、完成的项目第七章可接受标准一、 Q、OQ、PQ通用可接受标准,列出适用与所有系统的可接受标准。
二、定的接受标准,列出某种产品或工艺的特定可接受标准。
第八章验证文件要求一、通用程序二、证方案的编写要求三、证报告的编写要求四、证文件的编号系统五、证文件的归档系统第九章时间进度和人员安排一、验证次序二、验证活动清单三、人力安排第十章附录一、厂区、车间平面图二、人流、物流图三、工艺流程图1、建筑工艺流程图2、管道和仪表布置图3、生产工艺流程图4、公用系统流程图5、送风、排风分区图6、区域压差图7、区域洁净级别和标准四、验证方案、验证报告格式五、标准操作程序格式1. 目的: 建立取样车的标准操作程序,规范取样车的使用与维护。


1 验证方针与目的1.1 验证方针➢GMP是保证生产出符合既定质量标准药品的唯一手段,而验证是证明和保证关键生产要素,包括设施、系统、仪器设备、生产工艺、分析方法、清洁规程以及消毒/灭菌规程符合既定要求的公认方法。
验证主计划是公司进行确认与验证的纲领性文件,指导公司在各项验证过程中,有组织,有计划,有步骤的进行,使各项验证必须依据计划起草、审批和实施,确保验证工作能够顺利进行和验证的有效性,为保证产品质量提供可靠的保障和依据。
➢鉴于验证工作的重要性,本公司将验证工作放在GMP管理体系的重要位置,并给予高度重视。
提出通过确认与验证确立控制生产过程的运行标准,通过对已验证状态进行监控,控制整个工艺过程,确保质量,并不断通过验证、建标、监控、再验证、再建标的循环动态控制为指导方针。
1.2 验证目的编制验证主计划是GMP(2010版)法规及附录《确认与验证》的要求。
➢GMP(2010版)法规要求:验证主计划中应当作出规定,确保厂房、设施、设备、检验仪器、生产工艺、操作规程和检验方法等能够保持持续稳定。
➢附录《确认与验证》的要求:⏹所有的确认与验证活动都应当事先计划。
确认与验证的关键要素都应在验证主计划或同类文件中详细说明。
⏹验证主计划应当至少包含以下信息:◆确认与验证的基本原则;◆确认与验证活动的组织机构及职责;◆待确认或验证项目的概述;◆确认或验证方案、报告的基本要求;◆总体计划和日程安排;◆在确认与验证偏差处理和变更控制的管理;◆保持持续验证状态的策略,包含必要的再确认和再验证;◆所引用的文件、文献。
⏹对于大型和复杂的项目,可制定单独的项目验证主计划。
文件编号:生效日期:第2 页共17页本验证主计划概括地描述了本公司应该进行的验证和确认活动的管理原则,包括验证方针、组织机构、范围领域、文件管理、计划安排、实施程序、简要方法和可接受标准等,以确保本公司的验证工作按照规定得到良好执行,满足新版GMP有关验证的要求。

验证主计划一、项目介绍1.1公司企业简介这里主要是对企业进行简单介绍,如:名称、地址、占地面积、生产车间数量、公用系统情况等。
描述企业的验证方针如:1)确定需要进⾏的确认或验证⼯作,以证明有关操作的关键要素能够得到有效控制。
2)确认和验证的范围和程度应根据⻛险评估的结果确认。
(采⽤最差状况⽅法来确定验证)。
3)确认与验证应当贯穿于产品⽣命周期的全过程。
4)⼚房、设施、设备或⼯艺的的重要变更可能会直接或间接影响到产品质量时,应进⾏确认和验证。
包括:①所有新的关键⽅法、规程、⼯艺及关键系统、设备在投⼊使⽤前应经验证。
②所有的变更当影响产品质量时,应经过验证。
③当质量回顾、偏差或其它事件表明验证状态发⽣漂移时应进⾏再验证。
④关键⼯艺参数和关键⼯艺步骤应进⾏验证。
⑤检验⽅法发⽣变化时应进⾏验证。
本验证总计划(VMP)描述了企业应该进行的验证和确认活动的验证组织机构、验证方针、验证内容及其计划安排。
以确保公司的各项验证活动有组织,有计划,有步骤的进行,满足GMP对于验证的要求。
概括地阐述验证目的、原则、方针、项目、计划、方法和可接受标准等。
四、组织机构及职责简单描述公司的验证的组织机构的组成,及各部门和关键人员职责如:人员职责质量负责人确保为相关部门的验证工作提供足够的资源,以达到VMP中规定的验证目标,并符合GMP要求。
带领验证委员会,按照本验证总计划与各项次级验证计划,领导和组织本公司的全部验证活动的发动和实施。

V ALIDATION MASTER PLAN验证主计划(China) Co., Ltd.MANUFACTURING PLANT有限公司工厂PREPARED BY:制定人:QA MANAGER QA经理CHECKED BY:审核人:HEAD OF QA 质量经理APPROVED BY:批准人:VERSION/版本:V ALID DATE/生效日期Content/目录1.INTRODUCTION 简介 ----------------------------------------------------------------------------------- 41.1. Validation policy 验证方针------------------------------------------------------------------------------------------ 41.2. Aim of the Validation Master Plan (VMP) 验证主计划(VMP)的目的--------------------------------- 42.LOCATION 位置 ------------------------------------------------------------------------------------------- 63.RESPONSIBILITIES 职责-------------------------------------------------------------------------------- 64.V ALIDATION: FLOW SHEETS AND DEFINITIONS 验证:流程和定义 ------------------- 104.1. General criteria 一般标准 ------------------------------------------------------------------------------------------104.2. Validation flow chart 验证流程图 -------------------------------------------------------------------------------- 114.3. Operative scheme 实施程序 ---------------------------------------------------------------------------------------125.ACCEPTANCE CRITERIA 接收标准: ------------------------------------------------------------- 165.1. General acceptance criteria for qualifications 确认的一般接收标准 --------------------------------------165.1.1. Design Qualification (DQ) 设计确认(DQ) ---------------------------------------------------------165.1.2. Installation Qualification (IQ) 安装确认(IQ) ------------------------------------------------------165.1.3. Operation Qualification (OQ) 运行确认(OQ)------------------------------------------------------175.1.4. Performance qualification (PQ) 性能资料(PQ)----------------------------------------------------185.2. Specific acceptance criteria for qualifications 确认的专属接收标准--------------------------------------185.3. General acceptance criteria for process validations 工艺验证和一般接收 -------------------------------185.4. General acceptance criteria for cleaning validations 清洁验证的一般接收标准------------------------245.4.1. Chemical check 化学检查 ---------------------------------------------------------------------------------245.4.2. Microbiological check 微生物检查 ----------------------------------------------------------------------256.QUALIFICATIONS AND V ALIDATIONS LISTS 确认和验证清单---------------------------- 266.1. List of GMP related building and building services qualifications including level of validation GMP相关的建筑物和厂房服务系统确认清单包括各层水平的验证 ------------------------------------------266.2. List of equipment qualifications including level of validation and critical items设备确认验证层次的重要项目之清单--------------------------------------------------------------------------276.2.1. MANUFACTURING EQUIPMENT 生产设备 -------------------------------------------------------276.3. List of Quality Control Equipment including the level of qualification 质量控制设备清单 ----------296.3.1. Quality Control equipment – Chemical Laboratory 质量控制设备-化学试验室 ---------------296.3.2. Quality Control equipment – IPC 质量控制设备-中间过程控制室-------------------------------306.3.3. Quality Control equipment – Microbiological Laboratory质量控制设备–微生物试验室 -------------------------------------------------------------------------306.4. Analytical method validation 分析方法验证 -------------------------------------------------------------------316.5. List of products with manufacturing steps 产品清单及生产步骤 ------------------------------------------326.6. List of products including level of process validation 拟进行验证的产品清单 -------------------------336.7. Maintenance of validation 验证维护 -----------------------------------------------------------------------------347.DOCUMENTATION 文件 ------------------------------------------------------------------------------ 357.1. Validation protocol 验证方案--------------------------------------------------------------------------------------357.2. Validation report 验证报告-----------------------------------------------------------------------------------------357.3. Deviations 偏差-------------------------------------------------------------------------------------------------------367.4. Document structure for DQ, IQ, OQ, PQ. DQ, IQ, OQ及PQ的文件结构 -------------------------------367.5. Documents numbering 文件编号 ---------------------------------------------------------------------------------387.6. Document filing of qualification and validation protocols and reports确认和验证方案及报告的归档 -----------------------------------------------------------------------------------388.STANDARD OPERATING PROCEDURES 标准运作程序-------------------------------------- 389.GLOSSARY 术语----------------------------------------------------------------------------------------- 3810.GUIDELINES ----------------------------------------------------------------------------------------- 44 ANNEX 1. ORGANIZATION CHART 附录1:组织机构图 ----------------------------------------- 45 ANNEX 2: LIST OF ROOMS IN GMP AREA 附录2:GMP房间清单 ---------------------------- 45 ANNEX 3: Annual validation plan 附录3:年度验证计划 -------------------------------------------- 481.INTRODUCTION简介1.1.Validation policy验证方针Validation is a part of our quality policy. We believe in it as a concept which provides both regulatory compliance and cost benefits. It is the responsibility of the Head of QA to assure that the compliance with this VMP is maintained. Plant Director to assure the resources necessary to achieve the compliance with this guideline shall be provided within the operating budgets of all organizational units.验证是我们质量方针的组成部份。

生产设备验证主计划1.目的2.概述2.1公司概述2.2车间描述2.3厂房、设备设施描述2.4工艺描述3.术语4.验证方法5.验证范围和接收标准6.验证支持系统7.验证组织机构及职责8.验证进度表9.修改、变更控制和再验证10.附件1.目的:此文件可以指导验证小组有计划的进行年度所有的验证和确认工作,验证主计划中包括设备与公用设施的确认、工艺验证、设备清洗验证、分析方法验证、计算机系统验证以及其它所有影响到产品质量的系统的验证。
验证主计划提供各类验证的方法和接受标准以及验证的工作进度计划。
它还规定了验证组织的成立以及相关的职责,各部门和相关人员必须按照此文件履行其职责并完成所有的验证和确认工作。
2.概述:2.1公司概述2.2车间概况要求:尽可能详尽。
其中要包括以下内容:建成时间、建筑面积、层高、生产品种、通过认证情况。
2.3产品描述要求:至少包括以下内容:产品化学名称、通用名、分子式、结构式、分子量、产品性状及理化指标、合成步骤、产品主要用途。
2.4厂房、设备设施描述2.4.1厂房、设备设施描述洁净室的设施、洁净度、压差、温湿度等,均符合GMP的有关标准,并进行严格的监控,车间的主要设备有蒸馏水机、空调机组。
蒸馏水机采用多效蒸馏水机,316L不锈钢材料、电抛光。
贮罐采用316L不锈钢制作,内壁抛光,并做钝化处理。
夹套可进行蒸汽加热。
贮罐的排气口及蒸馏水机冷凝器的排气口装有0.22μm的过滤器。
管道采用316L不锈钢管,内外壁电抛光,采用热熔式氩弧焊焊接,卫生夹头分段连接,阀门采用洁净隔膜阀车间洁净区的空调系统均采用初、中、高效三级过滤,排风口加装过滤装置,防止粉尘污染大气。
3不锈钢制作,内壁抛光,并做钝化处理。
夹套可进行蒸汽加热。
贮罐的排气口及蒸馏水机冷凝器的排气口装有0.22μm的过滤器。
管道采用316L不锈钢管,内外壁电抛光,采用热熔式氩弧焊焊接,卫生夹头分段连接,阀门采用洁净隔膜阀车间洁净区的空调系统均采用初、中、高效三级过滤,排风口加装过滤装置,防止粉尘污染大气。

冷链验证主计划(暂行)(适用小型医药批发、生产企业)XXXX医药有限公司年月冷链验证主计划目录1 概述……………………………………………………………………………2 目的……………………………………………………………………………3 组织机构、人员与职责………………………………………………………4 验证范围………………………………………………………………………5 验证可接受标准………………………………………………………………6验证文件………………………………………………………………………7验证进度计划…………………………………………………………………8 附录……………………………………………………………………………1 概述XXXX医药有限公司是一家专业从事药品、医疗器械经营业务的独立法人企业,目前,药品经营许可证经营范围包括中成药、化学药制剂、化学原料药、抗生素、生化药品、生物制品、体外诊断试剂,蛋白同化制剂、肽类激素。
由于生物制品或利用生物制剂技术生产的药品,绝大多数要求在2-8℃的条件下低温、冷藏。
因此,这一类药品在流通过程中对储运温度的要求非常严格。
随着生物制药在医疗临床的广泛应用,冷藏药品的需求量也在不断增多,由于流通环节因素导致冷藏药品出现质量问题的事件时有发生。
因此,加强冷藏药品在经营过程中的质量控制,使冷藏药品在贮藏、运输过程中的温度始终控制在规定范围内,已是当务之急。
为贯彻“XX省药品冷链物流操作规范(暂行)”的精神,确保冷藏保管的药品在贮藏、运输等流通过程中始终处于规定温度环境下,保证冷藏药品的质量,对冷链系统中药品贮藏、运输过程涉及的设施设备、公用工程、仪器仪表、计算机网络等方面的性能状态、效果和人员职责等进行验证,而制定本验证计划。
2 目的药品冷链物流操作规范(暂行)的目的是使冷藏药品在贮藏、运输过程中都必须处于规定的温度环境下,以保证冷藏药品的质量。
公司验证工作的整体目标就是证明按公司规定的操作流程能保证冷藏药品在贮藏、运输过程中的温度始终控制在规定范围内,以保证冷藏药品的质量。

{Contract Logo}: VMP-01-A : :: 1 of 29{Client Logo}题目:文件编号.版本 生效日期 页码A 供审核及讨论徐文勤2022-03-11.......................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................5.1. 组织结构表 (6)5.2. 福尔验证经理 (6)5.3. 福尔质量保证部 (6)5.4. KCS 验证项目经理 (6)5.5. KCS 验证工程师主管 (6)5.6. KCS 验证工程师(公用设施) (6)5.7. KCS 验证工程师(工艺) (7)5.8. KCS 文档控制员 (7)5.9. 设备供应商验证团队 (7)........................................................................................................6.1. 总原则 (7)6.2. 验证序列 (7)6.3. 文件系统 (8)6.4. 再验证 (9)...................................................................................................................................................................................8.1. 用户需求(URS) (10)8.2. 验证主计划(VMP) (10)8.3. 设计确认(DQ) (10)8.4. FAT/SAT (11)8.5. 调试 (11)8.6. 安装确认(IQ) (11)8.7. 运行确认(OQ) (13)8.8. 性能确认(PQ) (15)8.9. 工艺验证(PV) (17)....................................................................................9.1 工程变更控制 (20)9.2 验证变更控制 (20)9.3 验证偏差管理 (20).......................................................................................................................................................................................................................................................................................................12.1 项目验证计划 (21)12.2 常规验证计划 (21)............................................................................................................................................................................................................附录一验证序列表 (22)附录二验证明细表 (22)附录三验证时间表 (22)附录四工厂布局图(最新版本) (22)附录五人流和物流图(最新版本) (22)附录六GMP 区域分级图(最新版本) (22)附录七工艺P & ID 图(最新版本) (22)本验证主计划为福尔生化狂苗改造项目验证活动的指导文件。
验证主计划验证主计划第一部分总则1、企业介绍: xxxx 股份有限公司正式成立于 1993 年。
厂区占地面积为30000 平方米,生产建筑及设施严格按照 GMP 管理要求设计施工,年生产能力达到1000 万支以上。
目前,公司生产注射用重组人干扰素α2a 及重组人干扰素α2a 注射液商品名: 因特芬、注射用重组人白介素—2商品名:英路因、重组人促红素注射液商品名:益比奥及重组人促血小板生成素注射液商品名:特比澳,5 个品种,共 16 个规格。
生产厂主厂房面积约为 2500 平方米,洁净区域1600 平方米,分为三个车间,细胞工程制药车间、细菌工程制药车间、制剂包装车间及附属部分(人流、物流通道,洗刷室、器具储存室和二级库等)。
细胞工程车间生产重组人促红素rhEPO 原液生产细菌工程车间分为发酵、干扰素纯化、白介素纯化三个区域制剂车间负责所有品种的调剂、灌装及包装。
洁净车间的设计完全按照中国GMP 的标准进行设计和规划,并参照欧盟 GMP 运行管理,完全满、足生产工艺和空气洁净级别的要求,洁净区洁净级别分为D 级(10 万级)C级(1 万级) 、B级(100 级)及 A 级(100 级)净化区,满足不同生产工艺的要求。
洁净区、人员净化、物料净化和其它辅助用房分区布置。
同时考虑生产操作、工艺设备安装和维修、管线布置、气流流型以及净化空调系统各种技术设施的综合协调。
生产车间平面图及人流/物流图见附图. 2、验证定义:中国GMP(98 年修订)定义是:证明任何程序、生产过程、设备、物料、活动或系统确实能达到预期结果的有文件证明的一系列活动WHO/EU GMP 中对验证的定义:能证明任何程序、工艺、设备、物料、活动、或系统确实能导致预期结果的文件证明的行为。
3、验证总计划目的及作用:目的:验证总计划是验证活动实施内容、计划及其组织机构的概述。
其核心是验证项目及计划方案。
验证总计划作用使三生制药厂各部门明确所需验证项目、验证项目应实施的时间、验证所涉及人员及验证程序等,同时了解验证项目的必要性;使验证小组成员知道自己的任务和责任。
工艺验证主计划
序言
为顺利开展产品的工艺验证工作,特制订本主计划。
一、目的
1. 验证产品的关键工艺是否满足生产要求;
2. 找出产品工艺中的不足之处,为正式生产做好准备。
二、内容
1. 材料准备:根据产品结构确定所需材料种类和数量;
2. 设备准备:完成所需设备的安装调试和性能测试;
3. 工艺制定:根据产品图纸制定流程工艺;
4. 试验实施:分步实施工艺试验,进行检测分析;
5. 不合格处处理:根据检测结果对不合格问题进行排除;
6. 试验报告编写:汇总试验结果,编制试验报告。
三、时间安排
1. 材料采购实施日期:2021年6月1日;
2. 设备调试完成日期:2021年6月15日;
3. 第一个工艺批产完成日期:2021年7月1日;
4. 报告编写完成日期:2021年7月15日。
四、责任部门
1. 质量部负责试验计划和报告编写;
2. 工艺部负责工艺标准制定和试验实施;
3. 采购部负责材料采购和设备采购;
4. 所有相关部门共同参与解决在试验中出现的问题。
五、签字认可
技术经理加工部长质量部长
以上内容仅为范例,如需要实际使用,请结合自己的工艺验证内容进行修改和完善。
计划批准目录一•前言 (4)二.公司及工厂膨兄 (4)♦公司简介 4 ♦公司组织机构图 (4).公司产品 5 .项目描述 6 ♦操作流程图 (7)三.公司标准 (8)♦指南 (8)四•主计划目的 (8)五・部门职责 (9)♦运行(工程)部门XXX-设备工程师 (9)♦药品生产(原料药)部XXX -生产主管9 ■ QA部门XXX- QA主管10 ♦验证部门xxx-验证&培训组织者 (10)六・验证方法 (11)七.设备、公用设施和系统的确认11♦轴确认草案 (11)♦运行确认草案12♦性能确认草案14 ♦工艺验证16 ♦嵐吉报告16 八.验证支持系统17 ♦虹17 ■ SOPs操作程序和SOPs书写程序17 .清i吉验证17 .人员培训17 九.修改、变更控刑Jffl再验证17 附件1工厂全面规划图18 附件2公司鉀机构图19 附件3工艺潮呈图20 附件4设施及操作流程图21 附件5公司标}隹操作程序22 附件6需馳的设备设施系统23 附件7验证项目时间表24—・刖吕验证主计划所述方法,应验证用于控制工艺步骤的设备和公用系统。
主计划目的是提供关于验证工艺和验证工厂设施、工艺设备和公用系统所采用的方法。
另外,主计划包括如下内容:•列出负责执行验证程序部门的职能。
•描述将被验证的工厂、工艺和设备,包括对支持设备和系统的确认。
•关键性的控制工艺设备、设施、系统和/或公用设施的一般验收标准。
•用于验证工作的一般文件记录要求。
二・公司及工厂概况♦公司简介公司是公司成立于—年,专门从事于产品的研究、开发和商品化生产。
公司生产车间面积共计_______ 多平方米,符合中国GMP标准。
主要的实验室和生产设备都是从_______ 口的。
—年该公司原料药的年产星达工厂有—个车间:填充车间(建筑01),原车间(建筑02 )和新车间(建筑03 );三个仓库:原料和包装材料贮藏室(建筑01-2和建筑01-4 );溶媒的地下仓库(建筑06 );贮藏工具和其他仪器的仓库(建筑05](见附♦公司组织机构图公司拥有充足的负责生产运行的主管人员。
FDA验证主计划验验证主计划:是整个验证工作的指导大纲和基本依据,它对确保整个验证工作的顺利完成并达到符合FDA认证要求至关重要。
验证主计划将覆盖全部验证的各个方面及组成部分,包括公用工程设施,生产设备,生产环境,生产工艺,设备的清洁验证等。
它包括:(1)验证工作总体介绍;(2)需要验证的全部系统的描述;(3)工艺控制方面的考虑;(4)验证方案的主要内容及其接受的标准依据;(5)验证文件的格式;(6)验证所涉及的SO P;(7)验证时间计划与进度。
By Denis M. Kluba验证方案批准方案起草签名日期方案审核签名日期工程部经理质量控制部经理制造部经理质量保证部方案批准签名日期质量总监目录Table of Contents生产工厂验证方案批准 (2)导言 (4)Introduction (4)公司及工厂概况 (4)某公司 (4)公司组织机构图 (4)公司产品 (5)项目描述 (6)工厂操作流程图(见附4) (7)公司标准 (8)指南 (8)部门职责 (9)运行(工程)部门Mr.Li Minqian-设备工程师 (9)药品生产(原料药)部Ms.Shen Jiangbo-生产主管 (9)QA部门Mr.Yang Shizheng-QA主管 (10)验证部门Mr.Yu Zemin-验证&培训组织者Validation Department (1)验证方法 (11)IQ 、OQ (11)工艺验证(PV/PQ) (15)验收标准 (16)IQ通用接收的标准 (16)通用的OQ验收标准 (17)通用PQ验收标准 (17)特定验收标准 (17)总结报告 (17)验证支持系统 (18)校准 (18)SOPs操作程序和SOPs书写程序 (18)清洁验证 (18)人员培训 (18)修改、变化控制和重新验证 (19)附件1 (20)附件2 (21)附件3 (22)附件4 (23)附件5 (24)附件6 (25)附件7 (26)导言Introduction验证主文件所述方法,应验证用于控制工艺步骤的设备和公用系统。
产品包验证产计划
1目的和范围 (1)
2定义 (1)
3计划概述 (1)
3.1 关键技术要素 (1)
3.2 计划的交付件 (1)
3.3 计划的关键日期和里程碑 (1)
3.4 计划成本(资源、资金投入和花费) (1)
3.5 计划依赖关系和问题点 (1)
3.6 计划的验证策略 (1)
3.7计划的风险、风险级别以及相应的风险规避措施 (1)
4产品包验证计划要素 (1)
5验证计划编制要素表 (3)
6本模板的目的 (9)
7使用方法 (9)
8模板说明 (10)
9参考文档 (10)
注:通过插入目录方式自动生成,推荐保留二级目录。
1 目的和范围
概述计划的目的、范围和关键技术要素
2 定义
列出本文档中所使用的术语和缩略语。
可引用已有的数据字典,如没有则需要在此列出。
例如:参见《数据字典.doc》
3 计划概述
3.1 关键技术要素
3.2 计划的交付件
3.3 计划的关键日期和里程碑
3.4 计划成本(资源、资金投入和花费)
3.5 计划依赖关系和问题点
3.6 计划的验证策略
3.7计划的风险、风险级别以及相应的风险规避措施
表2-1 风险列表
4 产品包验证计划要素
在下表中,请说明是否要用到产品包验证主计划的每个要素。
如果不会用到,请说明理由。
如果要用到该要素,请粗略估计完成该要素活动的时间、成本(花费&资金)和资源。
表3-1验证计划要素表。
目的:概括验证的指导思想,目标和达到目标的方式。
范围:适用于验证主计划。
责任人:验证总负责人。
1.释义
无
2.材料与设备
无
3.相关文件
3.1厂区平面图
3.2 各种图表
4.内容
4.1简介
4.1.1 公司介绍:豪威生物科技有限公司是一家专业从事兽用生物制品生产、研发、经营销售和技术服务于一体的高新技术企业,坐落于风景秀丽的武清,注册资金2.7亿元。
豪威生物科技有限公司位于天津市武清区第三国家级开发区,占地面积88亩(约60000 m2),建筑面积约47375 m2,建筑占地面积约为58800m2。
建筑设施包括办公楼、研发中心、疫苗GMP车间、质检及实验动物中心;采用国际上先进的生产工艺和设备,执行批签发制度,实施生产过程的品控管理,向客户提供品质均一、性能稳定的优质产品和完善的满意服务。
本项目投资2.7亿元,GMP生产车间建有六条生产线,年产禽猪用活疫苗108亿羽(头)份、灭活疫苗2.5亿ml。
4.1.2验证的意义:通过一种有组织有计划的制度,按照兽药GMP的标准,原辅料生产设备,设施,生产工艺确保能生产出合格的产品。
4.2验证的目标及合格标准:即兽药GMP和其他药监法规的要求,以及本公司产品及工艺的特殊要求。
4.3组织机构及其职责:
4.3.1 组成:验证临时委员会及验证小组。
4.3.1.1 验证临时委员会:主管副总经理、研发部经理、QA主管、生产部经理等。
4.3.1.2 验证小组:由验证临时委员会根据具体的验证对象组建。
4.3.2 职责:
4.3.2.1有关验证管理及操作规程的制订和修订。
4.3.2.2变更计划的审核。
4.3.2.3日常验证计划、验证方案的制订和监督实施。
4.3.2.4日常验证活动的组织、协调。
4.3.2.5参加公司新建和改建项目的验证以及新产品生产工艺的验证。
4.3.2.6验证的文档管理。
4.4验证的原则要求:
4.4.1安装确认IQ:安装确认是对供应商所提供的技术资料的核查,设备、备品备件的检查验收以及设备的安装检查,以确认其是否符合兽药GMP、厂商的标准及公司特定技术要求的一系列活动。
4.4.2运行确认OQ:运行确认是指按草拟的标准操作程序SOP进行单机或系统的运行试验,借以证实设备在规定范围内能否正常运行,各项技术参数能否达到设定要求的一系列活动。
4.4.3性能确认PQ:性能确认是为了证明设备、系统是否达到设计标准和GMP 而进行的系统性检查和试验。
4.5 验证范围:厂房设施、生产设备、空气净化系统、工艺用水系统、生产工艺及其变更、设备清洗、主要原辅材料变更、灭菌设备及灌封系统等。
4.6验证进度计划:
4.6.1 所有验证要在2014年10月末完成。
4.7附录:
4.7.1平面布置图。
4.7.2工艺流程图。
4.7.3系统图。
4.7.4其他各种图表等。