第七章配位平衡
- 格式:doc
- 大小:260.00 KB
- 文档页数:3





配位平衡与氧化还原平衡
配位平衡是指配位化合物中配体与中心离子形成的配合物的形成与解离之间的平衡。
在配位平衡中,配体可以与中心离子结合形成稳定的配合物,也可以从配合物中解离,使配合物分解成配体与中心离子。
配位平衡受到温度、浓度、配体和中心离子性质等因素的影响。
配位平衡的常用表达式有配合物的形成常数和配位平衡常数。
氧化还原平衡是指氧化还原反应中,电子的转移导致氧化剂和还原剂之间的平衡。
在氧化还原平衡中,氧化剂失去电子而被还原,还原剂获得电子而被氧化。
氧化还原平衡受到温度、浓度、氧化剂和还原剂性质等因素的影响。
氧化还原平衡的常用表达式有氧化还原电势和氧化还原平衡常数。
配位平衡和氧化还原平衡有时会相互影响。
例如,在配位化合物中,配体可以提供电子给中心离子,参与氧化还原反应。
另外,在氧化还原反应中,可以形成配合物的中心离子可能发生氧化还原反应。
因此,配位平衡和氧化还原平衡是相互关联的,并在化学反应中起着重要作用。

第七章 配位化合物第一节 配合物的组成及命名一、配合物的组成 1、配合物配离子:由两种不同离子或一种离子与一种分子形成的复杂离子称之。
如:[]+23)(NH Ag 、[]+243)(NH Cu 、[]-36)(CN Fe 、[]-46)(CN Fe配合物:含配离子的化合物。
如:[]Cl NH Ag 23)(、[]443)(SO NH Cu 、[]63)(CN Fe K 、[]64)(CN Fe K 有时也把配离子笼统称为配合物。
2、配合物的组成配合物结构较复杂,但一般都有一个成分作为配合物的核心,其它部分围绕这一核心有规则地排列。
(1)中心离子(配合物的形成体):位于配合物中心的离子或原子。
多为具有空轨道的过渡元素的金属离子(d 区、s d 区)。
少数为高氧化数非金属原子,如:[]-26SiF 、[]-6PF 。
个别为中性原子,如:[]4)(CO Ni 、[]5)(CO Fe 。
(2)配位体★含义:与中心原子结合的分子或离子。
多为含孤对电子的分子或离子。
如3NH 、O H 2、-Cl 、-CN 、-SCN 等。
★分类:根据一个配体中所含配位原子数目的不同,可将配体分为单齿配体和多齿配体。
单齿配体:一个配位体只含一个配位原子。
多齿配体:一个配位体只含两个或两个以上的配位原子。
(3)配位原子:配位体中直接与中心离子结合的原子。
配位原子大多为电负性较大的非金属原子,如:N 、O 、F 、C 、S 、x 等。
(4)配位数:★含义:直接与中心原子结合的配位原子数。
单齿配体:配位数=配位体数。
多齿配体:配位数=配位体数×一个配位体所含配位原子的个数(齿数)。
如:[]+22)(en Pt★影响因素中心离子正电荷:电荷数↑,配位数↑半径:中心离子半径↑,配位数↑配体半径↑,配位数↓外界因素:浓度,配体浓度高有利于形成高配位数。
温度,温度低有利于形成高配位数。
★经验:中心离子 +1 +2 +3 +4 配位数 2 4(6) 6(4) 6(8) (5)内界:即配离子,用“[ ]”括起。

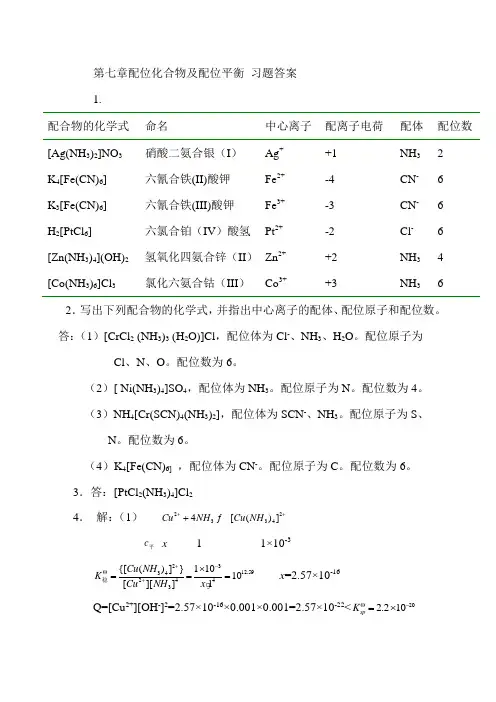
第七章配位化合物及配位平衡 习题答案 1.配合物的化学式 命名 中心离子 配离子电荷 配体 配位数 [Ag(NH 3)2]NO 3 硝酸二氨合银(I ) Ag + +1 NH 3 2 K 4[Fe(CN)6] 六氰合铁(II)酸钾 Fe 2+ -4 CN - 6 K 3[Fe(CN)6] 六氰合铁(III)酸钾Fe 3+-3 CN - 6 H 2[PtCl 6] 六氯合铂(IV )酸氢 Pt 2+ -2 Cl - 6 [Zn(NH 3)4](OH)2 氢氧化四氨合锌(II ) Zn 2+ +2 NH 3 4 [Co(NH 3)6]Cl 3氯化六氨合钴(III )Co 3++3NH 362.写出下列配合物的化学式,并指出中心离子的配体、配位原子和配位数。
答:(1)[CrCl 2 (NH 3)3 (H 2O)]Cl ,配位体为Cl -、NH 3、H 2O 。
配位原子为Cl 、N 、O 。
配位数为6。
(2)[ Ni(NH 3)4]SO 4,配位体为NH 3。
配位原子为N 。
配位数为4。
(3)NH 4[Cr(SCN)4(NH 3)2],配位体为SCN -、NH 3。
配位原子为S 、N 。
配位数为6。
(4)K 4[Fe(CN)6] ,配位体为CN -。
配位原子为C 。
配位数为6。
3.答:[PtCl 2(NH 3)4]Cl 24. 解:(1) 223344[()]Cu NH Cu NH +++ c 平 x 1 1×10-32312.59342443{[()]}11010[][]1Cu NH K Cu NH x +-Θ+⨯=== 稳x =2.57×10-16 Q=[Cu 2+][OH -]2=2.57×10-16×0.001×0.001=2.57×10-22<202.210sp K Θ-=⨯无沉淀。
(2) Q=[Cu 2+][S 2-]=2.57×10-16×0.001=2.57×10-19>366.310sp K Θ-=⨯,有沉淀。


第七章. 配位化合物与配位平衡测验题一、选择题1、欲用EDTA测定试液中的阴离子,宜采用: ()A.直接滴定法;B.返滴定法;C.置换滴定法;D.间接滴定法2、用EDTA测定Cu2+,Zn2+,Al3+中的Al3+,最合适的滴定方式是: ()A.直接滴定;B.间接滴定;C.返滴定;D.置换滴定(已知lg K CuY=18.8,lg K ZnY=16.5,lg K AlY=16.1)3、EDTA滴定Al3+的pH一般控制在4.0~7.0范围内。
下列说法正确的是: ()A.pH<4.0时,Al3+离子水解影响反应进行程度;B.pH>7.0时,EDTA的酸效应降低反应进行的程度;C.pH<4.0时,EDTA的酸效应降低反应进行的程度;D.pH>7.0时,Al3+的NH3配位效应降低了反应进行的程度4、在Fe3+,Al3+,Ca2+,Mg2+的混合液中,用EDTA法测定Fe3+,Al3+,要消除Ca2+,Mg2+的干扰,最简便的方法是采用: ()A.沉淀分离法;B.控制酸度法;C.溶液萃取法;D.离子交换法5、用指示剂(In),以EDTA(Y)滴定金属离子M时常加入掩蔽剂(X)消除某干扰离子(N)的影响。
不符合掩蔽剂加入条件的是: ()A.K NX<K NY;B.K NX>>K NY;C.K MX<<K MY;D.K MIn>K MX6、已知lg K BiY=27.9;lg K NiY=18.7。
今有浓度均为0.01mol⋅L−1的Bi3+,Ni2+混合试液。
欲测定其中Bi3+的含量,允许误差<0.1%,应选择pH值为: ()pH 0 1 2 3 4 5lgαY(H)24 18 14 11 8.6 6.6A.<1;B.1~2;C.2~3;D.>47、某配离子[M(CN)4]2-的中心离子M2+以(n-1)d、ns、np轨道杂化而形成配位键,则这种配离子的磁矩和配位键的极性将...........................................................................................()。
配位平衡的医学常识
医学上的配位平衡是一个重要的概念,它是所有生物体对维持内部环境平衡所必须做出的努力,也是调节和调整其生命活动的重要基础。
配位平衡是以化学反应的形式,即在相同的温度和压力条件下,互相平衡的化学反应的综合过程。
在人体内,配位平衡可以帮助调节多种内部刺激,从而促进组织和器官维持正常的功能。
配位平衡对于我们的身体健康至关重要,它可以帮助维持BUN、乳酸和血糖水平等指标的正常变化。
此外,它还可以维持血液pH值,同时保持身体水和电解质的平衡,保持体液和细胞渗透压的适宜水平,还可以帮助细胞吸收新陈代谢物,维护钠离子之间的平衡,有助于调节钙离子和葡萄糖含量等等。
此外,配位平衡还可以帮助调节消化系统的正常功能,以维护营养的平衡。
当肠道吸收的消化物排泄时,配位平衡可以帮助调节消化性元素的吸收。
配位平衡还可以帮助控制血液中的抗体,保持身体对导致病毒感染的免疫能力的稳定。
因此,维持配位平衡是所有生物体必须保持健康的关键。
通过良好的饮食,合理的营养摄入,适当的运动,保持良好的心理状态,维持身体配位平衡,帮助保护我们的健康。
大学化学 | 配合物与配位平衡总结●7.1 配位化合物的基本概念●中心离子(或原子):具有接受孤对电子或不定域电子的空位的原子或离子●具有9~17电子构型的d区金属离子,如Fe3+、Co3+;具有18电子构型的ds区金属离子,如Cu+、Ag+ 等;●s区金属离子如叶绿素中Mg2+、p区高氧化态的非金属元素,如BF4-中B(Ⅲ)、SiF62-中的Si(Ⅳ)、PF6-中的P(Ⅴ);●0价金属或负价金属,金属羰基配合物Ni(CO)4、Fe(CO)5 和[Ti(CO)6]2−、[M(CO)4]2− (M = Fe, Ru, Os,氧化数-2)。
●配体:能给出孤对电子或多个不定域电子的离子或分子●单齿配体:一个分子只有一个配位原子的配体●氢氰酸:H一C≡N、异氢氰酸:H-N ≡ C●硫氰根以S为配位原子;异硫氰根以N作配位原子。
●多齿配体:含有两个或两个以上配位原子的配体,如乙二胺四乙酸根,其中含有2个N、4个O均可配位,是六齿配体,1个配体可形成多个配位键●桥联配体:如OH-、Cl-不止1对孤对电子,可提供两对电子作桥,桥联多个中心离子。
主要在多核配合物中。
●配位原子:配体中与中心离子直接键合的原子,即提供孤对电子的原子。
常见配位原子是电负性较大的非金属原子,如O、S、N、X等●配位数,C.N.:配位原子的个数●配位数一般为偶数(2、4、6、8),其中最常见的是4和6●配位数大小与中心离子的电荷、半径以及配体的电荷、半径有关●规律●中心离子电荷数越高、半径r越大:内层空轨道越多、周围能容纳的配体就越多,C.N.越大●配体半径 r 越小(在中心离子周围能容纳的配体就越多),电荷数越少(配体之间的斥力小), C.N.越大●配合物生成条件:配体浓度越高、温度越低, C.N.越大●●配位单元:由中心离子和配体通过配位共价键结合形成的单元,用[ ]标出●配位键:一个原子提供孤对电子,一个原子或离子的空轨道接受孤对电子形成的共价键●内界:即配位单元,由中心原子(离子)和配体构成的离子●外界:带有与内界异号电荷的离子●如:在配合物[Co(NH3)6]Cl3中,内界[Co(NH3)6]3+,外界Cl-; K4[Fe(CN)6]?中性配位单元作为配合物的[Ni(CO)4]则无外界●7.1.3配合物的命名:中文名的写法●内、外界之间先写阴离子,后阳离子。
第七章配位平衡一、选择题1、欲用EDTA 测定试液中的阴离子,宜采用:A.直接滴定法;B.返滴定法;C.置换滴定法;D.间接滴定法答()2、用EDTA 测定Cu 2+,Zn 2+,Al 3+中的Al 3+,最合适的滴定方式是:A.直接滴定;B.间接滴定;C.返滴定;D.置换滴定(已知lg K CuY =18.8,lg K ZnY =16.5,lg K AlY =16.1)答( )3、EDTA 滴定Al 3+的pH 一般控制在4.0~7.0范围内。
下列说法正确的是:A.pH <4.0时,Al 3+离子水解影响反应进行程度;B.pH >7.0时,EDTA 的酸效应降低反应进行的程度;C.pH <4.0时,EDTA 的酸效应降低反应进行的程度;D.pH >7.0时,Al 3+的NH 3配位效应降低了反应进行的程度答( )4、在Fe 3+,Al 3+,Ca 2+,Mg 2+的混合液中,用EDTA 法测定Fe 3+,Al 3+,要消除Ca 2+,Mg 2+的干扰,最简便的方法是采用:A.沉淀分离法;B.控制酸度法;C.溶液萃取法;D.离子交换法答( )5、用指示剂(In),以EDTA(Y)滴定金属离子M 时常加入掩蔽剂(X)消除某干扰离子(N)的影响。
不符合掩蔽剂加入条件的是:A.K NX <K NY ;B.K NX >>K NY ;C.K MX <<K MY ;D.K MIn >K MX答( ) 6、已知lg K BiY =27.9;lg K NiY =18.7。
今有浓度均为0.01mol ⋅L -1的Bi 3+,Ni 2+混合试液。
欲测定其中Bi 3+的含量,允许误差A.<1; 答( )7、某配离子[M(CN)4]2-的中心离子M 2+以(n -1)d 、ns 、np 轨道杂化而形成配位键,则这种配离子的磁矩和配位键的极性将...........................................................................................( )。
(A)增大,较弱; (B)减小,较弱;(C)增大,较强; (D)减小,较强。
8、EDTA 溶液中,HY 3-和Y 4-两种离子的酸效应系数之比,即αHY 3£-/αY 4-等于:A.[H +]/K a5; B.[H +]/K a6; C.K a5/[H +]; D.K a6/[H +]答( )9、AgCl 在1mol ⋅L -1氨水中比在纯水中的溶解度大。
其原因是:A.盐效应;B.配位效应;C.酸效应;D.同离子效应答( ) 10、在pH=1,0.1mol ⋅L -1EDTA 介质中,Fe 3+/Fe 2+的条件电极电位E '+2+/Fe Fe 3和其标准电极电位/E +Fe Fe 32+相比:A.E '+2+/Fe Fe 3</E +Fe Fe 32+;B.E '+2+/Fe Fe 3>/E +Fe Fe 32+;C.E '+2+/Fe Fe 3=/E +Fe Fe 32+; D.无法比较 答( )11、已知AgBr 的p K sp =12.30,Ag(NH 3)2+的lg K 稳=7.40,则AgBr 在1.001mol ⋅L -1NH 3溶液中的溶解度(单位:mol ⋅L -1)为:A.10-4.90;B.10-6.15;C.10-9.85;D.10-2.45答()12、用EDTA滴定Bi3+时,为了消除Fe3+的干扰,采用的掩蔽剂是:A.抗坏血酸;B.KCN;C.草酸;D.三乙醇胺答()13、用EDTA测定Zn2+,Al3+混合溶液中的Zn2+,为了消除Al3+的干扰可采用的方法是:A.加入NH4F,配位掩蔽Al3+;B.加入NaOH,将Al3+沉淀除去;C.加入三乙醇胺,配位掩蔽Al3+;D.控制溶液的酸度答()14、25℃时,在Ag+的氨水溶液中,平衡时c(NH3)=2.98⨯10-4mol·L-1,并认为有c(Ag+)=c([Ag(NH3)2]+),忽略Ag(NH3)+的存在。
则[Ag(NH3)2]+的不稳定常数为...()。
(A)2.98⨯10-4;(B)4.44⨯10-8;(C)8.88⨯10-8;(D)数据不足,无法计算。
15、下列叙述中正确的是 ........................................................................................... ()。
(A)配合物中的配位键必定是由金属离子接受电子对形成的;(B)配合物都有内界和外界;(C)配位键的强度低于离子键或共价键;(D)配合物中,形成体与配位原子间以配位键结合。
16、某金属离子M2+可以生成两种不同的配离子[MX4]2-和[MY4]2-,K([MX4]2-)<K([MY4]2-)。
若在[MX4]2-溶液中加入含有Y-的试剂,可能发生某种取代反应。
下列有关叙述中,错误的是....................................................................................................................................... ()。
(A)取代反应为:[MX 4]2-+4Y-[MY4]2-+4X-;(B)由于K([MX4]2-)<K([MY4]2-),所以该反应的K>1。
(C)当Y-的量足够时,反应必然向右进行。
(D)配离子的这种取代反应,实际应用中并不多见。
17、已知[Co(NH3)6]3+的磁矩μ=0B.M.,则下列关于该配合物的杂化方式及空间构型的叙述中正确的是..................................................................................................................................()。
(A)sp3d2杂化,正八面体;(B)d2sp3杂化,正八面体;(C)sp3d2,三方棱柱;(D)d2sp2,四方锥。
19、下列叙述中错误的是 ........................................................................................... ()。
(A)配合物必定是含有配离子的化合物;(B)配位键由配体提供孤对电子,形成体接受孤对电子而形成;(C)配合物的内界常比外界更不易解离;(D)配位键与共价键没有本质区别。
20、25℃时,在Cu2+的氨水溶液中,平衡时c(NH3)=6.7⨯10-4mol·L-1,并认为有50%的Cu2+形成了配离子[Cu(NH3)4]2+,余者以Cu2+形式存在。
则[Cu(NH3)4]2+的不稳定常数为........................ (....................................................................................................................................... )。
(A)4.5⨯10-7;(B)2.0⨯10-13;(C)6.7⨯10-4;(D)数据不足,无法确定。
二、是非题1、五氯·一氨合铂(Ⅳ)酸钾的化学式为K3[PtCl5(NH3)]。
..................................... ()2、已知[HgCl4]2-的K=1.0⨯1016,当溶液中c(Cl-)=0.10mol·L-1时,c(Hg2+)/c([HgCl4]2-)的比值为1.0⨯10-12。
.. ................................................................................................. ()3、在多数配位化合物中,内界的中心原子与配体之间的结合力总是比内界与外界之间的结合力强。
因此配合物溶于水时较容易解离为内界和外界,而较难解离为中心离子(或原子)和配体。
.........................................................................................................................()4、磁矩大的配合物,其稳定性强。
.....................................................................()5、金属离子A3+、B2+可分别形成[A(NH3)6]3+和[B(NH3)6]2+,它们的稳定常数依次为4⨯105和2⨯1010,则相同浓度的[A(NH3)6]3+和[B(NH3)6]2+溶液中,A3+和B2+的浓度关系是c(A3+)>c(B2+)。
()6、能形成共价分子的主族元素,其原子的内层d轨道均被电子占满,所以不可能用内层d参与形成杂化轨道。
.......................................................................................................()7、[AlF6]3-的空间构型为八面体,Al原子采用sp3d2杂化。
..........................................()8、已知K 2[Ni(CN)4]与Ni(CO)4均呈反磁性,所以这两种配合物的空间构型均为平面正方形。
..................................................................................................................................................( )三、计算题1、在c Al 3+=0.010mol ⋅L -1的溶液中,加入NaF 固体,使溶液中游离的F -浓度为0.10mol ⋅L -1。
计算溶液中[Al 3+],[AlF 4-],[AlF 52-]和[AlF 63-]。
(已知AlF 63-的lg β1~lg β6为6.1,11.15,15.0,17.7,19.4,19.7)2、查得汞(Ⅱ)氰配位物的lg β1~lg β4分别为18.0,34.7,38.5,41.5。