5--金属的物理性质和某些化学性质实验报告
- 格式:doc
- 大小:21.00 KB
- 文档页数:1

实验活动4:金属的物理性质和特定化学
性质学生实验报告单
实验目的:
通过本次实验,我们旨在探究金属的物理性质和特定化学性质,以增加对金属性质的了解。
实验步骤:
1. 准备实验材料和仪器设备。
2. 测量金属样品的质量,记录结果。
3. 使用导热仪测定金属样品的导热性能,记录结果。
4. 使用硫酸测定金属样品的活性,记录结果。
5. 使用铜酸钠溶液观察金属样品的腐蚀情况,记录结果。
6. 将金属样品放入氯化银溶液中,观察反应情况并记录结果。
实验结果:
1. 测量得到金属样品的质量为X克。
2. 导热仪测定结果显示,金属样品的导热性能为Y。
3. 使用硫酸测试后,金属样品出现了Z反应。
4. 铜酸钠溶液的观察结果显示,金属样品没有发生腐蚀。
5. 将金属样品放入氯化银溶液中,观察到了A反应。
实验讨论:
通过本次实验,我们探索了金属的物理性质和特定化学性质。
实验结果显示,金属样品具有良好的导热性能,并且对硫酸具有活性。
另外,金属样品在铜酸钠溶液中没有发生腐蚀,但在氯化银溶液中发生了反应。
结论:
通过本次实验,我们对金属的物理性质和特定化学性质有了更深入的了解。
金属具有良好的导热性能,对硫酸具有活性,并且在不同溶液中呈现出不同的化学活性。
这些结果对于金属的应用和研究具有一定的指导意义。
实验总结:
通过本次实验,我们迈进了对金属性质的认识之旅。
在未来的研究和研究中,我们将继续深入探索金属的性质和应用领域,为科学的发展做出贡献。
参考文献:
- 引用参考文献1 - 引用参考文献2。


实验活动4:金属的化学性质和某些物理性质学生实验报告单1. 实验目的本实验旨在探究金属的化学性质和某些物理性质,并通过实验结果分析金属的特性和变化过程。
2. 实验原理金属是一类常见的物质,具有一些独特的化学性质和物理性质。
在本实验中,我们将通过以下实验方法来研究金属的特性:- 实验一:金属的化学反应。
通过观察金属与酸、氧化剂等物质的反应,了解金属与不同物质的化学反应性。
- 实验二:金属的燃烧性质。
通过观察金属在氧气中的燃烧现象,了解金属的燃烧性质。
- 实验三:金属的电导性能。
通过使用电流表和电池将金属接入电路,测量金属的电导性能。
3. 实验步骤实验一:金属的化学反应1. 取少量金属样品,将其分别与酸、氧化剂等物质接触。
2. 观察金属与不同物质的反应过程和产物生成情况。
3. 记录下实验结果。
实验二:金属的燃烧性质1. 取少量金属样品,放置在装有氧气的实验器皿中。
2. 使用火柴点燃金属样品。
3. 观察金属在氧气中的燃烧现象。
4. 记录下实验结果。
实验三:金属的电导性能1. 准备一个电路,包括一个电流表和一个电池。
2. 将金属样品与电路连接,并关闭电路开关。
3. 测量电流表上的电流数值。
4. 记录下实验结果。
4. 实验结果根据实验步骤,记录下实验过程中的观察结果和数据。
5. 结果分析根据实验结果,分析金属的化学性质和某些物理性质。
结合实验过程中观察到的现象和数据,对金属的特性和变化过程进行解释和分析。
6. 实验结论根据实验结果和分析,总结金属的化学性质和某些物理性质。
提出对实验的改进和进一步研究的建议。
7. 参考文献列出本实验中使用到的参考文献。
8. 附录附上实验中使用到的数据表格、图表等相关材料。

实验活动4 金属的物理性质和某些化学性质
实验类型:
验证性实验
实验目的:
1.巩固和加深对金属性质的认识;
2.培养实验设计能力。
实验用品:
试管、试管夹、试管架、酒精灯、坩埚钳、电池、导线、小灯泡、火柴;
镁条、锌粒、铝片、铁片、铁粉、铜片、黄铜片(或白铜片)、稀盐酸、稀硫酸、硫酸铜溶液、硝酸银溶液。
你还需要的实验用品是。
实验过程:
问题与讨论:
1.请你设计实验证明锌、铁、铜三种金属的活动性顺序。
2.市面上的不法商人利用假黄金(锌与铜的合金)骗取钱财,你能用学过的知识鉴别真假黄金吗?
3.实验室用金属与稀硫酸反应制取氢气。
在镁、锌、铁、铜四种金属中,你认为用哪种金属与稀硫酸反应制取氢气最佳,请说明理由。



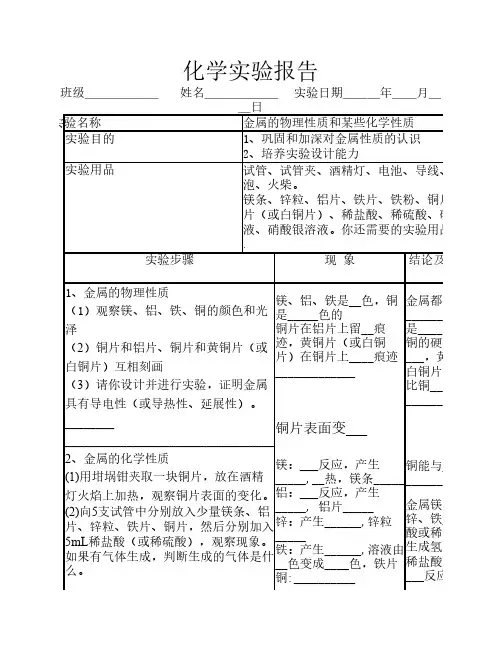
化学实验报告班级______姓名______实验日期___年__月__日实验名称金属的物理性质和某些化学性质实验目的1、巩固和加深对金属性质的认识2、培养实验设计能力实验用品试管、试管夹、酒精灯、电池、导线、小灯泡、火柴。
镁条、锌粒、铝片、铁片、铁粉、铜片、黄铜片(或白铜片)、稀盐酸、稀硫酸、硫酸铜溶液、硝酸银溶液。
你还需要的实验用品:.实验步骤现象结论及反应方程1、金属的物理性质(1)观察镁、铝、铁、铜的颜色和光泽(2)铜片和铝片、铜片和黄铜片(或白铜片)互相刻画(3)请你设计并进行实验,证明金属具有导电性(或导热性、延展性)。
__________________________________________ 2、金属的化学性质(1)用坩埚钳夹取一块铜片,放在酒精灯火焰上加热,观察铜片表面的变化。
(2)向5支试管中分别放入少量镁条、铝片、锌粒、铁片、铜片,然后分别加入5mL稀盐酸(或稀硫酸),观察现象。
如果有气体生成,判断生成的气体是什么。
镁、铝、铁是__色,铜是_____色的铜片在铝片上留__痕迹,黄铜片(或白铜片)在铜片上____痕迹_____________铜片表面变___镁:___反应,产生_____,__热,镁条_____铝:___反应,产生_____, 铝片_____锌:产生______,锌粒_____铁:产生______,溶液由__色变成____色,铁片铜:__________金属都有_______,大多数是____色的铜的硬度比铝___,黄铜片(或白铜片)的硬度比铜__________________铜能与____反应_______________金属镁、铝、锌、铁___与稀盐酸或稀硫酸反应生成氢气,铜与稀盐酸或稀硫酸___反应(3)请你设计并进行实验,比较铁、铜、银的金属活动性强弱。
_____________________ _____________________讨因为铁粉比较____,光学原因造成___反射,有很少的光可以进入我们的眼睛,所以铁粉显黑色。
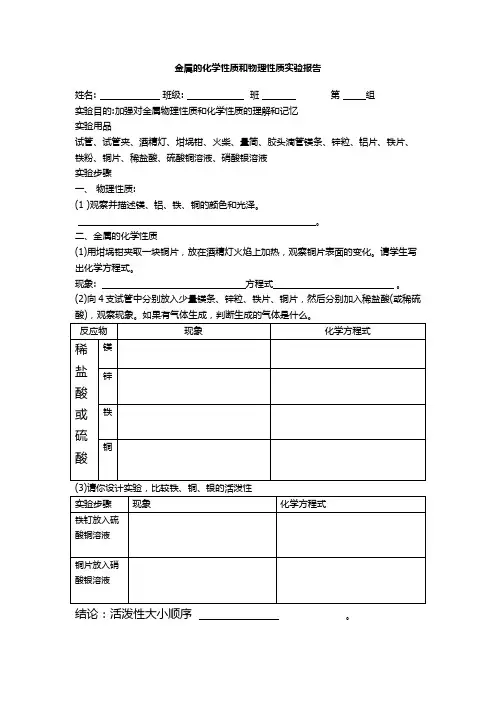
金属的化学性质和物理性质实验报告
姓名: 班级: 班第组
实验目的:加强对金属物理性质和化学性质的理解和记忆
实验用品
试管、试管夹、酒精灯、坩埚钳、火柴、量简、胶头滴管镁条、锌粒、铝片、铁片、铁粉、铜片、稀盐酸、硫酸铜溶液、硝酸银溶液
实验步骤
一、物理性质:
(1 )观察并描述镁、铝、铁、铜的颜色和光泽。
二、金属的化学性质
(1)用坩埚钳夹取一块铜片,放在酒精灯火焰上加热,观察铜片表面的变化。
请学生写出化学方程式。
现象: 方程式。
(2)向4支试管中分别放入少量镁条、锌粒、铁片、铜片,然后分别加入稀盐酸(或稀硫
(3)请你设计实验,比较铁、铜、银的活泼性
结论:活泼性大小顺序。

化学六年级金属的物理性质与化学性质实验一、金属的物理性质1. 密度金属的物理性质之一是密度。
密度是单位体积内所含质量的量度,通常以克/厘米³或克/毫升来表示。
金属一般具有较高的密度,比如铁、铜等金属的密度相对较大。
密度的大小与金属中原子的质量有关,质量越大,密度越大。
2. 熔点金属的熔点是指金属物质在加热过程中从固态转变为液态的温度。
不同金属的熔点范围各不相同。
例如,铁的熔点约为1535℃,而铜的熔点约为1083℃。
金属的熔点常常用作判定矿石中的金属成分的重要依据。
3. 导电性金属具有良好的导电性。
这是由于金属中的自由电子能够在金属内部自由运动以及在外部电场的作用下形成电流。
该性质使得金属常被用来制造电线、电器等导电材料。
另外,金属还具有较低的电阻率,使得电流能够在金属内部迅速传导。
4. 导热性金属材料具有良好的导热性。
金属内部的自由电子能够传导热量,使得金属成为非常适合制作热导体的材料。
例如,铝是一种常用的热导体,具有较高的热传导能力。
这种导热性质使得金属材料常被应用于散热器、锅具等领域。
二、金属的化学性质1. 氧化反应金属与氧气反应会形成金属氧化物,这被称为氧化反应。
不同金属与氧气进行氧化反应的速度各不相同。
例如,钠在与氧气反应时会迅速燃烧,产生白色固体氧化钠。
而金属铝则与氧气反应较为缓慢,生成氧化铝。
氧化反应是金属腐蚀的一种表现。
2. 酸和金属的反应金属与酸反应会生成盐和氢气。
这是一种常见的化学性质。
一些活泼金属,比如钠、镁等,在与酸反应时会迅速放出氢气。
例如,将镁与盐酸反应可以观察到产生气泡的现象,同时生成氯化镁和氢气。
然而,并非所有金属都会与酸产生反应,一些稳定性较高的金属如铜、银等通常不与酸发生反应。
3. 金属与水的反应某些金属与水反应也会产生氢气。
例如,将钠投入水中,会观察到剧烈的反应,并有大量氢气释放。
反应还会生成氢氧化钠。
一些金属如铝、锌等也会与水反应,但反应速率较慢。

实验活动4:金属的物理属性和某些化学属性学生实验报告单实验目的:探究金属的物理属性和某些化学属性,以加深对金属特性的理解和认识。
实验材料:1. 不锈钢片2. 钢丝3. 铝片4. 铜片5. 锌片6. 铁片7. 粗砂纸8. 表面清洁剂9. 腐蚀试剂(如盐酸或硫酸)10. 导线11. 电池12. 电灯泡13. 开关实验步骤:1. 利用粗砂纸和表面清洁剂将金属片表面清洁干净。
2. 将每种金属片分别连上一个导线,并将导线的另一头连接到电灯泡的两个接线口。
3. 将电灯泡连接到电池,并打开开关,观察电灯泡是否亮起。
4. 使用腐蚀试剂将每种金属片分别腐蚀,观察金属片的变化。
5. 记录电灯泡亮灭和金属片的变化情况。
实验结果:通过实验观察和实验记录,我们得出以下结论:1. 在电池的作用下,能够导电的金属片可以使电灯泡亮起,而不能导电的金属则不会。
2. 金属片在与腐蚀试剂接触后,可能会发生氧化、腐蚀或其他化学反应,导致表面出现变化。
实验结论:金属的物理属性包括导电性,导电性好的金属可以使电流通过,使电灯泡亮起;金属的化学属性包括与腐蚀试剂接触后的反应,可能会导致金属腐蚀或氧化。
这些实验结果对于我们的日常生活和工业应用有重要意义,有助于我们更好地了解和使用金属。
实验注意事项:1. 实验过程中要注意安全,避免触电或腐蚀性试剂的接触。
2. 保持实验环境整洁,避免杂物干扰实验结果。
3. 实验结束后,按要求归还实验器材,并清理实验场地。
附录:实验记录表:以上实验记录仅为示范,具体实验记录请根据实际实验结果填写。
参考文献:[1] 实验活动4:金属的物理属性和某些化学属性,化学课程教学辅助资料。
[2] 理论与实践结合中金属的物理性质和化学性质研究,中国金属学会,2010。
实验活动4 金属的物理性质和某些化学性质
【实验目的】
1.巩固和加深对金属性质的认识。
2.培养实验设计能力。
【实验用品】
试管、试管夹、酒精灯、坩埚钳、电池、导线、小灯泡、火柴、开关。
镁条、锌粒、铝片、铁片、铜片、黄铜片、稀盐酸、稀硫酸、硫酸铜溶液、硝酸银溶液。
【实验步骤】
1.金属的物理性质
(1)观察并描述金属的颜色和光泽:镁________、铝________、铁________、铜________,金属都具有________。
(2)比较铜片和铝片、铜片和黄铜片的硬度,可以得出金属的硬度比合金的________。
(3)设计实验验证金属具有的物理性质:
2.金属的化学性质
(1)用坩埚钳夹取一块铜片,放在酒精灯火焰上加热,可看到
__________________,反应的化学方程式为____________________。
(2)金属与稀酸的反应:
(3)比较铁、铜、银的金属活动性强弱:
【问题与交流】
铁是银白色金属,而铁粉是黑色的,为什么?
【反思、拓展与评价】
教师或小组评价:
________________________________________________________________________。
实验活动4:金属的物理特性和某些化学特性学生实验报告单实验目的本实验旨在研究金属的物理特性和某些化学特性,通过实验了解金属的导电性、热传导性、弹性等物理特性,以及金属与非金属氧化物反应的化学特性。
实验材料和设备- 金属样品:铜、铁、铝- 试剂:硝酸铜、硝酸铁、硝酸铝- 试管、试管架、试管夹- 温度计- 火焰- 细砂纸实验步骤1. 按照实验要求,取一小块铜样品、铁样品和铝样品,使用细砂纸将其表面擦拭干净,去除氧化层。
2. 将铜样品放入试管中,加入少量硝酸铜。
3. 将铁样品放入试管中,加入少量硝酸铁。
4. 将铝样品放入试管中,加入少量硝酸铝。
5. 观察三个试管中的反应情况,记录下变化现象。
6. 分别使用温度计测量铜、铁、铝的初始温度。
7. 将铜、铁、铝样品分别放入火焰中加热一段时间,然后立即用温度计测量其最高温度。
8. 观察金属在受热后的变化,记录下变化现象。
9. 将实验后的金属样品清洁干净,归还实验室。
实验数据和结果实验讨论1. 根据实验结果可知,铜和铁与硝酸铜、硝酸铁反应产生气体,而铝与硝酸铝无反应。
这说明铜和铁具有较强的还原性,可以与非金属氧化物发生反应。
2. 金属的热传导性能与其电导性能一样重要,通过加热金属样品可以观察到其最高温度的变化。
在实验中,铁样品的最高温度明显高于铜和铝样品,说明铁的热传导性能较好。
3. 在实验过程中,需要注意使用火焰时的安全操作,避免发生意外事故。
4. 实验中的数据和结果仅代表本次实验的情况,不具备普适性。
结论通过本次实验,我们了解了金属的物理特性和某些化学特性。
铜和铁具有较强的还原性,可以与非金属氧化物发生反应,而铝则在本实验条件下未发生反应。
通过加热金属样品,可以观察到其热传导性能的差异。
实验结果有助于增加对金属性质的认识和理解。
参考文献[1] 实验教学课件,XXX大学化学实验教学。