水的相图2
- 格式:doc
- 大小:153.50 KB
- 文档页数:5
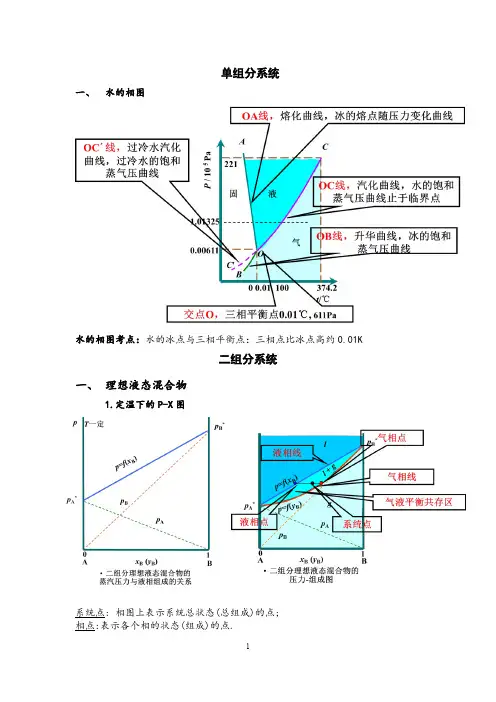
单组分系统一、水的相图水的相图考点:水的冰点与三相平衡点:三相点比冰点高约0.01K二组分系统一、理想液态混合物1.定温下的P-X图系统点: 相图上表示系统总状态(总组成)的点;相点:表示各个相的状态(组成)的点.结线:两个平衡相点的连结线.系统点总是在结线上2.定压下的T-X图泡点: 液相升温至开始起泡沸腾的温度;露点: 气相降温至开始凝结的温度.两点之间为相变温度区间, 与系统总组成有关.精馏原理:将液态混合物同时经多次部分气化和部分冷凝而使之分离的操作称为精馏。
同一层隔板上, 自下而上的有较高温度的气相与反方向的较低温度的液相相遇. 通过热交换,气相部分冷凝, 液相则部分气化.二、非理想液态混合物1.二组分真实液态混合物的4种类型的P-X图关于正偏差:若两组分分子间的吸引力小于各纯组分分子间吸引力,形成混合物后,分子就容易逸出液面而产生正偏差.若纯组分有缔合作用,在形成混合物后发生离解,因分子数增多而产生正偏差.混合时常有吸热及体积增大现象.关于负偏差:若两组分分子间的吸引力大于各纯组分分子间吸引力,形成混合物后,分子就较难逸出液面而产生负偏差.若形成混合物后分子发生缔合,因分子数减少而产生负偏差.混合时常有放热及体积缩小现象.2. 二组分真实液态混合物的4种类型的T-X图恒沸点处气相组成和液相组成相同。
此点对应的自由度数为0.一般正偏差和一般负偏差系统的温度-组成相图与理想系统的类似.3.部分互溶系统部分互溶的情况:系统会以两个饱和溶液平衡共存,这两个液层称为共轭溶液. 当混合物组成未达到两组分的相互溶解度时, 系统都以均相存在。
将具有两个液层的系统升高或降低至某个温度,两个液层的界面消失而成为一个液相,这个温度叫做最高或最低会溶温度。
4. 二组分液态完全互溶向部分互溶过渡5. 二组分液态部分互溶向完全不互溶过渡6. 完全不互溶三、二组分固-液平衡体系1.固态完全不互溶系统2.热分析法冷却曲线出现平台的原因:释放的凝固热抵消了因冷却而散失的热量出现最低点:因最初非常微细的晶体难以析出,过冷现象导致斜率变小的原因:固态Bi析出所释放的凝固热部分抵消了降温过程散失的热量低共熔温度、低共熔混合物3.溶解度法4.固态部分互熔系统5.固态完全互熔系统晶内偏析:退火:淬火:6.生成稳定化合物的系统注:若化合物数目有N种,则其相图就被看作是由(N+1)个简单低共熔点的固态不互溶系统的相图组合而成。


水的相图在通常压力下,水的相图为单组分系统中最简单的相图。
在此系统中只有一个相存在时,即水以气相或液相或固相存在时,系统的自由度数f=2,即温度、压力均可变更。
因此,在T-p图上有三个面各代表这三个相。
在此系统中可能存在的两相平衡有三种情形,即(1)液-气平衡,(2)固-气平衡,(3)固-液平衡;此时系统的自由度数f=1,即T和p 只有一个能任意变更。
因此,在T-p图上有三条线各代表上述三种两相平衡。
在此系统中可能存在的三相平衡为固-液-气三相平衡;此时系统的自由度数f=0,即T和p均已一定,不能变更。
因此,在T-p图上有一个三相点。
虽然根据相律指出了水的相图的大概情况只是所有的线和点的具体位置却不能由相律指出,必须依靠实验来测定。
水的相图的具体形状见下图。
其中OA线是液-气平衡线,即水的蒸气压曲线;OB线是固-气平衡线,即冰的蒸气压曲线;OB线是固-气平衡线,即冰的蒸气压曲线;OC线是固-液平衡线;O点是冰-水-气三相平衡的三相点,从图可以看出,此时的温度和压力均已一定,温度为0.0098℃压力为609Pa。
此图与相律所指示的完全一致,即有三个单相面,三条两相平衡线,一个三相点。
水的蒸气压曲线OA向上不能无限地延伸,只能延伸到水的临界点,因为在该点以上,液态水将不复存在。
水的临界点的温度为374℃;压力为2.23×107Pa。
OA线超过三相点O向下延伸所形成的OF线代表过冷水与蒸气的平衡,因此OF线为不稳定的液-气平衡线,此种液-气平衡系统处于介稳状态,只要稍受干扰,如受到搅动或有小冰块投入系统,立即就会有冰析出。
由上图可以看出,过冷水的饱和蒸气压大于冰的饱和蒸气压,即OF线比OB线略高。
OB线向下可延伸到绝对零度。
向上延伸不能超过三相点O,因为不存在过热的冰。
OC线向上可延伸到2×108Pa和-20℃左右。
压力再增加,将出现另外的冰晶型,本图中不再介绍由图可以看出,OA、OB线的斜率为正值,而OC线的斜率为负值。



§1水的相变及相图返回概述1.水蒸气是热力工程中最为常见的工质在18世纪发明的蒸气机,水蒸气是唯一的工质,直到内燃机发明,才有了燃气工质。
尽管在各种热力设备或系统中,已采用了其他物质作为工质,如空气、各种制冷剂、燃气等等,但水蒸气目前仍是暖通、火力发电、核电、化工等行业热力设备或系统中最为普遍采用的工质。
作为工质,水蒸气具备:来源丰富,耗资少,无毒无味,比热容大,传热好,良好的膨胀和载热性能等优点。
2.水蒸气是实际气体水蒸气在工程应用中,一般处于离液态不远的状态,是一种实际气体。
只有在空气中,由于其含量极小,可视作理想气体处理。
在热力设备或系统工作过程中,涉及到物质的聚集态主要是液态和气态。
那么,对于非理想气体的性质及其热力过程如何分析呢?本章将以水蒸汽为例,说明实际气体热力性质的基本特点和确定方法、参数计算以及基本热力过程分析的基本方法。
重点内容:了解实际气体热力性质的基本特点,与理想气体的区别所在。
一、纯物质聚集态的变化纯物质通常以三种聚集态固相、液相及气相状态存在。
1.纯物质聚集态的变化融解与凝固→固态与液态;汽化与凝结→液态与气态;升华与凝华→固态与气态。
2.聚集态变化的影响因素纯物质种类、压力、温度二、纯物质的p-t相图1. p-t相图指在p-t图上,纯物质在发生聚集态变化时压力及温度的变化规律。
如图7-2所示。
注意:(1)三相点是三条相平衡曲线的交点。
(2)临界点以上区域(虚线以上区域,即温度及压力均高于临界点温度及压力)为气液相不分或共存区域,只体现流体的特性。
(3)多数物质压力增大将使凝固点温度增加。
但对于水等少数物质,压力的增大将使其凝固点温度降低。
图7-2 纯物质的p-t相图2.几个基本概念(1)三相点与临界点(每种纯物质的三相点与临界点的压力和温度都是唯一确定的。
)临界状态(临界点):临界点(状态)是气-液共存的状态,而且气、液的状态参数值相同,例如具有相同的比容、密度等等。



2 液、固相化学势表达式 纯液体(或固体)物质B 的标准状态规定为同温度,标准压力时纯液体(或固体)物质B 的状态。
即O Bμ(l, T )= *B μ(l, T, O p ) (2—23a) 于是纯液体(或固体)物质B 的化学势为*B μ(l, T , p ) =O B μ(l, T )+p V pp d )l (O m B,⎰ (2—23b) 实际上,在处理液体(或固体)问题时常用与液相平衡的气相化学势来表示。
考虑纯物质气-液、气-固两相平衡系统,根据两相平衡时化学势相等的关系,可以用气相的化学势来表示液相或固相的化学势。
如果将气体视为理想气体其化学势为O Oln ) (g,), (g,p p RT T p T **+=μμ 与之平衡的液相或固相的化学势为=*), (l ,p T μO Oln ) (g,),(g,p p RT T p T **+=μμ (2—24a ) =*), (s ,p T μO Oln ) (g,), (g,p p RT T p T **+=μμ (2—24b ) 上式中p *是与液(或固)相平衡的蒸气的压力,称为饱和蒸气压,此两相平衡系统中在液体(或固体)上面除了其蒸气外别无他物,这时系统的压力就是蒸气压p *。
3* 外压对蒸气压的影响 如果气相中混有其它惰性气体,这时系统的压力p >p *,由于μ(T , p , l) -μ(T , p *, l)=⎰*pp p V (l)d m若以*e p 表示外压为p 时的饱和蒸气压,则利用上面液相化学势表达式可得**pp RT e ln =⎰*p p p V (l)d m , 如果V m (l)与p 无关则 )((l)ln m ***-=p p RT V p p e (2—25) 由于V m (l)很小,所以在外压增加时,液体(或固体)的蒸气压会略有上升。
二 两相平衡时温度与压力的关系1 Clapeyron 方程 在T 、p 一定的条件下,纯物质两相平衡系统 , βμ=αμ 。


水的相图众所周知,水有三种不同的聚集状态。
在指定的温度、压力下可以互成平衡,即在特定条件下还可以建立其的三相平衡体系。
表5-1的实验数据表明了水在各种平衡条件下,温度和压力的对应关系。
水的相图(图5-2)就是根据这些数据描绘而成的。
表5-1水的压力~温度平衡关系温度(℃)体系的水蒸气压力(kPa)(kPa) (kPa) (kPa)-20 -15 -10-5 0.00989 +20 +100 374--0.1910.2860.4210.6102.338101.32.204x1040.1030.1650.2590.4010.610------1.996x1051.611x1051.145x1046.18x1040.6101.两相线:图中三条曲线分别代表上述三种两相平衡状态,线上的点代表两相平衡的必要条件,即平衡时体系温度与压力的对应关系。
在相图中表示体系(包含有各相)的总组成点称为"物系点",表示某一相的组成的点称为"相点",但两者常通称为"状态点"。
OA 线是冰与水气两相平衡共存的曲线,它表示冰的饱和蒸气压与温度的对应关系,称为"升华曲线",由图可见,冰的饱和蒸气压是随温度的下降而下降。
OC 线是(蒸)气与液(水)两相平衡线,它代表气~液平衡时,温度与蒸气压的对应关系,称为"蒸气压曲线"或"蒸发曲线"。
显然,水的饱和蒸气压是随温度的增高而增大,F点表示水的正常沸点,即在敞开容器中把水加热到100℃时,水的蒸气压恰好等于外界的压力(),它就开始沸腾。
在压力下液体开始沸腾的温度称其为"正常沸点"。
OB 线是固(冰)与液(水)两相平衡线,它表示冰的熔点随外压变化关系,故称之为冰的"熔化曲线"。
熔化的逆过程就是凝固,因此它又表示水的凝固点随外压变化关系,故也可称为水的"凝固点曲线"。
典型相图举例分析(一)水的相图众所周知,水有三种不同的聚集状态。
在指定的温度、压力下可以互成平衡,即在特定条件下还可以建立其的三相平衡体系。
表5-1的实验数据表明了水在各种平衡条件下,温度和压力的对应关系。
水的相图(图5-2)就是根据这些数据描绘而成的。
表5-1 水的压力~温度平衡关系1.两相线:图中三条曲线分别代表上述三种两相平衡状态,线上的点代表两相平衡的必要条件,即平衡时体系温度与压力的对应关系。
在相图中表示体系(包含有各相)的总组成点称为"物质点",表示某一相的组成的点称为"相点",但两者常通称为"状态点"。
OA 线是冰与水气两相平衡共存的曲线,它表示冰的饱和蒸气压与温度的对应各相,称为"升华曲线",由图可见,冰的饱和蒸气压是随温度的下降而下降。
OC 线是(蒸)气与液(水)两相平衡线,它代表气~液平衡时,温度与蒸气压的对应关系,称为"蒸气压曲线"或"蒸发曲线"。
显然,水的饱和 蒸气压是随温度的增高而增大,F 点表示水的正常沸点,即在敞开容器中发水加热到 100℃ 时,水的蒸气压恰好等于外界的压力(),它就开始沸腾。
在压力下液体开始沸腾的温度称其为"正常沸点"。
OB 线是固(冰)与液(水)两相平衡线,它表示冰的熔点随外压变化关系,故称之为冰的"熔化曲线"。
熔化的逆过程就是凝固,因此它又表示水的凝固点随外压变化关系,故也可称为水的"凝固点曲线"。
该线甚陡,略向左倾,斜率呈负值,意味着外压剧增,冰的熔点仅略有降低,大约是每增加1个,下降 0.0075℃ 。
水的这种行为是反常的,因为大多数物质的熔点随压力增加而稍有升高。
在单组分体系中,当体系状态点落在某曲线上,则意味体系处于两相共存状态,即Ф =2,f = 1。
这说明温度和压力,只有一个可以自由变动,另一个随前一个而定。
关于两相线的分析以及斜率的定量计算将在"克拉贝龙方程式"讨论。
必须指出,OC线不能向上无限延伸,只能到水的临界点即374℃ 与22.3×103kPa 为止,因为在临界温度以上,气、液处于连续状态。
如果特别小心,OC线能向下延伸如虚线OD所示,它代表未结冰的过冷水与水蒸气共存,是一种不稳定的状态,称为"亚稳状态"。
OD线在OA线之上,表示过冷水的蒸气压比同温度下处于稳定状态的冰蒸气压大,其稳定性较低,稍受扰动或投入晶种将有冰析出。
OA线在理论上可向左下方延伸到绝对零点附近,但向右上方不得越过交点O,因为事实上不存在升温时该熔化而不熔化的过热冰。
OB线向左上方延伸可达二千个压力左右,若再向上,会出现多种晶型的冰,称为"同制多晶现象",情况较复杂,后面将简单提及。
2.单相面:自图5-2,三条两相线将坐标分成三个区域;每个区域代表一个单相区,其中AOC为气相区,AOB为固相区,BOC为液相区。
它们都满足Ф =1,f = 2,说明这些区域内T、p均可在一定范围内自由变动而不会引起新相形成或旧相消失。
换句话说要同时指定T、p两个变量才能确定体系的一个状态。
另外从图中亦可推断,由一个相变为另一相未必非得穿过平衡线;如蒸气处于状态点M经等温压缩到N点,再等压降温至h,最后等温降压到P点,就能成功地使蒸气不穿过平衡线而转变到液体水。
3.三相点:①:三条两相线的交点O是水蒸气、水、冰三相平衡共存的点,称为"三相点"。
在三相点上Ф =3,f =0,故体系的稳定、压力皆恒定,不能变动。
否则会破坏三相平衡。
三相点的压力p = 0.61kPa ,温度T= 0.00989℃,这一温度已被规定为 273.16K,而且作为国际绝对温标的参考点。
值得强调,三相点温度不同于通常所说的水的冰点,后者是指敞露于空气中的冰~水两相平衡时的温度,在这种情况下,冰~水已被空气中的组分(CO2、N2、O2等)所饱和,已变成多组分体系。
正由于其它组分溶入致使原来单组分体系水的冰点下降约0.00242℃;其次,因压力从 0.61kPa 增大到 101.325kPa,根据克拉贝龙方程式计算其相应冰点温度又将降低0.00747℃,这两种效应之和即0.00989℃ ≈ 0.01℃(或273.16K )就使得水的冰点从原来的三相点处即0.00989℃ 下降到通常的0℃(或 273.15K)。
图5-2 为低压下相图,有一个三相点,而在高压下水可能出现同质多晶现象,因此在水的相图上就不止存在一个三相点(图5-3),不过这些三相点不出现蒸气相罢了。
水在高压下共有六种不同结晶形式的冰,即Ⅰ、Ⅱ、Ⅲ、Ⅴ、Ⅵ、Ⅶ(普通冰以Ⅰ表示,冰Ⅳ不稳定),表5-2列出高压下水各三相点的温度和压力。
图5-3 水在高压下的相图图5-2 水的相图至此我们已明了相图中点、线、面之意义,于是可借助相图(图5-2)来分析指定物系当外界条件改变时相变化的情况。
例如,101.325kPa,-40℃ 的冰(即Q点),当恒压升温,最终达到250℃(即J点)。
其中物系点先沿着QJ线移动,此时先在单一固相区内,由相律可知f * = 1,故温度可不断上升。
当抵达 G 点,即固~液两相线时,冰开始熔化,冰点不变 f *= 0,直到冰全部变成液态水。
继续升温,状态点进入液态水的相区又恢复 f *= 1,故可右移升温至 F 点,它位于水的蒸发曲线上,故水开始汽化,沸点不变即 f *= 0,直到液态水全部变成水蒸气。
继续升温右移,f *= 1 即进入水的气相区,最后到终点 J 。
表5-2 水在各三相点时的温度和压力(二)硫的相图硫有四种不同的聚集状态;固态的正交(或斜方)硫(R),固态的单斜硫(M),液态硫(I)和气态硫(g)),分别表明在图5-4硫的相图中。
已知单组分体系不能超过三个相,故上述四个相不可同时存在。
硫的相图中有四个三相点:B 、C 、E 、O ,各点代表的平衡体系如下:9.33×10-4kPa6.67×10-3kPa172.0kPa3.47×10-3kPa95.4℃ 119.3℃151.0℃113.0℃如图所示,各实线为其相邻两相共存平衡线。
可以看出,在室温下斜方硫(R)是稳定的。
由于晶体转变是个慢过程,故只能徐缓加热到 95.4℃ 时斜方硫才逐渐转变为单斜硫,一旦加热太快,则可使斜方硫以介稳态平衡到它的熔点(113.0℃)而不必经过单斜硫。
95.4℃ 以上单斜硫是稳定的,于119.3℃ 开始溶解。
在95.4℃ 时两种不同晶型的固体(R 和 M)与硫蒸气平衡共存,此温度称为"转变温度",因它处于斜方硫和单斜硫熔点以下,故转变可以在任一方向进行,即相转变是可逆的,这种相转变叫做对称异构(双变)现象的同质多晶体转变,简称多晶体中的"互变现象",但也有许多物质其晶型转变是不可逆的,即只能朝一个方向变化。
此类物质的熔点比转变温度低,故在物质未达到转变温度之前就溶解了,这种相转变称之单变现象的同质多晶型转变,例如磷就表现出此类性质。
图中虚线OB代表介稳平衡,此即过热斜方硫的蒸气压曲线。
若加热太快,题字可超过95.4℃,沿BO线上升而不转变为单斜硫。
虚线OE代表介稳平衡,即过热斜方硫的熔化曲线。
虚线OC代表 S介稳平衡,即过冷液硫的蒸气压曲线,虚线BH代表介稳平衡,即过冷单斜硫的蒸气压曲线。
i>D 点为临界点,高于此点温度只有气相存在。
(三)的相图图5-5(a)为的相图。
它与已知的任何其它单组分体系的相图在许多方面都不相同。
首先,在常压下及时温度低到 10-3K,仍保持为液态。
目前所知具有这种特性的物质只有 He 。
当温度趋于 0K 时,液态在其本身的蒸气压下也不凝结,故不存在气、液、固三相平衡共存的三相点。
固态在 2.53MPa 以上才能存在。
这个压力比它的临界压力 0.228MPa 高得多,因而固体不可能发生升华。
即不存在固、气平衡共存的状态。
的另一特征是存在两种液体,He(I) 是正常液体,He(II) 是超流液体(无粘滞性),它能经过细小到连气都通不过的缝隙从容器中漏出。
两液体平衡共存的线称为λ线,该线与熔化线的交点 A 是个三相点(1.76K,30.03MPa),此时两液体与固体平衡共存。
λ线与蒸气压线的交点 B 称为λ点(2.17K,5.04KPa),在此点两液体与蒸气三相平衡共存。
从 A 点沿λ线到 B 点,He(I) 与 He(II) 的转变看来是连续相变。
因为它的热容随温度的变化曲线具有连续相变的特有的λ形状。
如图5-5(b)的相图表明,但T→ 0 时,气-液共存线的斜率,这是热力学第三定律的一个推论。
因此,它为热力学第三定律提供了一个很好的例证。
尽管有许多奇特的行为,但它的相图仍遵从相律。
它可看成是以两个三相点A,B为中心的两个基本相图组合而成的。
图中 C 为临界点(5.20K,0.228MPa),的正常沸点为 4.22K。
由图可看出,气能通过适当路径不经相变二过渡到 He(I),但不能到 He(II) 。