溶解性与沸点
- 格式:doc
- 大小:28.50 KB
- 文档页数:8

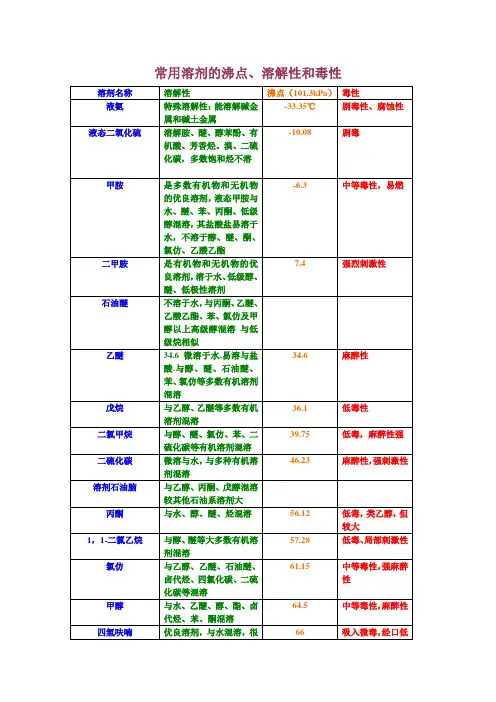
常用溶剂的沸点、溶解性和毒性溶剂名称沸点(101.3kPa)溶解性毒性液氨-33.35℃特殊溶解性:能溶解碱金属和碱土金属剧毒性、腐蚀性液态二氧化硫-10.08 溶解胺、醚、醇苯酚、有机酸、芳香烃、溴、二硫化碳,多数饱和烃不溶剧毒甲胺-6.3 是多数有机物和无机物的优良溶剂,液态甲胺与水、醚、苯、丙酮、低级醇混溶,其盐酸盐易溶于水,不溶于醇、醚、酮、氯仿、乙酸乙酯中等毒性,易燃二甲胺7.4 是有机物和无机物的优良溶剂,溶于水、低级醇、醚、低极性溶剂强烈刺激性石油醚不溶于水,与丙酮、*****、乙酸乙酯、苯、氯仿及甲醇以上高级醇混溶与低级烷相似***** 34.6 微溶于水,易溶与盐酸.与醇、醚、石油醚、苯、氯仿等多数有机溶剂混溶*****性戊烷36.1 与乙醇、*****等多数有机溶剂混溶低毒性员?婷疋0?二氯甲烷39.75 与醇、醚、氯仿、苯、二硫化碳等有机溶剂混溶低毒,*****性强二硫化碳46.23 微溶与水,与多种有机溶剂混溶*****性,强刺激性溶剂石油脑与乙醇、丙酮、戊醇混溶较其他石油系溶剂大丙酮56.12 与水、醇、醚、烃混溶低毒,类乙醇,但较大1,1-二氯乙烷57.28 与醇、醚等大多数有机溶剂混溶低毒、局部刺激性氯仿61.15 与乙醇、*****、石油醚、卤代烃、四氯化碳、二硫化碳等混溶中等毒性,强*****性甲醇64.5 与水、*****、醇、酯、卤代烃、苯、酮混溶中等毒性,*****性四氢呋喃66 优良溶剂,与水混溶,很好的溶解乙醇、*****、脂肪烃、芳香烃、氯化烃吸入微毒,经口低毒己烷68.7 甲醇部分溶解,比乙醇高的醇、醚丙酮、氯仿混溶低毒。
*****性,刺激性三氟代乙酸71.78 与水,乙醇,*****,丙酮,苯,四氯化碳,己烷混溶,溶解多种脂肪族,芳香族化合物1,1,1-三氯乙烷74.0 与丙酮、、甲醇、*****、苯、四氯化碳等有机溶剂混溶低毒类溶剂四氯化碳76.75 与醇、醚、石油醚、石油脑、冰醋酸、二硫化碳、氯代烃混溶氯代甲烷中,毒性最强乙酸乙酯77.112 与醇、醚、氯仿、丙酮、苯等大多数有机溶剂溶解,能溶解某些金属盐低毒,*****性乙醇78.3 与水、*****、氯仿、酯、烃类衍生物等有机溶剂混溶微毒类,*****性丁酮79.64 与丙酮相似,与醇、醚、苯等大多数有机溶剂混溶低毒,毒性强于丙酮苯80.10 难溶于水,与甘油、乙二醇、乙醇、氯仿、*****、、四氯化碳、二硫化碳、丙酮、甲苯、二甲苯、冰醋酸、脂肪烃等大多有机物混溶强烈毒性乙睛81.60 与水、甲醇、乙酸甲酯、乙酸乙酯、丙酮、醚、氯仿、四氯化碳、氯乙烯及各种不饱和烃混溶,但是不与饱和烃混溶中等毒性,大量吸入蒸气,引起急性中毒异丙醇82.40 与乙醇、*****、氯仿、水混溶微毒,类似乙醇1,2-二氯乙烷83.48 与乙醇、*****、氯仿、四氯化碳等多种有机溶剂混溶高毒性、致癌乙二醇二甲醚85.2 溶于水,与醇、醚、酮、酯、烃、氯代烃等多种有机溶剂混溶。


一些常用化学品物性介绍化学品的物性是指该化学品的物理和化学特性,包括外观、密度、熔点、沸点、溶解性、稳定性等。
以下是一些常见化学品的物性介绍。
1.水(H2O):-外观:无色透明液体- 密度:1 g/cm³-熔点:0℃-沸点:100℃-溶解性:能溶解许多物质,是极好的溶剂-稳定性:作为一种天然分子,水非常稳定2.乙醇(C2H5OH):-外观:无色液体- 密度:0.789 g/cm³-熔点:-114℃-沸点:78℃-溶解性:乙醇具有极好的溶解性,可以与水和许多有机溶剂混溶-稳定性:能被加热和燃烧,但易被氧化3.苯(C6H6):-外观:无色液体- 密度:0.874 g/cm³-熔点:5.5℃-沸点:80.1℃-溶解性:能与其他有机溶剂混溶,但与水的溶解性相对较差-稳定性:苯在空气中相对稳定,但容易被氧化,生成苯酚4.氯气(Cl2):-外观:黄绿色气体-密度:3.2g/L-熔点:-101℃-沸点:-34℃-溶解性:能够溶于水,生成氢氯酸-稳定性:氯气在室温下相对稳定,但与一些物质如金属和有机物反应强烈,易发生爆炸5.硫酸(H2SO4):-外观:无色液体- 密度:1.84 g/cm³-熔点:10℃-沸点:337℃-溶解性:能与水剧烈反应,产生大量热量,是一种强酸-稳定性:硫酸具有强腐蚀性,应小心存放和处理6.盐酸(HCl):-外观:无色气体或无色液体(浓缩时)- 密度:1.49 g/cm³(浓缩时)-熔点:-26℃-沸点:-85℃-溶解性:盐酸能与水剧烈反应,生成氢氯酸-稳定性:盐酸具有强酸性和腐蚀性,应小心存放和处理以上只是一些常见化学品的物性介绍,每种化学品都有具体的物性数据,这些数据对于化学实验、工业生产和风险评估等方面都非常重要。
在使用化学品时,需要谨慎处理,遵守相应的操作规程和安全措施。


物质结构与性质高考热点归纳物质熔沸点、溶解性、稳定性等性质的比较物质溶沸点的比较一、先将物质分类:从物质的晶体类型上一般分为分子晶体,离子晶体,原子晶体和金属晶体。
不同物质类别熔沸点的比较方法不同。
一般情况下:原子晶体﹥离子晶体﹥分子晶体。
金属晶体有常温是液态的汞和熔点高达三千多摄氏度的钨。
1.对于分子晶体:a.结构相似时,相对分子质量越大分子间作用力越强其熔沸点越高。
如:CH4﹤SiH4﹤GeH4;CH4﹤C2H6﹤C3H8﹤C4H10b.能形成分子间氢键时熔沸点陡然增高。
如:H2O﹥H2Te﹥H2Se﹥H2S(能形成氢键的元素有N、O、F,如HF 、H2O、NH3,低级醇、醛、酸与水均能形成氢键) 。
c.当形成分子内氢键时熔沸点降低。
如:邻羟基甲苯的熔沸点低于对羟基甲苯。
d.对于烃类物质碳原子数相同时支链越多熔沸点越低。
2.对于离子晶体:a、要看离子半径的大小和离子所带电荷的多少,离子半径越小,离子所带电荷越多则离子键越强晶格能越大熔沸点越高。
如:KCl﹤NaCl﹤MgO (注意:NaCl、MgCl2晶体中离子排列方式不同,不能简单得出熔沸点NaCl﹤MgCl2,实际上刚好相反。
有些参考书上熔沸点NaCl﹤MgCl2是错误的,根据所学知识无法比较。
)3.原子晶体:要看原子半径的大小,原子半径越小,则键长越短,导致键能越大,熔沸点越高。
如:金刚石﹥碳化硅﹥单晶硅(注意:金刚石、碳化硅、硅原子晶体中原子排列方式相同,但与二氧化硅不同,不能简单得出二氧化硅熔沸点的位置。
有些参考书上熔沸点金刚石﹥二氧化硅﹥碳化硅﹥单晶硅是错误的,根据所学知识无法比较。
)例:C60与金刚石的熔点比较,不应该从键长角度比较。
因为C60是分子晶体,熔沸点由分子间作用力决定。
C60熔点应该比金刚石的熔点低很多。
4.金属晶体:一般比金属离子的半径和金属阳离子所带电荷的多少(教材:单位体积内自由电子数目的多少)。
如Na﹤Mg﹤Al二、从物质在常温常压下的状态去分析。


有机物的物理性质规律有机物是指含有碳元素并与氢、氧、氮等元素形成碳氢化合物或含有醇、醚、酮、酸等官能团的化合物。
在自然界中广泛存在着各种有机物,它们不仅构成了生命的基本组成部分,也有着丰富的物理性质。
本文将探讨有机物的一些常见的物理性质规律。
一、溶解性有机物的溶解性是指其在溶剂中的溶解程度。
根据有机物的溶解性特点,可以将其分为两类:极性有机物和非极性有机物。
1. 极性有机物极性有机物通常具有较强的极性基团,如羟基(-OH)、醇基(-OH)、羧基(-COOH)等。
这些基团能够与水分子形成氢键,因此极性有机物在水中具有较好的溶解性。
例如乙醇、乙酸等。
2. 非极性有机物非极性有机物通常由纯碳和氢构成,分子中没有明显的极性基团。
它们与水的相互作用较弱,因此溶解性较差,但在非极性溶剂中具有较好的溶解性。
典型的非极性有机物就是烃类,如甲烷、乙烷等。
二、沸点和熔点有机物的沸点和熔点是其物质转变的温度指标,反映了有机物分子之间的相互作用力。
1. 沸点有机物的沸点与其分子的相对分子质量、分子间的分子间力有关。
分子质量较大的有机物通常具有较高的沸点,因为它们之间的分子间力较强,需要较高的温度才能克服这种力。
另外,分子间氢键、范德华力和电偶极-电偶极相互作用也会影响有机物的沸点。
例如,醇类和酸类由于分子间的氢键较强,其沸点较高。
2. 熔点有机物的熔点通常与其分子间力有关,分子间力强的有机物熔点较高。
分子中存在氢键或其他较强的分子间力时,熔点会相应提高。
此外,分子结构的对称性和分子量对熔点也有影响。
一般来说,对称分子熔点较低,而分子量较大的有机物由于分子间力较强,熔点也较高。
三、密度有机物的密度是指物质的质量与体积的比值,反映了有机物的分子结构和排列方式。
1. 密度的大小有机物的密度大小与其分子质量、分子间的相互作用力以及分子结构有关。
分子质量较大的有机物通常具有较高的密度。
而分子间相互作用力较强的有机物密度也相对较高。

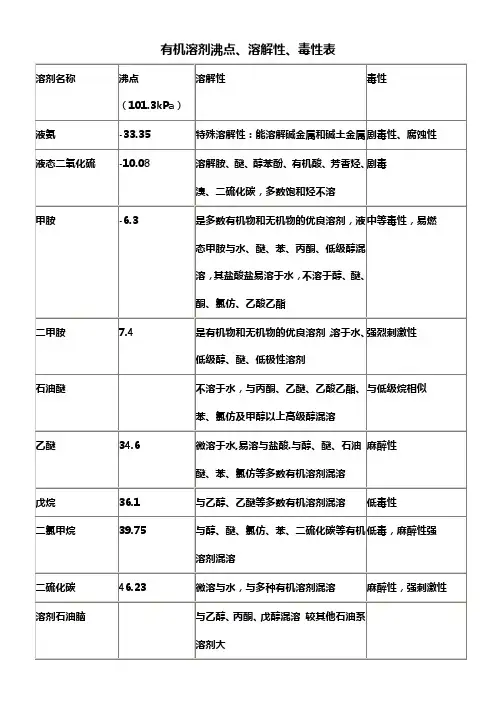
常用溶剂的沸点、溶解性与毒性溶剂名称沸点(101、3kPa) 溶解性毒性液氨-33、35℃特殊溶解性:能溶解碱金属与碱土金属剧毒性、腐蚀性液态二氧化硫-10、08 溶解胺、醚、醇苯酚、有机酸、芳香烃、溴、二硫化碳,多数饱与烃不溶剧毒甲胺-6、3 就是多数有机物与无机物的优良溶剂,液态甲胺与水、醚、苯、丙酮、低级醇混溶,其盐酸盐易溶于水,不溶于醇、醚、酮、氯仿、乙酸乙酯中等毒性,易燃二甲胺7、4 就是有机物与无机物的优良溶剂,溶于水、低级醇、醚、低极性溶剂强烈刺激性石油醚不溶于水,与丙酮、乙醚、乙酸乙酯、苯、氯仿及甲醇以上高级醇混溶与低级烷相似乙醚34、6 微溶于水,易溶与盐酸、与醇、醚、石油醚、苯、氯仿等多数有机溶剂混溶麻醉性戊烷36、1 与乙醇、乙醚等多数有机溶剂混溶低毒性二氯甲烷39、75 与醇、醚、氯仿、苯、二硫化碳等有机溶剂混溶低毒,麻醉性强二硫化碳46、23 微溶与水,与多种有机溶剂混溶麻醉性,强刺激性溶剂石油脑与乙醇、丙酮、戊醇混溶较其她石油系溶剂大丙酮56、12 与水、醇、醚、烃混溶低毒,类乙醇,但较大1,1-二氯乙烷57、28 与醇、醚等大多数有机溶剂混溶低毒、局部刺激性氯仿61、15 与乙醇、乙醚、石油醚、卤代烃、四氯化碳、二硫化碳等混溶中等毒性,强麻醉性甲醇64、5 与水、乙醚、醇、酯、卤代烃、苯、酮混溶中等毒性,麻醉性,四氢呋喃66 优良溶剂,与水混溶,很好的溶解乙醇、乙醚、脂肪烃、芳香烃、氯化烃吸入微毒,经口低毒己烷68、7 甲醇部分溶解,比乙醇高的醇、醚丙酮、氯仿混溶低毒。
麻醉性,刺激性三氟代乙酸71、78 与水,乙醇,乙醚,丙酮,苯,四氯化碳,己烷混溶,溶解多种脂肪族,芳香族化合物1,1,1-三氯乙烷74、0 与丙酮、、甲醇、乙醚、苯、四氯化碳等有机溶剂混溶低毒类溶剂四氯化碳76、75 与醇、醚、石油醚、石油脑、冰醋酸、二硫化碳、氯代烃混溶氯代甲烷中,毒性最强乙酸乙酯77、112 与醇、醚、氯仿、丙酮、苯等大多数有机溶剂溶解,能溶解某些金属盐低毒,麻醉性乙醇78、3 与水、乙醚、氯仿、酯、烃类衍生物等有机溶剂混溶微毒类,麻醉性丁酮79、64 与丙酮相似,与醇、醚、苯等大多数有机溶剂混溶低毒,毒性强于丙酮苯80、10 难溶于水,与甘油、乙二醇、乙醇、氯仿、乙醚、、四氯化碳、二硫化碳、丙酮、甲苯、二甲苯、冰醋酸、脂肪烃等大多有机物混溶强烈毒性环己烷80、72 与乙醇、高级醇、醚、丙酮、烃、氯代烃、高级脂肪酸、胺类混溶低毒,中枢抑制作用乙睛81、60 与水、甲醇、乙酸甲酯、乙酸乙酯、丙酮、醚、氯仿、四氯化碳、氯乙烯及各种不饱与烃混溶,但就是不与饱与烃混溶中等毒性,大量吸入蒸气,引起急性中毒异丙醇82、40 与乙醇、乙醚、氯仿、水混溶微毒,类似乙醇1,2-二氯乙烷83、48 与乙醇、乙醚、氯仿、四氯化碳等多种有机溶剂混溶高毒性、致癌乙二醇二甲醚85、2 溶于水,与醇、醚、酮、酯、烃、氯代烃等多种有机溶剂混溶。
常用溶剂得沸点、溶解性与毒性溶剂名称沸点(101.3kPa) 溶解性毒性ﻫ液氨-33、35℃特殊溶解性:能溶解碱金属与碱土金属剧毒性、腐蚀性ﻫ液态二氧化硫—10。
08溶解胺、醚、醇苯酚、有机酸、芳香烃、溴、二硫化碳,多数饱与烃不溶剧毒ﻫ甲胺-6、3 就是多数有机物与无机物得优良溶剂,液态甲胺与水、醚、苯、丙酮、低级醇混溶,其盐酸盐易溶于水,不溶于醇、醚、酮、氯仿、乙酸乙酯中等毒性,易燃二甲胺7。
4就是有机物与无机物得优良溶剂,溶于水、低级醇、醚、低极性溶剂强烈刺激性ﻫ石油醚不溶于水,与丙酮、乙醚、乙酸乙酯、苯、氯仿及甲醇以上高级醇混溶与低级烷相似乙醚34。
6微溶于水,易溶与盐酸。
与醇、醚、石油醚、苯、氯仿等多数有机溶剂混溶麻醉性戊烷36.1与乙醇、乙醚等多数有机溶剂混溶低毒性ﻫ二氯甲烷39、75 与醇、醚、氯仿、苯、二硫化碳等有机溶剂混溶低毒,麻醉性强二硫化碳46。
23 微溶与水,与多种有机溶剂混溶麻醉性,强刺激性溶剂石油脑与乙醇、丙酮、戊醇混溶较其她石油系溶剂大丙酮56.12 与水、醇、醚、烃混溶低毒,类乙醇,但较大ﻫ1,1-二氯乙烷57。
28 与醇、醚等大多数有机溶剂混溶低毒、局部刺激性ﻫ氯仿61.15 与乙醇、乙醚、石油醚、卤代烃、四氯化碳、二硫化碳等混溶中等毒性,强麻醉性甲醇64、5 与水、乙醚、醇、酯、卤代烃、苯、酮混溶中等毒性,麻醉性, ﻫ四氢呋喃66优良溶剂,与水混溶,很好得溶解乙醇、乙醚、脂肪烃、芳香烃、氯化烃吸入微毒,经口低毒ﻫ己烷68、7甲醇部分溶解,比乙醇高得醇、醚丙酮、氯仿混溶低毒、麻醉性,刺激性三氟代乙酸71、78与水,乙醇,乙醚,丙酮,苯,四氯化碳,己烷混溶,溶解多种脂肪族,芳香族化合物1,1,1-三氯乙烷74、0与丙酮、、甲醇、乙醚、苯、四氯化碳等有机溶剂混溶低毒类溶剂四氯化碳76.75与醇、醚、石油醚、石油脑、冰醋酸、二硫化碳、氯代烃混溶氯代甲烷中,毒性最强ﻫ乙酸乙酯77。
常用有机溶剂的沸点、溶解性和毒性常用溶剂的沸点、溶解性和毒性溶剂名称沸点(101.3kPa)溶解性毒性正丁醇:沸点:116-118度,异丁醇:沸点:108度液氨-33.35℃特殊溶解性:能溶解碱金属和碱土金属剧毒性、腐蚀性液态二氧化硫-10.08 溶解胺、醚、醇苯酚、有机酸、芳香烃、溴、二硫化碳,多数饱和烃不溶剧毒甲胺-6.3 是多数有机物和无机物的优良溶剂,液态甲胺与水、醚、苯、丙酮、低级醇混溶,其盐酸盐易溶于水,不溶于醇、醚、酮、氯仿、乙酸乙酯中等毒性,易燃二甲胺7.4 是有机物和无机物的优良溶剂,溶于水、低级醇、醚、低极性溶剂强烈刺激性石油醚不溶于水,与丙酮、乙醚、乙酸乙酯、苯、氯仿及甲醇以上高级醇混溶与低级烷相似乙醚34.6 微溶于水,易溶与盐酸.与醇、醚、石油醚、苯、氯仿等多数有机溶剂混溶麻醉性戊烷36.1 与乙醇、乙醚等多数有机溶剂混溶低毒性员?婷疋0?二氯甲烷39.75 与醇、醚、氯仿、苯、二硫化碳等有机溶剂混溶低毒,麻醉性强二硫化碳46.23 微溶与水,与多种有机溶剂混溶麻醉性,强刺激性溶剂石油脑与乙醇、丙酮、戊醇混溶较其他石油系溶剂大丙酮56.12 与水、醇、醚、烃混溶低毒,类乙醇,但较大1,1-二氯乙烷57.28 与醇、醚等大多数有机溶剂混溶低毒、局部刺激性氯仿61.15 与乙醇、乙醚、石油醚、卤代烃、四氯化碳、二硫化碳等混溶中等毒性,强麻醉性甲醇64.5 与水、乙醚、醇、酯、卤代烃、苯、酮混溶中等毒性,麻醉性四氢呋喃66 优良溶剂,与水混溶,很好的溶解乙醇、乙醚、脂肪烃、芳香烃、氯化烃吸入微毒,经口低毒己烷68.7 甲醇部分溶解,比乙醇高的醇、醚丙酮、氯仿混溶低毒。
麻醉性,刺激性三氟代乙酸71.78 与水,乙醇,乙醚,丙酮,苯,四氯化碳,己烷混溶,溶解多种脂肪族,芳香族化合物1,1,1-三氯乙烷74.0 与丙酮、、甲醇、乙醚、苯、四氯化碳等有机溶剂混溶低毒类溶剂四氯化碳76.75 与醇、醚、石油醚、石油脑、冰醋酸、二硫化碳、氯代烃混溶氯代甲烷中,毒性最强乙酸乙酯77.112 与醇、醚、氯仿、丙酮、苯等大多数有机溶剂溶解,能溶解某些金属盐低毒,麻醉性乙醇78.3 与水、乙醚、氯仿、酯、烃类衍生物等有机溶剂混溶微毒类,麻醉性丁酮79.64 与丙酮相似,与醇、醚、苯等大多数有机溶剂混溶低毒,毒性强于丙酮苯80.10 难溶于水,与甘油、乙二醇、乙醇、氯仿、乙醚、、四氯化碳、二硫化碳、丙酮、甲苯、二甲苯、冰醋酸、脂肪烃等大多有机物混溶强烈毒性乙睛81.60 与水、甲醇、乙酸甲酯、乙酸乙酯、丙酮、醚、氯仿、四氯化碳、氯乙烯及各种不饱和烃混溶,但是不与饱和烃混溶中等毒性,大量吸入蒸气,引起急性中毒异丙醇82.40 与乙醇、乙醚、氯仿、水混溶微毒,类似乙醇1,2-二氯乙烷83.48 与乙醇、乙醚、氯仿、四氯化碳等多种有机溶剂混溶高毒性、致癌乙二醇二甲醚85.2 溶于水,与醇、醚、酮、酯、烃、氯代烃等多种有机溶剂混溶。
常用有机溶剂的沸点、溶解性和毒性常用溶剂的沸点、溶解性和毒性溶剂名称沸点(101.3kPa)溶解性毒性液氨-33.35℃特殊溶解性:能溶解碱金属和碱土金属剧毒性、腐蚀性液态二氧化硫-10.08 溶解胺、醚、醇苯酚、有机酸、芳香烃、溴、二硫化碳,多数饱和烃不溶剧毒甲胺-6.3 是多数有机物和无机物的优良溶剂,液态甲胺与水、醚、苯、丙酮、低级醇混溶,其盐酸盐易溶于水,不溶于醇、醚、酮、氯仿、乙酸乙酯中等毒性,易燃二甲胺7.4 是有机物和无机物的优良溶剂,溶于水、低级醇、醚、低极性溶剂强烈刺激性石油醚不溶于水,与丙酮、乙醚、乙酸乙酯、苯、氯仿及甲醇以上高级醇混溶与低级烷相似乙醚34.6 微溶于水,易溶与盐酸.与醇、醚、石油醚、苯、氯仿等多数有机溶剂混溶麻醉性戊烷36.1 与乙醇、乙醚等多数有机溶剂混溶低毒性员?婷疋0?二氯甲烷39.75 与醇、醚、氯仿、苯、二硫化碳等有机溶剂混溶低毒,麻醉性强二硫化碳46.23 微溶与水,与多种有机溶剂混溶麻醉性,强刺激性溶剂石油脑与乙醇、丙酮、戊醇混溶较其他石油系溶剂大丙酮56.12 与水、醇、醚、烃混溶低毒,类乙醇,但较大1,1-二氯乙烷57.28 与醇、醚等大多数有机溶剂混溶低毒、局部刺激性氯仿61.15 与乙醇、乙醚、石油醚、卤代烃、四氯化碳、二硫化碳等混溶中等毒性,强麻醉性甲醇64.5 与水、乙醚、醇、酯、卤代烃、苯、酮混溶中等毒性,麻醉性四氢呋喃66 优良溶剂,与水混溶,很好的溶解乙醇、乙醚、脂肪烃、芳香烃、氯化烃吸入微毒,经口低毒己烷68.7 甲醇部分溶解,比乙醇高的醇、醚丙酮、氯仿混溶低毒。
麻醉性,刺激性三氟代乙酸71.78 与水,乙醇,乙醚,丙酮,苯,四氯化碳,己烷混溶,溶解多种脂肪族,芳香族化合物1,1,1-三氯乙烷74.0 与丙酮、、甲醇、乙醚、苯、四氯化碳等有机溶剂混溶低毒类溶剂四氯化碳76.75 与醇、醚、石油醚、石油脑、冰醋酸、二硫化碳、氯代烃混溶氯代甲烷中,毒性最强乙酸乙酯77.112 与醇、醚、氯仿、丙酮、苯等大多数有机溶剂溶解,能溶解某些金属盐低毒,麻醉性乙醇78.3 与水、乙醚、氯仿、酯、烃类衍生物等有机溶剂混溶微毒类,麻醉性丁酮79.64 与丙酮相似,与醇、醚、苯等大多数有机溶剂混溶低毒,毒性强于丙酮苯80.10 难溶于水,与甘油、乙二醇、乙醇、氯仿、乙醚、、四氯化碳、二硫化碳、丙酮、甲苯、二甲苯、冰醋酸、脂肪烃等大多有机物混溶强烈毒性乙睛81.60 与水、甲醇、乙酸甲酯、乙酸乙酯、丙酮、醚、氯仿、四氯化碳、氯乙烯及各种不饱和烃混溶,但是不与饱和烃混溶中等毒性,大量吸入蒸气,引起急性中毒异丙醇82.40 与乙醇、乙醚、氯仿、水混溶微毒,类似乙醇1,2-二氯乙烷83.48 与乙醇、乙醚、氯仿、四氯化碳等多种有机溶剂混溶高毒性、致癌乙二醇二甲醚85.2 溶于水,与醇、醚、酮、酯、烃、氯代烃等多种有机溶剂混溶。
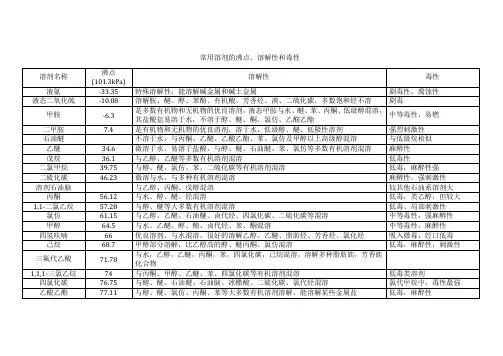
常用溶剂的沸点、溶解性和毒性溶剂名称沸点(101.3kPa)溶解性毒性液氨 -33.35℃ 特殊溶解性:能溶解碱金属和碱土金属剧毒性、腐蚀性液态二氧化硫 -10.08 溶解胺、醚、醇苯酚、有机酸、芳香烃、溴、二硫化碳,多数饱和烃不溶剧毒甲胺 -6.3 是多数有机物和无机物的优良溶剂,液态甲胺与水、醚、苯、丙酮、低级醇混溶,其盐酸盐易溶于水,不溶于醇、醚、酮、氯仿、乙酸乙酯中等毒性,易燃二甲胺 7.4 是有机物和无机物的优良溶剂,溶于水、低级醇、醚、低极性溶剂强烈刺激性[石油醚不溶于水,与丙酮、乙醚、乙酸乙酯、苯、氯仿及甲醇以上高级醇混溶与低级烷相似乙醚 34.6 微溶于水,易溶与盐酸.与醇、醚、石油醚、苯、氯仿等多数有机溶剂混溶麻醉性戊烷 36.1 与乙醇、乙醚等多数有机溶剂混溶低毒性二氯甲烷 39.75 与醇、醚、氯仿、苯、二硫化碳等有机溶剂混溶低毒,麻醉性强二硫化碳 46.23 微溶与水,与多种有机溶剂混溶麻醉性,强刺激性溶剂石油脑与乙醇、丙酮、戊醇混溶较其他石油系溶剂大丙酮 56.12 与水、醇、醚、烃混溶低毒,类乙醇,但较大1,1-二氯乙烷 57.28 与醇、醚等大多数有机溶剂混溶低毒、局部刺激性氯仿 61.15 与乙醇、乙醚、石油醚、卤代烃、四氯化碳、二硫化碳等混溶中等毒性,强麻醉性甲醇 64.5 与水、乙醚、醇、酯、卤代烃、苯、酮混溶中等毒性,麻醉性四氢呋喃 66 优良溶剂,与水混溶,很好的溶解乙醇、乙醚、脂肪烃、芳香烃、氯化烃吸入微毒,经口低毒己烷 68.7 甲醇部分溶解,比乙醇高的醇、醚丙酮、氯仿混溶低毒。
麻醉性,刺激性三氟代乙酸 71.78 与水,乙醇,乙醚,丙酮,苯,四氯化碳,己烷混溶,溶解多种脂肪族,芳香族化合物1,1,1-三氯乙烷 74.0 与丙酮、、甲醇、乙醚、苯、四氯化碳等有机溶剂混溶低毒类四氯化碳 76.75 与醇、醚、石油醚、石油脑、冰醋酸、二硫化碳、氯代烃混溶氯代甲烷中,毒性最强乙酸乙酯 77.112 与醇、醚、氯仿、丙酮、苯等大多数有机溶剂溶解,能溶解某些金属盐低毒,麻醉性乙醇 78.3 与水、乙醚、氯仿、酯、烃类衍生物等有机溶剂混溶微毒类,麻醉性丁酮 79.64 与丙酮相似,与醇、醚、苯等大多数有机溶剂混溶低毒,毒性强于丙酮苯 80.10 难溶于水,与甘油、乙二醇、乙醇、氯仿、乙醚、、四氯化碳、二硫化碳、丙酮、甲苯、二甲苯、冰醋酸、脂肪烃等大多有机物混溶强烈毒性环己烷 80.72 与乙醇、高级醇、醚、丙酮、烃、氯代烃、高级脂肪酸、胺类混溶低毒,中枢抑制作用乙睛 81.60 与水、甲醇、乙酸甲酯、乙酸乙酯、丙酮、醚、氯仿、四氯化碳、氯乙烯及各种不饱和烃混溶,但是不与饱和烃混溶中等毒性,大量吸入蒸气,引起急性中毒异丙醇 82.40 与乙醇、乙醚、氯仿、水混溶微毒,类似乙醇1,2-二氯乙烷 83.48 与乙醇、乙醚、氯仿、四氯化碳等多种有机溶剂混溶高毒性、致癌涂乙二醇二甲醚 85.2 溶于水,与醇、醚、酮、酯、烃、氯代烃等多种有机溶剂混溶。
常用有机溶剂的沸点、溶解性和毒性常用溶剂的沸点、溶解性和毒性溶剂名称沸点(101.3kPa)溶解性毒性正丁醇:沸点:116-118度,异丁醇:沸点:108度液氨-33.35℃特殊溶解性:能溶解碱金属和碱土金属剧毒性、腐蚀性液态二氧化硫-10.08 溶解胺、醚、醇苯酚、有机酸、芳香烃、溴、二硫化碳,多数饱和烃不溶剧毒甲胺-6.3 是多数有机物和无机物的优良溶剂,液态甲胺与水、醚、苯、丙酮、低级醇混溶,其盐酸盐易溶于水,不溶于醇、醚、酮、氯仿、乙酸乙酯中等毒性,易燃二甲胺7.4 是有机物和无机物的优良溶剂,溶于水、低级醇、醚、低极性溶剂强烈刺激性石油醚不溶于水,与丙酮、乙醚、乙酸乙酯、苯、氯仿及甲醇以上高级醇混溶与低级烷相似乙醚34.6 微溶于水,易溶与盐酸.与醇、醚、石油醚、苯、氯仿等多数有机溶剂混溶麻醉性戊烷36.1 与乙醇、乙醚等多数有机溶剂混溶低毒性员?婷疋0?二氯甲烷39.75 与醇、醚、氯仿、苯、二硫化碳等有机溶剂混溶低毒,麻醉性强二硫化碳46.23 微溶与水,与多种有机溶剂混溶麻醉性,强刺激性溶剂石油脑与乙醇、丙酮、戊醇混溶较其他石油系溶剂大丙酮56.12 与水、醇、醚、烃混溶低毒,类乙醇,但较大1,1-二氯乙烷57.28 与醇、醚等大多数有机溶剂混溶低毒、局部刺激性氯仿61.15 与乙醇、乙醚、石油醚、卤代烃、四氯化碳、二硫化碳等混溶中等毒性,强麻醉性甲醇64.5 与水、乙醚、醇、酯、卤代烃、苯、酮混溶中等毒性,麻醉性四氢呋喃66 优良溶剂,与水混溶,很好的溶解乙醇、乙醚、脂肪烃、芳香烃、氯化烃吸入微毒,经口低毒己烷68.7 甲醇部分溶解,比乙醇高的醇、醚丙酮、氯仿混溶低毒。
麻醉性,刺激性三氟代乙酸71.78 与水,乙醇,乙醚,丙酮,苯,四氯化碳,己烷混溶,溶解多种脂肪族,芳香族化合物1,1,1-三氯乙烷74.0 与丙酮、、甲醇、乙醚、苯、四氯化碳等有机溶剂混溶低毒类溶剂四氯化碳76.75 与醇、醚、石油醚、石油脑、冰醋酸、二硫化碳、氯代烃混溶氯代甲烷中,毒性最强乙酸乙酯77.112 与醇、醚、氯仿、丙酮、苯等大多数有机溶剂溶解,能溶解某些金属盐低毒,麻醉性乙醇78.3 与水、乙醚、氯仿、酯、烃类衍生物等有机溶剂混溶微毒类,麻醉性丁酮79.64 与丙酮相似,与醇、醚、苯等大多数有机溶剂混溶低毒,毒性强于丙酮苯80.10 难溶于水,与甘油、乙二醇、乙醇、氯仿、乙醚、、四氯化碳、二硫化碳、丙酮、甲苯、二甲苯、冰醋酸、脂肪烃等大多有机物混溶强烈毒性乙睛81.60 与水、甲醇、乙酸甲酯、乙酸乙酯、丙酮、醚、氯仿、四氯化碳、氯乙烯及各种不饱和烃混溶,但是不与饱和烃混溶中等毒性,大量吸入蒸气,引起急性中毒异丙醇82.40 与乙醇、乙醚、氯仿、水混溶微毒,类似乙醇1,2-二氯乙烷83.48 与乙醇、乙醚、氯仿、四氯化碳等多种有机溶剂混溶高毒性、致癌乙二醇二甲醚85.2 溶于水,与醇、醚、酮、酯、烃、氯代烃等多种有机溶剂混溶。
化学物质的液体性质液体是一种常见的物质状态,它具有特定的性质和行为。
在化学中,液体性质的研究对于理解物质的行为和化学反应至关重要。
本文将探讨几种常见化学物质的液体性质,包括溶解性、黏度、表面张力和沸点。
1. 溶解性溶解性是指物质在液体中的溶解程度。
不同物质的溶解度各不相同,这取决于物质的化学性质和结构。
一般来说,极性物质更容易溶解在极性溶剂中,而非极性物质则更容易溶解在非极性溶剂中。
溶解度可以用一些实验方法进行测定,如饱和溶解度实验。
通过逐渐加入溶质到溶剂中,当无法再溶解更多的溶质时,称之为饱和溶解度。
这个实验可以用来研究浓度对溶解度的影响,从而得出相应的溶解度曲线。
2. 黏度黏度是液体流动性的量度,可以理解为液体的粘稠程度。
黏度与液体分子之间的相互作用力有关。
分子间的相互作用力越强,黏度就越高。
黏度可以通过简单的实验方法进行测定,如粘度计法。
粘度计是一种特殊的装置,通过液体流动的速度和流动的阻力来计算黏度。
此外,温度和压力也会对黏度产生影响。
在较高的温度和较低的压力下,液体的分子运动更自由,黏度较低。
3. 表面张力表面张力是液体表面上存在的一种特殊力现象,液体表面上形成一层薄薄的膜,使液体表面呈现紧绷状态。
表面张力由液体分子之间的吸引力引起。
表面张力会导致液体呈现球形,因为球形形状可以最小化液体表面积。
此外,表面张力还会导致液体与固体表面产生接触角,如水在玻璃表面上的接触角。
这一现象对于解释液体在固体表面上的吸附行为有着重要的意义。
4. 沸点沸点是液体转化为气体的温度。
沸点取决于液体的化学成分和环境压力。
一般来说,沸点随着环境压力的增加而升高。
许多物质的沸点都是常见的物理性质,用于区分不同物质。
沸点的测定方法可以通过沸点计来进行。
沸点计是一种常见的实验仪器,在确定沸点时,液体会被加热,当液体开始汽化时,沸点计会发出声音或指示。
通过观察沸点计的指示可以确定液体的沸点。
结论液体的性质涉及溶解性、黏度、表面张力和沸点等方面。
一、相似相溶原理
1.极性溶剂(如水)易溶解极性物质(离子晶体、分子晶体中的极性物质如强酸等);
2.非极性溶剂(如苯、汽油、四氯化碳、酒精等)能溶解非极性物质(大多数有机物、Br2、I2等);
3.含有相同官能团的物质互溶,如水中含羟基(—OH)能溶解含有羟基的醇、酚、羧酸。
二、有机物的溶解性与官能团的溶解性
1.官能团的溶解性:
(1)易溶于水的官能团(即亲水基团)有—OH、—CHO、—COOH、—NH2。
(2)难溶于水的官能团(即憎水基团)有:所有的烃基(—CnH2n+1、—CH=CH2、—C6H5等)、卤原子(—X)、硝基(—NO2)等。
2.分子中亲水基团与憎水基团的比例影响物质的溶解性:
(1)当官能团的个数相同时,随着烃基(憎水基团)碳原子数目的增大,溶解性逐渐降低;
例如,溶解性:CH3OH>C2H5OH>C3H7OH>……,一般地,碳原子个数大于5的醇难溶于水。
(2)当烃基中碳原子数相同时,亲水基团的个数越多,物质的溶解性越大;
例如,溶解性:CH3CH2CH2OH
(3)当亲水基团与憎水基团对溶解性的影响大致相同时,物质微溶于水;
例如,常见的微溶于水的物质有:苯酚C6H5—OH、苯胺
C6H5—NH2、苯甲酸C6H5—COOH、正戊醇
CH3CH2CH2CH2CH2—OH(上述物质的结构简式中“—”左边的为憎水基团,右边的为亲水基团);乙酸乙酯CH3COOCH2CH3(其中—CH3和—CH2CH3为憎水基团,—COO—为亲水基团)。
(4)由两种憎水基团组成的物质,一定难溶于水。
例如,卤代烃R-X、硝基化合物R-NO2 ,由于其中的烃基R—、卤原子—X和硝基—NO2均为憎水基团,故均难溶于水。
三、液态有机物的密度
1.难溶于水,且密度小于水的有机物
例如,液态烃(乙烷、乙烯、苯、苯的同系物……),液态酯(乙酸乙酯、硬脂酸甘油酯……),一氯卤代烷烃(1-氯乙烷……),石油产品(汽油、煤油、油脂……)
注:汽油产品分为直馏汽油和裂化汽油(含不饱和烃)。
2.难溶于水,且密度大于水的有机物
例如:四氯化碳、氯仿、溴苯、二硫化碳
怎样理解有机物沸点变化的规律
有机物的沸点高低变化是有规律可循的。
液体沸点的高低决定于分子间引力的大小,分子间引力越大,使之沸腾就必须提供更多的能量,因此沸点就越高。
分子间的引力称范德华力,它包括取向力、诱导力和色散力。
除此之外还有一种力叫氢键,它的存在也对有机物的沸点有重要影响。
分子间引力的大小取决于分子结构,所以归根到底,有机物沸点的高低取决于分子本身的结构,其变化规律可以归纳为以下几个方面。
1.结构相似看分子量
对结构相似的有机物,其沸点高低主要由他子量的大小来决定。
因为分子量越大,分子间的范德华力越大,沸点就越高。
例如正烷烃系列:
名称分子式状态沸点(℃)
甲烷 CH4 气—164
乙烷 C2H6 气—88.6
丙烷 C3H8 气—42.1
丁烷 C4H10 气—0.5
戊烷 C5H12 液 36.1
庚烷 C7H16 液 68.9
辛烷 C8H18 液 125.7
正烷烃是非极性分子,分子间主要存在色散力。
正烷烃分子的分子量越大即含碳原子数越多,原子个数也就越多,色散力当然也就越大。
因此,正烷烃的沸点随着碳原子数的增多而升高。
2.同类同分异构体看支链
在有机物的同分异构体中,分子中所含的支链越多,其沸点越低。
如戊烷的三种同分异构体的沸点如下:
名称正戊烷异戊烷新戊烷
结构 CH3CH2CH2CH2CH3 (CH3)2CHCH2CH3 (CH3)4C
沸点 36.1 27.9 9.5
(℃)
分子中支链的增多,使分子间相互靠近受到阻碍,分子间接近程度或者说分子间接触面积减小。
由于色散力只有近距离内方能有效地产生作用.因此随着分子中支链的增多,分子之间距离增大,必然表现出有机物沸点的降低。
3.分子量相同看分子极性
如果有机物分子是极性分子,由于极性分子具有偶极,而偶极是电性的。
因此,极性分子之间除了具有色散力外,还具有偶极之间的静电引力。
这样,极性分子之间的分子间力比非极性分子要大得多,所以使沸点升高。
例如分子量相同的丁烷和丙酮:
分子量结构沸点(℃)
丙酮 5856.2
丁烷 58 CH3CH2CH2CH3 —0.5
丙酮分子中含有羰基,由于碳氧电负性不同,碳原子上带有部分正电荷,氧原子上带有部分负电荷。
当这样的极性分子相互接近时,势必产生较大的分子间力,从而表现出沸点值较大程度地升高。
4.不要忘记看氢键
如果有机物分子间能形成氢键,在液态时,分子间就能通过氢键结合形成较大的缔合体。
这样的液体沸腾气化时,不仅要破坏分子间的范德华力,而且还必须消耗较多的能量破坏分子间的氢键,因此,含有氢键的有机物较之分子量相近的其它有机物,应具有反常的高沸点。
例如甲醇和乙烷:
分子量结构沸点(℃)
甲醇 32 CH3OH 64.9
乙烷 30 CH3—CH3 —88.6
醇的沸点反常高就是由于其分子间有较强的氢键而发生缔合。
除了醇之外,酚、羧酸和胺等也含有氢键,其沸点也相应较高。