初中化学第三章复习人教版知识精讲
- 格式:doc
- 大小:24.50 KB
- 文档页数:3

第三单元物质构成的奥秘第一节分子和原子一、分子和原子的异同分子原子定义分子是保持物质化学性质的最小粒子。
原子是化学变化中的最小粒子。
性质质量小、体积小;不断运动;有间隔;同种粒子的化学性质相同。
联系分子是由原子构成的。
分子、原子都是构成物质的微粒。
区别在化学变化中,分子可以再分,而原子不可以再分。
备注1.所有金属、稀有气体、金刚石(石墨)和硅是由原子构成的,其他大多数物质是由分子构成的。
2.在受热的情况下,粒子能量增大,运动速率加快。
3.物体的热胀冷缩现象,原因是构成物质的粒子的间隔受热时增大,遇冷时缩小。
4.气体容易压缩是因为构成气体的粒子的间隔较大。
5.不同液体混合后总体积小于原体积的和,说明粒子间是有间隔的。
6.一种物质如果由分子构成,那么保持它化学性质的最小粒子是分子;如果它由原子构成,那么保持它化学性质的最小粒子是原子。
二、验证分子运动的探究实验【实验操作】如右图,取适量的酚酞溶液,分别倒入A、B两个小烧杯中,另取一个小烧杯C,加入约5mL浓氨水。
用一个大烧杯罩住A、C两个小烧杯,烧杯B置于大烧杯外。
观察现象。
【实验现象】烧杯A中的酚酞溶液由上至下逐渐变红。
【实验结论】分子是不断运动的。
【注意事项】浓氨水显碱性,能使酚酞溶液变红。
浓氨水具有挥发性,能挥发出氨气。
三、从微观角度解释问题1.用分子观点解释由分子构成的物质的物理变化和化学变化物理变化:没有新分子生成的变化。
(水蒸发时水分子的间隔变大,但水分子本身没有变化,故为物理变化)化学变化:分子本身发生变化,有新分子生成的变化。
(电解水时水分子变成了新物质的分子,故为化学变化)2.纯净物和混合物(由分子构成的物质)的区别:纯净物由同种分子构成,混合物由不同种分子构成。
3.分子和原子的联系:分子是由原子构成的,同种原子结合成单质分子,不同种原子结合成化合物分子。
4.分子和原子的本质区别:在化学变化中,分子可以再分,而原子不能再分。
5.化学变化的实质:在化学变化过程中,分子裂变成原子,原子重新组合,形成新物质的分子。


人教版七年级化学上册第三章知识点总结及阶梯练习一、知识点总结本章主要讲解了物质的物理性质以及多种分离技术的原理与应用。
具体内容如下:1. 物质的物理性质物质的物理性质是指物质固有的、不改变其物质组成的性质。
主要包括:- 气态物质的压强、体积、温度间关系的研究;- 结晶、熔点、沸点、密度等固态物质的性质;- 溶解度、表面张力等液态物质的性质。
2. 分离技术分离技术是指利用物质的不同性质进行分离的方法。
主要包括:- 蒸馏法;- 结晶法;- 过滤法;- 萃取法;- 水解法;- 电解法。
二、阶梯练1. 选择题选择题1. 物质的物理性质是指物质固有的、[不改变其物质组成的](?) _A_性质。
2. 下列分离技术中,不属于物理分离的是(过滤法/蒸馏法/水解法) _(答案:水解法)_2. 填空题填空题1. 水的三态变化中液态到固态的过程称为[凝固](?)。
2. 蒸馏法是利用不同物质沸点差异进行[分离](?)的。
3. 萃取法多用于[提取](?)药物中的有效成分等。
3. 简答题简答题1. 请简述物质的物理性质的概念及其要素_参考答案:物质的物理性质是指物质固有的、不改变其物质组成的性质。
要素包括气态物质的压强、体积、温度间关系的研究、结晶、熔点、沸点、密度等固态物质的性质、溶解度、表面张力等液态物质的性质。
_2. 请简单概述蒸馏法的原理及其在实际中的应用_参考答案:蒸馏法是一种利用不同物质沸点差异进行分离的物理分离方法。
在实际中,蒸馏法常用于分离液体混合物中的纯液体、提高某些液体的纯度等方面。
_。
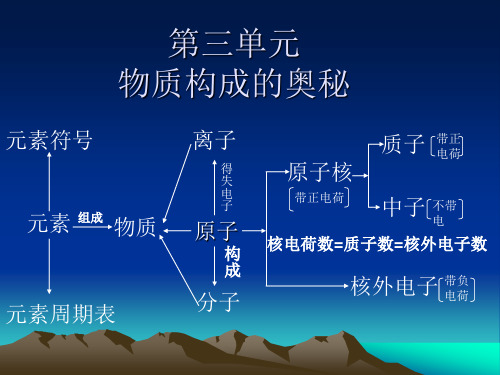

第三单元物质构成的奥秘课题一、分子和原子1、分子是由原子构成的。
分子、原子都是构成物质的微粒。
这些微粒总是在不断运动着2、物质的三态变化、热胀冷缩的实质,都是粒子间的间隔的变化3、分子是保持物质化学性质的最小粒子,原子是化学变化中的最小粒子4、化学变化中,分子可分,原子不可分课题二、原子的构成1、原子组成①质子数=核外电子数=核电荷数=原子序数②原子的质量主要集中在原子核上2、相对原子质量①定义:以碳12原子质量的1/12为标准,其他原子的质量跟它相比所得的值。
②相对原子质量≈质子数+中子数课题三、元素1、定义:具有相同质子数(核电荷数)的一类原子的总称。
2、特点:只讲种类,不讲个数3、元素符号的意义:宏观:表示一种元素、表示一种物质(金属元素、固态非金属、稀有气体)微观:表示一个原子例如:H:表示氢元素;一个氢原子He:表示氦元素;氦气;一个氦原子C:表示碳元素;碳;一个碳原子Al:表示铝元素;铝;一个铝原子注意:当元素符号前出现数字时,只有微观意义,符号前是几就表示几个原子。
例如:3H:3个氢原子4C:4个碳原子2Ar:2个氩原子4、原子和元素的比较原子元素概念化学变化中的最小粒子具有相同核电荷数的一类原子的总称特征表示具体的粒子,也表示种类。
既讲种类也讲个数。
表示种类,不是针对具体的某个粒子而言。
只具有宏观含义5、地壳中元素居前五位的:氧、硅、铝、铁、钙。
生物体中元素居前五位:氧、碳、氢、氮、钙原子原子核(+)核外电子(-)质子(+)中子(不带电)课题四、离子1、元素周期表①行为周期(七个),列为族(主族、副族)②核外电子的排布:原子核外电子是分层排布的,可用原子结构示意图简单表示。
③电子排布的规律:a、第一层最多容纳2个电子,第二层最多容纳8个电子,第三层最多容纳18个电子b、最外层电子层不超过8个,(只有一层的不超过2个)④元素性质:元素的化学性质与原子最外层上的电子数目有密切关系。
最外层具有8个电子(只有一个电子层的具有2个电子)的结构,属于相对稳定结构。

九年级化学第三章知识总结要点
本文档总结了九年级化学第三章的知识要点,旨在帮助学生回顾和巩固所学的内容。
1. 原子和分子
- 原子:物质的最小单位,由质子、中子和电子组成。
- 分子:由两个或更多原子组合而成的粒子。
2. 元素和化合物
- 元素:由同一种原子组成的纯物质。
- 化合物:由两种或更多不同元素组合而成的纯物质。
3. 化学式
- 化学式是化合物组成的简写方式。
- 有机化合物的化学式通常由C、H、O等元素符号组成。
4. 反应式和反应类型
- 反应式:描述化学反应所发生的变化。
- 反应类型:包括合成反应、分解反应、置换反应和电解反应等。
5. 离子和离子反应
- 离子:带电的原子或由原子组成的粒子。
- 离子反应:以离子为反应物的化学反应。
6. 相对分子质量和摩尔质量
- 相对分子质量:化合物相对于碳-12同位素的质量比。
- 摩尔质量:物质的相对分子质量或相对原子质量的单位质量(克)。
7. 配制溶液
- 配制溶液的步骤:称取溶质、溶解溶质、加水并充分搅拌。
8. 酸碱中和反应
- 酸碱中和反应:指酸和碱反应生成盐和水的过程。
以上是九年级化学第三章的知识总结要点。
希望对学生们的研究有所帮助!。

九年级化学上册第三章知识点总结(人教版)本资料为woRD文档,请点击下载地址下载全文下载地址第三单元自然界的水课题1水的组成一、水的组成、水的组成:(1)电解水的实验A.装置―――水电解器B.电源种类---直流电c.加入硫酸或氢氧化钠的目的----增强水的导电性D.化学反应:文字表达式::水(H2o)氢气(H2)+氧气(o2)化学方程式:2H2o2H2↑+o2↑产生位置负极正极体积比2:质量比:8E.检验:o2---出气口置一根带火星的木条----木条复燃H2---出气口置一根燃着的木条------气体燃烧,发出淡蓝色的火焰(2)结论:水是由氢、氧元素组成的。
2、水的性质物理性质:无色无味的液体、40c时密度最大,为1g/cm3 化学性质:通电分解文字表达式:水(H2o)氢气(H2)+氧气(o2)化学方程式:2H2o2H2↑+o2↑3、氢气、物理性质:密度最小的气体(向下排空气法)(氢气与其它气体的显著区别之处);难溶于水(排水法)、无色无味的气体证明氢气密度比空气小的方法:用氢气吹肥皂泡,若肥皂泡上升,则密度比空气小2、化学性质:可燃性(用途:高能燃料;焊接和切割金属)文字表达式:氢气(H2)+氧气(o2)水(H2o)化学方程式:2H2+o22H2o点燃前,要验纯现象:发出淡蓝色火焰,放出热量,有水珠产生注意:混有一定量的空气或氧气的氢气遇明火会发生爆炸,因此点燃前必须验纯。
二、物质的分类单质:由同种元素组成的纯净物例:氢气、氧气、红磷等化合物:由不同种元素组成的纯净物例:水、高锰酸钾等氧化物:由两种元素组成,且其中之一为氧元素的化合物例:二氧化硫、水等注意:单质、化合物前提必须是纯净物。
课题2分子和原子一、构成物质的微粒:分子、原子等微粒、由分子构成的物质:例如水、二氧化碳、氢气、氧气等物质2、由原子构成的物质:金属、稀有气体、金刚石、石墨等物质3、物质构成的描述:物质由××分子(或原子)构成。

中考人教版初三化学第三章知识点第一节 分子和原子五、分子和原子的异同六、验证分子运动的探究实验【实验操作】如右图,取适量的酚酞溶液,分别倒入A 、B 两个小烧杯中,另取一个小烧杯C ,加入约5mL 浓氨水。
用一个大烧杯罩住A 、C 两个小烧杯,烧杯B 置于大烧杯外。
观察现象。
【实验现象】烧杯A 中的酚酞溶液由上至下逐渐变红。
【实验结论】分子是不断运动的。
【注意事项】浓氨水显碱性,能使酚酞溶液变红。
浓氨水具有挥发性,能挥发出氨气。
七、从微观角度解释问题6.用分子观点解释由分子构成的物质的物理变化和化学变化物理变化:没有新分子生成的变化。
(水蒸发时水分子的间隔变大,但水分子本身没有变化,故为物理变化)化学变化:分子本身发生变化,有新分子生成的变化。
(电解水时水分子变成了新物质的分子,故为化学变化)7.纯净物和混合物(由分子构成的物质)的区别:纯净物由同种分子构成,混合物由不同种分子构成。
8.分子和原子的联系:分子是由原子构成的,同种原子结合成单质分子,不同种原子结合成化合物分子。
9.分子和原子的本质区别:在化学变化中,分子可以再分,而原子不能再分。
10.化学变化的实质:在化学变化过程中,分子裂变成原子,原子重新组合,形成新物质的分子。
第二节 原子的结构4.原子的构成原子一般是由质子、中子和电子构成,有的原子不一定有中子,质子数也不一定等于中子数。
原子的种类由核电荷数(质子数)决定。
5.构成原子的各种粒子间的关系 在原子中,原子序数=核电荷数=核内质子数=核外电子数。
由于原子核所带的正电荷与核外电子所带的负电荷的电量相等,电性相反,所以原子整体不显电性。
6.相对原子质量以一种碳原子(碳12)质量的1/12(1.66×10-27kg )为标准,其他原子的质量跟它相比较所得到的比,作为这种原子的相对原子质量,符号为Ar 。
相对原子质量是通过比较得出的比值,单位为“1”。
121(kg)(kg)⨯=标准碳原子的质量一个原子的实际质量相对原子质量 原子中质子和中子的质量接近碳原子质量的1/12,而电子的质量约为质子质量的1/1836,可以忽略不计,所以原子的质量集中在原子核上,即相对原子质量≈质子数+中子数第三节 元素8.定义:元素就是具有相同电荷数(即核内电子数)的一类原子的总称。

第三单元物质构成的奥秘构成物质的粒子有:原子、分子、离子。
考点1 分子(50页)★1.分子的基本性质(48-49页)⑴分子体积和质量都很小。
⑵分子间有间隔,且分子间的间隔受热增大,遇冷缩小,气态物质分子间隔最大。
⑶分子在不停运动。
用⑵⑶两条性质可解释一些物理现象,如热胀冷缩、分子扩散、蒸发物质三态变化、气体压缩等。
⑷同种物质的分子化学性质相同,不同种物质的分子化学性质不同。
★2.概念:分子是保持物质化学性质的最小粒子。
注意:分子只能保持物质的化学性质,但不能保持物质的物理性质,因为一些物理性质(如颜色、状态等)是由大量的分子聚集在一起才表现出来,单个分子不能表现。
⒊分子的内部结构⑴在化学变化中分子可分成原子,分子是由原子构成的;如:1个水分子由两个氢原子和一个氧原子构成。
⑵同种元素的原子构成单质分子,不同种元素的原子构成化合物的分子。
考点2 原子(50页)★⒈概念:原子是化学变化中的最小粒子。
⒉化学反应的实质:在化学反应中,分子可分成原子,原子重新组合成新的分子。
★⒊分子与原子的本质区别:在化学变化中分子可分,而原子不可再分。
⒋分子与原子的联系:分子是由原子构成的,分子分成原子,原子经过组合可构成分子。
金属单质,如:铁、铜、金、汞等★⒌由原子直接构成的物质:固体非金属单质,如:硫、磷、碳、硅等稀有气体单质,如:氦气、氖气等考点3 运用分子、原子观点解释有关问题和现象(50页)⒈物理变化和化学变化★⑴物理变化:分子原子本身大小不变,只是分子间的间隔大小发生变化。
;★⑵化学变化:分子要分解成原子,原子重新组合成新的分子。
2各类物质的微观构成:混合物由多种分子构成;纯净物由一种分子构成。
单质由一种原子构成的同种分子构成;化合物由多种原子构成的同种分子构成⒊有些生活中的现象和自然现象也可用分子、原子的观点解释。
如:衣服晾晒,花香等。
考点4 原子的构成(53页)★⒈构成原子的粒子:质子、中子、电子。
原子由原子核和核外电子两部分构成。

中考人教版初三化学第三章知识点第一节 分子和原子五、分子和原子的异同六、验证分子运动的探究实验【实验操作】如右图,取适量的酚酞溶液,分别倒入A 、B 两个小烧杯中,另取一个小烧杯C ,加入约5mL 浓氨水。
用一个大烧杯罩住A 、C 两个小烧杯,烧杯B 置于大烧杯外。
观察现象。
【实验现象】烧杯A 中的酚酞溶液由上至下逐渐变红。
【实验结论】分子是不断运动的。
【注意事项】浓氨水显碱性,能使酚酞溶液变红。
浓氨水具有挥发性,能挥发出氨气。
七、从微观角度解释问题6.用分子观点解释由分子构成的物质的物理变化和化学变化物理变化:没有新分子生成的变化。
(水蒸发时水分子的间隔变大,但水分子本身没有变化,故为物理变化)化学变化:分子本身发生变化,有新分子生成的变化。
(电解水时水分子变成了新物质的分子,故为化学变化)7.纯净物和混合物(由分子构成的物质)的区别:纯净物由同种分子构成,混合物由不同种分子构成。
8.分子和原子的联系:分子是由原子构成的,同种原子结合成单质分子,不同种原子结合成化合物分子。
9.分子和原子的本质区别:在化学变化中,分子可以再分,而原子不能再分。
10.化学变化的实质:在化学变化过程中,分子裂变成原子,原子重新组合,形成新物质的分子。
第二节 原子的结构4.原子的构成原子一般是由质子、中子和电子构成,有的原子不一定有中子,质子数也不一定等于中子数。
原子的种类由核电荷数(质子数)决定。
5.构成原子的各种粒子间的关系在原子中,原子序数=核电荷数=核内质子数=核外电子数。
由于原子核所带的正电荷与核外电子所带的负电荷的电量相等,电性相反,所以原子整体不显电性。
6.相对原子质量以一种碳原子(碳12)质量的1/12(1.66×10-27kg )为标准,其他原子的质量跟它相比较所得到的比,作为这种原子的相对原子质量,符号为Ar 。
相对原子质量是通过比较得出的比值,单位为“1”。
121(kg)(kg)⨯=标准碳原子的质量一个原子的实际质量相对原子质量原子中质子和中子的质量接近碳原子质量的1/12,而电子的质量约为质子质量的1/1836,可以忽略不计,所以原子的质量集中在原子核上,即相对原子质量≈质子数+中子数第三节 元素8.定义:元素就是具有相同电荷数(即核内电子数)的一类原子的总称。

中考人教版初三化学第三章知识点第一节 分子和原子五、分子和原子的异同六、验证分子运动的探究实验【实验操作】如右图,取适量的酚酞溶液,分别倒入A 、B 两个小烧杯中,另取一个小烧杯C ,加入约5mL 浓氨水。
用一个大烧杯罩住A 、C 两个小烧杯,烧杯B 置于大烧杯外。
观察现象。
【实验现象】烧杯A 中的酚酞溶液由上至下逐渐变红。
【实验结论】分子是不断运动的。
【注意事项】浓氨水显碱性,能使酚酞溶液变红。
浓氨水具有挥发性,能挥发出氨气。
七、从微观角度解释问题6.用分子观点解释由分子构成的物质的物理变化和化学变化物理变化:没有新分子生成的变化。
(水蒸发时水分子的间隔变大,但水分子本身没有变化,故为物理变化)化学变化:分子本身发生变化,有新分子生成的变化。
(电解水时水分子变成了新物质的分子,故为化学变化)7.纯净物和混合物(由分子构成的物质)的区别:纯净物由同种分子构成,混合物由不同种分子构成。
8.分子和原子的联系:分子是由原子构成的,同种原子结合成单质分子,不同种原子结合成化合物分子。
9.分子和原子的本质区别:在化学变化中,分子可以再分,而原子不能再分。
10.化学变化的实质:在化学变化过程中,分子裂变成原子,原子重新组合,形成新物质的分子。
第二节 原子的结构4.原子的构成原子一般是由质子、中子和电子构成,有的原子不一定有中子,质子数也不一定等于中子数。
原子的种类由核电荷数(质子数)决定。
5.构成原子的各种粒子间的关系 在原子中,原子序数=核电荷数=核内质子数=核外电子数。
由于原子核所带的正电荷与核外电子所带的负电荷的电量相等,电性相反,所以原子整体不显电性。
6.相对原子质量以一种碳原子(碳12)质量的1/12(1.66×10-27kg )为标准,其他原子的质量跟它相比较所得到的比,作为这种原子的相对原子质量,符号为Ar 。
相对原子质量是通过比较得出的比值,单位为“1”。
121(kg)(kg)⨯=标准碳原子的质量一个原子的实际质量相对原子质量 原子中质子和中子的质量接近碳原子质量的1/12,而电子的质量约为质子质量的1/1836,可以忽略不计,所以原子的质量集中在原子核上,即相对原子质量≈质子数+中子数第三节 元素8.定义:元素就是具有相同电荷数(即核内电子数)的一类原子的总称。

第三章微粒的性质一、微粒的性质(1) 构成物质的微粒极小、肉眼看不见。
构成物质的微粒极小、肉眼看不见。
(2) 不论气体、液体还是固体,构成物质的微粒都在不停地运动。
不论气体、液体还是固体,构成物质的微粒都在不停地运动。
微粒的运动速率受温度影响,温度越高,微粒运动速率越快。
微粒的运动速率受温度影响,温度越高,微粒运动速率越快。
(3) 构成物质的微粒之间都有一定的空隙。
构成物质的微粒之间都有一定的空隙。
微粒间空隙大小受温度的影响,温度越高,微粒间空隙越大;微粒间空隙大小受温度的影响,温度越高,微粒间空隙越大;气体物质的微粒间空隙较大,因而受压强的影响,压强越大,微粒间空隙越小,气体体积变小;固体、液体微粒间空隙本身较小,难被压缩。
小,气体体积变小;固体、液体微粒间空隙本身较小,难被压缩。
※注意:1.温度对微粒的运动速率与微粒间的空隙大小都产生影响。
在分析时,可根据具体现象回答主要影响。
可根据具体现象回答主要影响。
2.物体的“热胀冷缩”现象、物体随温度的“三态”变化都可以用温度改变时,微粒间空隙大小改变来解释。
间空隙大小改变来解释。
二、构成物质的微粒(1)构成物质的基本微粒有分子、原子、离子。
构成物质的基本微粒有分子、原子、离子。
①由原子构成的物质①由原子构成的物质金属,如铁、铜、镁等,金属中除了金属原子,还有金属离子和电子;金属,如铁、铜、镁等,金属中除了金属原子,还有金属离子和电子; 稀有气体,如氦气、氖气、氩气等;稀有气体,如氦气、氖气、氩气等;少数固态非金属,如:金刚石、石墨、硅等。
少数固态非金属,如:金刚石、石墨、硅等。
②由分子构成的物质②由分子构成的物质大多数非金属单质,如氢气、氧气、氮气、硫、磷等;大多数非金属单质,如氢气、氧气、氮气、硫、磷等; 由非金属与非金属元素形成的化合物,如水、二氧化碳、二氧化硫、氨气、氯化氢、酒精等。
氢、酒精等。
③由离子构成的物质③由离子构成的物质氯化钠、活泼金属氧化物,如氧化镁、氧化钙等氯化钠、活泼金属氧化物,如氧化镁、氧化钙等(2)保持物质化学性质的微粒(或最小微粒)就是构成物质的微粒。
初三化学第三章第一节[水是人类宝贵的自然资源]练习
【同步达纲练习】
一、选择题(6小题×10分/题=60分)
1.下列关于水的存在的说法,不正确的是()
A.某些蔬菜含水量高达90%以上B.人体含水约占人体质量的2/3
C.江河湖海约占地球表面积的1/4
2.下列物质属于纯净物的是()
A.含氧元素80%的水 B.纯净的盐水C.铁水D.汽水
3下列物质属于混合物的是()
A.蒸馏水B.水蒸气C.冰水D.矿泉水
4.渔民在海上遇到淡水用完该怎么办()
A.喝海水B.赶快返航C.将海水蒸馏成淡水D.吃海生动物得到水
5.下列做法有利于保护江河水资源的是()
①废水经过处理达标后再向江河排放②不允许在江河边建造垃圾站
③在河岸种植树木并严禁乱砍乱伐④船上垃圾集中处理
A.只有①③B.只有②④C.①②③④D.全都不是
6.下列做法对人类生存环境有利的是()
①合理种植花草树木②利用水力发电代替火力发电③控制含碳、硫元素矿物燃料的燃烧④禁止使用高毒性、难分解的农药
A.①②③④B.只有③④C.只有②③④D.只有④
二、填空题(4小题,共40分)
7.有人说把地球称为水球更合适一些,这是因为水约占地球表面积的,但地面淡水量还不到总水量的。
世界上用于农业的淡水占人类消耗淡水总量的,故
科学家预言,,不久将来成为一个深刻的社会危机,因此,每个人都应保护水,树立起的好风尚,人类长期的重要的任务是和 .
8.水是人类宝贵的自然财富,如果没有水都不能生存.工业上要用大量的水来、、或,并用水作原料来制造等产品.农业上用水来农田.
9.工业生产中的、、和的任意排放;农业生产中施用的、随雨水流入河中都使水受到污染.因此我们食用的自来水要经过、,同时还要进行、.
10.我国的四大发明中,与化学关系最密切的是、,其中用到水较多的是.与上述有关的,极易造成水污染的工业生产是,极易造成大气污染的产品是.
【素质优化训练】
1.1mL水约20滴,某容器若每秒漏2滴水,一昼夜所漏的水有多少?可供一个人补充水分多少天?(以一个人口补充水2.5升计算)
2.近期人类解决水危机的方法有哪些?
3.生物之间存在着一定的食物联系,叫食物链.跟人类有关的食物链主要有两条:
(1)土壤→植物→禽畜→人;
(2)水→浮游植物→浮游动物→鱼→人.
请根据食物链说明,保护水资源和防止水污染的重要性.
【生活实际运用】
1.武汉市的东湖是大自然赐给武汉市的宝贵财富.但随着工业发展和人们物质生活水平的提高,东湖水质日益恶化.如因为水中的某些营养元素含量过高,导致水面上的藻类疯狂生长、繁殖,水发出腥臭味,并造成鱼类缺氧而死亡.目前,武汉市政府加大了整治东湖水质的力度.请你根据自己的切实体会提出几条可行性建议.
2.近年来我国北方许多省市发生干旱、相继发生缺水危机.水资源严重不足,影响了这些地区的人们生活和经济的发展.你能说出我国南水北调工程将什么地方的水往什么地方调吗?
【知识验证实验】
取两只蒸发血和两只烧杯,在一只烧杯中加入50mL的蒸馏水,在另一只烧杯中加入50
mL的湖水(取清亮透明的),对比两烧杯中的水,有什么明显区别.分别取少量(约20mL)倒入两个蒸发皿中,用酒精灯加热,直至水被蒸干,看看能否找出哪只蒸发血中装的是湖水.
【知识探究学习】
“联想与启示”也是借助于它学习化学的一种方法,通过一种知识的学习,经过联想、迁移,而获得新的知识.例如,自来水是把江、河里的水引入水厂,经过净化、消毒处理后的水.矿泉水中含有一些有益于健康的元素.海水中含有氯化钠等多种物质,是咸水,不宜饮用.请思考这些水与纯净的水之间有什么联系与区别.
第二节水的组成练习
同步自测一。