中考化学复习专题7 饱和溶液和溶解度
- 格式:ppt
- 大小:1.30 MB
- 文档页数:51



溶解度与饱和溶液的关系溶解度是指在一定温度下,单位溶剂中最多能溶解的溶质的量。
而饱和溶液是指溶剂在一定温度下已溶解了最大量的溶质,无法再溶解更多的溶质。
溶解度与饱和溶液之间存在着密切的关系。
首先,溶解度是衡量溶剂对溶质溶解能力的指标。
在相同温度下,溶解度越大,说明溶剂具有更强的溶解能力。
而饱和溶液则反映了溶剂在特定条件下,能够溶解的最大量溶质。
当达到饱和状态时,溶剂无法再溶解更多的溶质,溶解度的值也就确定下来了。
其次,温度对溶解度和饱和溶液的形成有着重要的影响。
通常来说,溶解度随温度的升高而增大。
这是因为温度升高能够增加溶剂分子的动能,使其具有更大的分子间间隔,从而有利于溶质分子插入其中。
因此,高温下溶质的溶解度较高,更容易形成饱和溶液。
但也有一些特殊情况,如氧气在水中的溶解度随温度升高而减小。
此外,溶解度还受到溶质和溶剂之间相互作用力的影响。
相互作用力越强,溶质与溶剂之间的吸引力越大,溶解度也就越大。
例如,极性溶质在极性溶剂中的溶解度通常较大,而非极性溶质在非极性溶剂中的溶解度也较大。
此外,在一定温度下,溶质的浓度也会影响溶解度和饱和溶液的形成。
一般来说,当溶剂中溶质的浓度接近其溶解度时,饱和溶液会形成。
然而,如果溶质的浓度远低于其溶解度,那么饱和溶液的形成速度会很慢,甚至无法形成饱和溶液。
综上所述,溶解度与饱和溶液是紧密相关的。
溶解度是溶剂对溶质溶解能力的指标,而饱和溶液则表示溶剂已溶解了最大量的溶质。
溶解度受到温度、相互作用力和溶质浓度的影响。
对溶液的研究有助于我们更好地理解溶解过程,以及在实际应用中的相关问题。

考点十七:溶解度概念:在一定温度下,某固态物质在100g溶剂里达到饱和状态时所溶解的质量,叫做这种物质在这种溶剂里,该温度下的溶解度。
正确理解溶解度概念的要素:①条件:在一定温度下,影响固体物质溶解度的内因是溶质和溶剂的性质,而外因就是温度。
如果温度改变,则固体物质的溶解度也会改变,因此只有指明温度时,溶解度才有意义。
②标准:“在100g溶剂里”,需强调和注意的是:此处100g是溶剂的质量,而不是溶液的质量。
③状态:“达到饱和状态”,溶解度是在同一条件下某种物质溶解能力大小的标准,只有达到该条件下溶解的最大值,才可知其溶解度,因此必须要求“达到饱和状态”。
④单位:溶解度是所溶解的质量,常用单位为克(g)。
易错考点溶解度曲线的应用a.根据溶解度曲线可以查出某物质在一定温度下的溶解度;b.可以比较不同物质在同一温度下的溶解度大小;c.可以知道某物质的溶解度随温度的变化情况;d.可以选择对混合物进行分离或提纯的方法;e.确定如何制得某温度时某物质的饱和溶液的方法等。
例题分析例题1:为了探究影响物质溶解性的因素,老师演示了以下实验:如图所示是碘或高锰酸钾分别放入水或汽油中.(1)观察①②两支试管的现象,可以得出影响物质溶解性的因素之一是_____.(2)观察②④两支试管的现象,可以得出影响物质溶解性的因素之一是______.(3)影响物质溶解性的因素还有______.答案:(1)与溶剂的种类有关;(2)与溶质的种类有关;(3)温度.解析:【解答】(1)碘几乎不溶于水,但易溶于汽油,所以影响碘的溶解性的因素是溶剂不同,所以与溶剂的种类有关;(2)碘易溶于汽油,高锰酸钾几乎不溶于汽油,而溶质的种类不同,所以影响溶解性的因素还与溶质的种类有关;(3)升高温度,分子运动速度加快,物质溶解的速度加快,所以影响物质溶解性的因素还有温度.【分析】:溶解性的大小与溶质,溶剂的性质(内因)有关,也与温度,压强(外因)有关。

中考化学复习---溶解度解答题练习(含答案解析)1.(2022•湖北)如图为甲、乙、丙三种固体物质的溶解度曲线,据图回答问题。
(1)t1℃时,甲、丙两种物质的溶解度大小关系是甲=丙(填“>”“<”或“=”)。
(2)溶解度随温度的升高而减小的物质是丙。
(3)t2℃时,将甲、乙两种物质的饱和溶液降温至t1℃,对所得溶液的叙述正确的是 C (填序号)。
A.甲溶液仍是饱和溶液,乙溶液变为不饱和溶液B.溶液中溶剂的质量甲<乙C.溶液中溶质的质量分数甲<乙【答案】(1)=;(2)丙;(3)C。
【解答】解:(1)t1℃时,甲、丙两种的溶解度曲线交于一点,甲、丙的溶解度相等。
(2)溶解度随温度的升高而减小的物质是丙。
(3)A、t2℃时,将甲、乙两种物质的饱和溶液降温至t1℃,甲、乙的溶解度均减小,均有晶体析出,甲、乙溶液均仍是饱和溶液,故选项说法错误。
B、t2℃时,将甲、乙两种物质的饱和溶液降温至t1℃,甲、乙的溶解度均减小,均有晶体析出,但选项说法无法确定饱和溶液的质量,无法确定溶液中溶剂的质量的关系,故选项说法错误。
C、t2℃时,将甲、乙两种物质的饱和溶液降温至t1℃,甲、乙的溶解度均减小,均有晶体析出,甲、乙溶液是t1℃时的饱和溶液,t1℃,甲的溶解度小于乙的溶解度,则溶液中溶质的质量分数甲<乙,故选项说法正确。
故答案为:(1)=;(2)丙;(3)C。
2.(2020•朝阳)如图,请根据A、B、C三种固体物质的溶解度曲线回答下列问题:(1)在t2℃时,A、B、C三种固体物质的溶解度大小关系是A=B>C 。
(2)当A中混有少量B时,提纯A的方法是降温结晶。
(3)在t3℃时,将等质量的A、B、C三种物质的饱和溶液降温到t1℃,所得溶液中溶剂质量最多的是 C 。
(4)在t3℃时,将30g的A物质加入到50g水中,充分溶解后所得溶液的质量为70 g。
【答案】(1)A=B>C;(2)降温结晶;(3)C;(4)70。
【解答】解:(1)通过分析溶解度曲线可知,在t2℃时,A、B、C三种固体物质的溶解度大小关系是A=B>C;(2)A物质的溶解度受温度变化影响较大,所以当A中混有少量B时,提纯A的方法是降温结晶;(3)t3℃时,A物质的溶解度最大,C物质的溶解度最小,等质量的A、B、C三种物质的饱和溶液中,A中的溶剂最少,C中的溶剂最多,降温到t1℃,不会影响溶剂质量的变化,所得溶液中溶剂质量最多的是C;(4)在t3℃时,A物质的溶解度是40g,将30g的A物质加入到50g水中,只能溶解20g的晶体,所以充分溶解后所得溶液的质量为70g。

中考化学知识点:溶解度的计算(学习版)编制人:__________________审核人:__________________审批人:__________________编制学校:__________________编制时间:____年____月____日序言下载提示:该文档是本店铺精心编制而成的,希望大家下载后,能够帮助大家解决实际问题。
文档下载后可定制修改,请根据实际需要进行调整和使用,谢谢!并且,本店铺为大家提供各种类型的教育资料,如语文资料、数学资料、英语资料、物理资料、化学资料、地理资料、政治资料、历史资料、艺术资料、其他资料等等,想了解不同资料格式和写法,敬请关注!Download tips: This document is carefully compiled by this editor.I hope that after you download it, it can help you solve practical problems. The document can be customized and modified after downloading, please adjust and use it according to actual needs, thank you!In addition, this shop provides various types of educational materials for everyone, such as language materials, mathematics materials, English materials, physical materials, chemical materials, geographic materials, political materials, historical materials, art materials, other materials, etc. Please pay attention to the data format and writing method!中考化学知识点:溶解度的计算新一轮中考复习备考周期正式开始,本店铺为各位初三考生整理了各学科的复习攻略,主要包括中考必考点、中考常考知识点、各科复习方法、考试答题技巧等内容,帮助各位考生梳理知识脉络,理清做题思路,希望各位考生可以在考试中取得优异成绩!下面是《2022中考化学知识点:溶解度的计算》,仅供参考!溶解度的计算固体物质溶解度的概念是:在一定温度下,某固态物质在100克溶剂里达到饱和状态时所溶解的质量,叫做这种物质在这种溶剂里的溶解度。
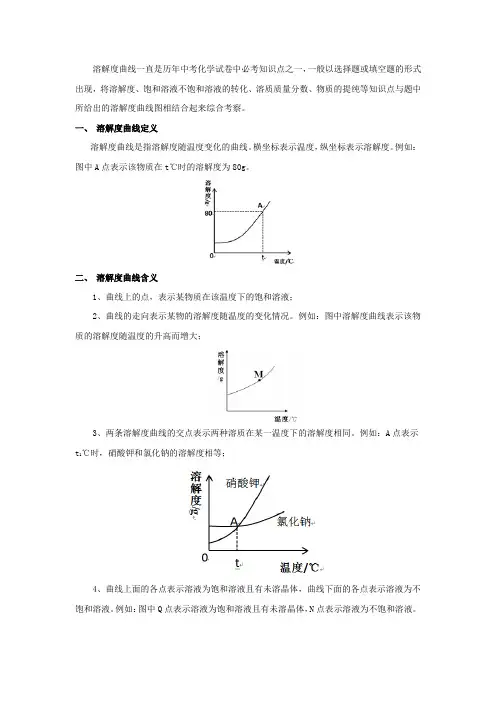
溶解度曲线一直是历年中考化学试卷中必考知识点之一,一般以选择题或填空题的形式出现,将溶解度、饱和溶液不饱和溶液的转化、溶质质量分数、物质的提纯等知识点与题中所给出的溶解度曲线图相结合起来综合考察。
一、溶解度曲线定义溶解度曲线是指溶解度随温度变化的曲线。
横坐标表示温度,纵坐标表示溶解度。
例如:图中A点表示该物质在t℃时的溶解度为80g。
二、溶解度曲线含义1、曲线上的点,表示某物质在该温度下的饱和溶液;2、曲线的走向表示某物的溶解度随温度的变化情况。
例如:图中溶解度曲线表示该物质的溶解度随温度的升高而增大;3、两条溶解度曲线的交点表示两种溶质在某一温度下的溶解度相同。
例如:A点表示t1℃时,硝酸钾和氯化钠的溶解度相等;4、曲线上面的各点表示溶液为饱和溶液且有未溶晶体,曲线下面的各点表示溶液为不饱和溶液。
例如:图中Q点表示溶液为饱和溶液且有未溶晶体,N点表示溶液为不饱和溶液。
三、溶解度曲线应用1、查找某一温度下物质的溶解度。
例如:查找图中甲物质在t3℃时的溶解度,就是Q点对应的纵坐标,也就是说,在t3℃时甲物质的溶解度为80g;2、比较某一温度下两种物质溶解度的大小。
例如:比较乙丙两种物质的溶解度大小,从图上可知,乙的溶解度是大于丙的;3、选择使某种物质从溶液中的结晶方法。
结晶的方法一般分为三种,分别是降温结晶、蒸发结晶和升温结晶。
降温结晶(又称冷却热饱和溶液),它适用于溶解度受温度影响较大的物质从溶液中结晶出来,例如图甲或硝酸钾;蒸发结晶,它适用于溶解度受温度影响不大,例如图乙或氯化钠;升温结晶,它适用于溶解度随温度的升高而减小,例如图丙或熟石灰。
四、典型例题1、下图为甲、乙两种固体物质在水中的溶解度曲线.下列说法错误的是( )A.甲物质的溶解度随温度的升高而增大B.在t1℃时,甲、乙两种物质的溶解度相等C.在t2℃时,N点表示甲物质的不饱和溶液D.在t1℃时,100g乙物质的饱和溶液中溶质的质量是25g2、下图是甲、乙两种固体物质在水中的溶解度曲线.下列说法不正确的是( )A.10℃时,甲、乙两种物质的饱和溶液浓度相同B.保持20℃,蒸发溶剂可使接近饱和的乙溶液变成饱和溶液C.30℃时,将40g甲物质加人50g水中,充分溶解后溶液的质量为80gD.10℃时,将两种饱和溶液升温至30℃,溶液中溶质的质量分数都增大3、下图是X、Y、Z三种固体物质的溶解度曲线图,根据曲线图回答下列问题.(1)如果要配制相同浓度的Y、Z饱和溶液,需要把温度控制在________℃.(2)t1℃时,将X、Y、Z的饱和溶液都升温到t3℃,溶液仍然饱和的是________的溶液.(3)t3℃时,将X、Y、Z的饱和溶液都降温到t1℃,溶液中溶质质量分数由小到大的顺序为________.4、如下图是甲、乙两种固体物质的溶解度曲线.(1)________℃时,甲、乙两种物质的溶解度相等.(2)t2℃时,将等质量的甲、乙两种物质加水溶解配制成饱和溶液,所得溶液质量的大小关系为:甲________乙(填“>”“<”或“=”).(3)把甲物质的不饱和溶液变为饱和溶液,下列有关说法正确的是________(填序号,下同).A.溶剂的质量一定变小B.溶质的质量可能不变C.溶质的质量分数一定变大D.溶液的质量一定变大E.该饱和溶液还可以溶解其他物质质量守恒定律是初中化学学到唯一的一个定律,是中考必考的一个知识点,也是中考化学的热点内容。

初三化学学科精讲精练——溶解度专题知识点:一、溶液1.(1)溶液:一种或几种物质分散到其他物质中形成的均一的、稳定的混合物(2)溶质:被溶解的物质(3)溶剂:溶解其他物质的物质2.溶液的特征(1)均一性:溶液中的各个部分成分、性质均相同注:溶液中的分子或离子在不断运动(2)稳定性:外界条件不变的情况下,溶液保持稳定(不会出现沉淀、分层)(3)溶液不一定是液体例:合金是固体溶液;空气是气体溶液3.溶解过程中的吸、放热(1)吸热:硝酸铵;(2)放热:浓硫酸、氢氧化钠;(3)大部分溶解都不引起温度变化;4.影响溶解的因素(1)溶剂的种类——相似相溶例:高锰酸钾易溶于水,难溶于酒精;碘单质易溶于酒精,难溶于水(2)温度:对于大部分固体:温度越高,溶解越多;对于气体:温度越高,溶解越少;(3)压强——针对气体压强越大,溶解越多5.悬浊液、乳浊液、乳化作用(1)悬浊液:固体和液体形成的不均一、不稳定的体系(如泥沙入水)(2)乳浊液:液体和液体形成的不均一、不稳定的体系(如油入水)(3)乳化现象:在不稳定的乳浊液中加入一种稳定剂(乳化剂)形成一种均一、稳定的乳化液,这种现象叫乳化现象。
注:乳化后的混合物并不是溶液,溶质并不以分子形式存在二、饱和溶液与溶解度1.(1)饱和溶液:一定温度、一定质量的溶剂,当溶质不能继续溶解时,此溶液成为饱和溶液;(2)不饱和溶液:一定温度、一定质量的溶剂,当溶质仍能继续溶解时,此溶液成为饱和溶液;(3)判断:若容器中有固体剩余,说明是饱和溶液;(4)转化:①饱和溶液→不饱和溶液:添加溶剂或升温;②不饱和溶液→饱和溶液:添加溶质或减少溶剂(恒温蒸发)或降温;2.溶解度(1)固体溶解度①定义:一定温度下,使100g 水达到饱和的溶质的质量,称为该溶质的饱和度②溶解度曲线a.点的含义:——在曲线上方,饱和溶液且有固体剩余;——曲线上,恰好达到饱和;——在曲线下方,不饱和溶液;b.点的转化——在曲线上方,通过升温或增加溶剂,使固体溶解;——曲线上,可通过升温或增加溶剂,变为不饱和溶液;或通过降温或蒸发溶剂,使固体析出;——在曲线下方,通过降温或蒸发溶剂,使溶液饱和;c.在溶解度的相关判断中,一定要注意必须同时提及温度相同且为饱和溶液(即“温”“饱”)注:若提及溶质的质量,则必须提及溶剂的质量d.溶解度曲线较陡的物质,提纯手段:冷却热饱和溶液;溶解度曲线较缓的物质,提纯手段:蒸发结晶例题:1.(2019•秦淮区二模)t℃时,某固体物质(不含结晶水)的饱和溶液中,溶质质量随溶剂质量的变化如图中斜线所示.下列说法正确是()A.由图可知,温度升高,该物质的溶解度增大B.由图可知,t℃时,该物质的溶解度为40C.N 点表示的溶液中,溶质的质量分数为20%D.P 点、Q 点表示的溶液中,溶质的质量分数相同【考点】7I:饱和溶液和不饱和溶液;7L:固体溶解度的概念;7R:溶质的质量分数.【分析】根据题干提供的信息结合图象进行分析,绘制的此图是在同一温度下固体物质在不同质量的水中达到饱和状态时所溶解的质量,溶解度是指在一定温度下某固体物质在100g 水中达到饱和状态时所溶解的质量.【解答】解:A、图示不能体现溶解度和温度的关系,故A 错误;B、由图可知,t℃时,该物质的溶解度为40g,溶解度的单位是克;故B 错误;C、N 点表示溶液中溶质的质量分数为=16.7%,故C 错误;D、P 点、Q 点表示的是同一温度下的饱和溶液,故溶质的质量分数相同,故D 正确;故选:D。
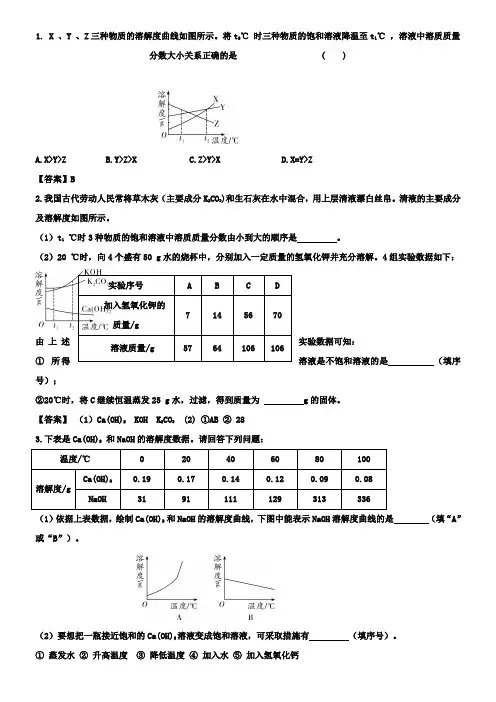
1. X 、Y 、Z三种物质的溶解度曲线如图所示。
将t2℃时三种物质的饱和溶液降温至t1℃,溶液中溶质质量分数大小关系正确的是 ( )A.X>Y>ZB.Y>Z>XC.Z>Y>XD.X=Y>Z【答案】B2.我国古代劳动人民常将草木灰(主要成分K2CO3)和生石灰在水中混合,用上层清液漂白丝帛。
清液的主要成分及溶解度如图所示。
(1)t1℃时3种物质的饱和溶液中溶质质量分数由小到大的顺序是。
(2)20 ℃时,向4个盛有50 g水的烧杯中,分别加入一定质量的氢氧化钾并充分溶解。
4组实验数据如下:由上述实验数据可知:①所得溶液是不饱和溶液的是(填序号);②20℃时,将C继续恒温蒸发25 g水,过滤,得到质量为 g的固体。
【答案】(1)Ca(OH)2 KOH K2CO3 (2) ①AB ② 283.下表是Ca(OH)2 和NaOH的溶解度数据。
请回答下列问题:温度/℃0 20 40 60 80 100溶解度/gCa(OH)2 0.19 0.17 0.14 0.12 0.09 0.08NaOH 31 91 111 129 313 336(1)依据上表数据,绘制Ca(OH)2 和NaOH的溶解度曲线,下图中能表示NaOH溶解度曲线的是(填“A”或“B”)。
(2)要想把一瓶接近饱和的Ca(OH)2溶液变成饱和溶液,可采取措施有(填序号)。
①蒸发水②升高温度③降低温度④加入水⑤加入氢氧化钙实验序号 A B C D加入氢氧化钾的质量/g7 14 56 70溶液质量/g 57 64 106 106(3)现有60 ℃时含有Ca(OH)2 和NaOH两种溶质的饱和溶液,若要得到较纯净的NaOH晶体,应采取的物理方法是。
(4)现有20 ℃时Ca(OH)2的饱和溶液(甲溶液),向其中加入一定量CaO后恢复20 ℃,得到乙溶液,溶液中溶质的质量分数的关系为甲乙(填“>”、“<”或“=”)。

中考化学专题--溶解度(附解析)溶解度一、选择题1.如图是甲、乙两种固体物质的溶解度曲线.下列说法错误的是()A.T℃时,甲、乙两物质的溶解度相等B.乙的饱和溶液降温时,溶质质量分数保持不变C.甲中混有少量乙,可采用降温结晶的方法提纯甲D.T℃时,甲的饱和溶液溶质质量分数为20%2.t℃时,向一支盛有0.15g熟石灰的烧杯中加入50g 水,充分振荡后静置,烧杯底部仍有未溶解的白色固体.下列相关叙述正确的是()A.升高温度上层清液变为不饱和溶液B.t℃时,熟石灰的溶解度为0.3gC.烧杯中溶液的质量小于50.15gD.上层清液中溶质质量分数大于0.3%3.下列说法不合理的是()A.“卤面”制作时,加入氯化钠当调味剂B.大脖子病是人体缺乏铁元素引起的C.大部分物质的溶解度随温度的升高而增大D.水受热膨胀是由于水分子间的距离变大4.T℃时,将少量生石灰放入一定质量的饱和石灰水中,搅拌并冷却至原温度,得到的溶液与原溶液相比,下列物理量前后不变的是()①溶质的质量②溶剂的质量③溶液的质量④溶质的质量分数⑤溶解度.A.①③⑤B.②④⑤C.②④D.④⑤5.下列四个图象能正确反应对应实验操作的是()A.向一定量的饱和石灰水中不断加入生石灰B.向等质量的锌、铁中滴加等质量分数的稀盐酸C.向一定的氧化铁入一氧化碳气体并持续高温D.向一定量的氢氧化钠和氯化钡的混合溶液中滴加稀硫酸6.下表是KCl固体在不同温度时的溶解度.下列说法错误的是()温度/℃020406080溶解度/g27.634.040.045.551.1A.KCl固体的溶解度随温度的升高而增大B.80℃时,KCl固体的溶解度是51.1gC.60℃的KCl饱和溶液降温后会有晶体析出D.20℃时,KCl饱和溶液的溶质质量分数为34.0% 7.下列说法不正确的是()A.物质的溶解度一定随温度的升高而增大B.蔗糖水属于溶液C.在一定条件下,饱和溶液与不饱和溶液之间可以相互转换D.打开汽水瓶盖,汽水会自动喷出来,证明气体的溶解度和压强有关8.小同学用某固体物质进行如图所示的实验,根据实验判断下列说法不正确的是()A.该固体物质的溶解度随温度的升高而增大B.溶液b一定是不饱和溶液C.溶液d中溶质质量一定大于溶液e中的溶质质量D.溶液d和溶液e的溶质质量分数可能相同9.下表列出了硝酸钾在不同温度时的溶解度.温度/℃10203040溶解度/g20.931.645.863.9某兴趣小组做了如图实验:下列说法中正确的是()A.①②③中溶液都为不饱和溶液B.②③中都含有末溶解的固体C.①②③中溶液的质量相等D.③中溶质质量分数最大10.在化学知识中有许多规律,下列具体物质的性质符合对应规律的是()A.某些非金属氧化物能和碱反应生成盐和水;例如:二氧化碳和三氧化硫B.一般固体物质的溶解度随温度的升高而增大;例如:氢氧化钙和氯化钠C.常温下金属一般为固态;例如:汞和金D.某些非金属单质可以将金属从其氧化物中还原出来;例如:氢气和一氧化碳11.如表是NaCl、KNO3在不同温度时的溶解度温度/℃0溶解度/gNaCl35.836.036.336.637.037.3KNO320.931.645.863.985.5110据此数据,下列有关说法中错误的是()A.在40℃时,100g水中最多可溶解KNO363.9g B.KNO3和NaCl的溶解度曲线在20℃~40℃温度围相交C.在60℃时,KNO3饱和溶液210g加入10g水后,溶质质量分数为50%D.在20℃时KNO3和NaCl的混合溶液100g,恒温蒸发,先析出的晶体一定是NaCl12.KCl与KNO3在不同温度的溶解度数据如表.则下列说确的是()温度/℃1020304050KCl30g33g35g38g41gKNO321g31g45g65g88gA.KNO3比KCl的溶解度大B.两物质的溶解度相等的温度在20~30℃之间C.在20℃时,10g水中加入5gKCl可得到33.3%的KCl 溶液D.在50℃时,两物质各5g分别加入10g水中,充分溶解,均有固体剩余13.Ca(OH)2在不同温度时的溶解度如下表:温度/℃020406080溶解度/g0.180.160.140.110.09根据表息,判断下列说确的是()A.Ca(OH)2的溶解度随温度的升高而增大B.20℃时,Ca(OH)2的溶解度为0.16gC.40℃时,降低Ca(OH)2饱和溶液温度会析出溶质D.60℃时,向100g水中加入0.20gCa(OH)2充分搅拌,固体完全溶解14.物质M在不同温度下的溶解度数据如下表所示,以下说确的是()温度(℃)020406080溶解度(g)12.615.320.025.038.2A.0℃时,15.9gM溶于150g水中形成饱和溶液B.20℃时,M形成饱和溶液的溶质质量分数是15.3% C.若要配制200.0g20.0%的M的饱和溶液,对应温度必须是60℃D.80℃时,M的饱和溶液138.2g降温至40℃,析出晶体的质量大于20.0g15.硝酸钾在不同的溶解度数据如表,下列说法错误的是()温度/℃0溶解度/g13.331.663.9110169246A.硝酸钾的溶解度受温度影响变化较大B.60℃时,饱和硝酸钾溶液中溶质与溶液质量之比为11:21C.20℃时,10g水中加入5g硝酸钾充分溶解后再加入5g 水,前后溶质的质量分数不变D.将溶质质量分数为28%的硝酸钾溶液从60℃降温至20℃,没有晶体析出16.下列有关量的变化图象与其对应叙述相符的是()A.常温下,向一定量的饱和石灰水中加入氧化钙B.t℃时,向等质量的甲、乙、丙三种物质中分别加水配成饱和溶液,所得溶液质量最小的是丙C.向一定质量的过氧化氢的水溶液中加入二氧化锰D.向等质量的铁和镁中分别加入足量的稀盐酸17.科学研究中常用图象来表示两个量(x,y)之间的关系,以使研究的间压变得直观明了.在某温度下.将少量氧化钙加入到一定量的饱和氢氧化钙溶液中.图甲表示整个过程中温度的变化,图乙表示氢氧化钙的溶解度与温度的关系.小阳同学要依据观察和思考,作出了如图丙所示的图象,此图象反映了该过程中()A.溶质的质量与时间的关系B.溶剂的质量与时间的关系C.溶质的溶解度与时间的关系D.溶质的质量分数与时间的关系二、填空题18.下表是NaCl、KNO3在不同温度(℃)时溶解度(g)温度(t)90100溶解度(s)NaCl35.735.836.036.336.637.037.337.838.439.039.8 KNO313.320.931.645.863.985.02246分析上表,回答问题(1)60℃时,KNO3的溶解度为g(2)溶解度受温度变化影响较小的是.(3)20℃时,NaCl饱和溶液溶质质量分数是(精确到0.1g).(4)温度为t℃时,NaCl和KNO3的溶解度相等且为S克,则S的取值围是.19.如图1是a、b、c三种物质的溶解度曲线,回答下列问题:(1)P点的含义是.(2)t2℃时,将50ga物质放入50g水中充分溶解得到溶液的质量为g.(3)将t2℃时,a、b、c三种物质的饱和溶液降温至t1℃,所得溶液中溶质的质量分数由大到小的顺序是.(4)t1℃时,将盛有c的饱和溶液的小试管放入盛水的烧杯中(如图2),向水中加入一定量的氢氧化钠固体后,试管中的溶液变浑浊,原因是.20.根据下表中的数据,回答下列问题:温度/℃溶解度/gKCl34.040.045.651.156.7KNO331.663.9110169246(1)20℃时KCl的溶解度是;(2)20℃时将20gKCl与50g水混合,充分溶解后,所得溶液为(填“饱和”或“不饱和”);(3)上表两种物质中,的溶解度受温度的影响大.21.下表是KNO3、NaCl在不同温度下的溶解度(单位:g/100g水)温度(℃)90100KNO313.320.93245.86485.02246NaCl35.735.83636.336.63737.337.838.43939.8①以上两种物质溶解度的变化受温度影响较小的是.②30℃时,KNO3的溶解度是g/100g水.③KNO3溶液中含有少量NaCl时,可通过的方法提纯.④对③析出的晶体剩余溶液描述正确的是(填写编号).I、剩余溶液一定是KNO3饱和溶液II、剩余溶液一定是NaCl不饱和溶液III、上述方法可以将两者完全分开IV、析出的晶体中只含有KNO3.22.下表是固体A和固体B在不同温度时的溶解度.温度/℃020406080溶解度/g固体A35.736.036.637.338.4固体B13.331.663.9110169(1)从表中数据可以看出固体A和固体B的溶解度随温度升高而(填“增大”或“减小”).(2)20℃时,把50g固体A放入100g水中,充分溶解后,所得溶液质量为g.(3)40℃时,A、B两种物质的饱和溶液中溶质的质量分数较大的是.(4)若B饱和溶液中有少量的A,可用下列法提纯B(填序号).①趁热过滤②蒸发结晶③冷却热饱和溶液.23.根据表中的数据,回答下列问题.温度/℃0溶解度/NaCl35.736.036.637.338.439.8KNO313.331.663.9110169246(1)40℃时,NaCl的溶解度是.(2)20℃时,称取31.6gKNO3固体加入盛有100g水的烧杯中,充分溶解形成的溶液是(填“饱和”或“不饱和”)溶液;称取31.6gKNO3固体时,发现托盘天平指针偏右,接下来的操作是.(3)当KNO3中混有少量NaCl时,提纯KNO3所采用的方法为.(4)将等质量KNO3的饱和溶液和NaC1的饱和溶液从60℃降温到20℃,对所得溶液的叙述正确的是(填序号).A、都是饱和溶液B、溶剂质量:KNO3>NaClC、溶液质量:KNO3<NaCl.24.下表是NaCl,KCl,KNO3三种物质在不同温度下的溶解度.温度/℃0溶解度/gNaCl35.736.036.637.338.439.8KCl27.634.040.045.551.156.7KNO313.331.663.9110169246(1)20℃时,NaCl的溶解度是g;(2)若NaCl和KCl的溶解度相等,对应表中最小温度围应在℃之间;(3)三种物质中,溶解度受温度影响变化最大的是,在一定温度下,要将该物质从其饱和溶液中结晶析出,最好的办法是.25.下表是KNO3、NaCl在不同温度下的溶解度(单位:g/100g水)温度(℃)90100KNO313.320.93245.86485.02246NaCl35.735.83636.336.63737.337.838.43939.8(1)以上两种物质溶解度的变化受温度影响较小的是;(2)50℃时,KNO3的溶解度是g/100g水;(3)KNO3溶液中含有少量NaCl时,可通过的方法提纯;(4)对(3)析出的晶体和剩余溶液描述正确的是(填写编号)A.剩余溶液一定是KNO3饱和溶液B.剩余溶液一定不含有NaClC.剩余的溶液一定是纯净物D.析出的晶体中只含有KNO3.26.下表是KNO3的部分溶解度数据,请回答问题:(1)40℃时,将70gKNO3固体加入100g水中,充分搅拌,形成的溶液质量为g.(2)60℃时,KNO3的饱和溶液中得到晶体的一种方法是.(3)依据表中数据,请在如图坐标图中画出KNO3溶解度曲线的草图.温度/℃0204060溶解度/g13.331.663.9110三、解答题27.分析处理图表中的信息是学习化学的一种重要方法.(1)如表是氯化钠和碳酸钠在不同温度时的溶解度,根据此表回答:温度/℃10203040溶解度/g氯化钠35.836.036.336.6碳酸钠12.221.839.753.2①40℃时,氯化钠的溶解度为g.②碳酸钠的溶解度随温度的升高而(填“增大”或“减小”).在20℃时,将100g的水加入30g碳酸钠中,充分搅拌后得到的是(填“饱和溶液”或“不饱和溶液”),将上述溶液升温到30℃,该溶液的溶质质量分数为(计算结果精确到0.1%).③10℃时,分别配制表中两种物质的饱和溶液,其中溶质质量分数较小的物质是.(2)将足量的稀盐酸加入一定量的铁、铜混合物中,写出其中反应的化学方程式.如图是实验过程生成气体或剩余固体的质量随反应时间的变化关系,其中表示正确的是(填标号).28.已知某碱溶液的溶解度随温度升高而增大;温度一定时,该碱溶液的浓度越大,其碱性越强.(1)要使该碱饱和溶液的pH升高(溶质不变),可采取的方法是.(2)要使该碱饱和溶液的pH降低,在下列试剂中,哪些可选择加入?A.CO2B.CaCO3C.Fe(OH)3D.CuSO4.29.下表是KCl在不同温度时的溶解度.温度/℃60溶解度/g27.631.034.037.0x42.645.5小明为测定x的值,取4份40℃的水各50g,分别进行实验,并记录数据如下表.实验编号实验1实验2实验3实验4KCl质量/g5152535溶液质量/g5*******请回答下列问题.(1)实验中需要用到的仪器有(只写一种).(2)要使实验2的溶液达到饱和,可采取的方法是.(3)由实验可知,40℃时KCl的溶解度x为g.(4)小明现要配制质量分数为30%的KCl溶液100g,为达实验目的其主要操作是.30.下表是NaCl和KNO3在不同温度时的溶解度:温度/℃0溶解度/gNaCl35.736.036.637.338.439.8KNO313.331.663.9110169246(1)从表中数据可以看出NaCl和KNO3的溶解度随温度升高而(填“增大”或“减小”).(2)若将KNO3的不饱和溶液变为相同温度下饱和溶液,其方法为(填一种).若KNO3饱和溶液中含有少量NaCl 时,提纯的方法是(填一种).(3)下列有关说确的是.A.40℃时,KNO3溶液的溶质质量分数一定比NaCl溶液的溶质质量分数大B.KNO3饱和溶液中一定不能再溶解NaCl固体C.从表中数据可以判断NaCl和KNO3的溶解度相等的温度在20﹣40℃之间.溶解度参考答案与试题解析一、选择题1.如图是甲、乙两种固体物质的溶解度曲线.下列说法错误的是()A.T℃时,甲、乙两物质的溶解度相等B.乙的饱和溶液降温时,溶质质量分数保持不变C.甲中混有少量乙,可采用降温结晶的方法提纯甲D.T℃时,甲的饱和溶液溶质质量分数为20%【考点】固体溶解度曲线及其作用;结晶的原理、方法及其应用;溶质的质量分数、溶解性和溶解度的关系.【专题】溶液、浊液与溶解度.【分析】根据已有的溶解度曲线的意义进行分析解答,交点表示在该温度下二者的溶解度相等,根据物质的溶解度受温度的变化确定析出晶体的方法,根据溶质质量分数计算即可.【解答】解:A、据图可以看出,在T℃时,甲、乙两物质的溶解度相等,正确;B、乙物质的溶解度随温度的降低而增大,当乙的饱和溶液降温时,溶液的组成不变,故溶质质量分数保持不变,正确;C、甲的溶解度随温度的升高而增大明显,故甲中混有少量乙,可采用降温结晶的方法提纯甲,正确;D、T℃时,甲的饱和溶液溶质质量分数为,错误.故选D.【点评】本题考查的是溶解度曲线的应用,完成此题,可以依据已有的溶解度曲线的意义进行.2.t℃时,向一支盛有0.15g熟石灰的烧杯中加入50g 水,充分振荡后静置,烧杯底部仍有未溶解的白色固体.下列相关叙述正确的是()A.升高温度上层清液变为不饱和溶液B.t℃时,熟石灰的溶解度为0.3gC.烧杯中溶液的质量小于50.15gD.上层清液中溶质质量分数大于0.3%【考点】固体溶解度的影响因素;固体溶解度的概念.【专题】压轴实验题;溶液、浊液与溶解度.【分析】解决此题时用到的知识点有:①氢氧化钙的溶解度随温度升高而减低;②溶液与溶质共存说明溶液是饱和状态;③溶质的质量是溶解在溶剂中的物质的质量;④计算溶质质量分数时溶质的量应该是溶解在水中的物质的质量.【解答】解:A、氢氧化钙的溶解度随温度升高而减低,升温会使溶解在水中的氢氧化钙析出,所剩溶液仍饱和,故A错误.B、t℃时,向一支盛有0.15g熟石灰的烧杯中加入50g 水,充分振荡后静置,烧杯底部仍有未溶解的白色固体,所以t℃时100g水中溶解熟石灰的质量小于0.3g,所以t℃时,熟石灰的溶解度小于0.3g,故B错误.C、0.15g熟石灰的烧杯加入50g水,烧杯管底部仍有未溶解的白色固体,说明氢氧化钙未全溶,溶质的质量应该小于0.15g,所以烧杯中溶液的质量小于50.15g,故C正确.D、溶质的量小于0.15g,故溶质的质量分数小于0.3%,故D错误.故选C.【点评】一般情况下,固体的溶解度随温度的升高而增大,但氢氧化钙特殊,它的溶解度随温度的升高而降低.3.下列说法不合理的是()A.“卤面”制作时,加入氯化钠当调味剂B.大脖子病是人体缺乏铁元素引起的C.大部分物质的溶解度随温度的升高而增大D.水受热膨胀是由于水分子间的距离变大【考点】固体溶解度的影响因素;氯化钠与粗盐提纯;利用分子与原子的性质分析和解决问题;人体的元素组成与元素对人体健康的重要作用.【专题】物质的微观构成与物质的宏观组成;溶液、浊液与溶解度;常见的盐化学肥料;化学与生活.【分析】A、根据食盐有咸味分析;B、根据碘元素与人体健康之间的关系分析;C、根据物质的溶解性规律分析;D、根据分子间有间隔的特性分析.【解答】解:A、由于食盐有咸味,“卤面”制作时,加入氯化钠当调味剂.故A说法合理;B、大脖子病是人体缺乏碘元素引起的.故B说法不合理;C、大部分物质的溶解度随温度的升高而增大.故C说法合理;D、分子间有间隔,水受热膨胀是由于水分子间的距离变大.故D说法合理.故选B.【点评】本题所考查的知识属于课本的基础知识,加强基础知识的学习,是解答本类题的关键.4.T℃时,将少量生石灰放入一定质量的饱和石灰水中,搅拌并冷却至原温度,得到的溶液与原溶液相比,下列物理量前后不变的是()①溶质的质量②溶剂的质量③溶液的质量④溶质的质量分数⑤溶解度.A.①③⑤B.②④⑤C.②④D.④⑤【考点】固体溶解度的影响因素;溶质的质量分数;生石灰的性质与用途.【专题】溶液、浊液与溶解度.【分析】根据温度不变饱和石灰水不能再继续溶解氢氧化钙的特点,判断对于此溶液的说法中正确的选项.【解答】解:由于氧化钙与饱和溶液中的水发生反应而使水减少,饱和溶液的溶剂减少会造成溶质析出,因此溶液的溶质、溶剂都在减少,溶液的质量也减小;固体物质的溶解度只受温度的影响,由于溶液的温度不变,因此,溶质的溶解度也不变.根据相同温度下的同种溶质的饱和溶液的溶质质量分数相同,饱和溶液的溶质质量分数不变,故④⑤正确.答案:D.【点评】生石灰遇水生成的氢氧化钙因溶液已为饱和溶液,所以不能继续溶解,溶液中溶质质量不会增大.5.下列四个图象能正确反应对应实验操作的是()A.向一定量的饱和石灰水中不断加入生石灰B.向等质量的锌、铁中滴加等质量分数的稀盐酸C.向一定的氧化铁入一氧化碳气体并持续高温D.向一定量的氢氧化钠和氯化钡的混合溶液中滴加稀硫酸【考点】固体溶解度的影响因素;金属的化学性质;一氧化碳还原氧化铁;生石灰的性质与用途;酸的化学性质.【专题】元素化合物知识型.【分析】A、根据氧化钙能够和水反应分析;B、根据金属与酸反应产生气体的多少分析;C、根据一氧化碳和氧化铁反应生成铁和二氧化碳分析;D、根据硫酸和氯化钡反应立即产生硫酸钡分析.【解答】解:A、生石灰和饱和石灰水中的水反应,因此会使饱和溶液中的水减少,则会析出部分溶质,因此溶质的质量会减少,故坐标错误;B、横坐标代表稀盐酸,相等质量的酸提供的氢元素质量相等,则产生的氢气相等,因此是同一条斜率;向等质量的铁和锌中加入溶质质量分数相同的稀盐酸至过量,则铁和锌全部参加反应,Fe+2HCl═FeCl2+H2↑562Zn+2HCl═ZnCl2+H2↑652通过反应的化学方程式以及金属与酸反应生成氢气的质量关系可以看出,铁生成的氢气大于锌,故坐标正确;C、一氧化碳和氧化铁反应生成铁和二氧化碳,固体质量会减少但不会减少为0,故坐标错误;D、硫酸应该和氯化钡立即产生硫酸钡沉淀,因此起点应该是0,故坐标错误;故选:B.【点评】此题是过程与图象结合题,是对学生识图能力的考查,解题的关键是能正确的分析各个反应的过程,并结合图象分析问题,对培养学生分析问题的能力有一定帮助.6.下表是KCl固体在不同温度时的溶解度.下列说法错误的是()温度/℃020406080溶解度/g27.634.040.045.551.1A.KCl固体的溶解度随温度的升高而增大B.80℃时,KCl固体的溶解度是51.1gC.60℃的KCl饱和溶液降温后会有晶体析出D.20℃时,KCl饱和溶液的溶质质量分数为34.0%【考点】固体溶解度的影响因素;晶体和结晶的概念与现象;溶质的质量分数、溶解性和溶解度的关系.【专题】溶液、浊液与溶解度.【分析】A、KCl溶解度随温度的升高而增大;B、由表格,可查出80℃时KCl的溶解度;C、根据氯化钾的溶解度随温度的变化特点确定是否析出固体;D、20℃时,100g水最多溶解KCl34.0g,34.0克为此温度下的溶解度.【解答】解:A、KCl溶解度随温度的升高而增大,正确;B、80℃时,KCl固体的溶解度是51.1g,正确;C、KCl溶解度随温度的升高而增大,故60℃的KCl饱和溶液降温后会有晶体析出,正确;D、20℃时,KCl饱和溶液的溶质质量分数为≈25.3%,错误;故选D.【点评】掌握溶质的质量分数、溶解性和溶解度的关系,掌握饱和溶液与不饱和溶液的相互转化的方法.7.下列说法不正确的是()A.物质的溶解度一定随温度的升高而增大B.蔗糖水属于溶液C.在一定条件下,饱和溶液与不饱和溶液之间可以相互转换D.打开汽水瓶盖,汽水会自动喷出来,证明气体的溶解度和压强有关【考点】固体溶解度的影响因素;溶液的概念、组成及其特点;饱和溶液和不饱和溶液相互转变的方法;气体溶解度的影响因素.【专题】溶液、浊液与溶解度.【分析】根据已有的溶解度的影响因素以及饱和溶液和不饱和溶液之间的转化和气体溶解度的影响因素进行分析解答即可.【解答】解:A、物质的溶解度不一定随温度的升高而增大,比如氢氧化钙的溶解度随温度的升高而减小,错误;B、蔗糖水属于溶液,正确;C、在一定条件下,饱和溶液与不饱和溶液之间可以相互转换,正确;D、打开汽水瓶盖,汽水会自动喷出来,是因为压强变小,气体的溶解度变小,证明气体的溶解度和压强有关,正确;故选A.【点评】本题考查的是溶液的知识,完成此题,可以依据已有的知识进行.8.小同学用某固体物质进行如图所示的实验,根据实验判断下列说法不正确的是()A.该固体物质的溶解度随温度的升高而增大B.溶液b一定是不饱和溶液C.溶液d中溶质质量一定大于溶液e中的溶质质量D.溶液d和溶液e的溶质质量分数可能相同【考点】固体溶解度的影响因素;饱和溶液和不饱和溶液;溶质的质量分数.【专题】溶液、浊液与溶解度.【分析】根据溶液的转化以及溶液中溶质的质量变化对溶质质量分数的改变的影响进行分析解答即可.【解答】解:A、从溶液c和溶液d可以看出,降低温度则溶液中会析出晶体,说明该物质的溶解度随温度的升高而增大,正确;B、溶液b中加入20g固体得到的溶液c中没有未溶解的固体,说明加入的物质全部溶解,故溶液b一定是不饱和溶液,正确;C、溶液d变成溶液e的过程中没有发生化学变化,说明溶液d中的固体除掉,可能是升高温度使固体溶解,则溶液d中溶质质量可能大于溶液e中的溶质质量,错误;D、若是溶液d中的固体是经过过滤除去,则溶液d和溶液e的溶质质量分数可能相同,正确;故选C.【点评】本题考查的是溶解度的变化特点以及溶液的转化和溶质质量分数的知识,完成此题,可以依据已有的知识进行.9.下表列出了硝酸钾在不同温度时的溶解度.温度/℃10203040溶解度/g20.931.645.863.9某兴趣小组做了如图实验:下列说法中正确的是()A.①②③中溶液都为不饱和溶液B.②③中都含有末溶解的固体C.①②③中溶液的质量相等D.③中溶质质量分数最大【考点】固体溶解度的影响因素;饱和溶液和不饱和溶液;溶质的质量分数.【专题】溶液、浊液与溶解度.【分析】根据溶液中溶质溶剂的判断方法分析,根据饱和溶液与不饱和溶液的特征判断.【解答】解:20℃时硝酸钾的溶解度为31.6g,将30g硝酸钾溶于100g水中得到的溶液①为不饱和溶液,再加入5g时得到的溶液②为饱和溶液且有硝酸钾剩余30g+5g﹣31.6g=3.4g,将②溶液升温到30℃,因30℃时硝酸钾的溶解度为45.8g,因此得到的溶液③为不饱和溶液.A、①、③中溶液为不饱和溶液,②为饱和溶液,故A错误;B、②中含有末溶解的固体,而③中不含有末溶解的固体,故B错误;C、①②③中溶质的质量不相等,所以溶液的质量也不相等,故C错误;D、③中溶质质量最大,所以溶质质量分数最大,故D正确.故选:D.【点评】本题考查溶剂的判断及饱和溶液不饱和溶液的转化,析出晶体及溶质质量分数的计算,需认真分析图示中溶剂溶质的质量与溶解度的关系.10.在化学知识中有许多规律,下列具体物质的性质符合对应规律的是()A.某些非金属氧化物能和碱反应生成盐和水;例如:二氧化碳和三氧化硫B.一般固体物质的溶解度随温度的升高而增大;例如:氢氧化钙和氯化钠C.常温下金属一般为固态;例如:汞和金D.某些非金属单质可以将金属从其氧化物中还原出来;例如:氢气和一氧化碳【考点】固体溶解度的影响因素;一氧化碳的化学性质;金属的物理性质及用途;氢气的化学性质与燃烧实验.【专题】溶液、浊液与溶解度;氧气、氢气的性质与用途;金属与金属材料;常见的碱碱的通性.【分析】A、根据碱的化学性质进行分析判断;B、根据常见物质的溶解度受温度的影响的变化趋势进行分析判断;C、根据金属的物理性质进行分析判断;D、根据氢气和一氧化碳的化学性质进行分析判断.【解答】解:A、某些非金属氧化物能和碱反应生成盐和水,如:二氧化碳和三氧化硫等,故A正确;B、一般固体物质的溶解度随温度的升高而增大,但氢氧化钙的溶解度随温度的升高而减小,氯化钠的溶解度受温度影响变化不大,故B错误;C、常温下金属一般为固态,如金等,汞在常温下为液态,。

学习资料专题突破溶解度之高频疑点一、饱和溶液和不饱和溶液1. 定义在一定的温度下,向一定量的溶剂里加入某种溶质,当溶质不能再继续溶解时所得的溶液叫做饱和溶液;还能继续溶解的溶液叫做不饱和溶液。
2. 判断依据判断一种溶液是否饱和的依据是看在一定条件下,加入某种物质是否溶解,一般来说,向原溶液中再加入同种溶质,若不再溶解,说明原溶液是饱和溶液,若继续溶解,则说明原溶液是不饱和溶液。
3. 相互转化一般情况下:(此法适用于绝大多数固体物质,溶解度随温度升高而上升)特殊情况下:(此法适用用Ca(OH)2固体和气体,溶解度随着温度上升而下降)注意:(1)无论哪种情况,NaCl的饱和溶液和不饱和溶液一般不能通过升降温度来改变。
(2)通常物质不能无限制地溶解在一定量的水中,物质的溶解现象与溶质和溶剂的性质有关。
(3)溶液的浓稀与溶液的饱和和不饱和只是考虑的角度不同,它们之间没有必须的联系。
饱和溶液可以是浓溶液,也可以是稀溶液,不饱和溶液也可以是浓溶液,也可以是稀溶液。
只有在相同温度下,同种溶质的饱和溶液才比其不饱和溶液的浓度大。
(4)彼此互溶的两种物质不能形成饱和溶液,如酒精和水能以任意比例互溶,酒精在一定温度下、一定量的水中不能形成饱和溶液。
二、固体溶解度1. 概念在一定温度下,100g溶剂里达到饱和状态时所溶解的质量,叫做这种溶质在这种溶剂里的溶解度。
2. 四要素例如:20℃时,氯化钠的溶解度是36g。
这句话可以从几个方面来理解:(1)表示20℃时,100g水中最多能溶解36g的氯化钠;(2)表示20℃时,36g氯化钠溶解在100g水中,能得到136g氯化钠饱和溶液;(3)表示20℃时,氯化钠饱和溶液中m(质)∶m(剂)∶m(液)=36∶100∶136。
三、气体溶解度1. 概念:某气体在压强为101kPa和一定温度时,溶解在1体积水里达到饱和状态时的气体体积。
例如,氮气在0℃、101kPa时的溶解度为0.024,表示在0℃、101kPa时1体积水中最多只能溶解0.024体积的氮气。
《溶液、饱和溶液与不饱和溶液、溶解度》专题班级 姓名 学号一、知识梳理 1. 溶液的形成 (1)溶液:①概念:一种或几种物质分散到另一种物质里,形成 的、 的混合物。
②组成:溶质: 的物质,可以是固体、液体或气体。
溶剂: 的物质, 是最常用的溶剂,汽油和酒精也可以作溶剂。
③特征: 性、 性、 物。
(2)溶解时的吸热或放热现象:①放热:有些物质在溶解时使溶液温度升高,如 (固)、 (液)等。
②吸热:有些物质在溶解时使溶液温度降低,如 (固)等。
③吸放热不明显:有些物质在溶解时无明显的温度变化,如 (固)等。
(3)乳化:①乳浊液:一种液体以 形式分散到另一种不相溶的液体里形成的混合物,如牛奶和豆浆。
乳浊液不 ,静置后会分层。
②乳化剂:能使乳浊液 性增强的物质。
③乳化现象:洗涤剂等乳化剂使植物油在水中分散成无数细小的液滴,而不聚成大的液滴,从而使油和水不再分层的现象。
其中洗涤剂所起的作用叫 作用。
注意:用乳化剂去油污是利用了乳化剂的 作用;用汽油洗去衣物上的油渍用的是 原理;用氢氧化钠去油污利用的是 。
2.饱和溶液与不饱和溶液(1)定义:在一定 下,一定量的 里, 继续溶解某种溶质的溶液,叫做这种溶质的饱和溶液; 继续溶解某种溶质的溶液,叫做这种溶质的不饱和溶液。
(2)判断:①若有未溶解的溶质(充分搅拌后),则该溶液一定为该溶质的 溶液。
②若无未溶解的溶质,保持温度、溶剂的量不变,向溶液中 ,若 ,则为该溶质的饱和溶液,反之则为不饱和溶液。
(3)相互转化:不饱和溶液饱和溶液2不饱和溶液饱和溶液(4)结晶:①定义:从溶液中的过程。
②方法:蒸发结晶:适用于所有溶质的溶液,特别适用于溶解度受温度影响的物质,如NaCl。
降温结晶(冷却):只适用于溶解度随温度升高而的物质,如KNO3。
3.溶解度和溶解度曲线(1)溶解度①概念:在一定下,某固态物质在 g溶剂里达到状态时所溶解的。
②影响因素:内因:、本身的性质;外因:温度多数固体物质的溶解度随温度的升高而 ,如KNO3。
2023年中考化学高频考点突破——溶解度一、单选题1.通常情况下,不列能实现“1+1=2”这一结果的是A.1毫升酒精加1毫升水得到2毫升酒精的水溶液B.1克酒精加1克水得到2克酒精的水溶液C.1克食盐加1克水得到2克食盐的水溶液D.1克食盐溶液加1克硝酸银溶液得到2克混合溶液2.A、B两种物质的溶解度曲线如右图所示,下列说法错误的是A.在t2℃时A的溶解度大于B的溶解度B.A、B两种物质的溶解度都随温度升高而增大C.t1℃时,A、B两种物质的饱和溶液中,溶质质量分数相等D.t2℃时,A的饱和溶液中溶质质量分数为30%3.KNO3与KCl的溶解度曲线如右图所示。
下列说法正确的是A.KNO3的溶解度比KCl的溶解度大B.t1温度下的KCl的饱和溶液升温至t2,有晶体析出C.A点所表示的KCl饱和溶液溶质的质量分数为29%D.冷却热的KNO3饱和溶液可获得KNO3晶体4.下图是甲、乙、丙三种固体物质(均不含结晶水)的溶解度曲线,下列说法正确的是A.甲的溶解度大于乙的溶解度B.降温可使接近饱和的丙溶液变为饱和溶液C.将t2°C甲、乙、丙的饱和溶液降温至t1℃,所得溶液的溶质质量分数:乙>甲=丙D.P点表示t1℃时甲、丙两种物质的溶解度都是25g5.如图是甲、乙两种固体物质在水中的溶解度曲线。
下列说法正确的是A.t1℃时,甲、乙两种物质的饱和溶液中溶质的质量分数相等B.由t2℃降温到t1℃,甲饱和溶液比乙饱和溶液析出晶体的质量多C.t2℃时,将40g甲物质加入50g水中,充分溶解后溶液的质量为90gD.t2℃时,用甲、乙配制等质量的饱和溶液,甲所需要水的质量比乙多6.一定温度下,向不饱和的氯化铜溶液中加入足量的下列固体,其对应关系正确的是A.B.C.D.7.硝酸钾的溶解度随温度升高而增大。
如图是有关硝酸钾溶液的实验操作及变化情况。
下列说法正确的是A.操作I一定是降温B.操作I一定是加溶质C.℃与℃的溶质质量一定相等D.℃与℃的溶质质量分数一定相等8.根据溶解度曲线判断,下列说法正确的是A.30℃时,100g水中最多溶解KNO3固体45.8gB.NaNO3溶液降温一定有晶体析出C.KCl的溶解度比NaCl的大D.NaCl的溶解度受温度影响比KCl大9.20℃时,四个实验小组分别取不同质量的NaCl,逐渐加入到各盛有50g水的烧杯中,不断搅拌直到不再溶解为止,然后分别称量剩余NaCl的质量。
2020南京中考题型-----溶解度曲线专题知识储备:1.固体溶解度[S]:⑴定义:一定温度下,某固态物质在100g溶剂里达到饱和状态所溶解的质量。
没指明溶剂时,通常所说的溶解度就是指在水中的溶解度。
简而言之,溶解度就是一个“数”,这个“数”就是物质在一定温度下的“100g 水”里所能溶解的“最大值”。
⑵溶解度含义及简单计算:20℃时氯化钠溶解度为36g,含意是20℃时100g水中最多溶解36g氯化钠。
20℃时,50g水最多溶解氯化钠18g,此时欲溶解36g氯化钠至少需水100g,欲溶解108g氯化钠至少需水300g。
(饱和溶液中,质:剂==S:100)⑶影响固体溶解度的因素:溶质的性质、溶剂的性质、温度。
注意:颗粒大小和搅拌只能影响溶解的速率。
2.溶解度曲线应用:(注:A、B、C代表物质依次为——硝酸钾、氯化钠、熟石灰或气体)⑴会比较S大小:0℃时溶解度大小顺序为B、C、A ,t2℃时三种物质溶解度大小顺序为A、B、C。
⑵会查S并进行简单推算、判断:①t2℃50g水中最多能溶解A物质25g。
②t2℃一瓶饱和A溶液的浓度为33.3%。
③t2℃把25gA物质放入100g 水中,所得溶液质量为125g,浓度为20%,所得溶液是否饱和:不是;降温至t1℃,所得溶液质量为115g,此时溶液是否饱和:是。
⑶会判断饱和溶液浓度随温度变化情况:①t2℃三物质的饱和溶液降温至t1℃,A溶液浓度将变小,B溶液浓度将变小,C溶液浓度将不变。
②t1℃三物质的饱和溶液升温至t2℃,A溶液浓度将不变,B溶液浓度将不变,C溶液浓度将变小。
③t1℃三物质的饱和溶液(杯内有剩余晶体),升温至t2℃,A溶液浓度将变大,B溶液浓度将变大,C溶液浓度将变小。
A溶液中能看到的现象是晶体减少,C溶液中能看到的现象是晶体增多。
④t1℃的三种物质饱和溶液,升温时浓度变小的是C,降温时浓度变小的是A、B。
⑤t2℃时三个物质饱和溶液的浓度大小顺序为A、B、C,降温至t1℃时溶液浓度的大小顺序为B、A、C(可画水平线判断:A溶解度虽下降但并没有低于C在t2℃的“高度”)。