双荧光素酶系统实验操作步骤及方法-
- 格式:ppt
- 大小:559.00 KB
- 文档页数:14

双荧光素酶报告实验质粒转染详细步骤及说明
1. 待测细胞在10 cm dish 中培养至80-90% 融合时,倾去培养液,用2ml PBS 洗涤细胞两次;
2. 加1ml Trypsin-EDTA solution, 混匀后,小心吸去胰酶溶液,37ºC 放置1-5分钟;
3. 加入2 ml 完全培养基,吹打使细胞形成单细胞悬液;
4. 血球计数板计数,将细胞稀释至1×10 6 细胞/ml;
5. 取100 μl 上述细胞稀释液加入96 孔板,使细胞密度达到1×10 5 个细胞/孔,混匀后于37ºC 5% CO 2 培养24 小时;
6. 在3 个1.5 ml EP 管中各加入50 μl 无血清培养基,分别加入0.2 μg,0.4 μg,0.8 μgpEX-1 质粒,混匀;取另一1.5 ml EP 管,加入150 μl 无血清DMEM,加入1.5 μl 转染试剂,充分混匀,室温放置5 分钟后将150 μl 平均3 等份对应加入含有质粒的3个EP 管,充分混合,室温放置20 分钟;
7. 吸去96 孔板中的培养液,将转染混合物逐滴加入96 孔板中,混匀后,在培养箱中
温育5 小时;
8. 吸弃转染液,加入100 μl 完全培养液。
37ºC 5% CO 2 继续培养, 24h 和48h 观察并拍照质粒转染效果图片。


双荧光素酶系统实验操作步骤及方法_实验材料和仪器:1. 双荧光素酶系统底物:荧光素酶底物(Luciferin)和共价链接的荧光素酶底物(Coelenterazine)。
2. 荧光素酶标记的目标蛋白质:目标蛋白质的N端或C端与荧光素酶(Luciferase)基因融合。
3. 共表达的荧光素酶底物荧光素酶基因:常用的是荧光素酶2(Luciferase2,Luc2)。
4.表达目标蛋白质的载体:供慢病毒或质粒转染目标细胞。
5.反应体系:包括含有目标蛋白质的细胞或细胞组织、荧光素酶底物溶液和荧光计。
操作步骤:1.细胞培养和转染:将目标蛋白质的载体转染至目标细胞中,经过选择培养形成稳定表达目标蛋白的细胞系。
此步骤应根据目标细胞类型和实验要求进行优化。
2.收集细胞:将转染好的细胞培养至适当的数量并收集。
收集的方式因实验要求而有所差异,可以直接培养盘中收集,也可以经过离心将细胞沉淀后收集。
3.荧光素酶底物处理:加入适量的荧光素酶底物溶液至细胞悬液中,通过处理细胞后激活荧光素酶。
4.检测荧光强度:将含有荧光素酶底物的细胞悬液转移至荧光计中,通过测量荧光强度来评估目标蛋白质的表达水平和相互作用。
5.分析和解释结果:根据实验要求和荧光素酶底物的不同,可以进行数据分析和结果解释。
例如,可以通过对细胞中不同亚基的荧光强度进行比较来研究蛋白复合物的组成与结构。
实验注意事项:1.选取合适的目标细胞系和转染条件,以确保目标蛋白质的高表达和稳定性。
2.根据实验要求调整荧光素酶底物的浓度和处理时间,避免荧光饱和和快速衰减的情况。
3.在处理荧光素酶底物前,确保细胞中没有存在荧光素酶活性的底物或成分,以免影响荧光素酶底物的初始浓度和稳定性。
4.对于共表达的荧光素酶底物荧光素酶基因,可以调整目标蛋白质与荧光素酶的比例来研究不同蛋白质的相互作用。
总结:双荧光素酶系统(BRET)是一种通过荧光素酶底物的处理来研究蛋白质相互作用和表达水平的实验技术。

荧光素酶报告基因步骤
荧光素酶报告基因是分子生物学实验中常用的工具,它可以用
来标记目的基因,以便研究该基因在细胞或生物体中的功能。
本
文将介绍荧光素酶报告基因的步骤。
一、选择适当的报告基因
在生物学研究中,常用的报告基因有GFP(绿色荧光蛋白)、luciferase(荧光素酶)等。
选择适当的报告基因需要考虑许多因素,例如研究目的、检测灵敏度等。
二、构建荧光素酶报告基因表达载体
将所选择的报告基因与荧光素酶的编码序列连接在一起,构建
荧光素酶报告基因表达载体。
该载体可用于后续的质粒转染实验。
三、转染表达载体
将构建好的荧光素酶报告基因表达载体转染至所需的细胞或生
物体中,使其表达。
转染方法包括电穿孔法、化学法、病毒载体
介导转染等。
四、用荧光素酶检测目的基因的表达
在实验中使用荧光素酶底物(如荧光素或共轭体H)进行检测,以判断目的基因在细胞或生物体中的表达水平。
五、分析实验结果
通过荧光素酶检测的实验结果,可以确定目的基因在细胞或生
物体中的表达情况。
若荧光素酶信号的强度高,则说明目的基因
表达较多;若荧光素酶信号的强度低,则说明目的基因表达较少。
总结
以上就是荧光素酶报告基因的步骤。
它是分子生物学研究中常
用的一种技术,可以用来研究基因在细胞或生物体中的表达情况。
在实际操作中,还需要根据需要进行优化和调整。

在同一组织细胞标本上需要同时检测两种抗原时,需进行双重荧光染色.双重免疫荧光标记法(double immunofluorescence labeling method)也分为直接法和间接法.(1)直接法双重免疫荧光标记:将标记有两种不同荧光素的抗体(如抗A 和抗B)以适当比例混合,滴加在标本上孵育,然后洗去未结合的荧光抗体,在荧光显微镜下分别选择两种相应的激发滤片观察,即可对两种抗原进行定位和定量。
直接法简便可靠,但灵敏度较低。
(2)间接法双重免疫荧光标记:用未标记的两种特异性第一抗体孵育组织或细胞,洗去多余的第一抗体后,再用两种不同的荧光素分别标记的第二抗体孵育组织或细胞,洗去多余的第二抗体,后在荧光显微镜下分别选择两种相应的激发滤片观察,从而对两种抗原进行定位和定量。
使用此法应注意两种特异性第一抗体必须来源于不同种属,且荧光标记第二抗体的种属必须与第一抗体的种属相匹配。
免疫荧光双标技术中操作要点和注意事项一、免疫荧光技术中标本制作的基本程序近似于酶免疫组化,不同点如下:1、免疫荧光不需要使用双氧水处理,封闭和一抗孵育与其相同。
2、免疫荧光的二抗使用不同荧光标记的二抗孵育,孵育时间根据抗体的工作浓度确定.3、二抗孵育之后充分洗片后即可贴片、封片和观察。
4、免疫荧光在封片时常使用专用封片剂或甘油:0.01M PBS (1:1)。
条件许可,建议购买抗淬灭的封片液,使标本可以保存更久.5、荧光抗体的孵育以及后续处理需要避光.6、荧光抗体染色假阳性可能会多,需要分别设定阳性和阴性对照.二、注意事项1、荧光染色后一般在1h内完成观察,或于4℃保存4h,时间过长,可能会使荧光提前衰退。
2、每次试验均需设置以下三种对照:(1) 阳性对照:阳性血清+荧光标记物;(2) 阴性对照:阴性血清+荧光标记物;(3)荧光标记物对照:PBS+荧光标记物。
三、免疫荧光双标的经验之谈1、选取一抗时,要求来源于两种不同的动物,我用的是来源于家兔和大鼠的抗体,二抗则是不同荧光信号标记的,我用的是donkey anti-rabbit—FITC(绿)和donkey anti—rat-Tex-Red(红).2、我的做法是两种一抗同时孵育,然后两种二抗同时孵育。


吉玛基因帮你做双荧光素酶报告基因实验(一)荧光素酶(luciferase)是自然界中能发出荧光的酶的统称。
他们可以通过酶促反应催化底物产生自发荧光。
因其便与检测,灵敏度高等特性,荧光素酶常作为报告基因被广泛应用于生化检测实验中。
在生化实验中,应用最广泛的是萤火虫荧光素酶(Firefly luciferase)和海肾荧光素酶(Renilla luciferase)。
两者分别催化各自的底物luciferin和coelenterazine发出不同颜色的荧光。
两种荧光的吸收波长不同(luciferin波长550-570nm,coelenterazine波长480nm),故而在同一个化学反应中,两种荧光的检测互不影响,由此双荧光素酶报告基因(Dual-luciferase)系统受到广泛欢迎。
双荧光素酶报告基因系统的应用miRNA与RNA靶向关系验证在miRNA的研究中经常会涉及到miRNA与RNA靶向关系的验证,这其中包括mRNA中CDs区后面的3’-UTR区,long non-coding RNA(LncRNA)或者circular RNA (circRNA)等。
miRNA通常是通过其种子区(seed region),及5’端2-8个碱基与目的RNA靶位点完全匹配结合(注:RNA之间存在U-G结合的模式),并在沉默复合体(miRNA-induced silencing complex)的共同作用下导致目的RNA降解,进而致使目的RNA的表达量下调。
基于这个原理,miRNA-target 双荧光素酶报告基因系统被科研工作者普遍认可,用于验证miRNA与靶基因的直接靶向关系。
吉玛基因采用pmiRGlo及psiCHECK双荧光素酶报告基因系统,帮助广大科研工作者解决miRNA-target验证的难题。
该验证实验的基本步骤如下:1. miRNA-target靶位点预测通过miRNA-target数据库,如Targetscan,miRDB,(Miranda program) 等来预测miRNA与mRNA的3’-UTR区的结合位点。

荧光素酶实验步骤
内容:
一、实验材料
1. 含有报告基因的重组质粒
2. 适合该报告基因表达的宿主细胞
3. 转染试剂
4. 培养基和培养皿
5. 荧光素钠盐等化学发光底物
二、实验步骤
1. 将重组质粒转染入宿主细胞,培养过夜使其表达报告基因。
2. 将转染后的细胞接种到培养皿中继续培养。
3. 当细胞长到适当密度时,吸除培养基,用PBS轻轻洗涤细胞。
4. 在无血清的培养基中加入适量荧光素钠盐,轻轻洗涤细胞后加入培养皿中。
5. 暗箱中孵育5-30分钟,然后使用发光成像系统观察并拍照。
6. 也可以使用酶标仪检测培养皿中溶液的相对发光值。
7. 对照组为未转染报告基因的细胞进行上述步骤,作为背景值。
三、结果分析
1. 发光成像看到转染组细胞发出荧光,对照组无荧光。
2. 转染组样品的发光值明显高于对照组背景值。
3. 转染效率高、报告基因表达水平高的样品,荧光信号越强。
以上是荧光素酶报告基因实验的基本步骤和分析方法。

双荧光素酶报告实验细胞转染详细步骤及说明
1. 待测细胞在10 cm 培养皿中培养至80-90% 融合时,倾去培养液,用2 ml PBS洗涤
细胞两次;
2. 加入2 ml Trypsin-EDTA solution, 混匀后,37ºC 放置1-5 分钟;
3. 小心吸去胰酶溶液,加入2 ml 完全培养基,吹打使细胞形成单细胞悬液;
4. 血球计数板计数,将细胞稀释至1×10 6 细胞/ml。
按5×10 5 细胞/孔的浓度接种12 孔板,混匀后于37ºC 5% CO 2 培养24 小时;
5. 每1 OD 260 microRNA 用125 μl DEPC-H 2 O 溶解,终浓度约为20 μM;
6. 在1.5 ml EP 管中加入100 μl 无血清培养基,加入10 μl microRNA,再加入对应的双荧光报告载体1 μg,混匀;取另一1.5 ml EP 管,加入100 μl 无血清DMEM,加入4μl lipofectamine 2000,混匀,室温放置5 分钟后将两管混合,室温放置20 分钟;
7. 实验分组:
验证分组为:A. mimic NC+ WT;B. mimic NC+ MUT;C. miRNA + WT;D. miRNA + MUT;E. mimic NC+ miRNA PC;F. miRNA + miRNA PC,各组设3 复孔;
8. 吸去12 孔板中的培养液,将转染混合物逐滴加入12 孔板中,混匀后,在培养箱中温育5 小时;
9. 吸弃转染液,加入500 μl 完全培养基。
37ºC 5% CO 2 继续培养24、48 小时,分别收样;
10. 所得细胞用于双荧光素酶系统检测。
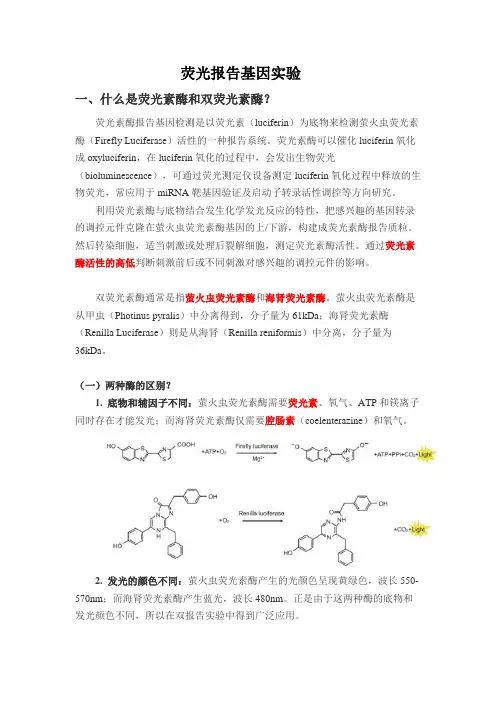
荧光报告基因实验一、什么是荧光素酶和双荧光素酶?荧光素酶报告基因检测是以荧光素(luciferin)为底物来检测萤火虫荧光素酶(Firefly Luciferase)活性的一种报告系统。
荧光素酶可以催化luciferin氧化成oxyluciferin,在luciferin氧化的过程中,会发出生物荧光(bioluminescence),可通过荧光测定仪设备测定luciferin氧化过程中释放的生物荧光,常应用于miRNA靶基因验证及启动子转录活性调控等方向研究。
利用荧光素酶与底物结合发生化学发光反应的特性,把感兴趣的基因转录的调控元件克隆在萤火虫荧光素酶基因的上/下游,构建成荧光素酶报告质粒。
然后转染细胞,适当刺激或处理后裂解细胞,测定荧光素酶活性。
通过荧光素酶活性的高低判断刺激前后或不同刺激对感兴趣的调控元件的影响。
双荧光素酶通常是指萤火虫荧光素酶和海肾荧光素酶。
萤火虫荧光素酶是从甲虫(Photinus pyralis)中分离得到,分子量为61kDa;海肾荧光素酶(Renilla Luciferase)则是从海肾(Renilla reniformis)中分离,分子量为36kDa。
(一)两种酶的区别?1. 底物和辅因子不同:萤火虫荧光素酶需要荧光素、氧气、ATP和镁离子同时存在才能发光;而海肾荧光素酶仅需要腔肠素(coelenterazine)和氧气。
2. 发光的颜色不同:萤火虫荧光素酶产生的光颜色呈现黄绿色,波长550-570nm;而海肾荧光素酶产生蓝光,波长480nm。
正是由于这两种酶的底物和发光颜色不同,所以在双报告实验中得到广泛应用。
(二)为什么采用双荧光素酶报告系统?单报告基因实验往往会受到各种实验条件的影响,而双报告基因则通过共转染的“对照”作为内参为试验提供一基准线,从而可以在最大程度上减小细胞活性和转染效率等外在因素对实验的影响,使得数据结果更为可信。
一般情况下,海肾荧光素酶基因作为内参使用,将带有海肾荧光素酶基因的质粒与报告基因质粒共转染细胞;或是将两个报告基因构建到同一个质粒上,分别用不同的启动子启动其表达。

带Luciferin荧光素酶细胞转染实验的具体步骤及方法一、细胞名称LLC-GFP-luc二、组织小鼠肺癌细胞系三、母细胞来源ATCC四、转染方法与标记过程的描述慢病毒转染Hygromycin筛选(一) 质粒部分1.酶切载体:pGL4.10(luc2)由酶切获得1400bp的luc2基因片断;EGFP片段由PCR扩增获得700-800bp左右片段;pSin-hyg-T2A载体酶切线性化。
2.电泳和胶回收:上述酶切产物DNA电泳,TAKARA试剂盒胶回收,回收产物取少量电泳鉴定。
3.连接载体与目的片段:使用Invitrogen T4连接酶连接luc2、EGFP片段和pSin-hyg-T2A线性化载体,连接使用20ul体系,25℃,10min。
4.转化:感受态菌One Shot Stbl3在冰上融化后,加入连接产物,静置25min 后在水浴42℃,45sec热休克,后加入250ul无抗培养基225转摇菌1h,将转化的菌铺于有氨苄抗性平板37度过夜。
5.挑取单克隆:观察平板后挑取15个单克隆至含2ml氨苄抗性LB培养基摇菌管中,255转摇菌6.5h。
6.小抽质粒与鉴定:使用碱裂解法小抽,质粒用25ul含RNA酶ddH2O溶解;酶切鉴定: 重组质粒用通过酶切鉴定。
7.荧光素表达鉴定: 重组质粒pSin-hyg-GFP/luc2(以下简称Gluc)转染293T 细胞:DNA定量后,使用PEI转染Gluc至24孔板已预铺的293T细胞中。
转染采用脂质体法转染,试剂采用JetPEI (Polyplus公司)。
两管EP管中分别加入50ul生理盐水,其中一管加入1ug量的质粒(DNA体积=1ug/DNA浓度),轻轻震荡混匀,再轻微离心;在另一管中加入PEI 2ul轻轻震荡混匀,轻微离心,然后把PEI管中的溶液加入含有的质粒管中,室温孵育20min。
将脂质体包绕DNA的混合液加入需要转染的24孔内,37 ℃、5 % CO2条件下培养,8小时后换培养液。
双荧光素酶实验目的双荧光素酶实验是一种常用的生物学实验,其主要目的是通过荧光素酶标记的蛋白质和双荧光素酶标记的DNA来研究生物分子在细胞内的表达、定位及相互作用等问题。
以下将从实验原理、步骤、应用以及注意事项四个方面详细介绍双荧光素酶实验。
一、实验原理1. 荧光素酶标记蛋白质:将荧光素酶基因与感兴趣的蛋白质基因进行融合,使其表达出能与荧光素底物结合并发出荧光信号的融合蛋白质。
2. 双荧光素酶标记DNA:将双荧光素酶基因与感兴趣的DNA序列进行连接,使其表达出能与两种不同颜色的荧光底物结合并发出不同颜色信号的双荧光素酶标记DNA。
3. 荧光显微镜观察:利用显微镜观察样品中发出的不同颜色信号,从而确定目标分子在细胞内的定位、相互作用等信息。
二、实验步骤1. 荧光素酶标记蛋白质构建:将荧光素酶基因与感兴趣的蛋白质基因进行PCR扩增,然后进行连接和转染等步骤。
2. 双荧光素酶标记DNA构建:将双荧光素酶基因与感兴趣的DNA序列进行连接,然后进行转染等步骤。
3. 荧光显微镜观察:利用荧光显微镜观察样品中发出的不同颜色信号,从而确定目标分子在细胞内的定位、相互作用等信息。
三、实验应用1. 研究蛋白质表达和定位:利用荧光素酶标记蛋白质可以确定目标蛋白质在细胞内的表达和定位情况。
2. 研究核酸转录和翻译:利用双荧光素酶标记DNA可以确定目标DNA序列在细胞内的转录和翻译情况。
3. 研究生物分子相互作用:通过将两种不同分子分别标记为荧光素酶和双荧光素酶,可以确定它们在细胞内的相互作用情况。
四、注意事项1. 实验条件:需要保证实验条件的稳定性和一致性,如细胞培养条件、荧光底物浓度等。
2. 质量控制:需要对标记蛋白质和DNA进行质量控制,以保证实验结果的准确性和可靠性。
3. 数据分析:需要对实验结果进行系统分析和统计处理,以得出科学结论。
4. 安全操作:在进行实验时需要注意安全操作,如佩戴手套、护目镜等防护措施。
双荧光素酶数据处理
双荧光素酶(Dual-Luciferase)报告系统是一种常用的生物荧
光素酶报告基因表达系统,用于研究基因调控、信号转导和蛋白质
相互作用等生物学过程。
对双荧光素酶数据进行处理时,需要考虑
以下几个方面:
1. 数据采集和标准化,首先要确保数据采集的准确性和一致性,使用标准化的实验操作流程和仪器设置来获取数据,以减少实验误
差对结果的影响。
2. 数据分析,双荧光素酶报告系统通常包括火萤酶(Firefly luciferase)和海洋光明蛋白(Renilla luciferase)两种荧光素
酶的活性测定。
数据处理时需要分析两种酶的活性比值或相对活性
变化,以确定基因表达水平或信号通路活性的变化。
3. 数据解释,在进行数据处理时,需要结合实验设计和研究目的,对双荧光素酶数据进行合理的解释。
比如,可以通过对照组和
实验组的数据对比,来判断基因表达水平的变化或信号通路的活化
或抑制。
4. 统计分析,为了确保数据处理的可靠性和科学性,通常需要进行统计学分析,比如t检验、方差分析等,来验证实验结果的显著性和可重复性。
5. 结果呈现,最后,将经过处理和分析的双荧光素酶数据以图表或统计指标的形式呈现出来,清晰地展示实验结果和结论,以便他人理解和验证。
总之,双荧光素酶数据处理需要严谨的实验操作、合理的数据分析和解释,以及科学的统计分析,最终将结果清晰地呈现出来。
这样才能确保研究结果的可靠性和科学性。
荧光素酶检测方法步骤一、引言荧光素酶检测方法是一种常用的生物分析技术,广泛应用于生物医学研究、生物工程、环境监测等领域。
本文将介绍荧光素酶检测方法的步骤,包括基本原理、实验准备、检测流程以及数据分析等内容。
二、基本原理荧光素酶检测方法是一种利用荧光素酶催化荧光素底物生成荧光信号的技术。
荧光素酶是一种天然存在于某些生物体内的酶,能够将荧光素底物氧化为产生荧光的产物。
荧光素酶检测方法通过检测荧光素底物转化为荧光产物的荧光信号来定量分析样品中的荧光素酶活性。
三、实验准备1. 准备荧光素酶底物:根据实验需要选择合适的荧光素底物,常见的有荧光素、二甲基荧光素等。
2. 调配荧光素酶反应缓冲液:根据实验要求配制荧光素酶反应缓冲液,确保适宜的pH值和离子浓度。
3. 样品处理:根据实验目的,对待测样品进行处理,如提取靶标蛋白、纯化荧光素酶等。
四、检测流程1. 预处理样品:将待测样品加入适量的荧光素酶反应缓冲液中,进行预处理,以提高荧光素酶的活性和稳定性。
2. 加入荧光素底物:将适量的荧光素底物加入反应液中,使荧光素酶与底物发生催化反应,生成荧光产物。
3. 反应体系优化:根据实验需求,优化反应体系的温度、反应时间等参数,以获得最佳的荧光信号。
4. 荧光检测:使用荧光分析仪器对反应体系中的荧光信号进行检测,记录荧光强度或发射光谱。
5. 数据分析:根据荧光信号的强度或光谱特征,进行数据分析,如计算样品中荧光素酶的活性或浓度。
五、数据分析荧光素酶检测方法的数据分析主要包括荧光强度计算、活性或浓度计算等。
常用的数据分析方法有标准曲线法、内标法、比较阈值循环法等。
根据实验设计和样品特点,选择合适的数据分析方法进行结果解读。
六、实验注意事项1. 严格控制实验条件:包括温度、pH值、反应时间等,以确保实验结果的准确性和可重复性。
2. 合理选择荧光素底物和荧光素酶:根据实验目的选择合适的底物和酶,以获得最佳的检测效果。
3. 保护荧光素底物的稳定性:荧光素底物易受光照、氧化等因素影响而降解,应储存和操作时避免光照和氧气接触。