初三化学思维导图
- 格式:doc
- 大小:43.50 KB
- 文档页数:6
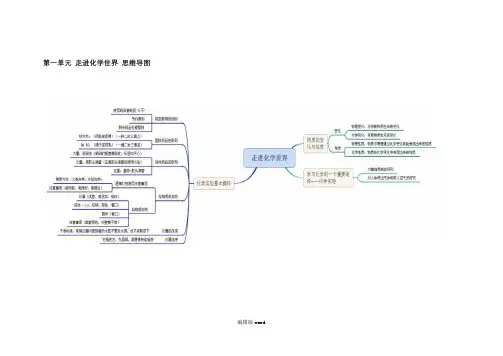
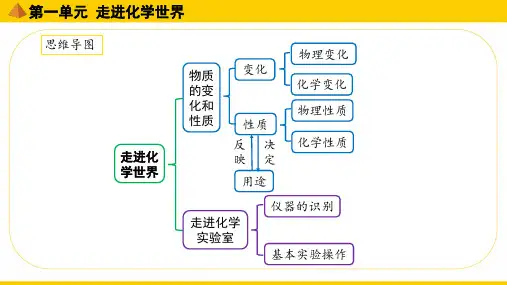
第一单元走进化学世界思维导图
编辑版word
第二单元我们周围的空气思维导图
编辑版word
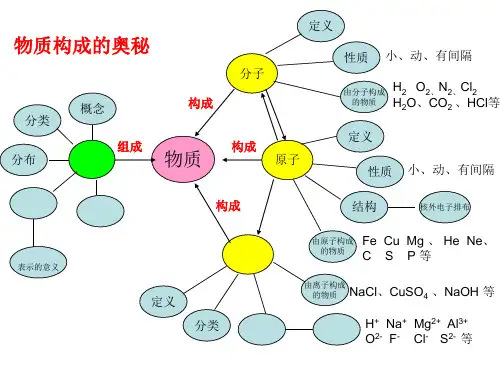
第三单元物质构成的奥秘思维导图
编辑版word
编辑版word
第四单元自然界的水思维导图
编辑版word
第五单元化学方程式思维导图
编辑版word
第六单元碳与碳的氧化物思维导图
编辑版word
第七单元燃料及其利用思维导图
编辑版word
第八单元金属和金属材料思维导图
编辑版word
第九单元溶液思维导图
编辑版word
编辑版word
第十单元酸和碱思维导图
编辑版word
第十一单元盐化肥思维导图
编辑版word
编辑版word
第十二单元化学与生活思维导图
编辑版word
编辑版word
编辑版word
1、征服畏惧、建立自信的最快最确实的方法,就是去做你害怕的事,直到你获得成功的经验。
2、忍别人所不能忍的痛,吃别人所别人所不能吃的苦,是为了收获得不到的收获。
就像驴子面前吊着个萝卜就会往前走。
正因为有那个目标,你才有劲儿往前走。
编辑版word
编辑版word
(此文档部分内容来源于网络,如有侵权请告知删除,文档可自行编辑修改内容,供参考,感谢您的配合和支持)
编辑版word。
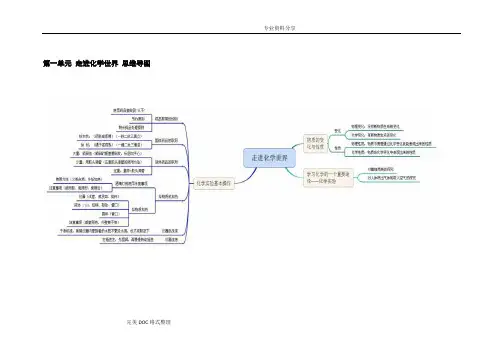
第一单元走进化学世界思维导图
完美DOC格式整理
第二单元我们周围的空气思维导图
完美DOC格式整理
第三单元物质构成的奥秘思维导图
完美DOC格式整理
完美DOC格式整理
第四单元自然界的水思维导图
完美DOC格式整理
第五单元化学方程式思维导图
完美DOC格式整理
第六单元碳与碳的氧化物思维导图
完美DOC格式整理
第七单元燃料及其利用思维导图
完美DOC格式整理
第八单元金属和金属材料思维导图
完美DOC格式整理
第九单元溶液思维导图
完美DOC格式整理
完美DOC格式整理
完美DOC 格式整理
第十单元 酸和碱 思维导图
第十一单元盐化肥思维导图
完美DOC格式整理
完美DOC格式整理
第十二单元化学与生活思维导图
完美DOC格式整理
完美DOC格式整理。
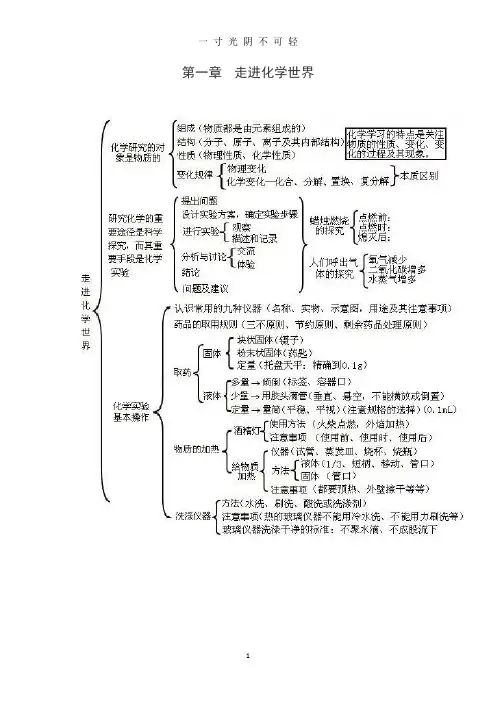
第一章走进化学世界第二章我们周围的空气第三章物质构成的奥秘第四章自然界的水第五章化学方程式第六章碳和碳的氧化物第七章燃料及其利用第八章金属和金属材料第九章溶液第十第十章酸碱盐一、化学用语1、电离方程式:H2SO4=2H++SO42-;NaOH=NA++OH-;Al2(SO4)=2Al3++3SO42-2、物质的俗称和主要成分:生石灰CaO;熟石灰、消石灰、石灰水的主要成分Ca(OH)2;石灰石、大理石CaCO3;食盐的主要成分NaCl ;纯碱、口碱Na2CO3;烧碱、火碱、苛性钠NaOH;胆矾、蓝矾CuSO4·5H2O;碳酸钠晶体Na2CO3·10H2O;氨水NH3H2O。
二、金属活动性1、金属活动性顺序:K>Ca>Na>Mg>Al>Zn>Fe>Sn>Pb(H)Cu>Hg>Ag>Pt>Au2、金属活动性顺序的意义:在金属活动性顺序中,金属位置越靠前,金属在水溶液(酸溶液或盐溶液)中就越容易失电子而变成离子,它的活动性就越强。
3、金属活动性顺序的应用:(1)排在氢前的金属能置换出酸里的氢(元素)。
(2)排在前面的金属才能把排在后面的金属从它们的盐溶液中置换出来(K、Ca、Na除外)。
三、酸、碱、盐的溶解性1、常见盐与碱的溶解性:钾(盐)、钠(盐)、铵盐全都溶,硝酸盐遇水影无踪。
硫酸盐不溶硫酸钡,氯化物不溶氯化银。
碳酸盐只溶钾(盐)、钠(盐)、铵(盐)。
碱类物质溶解性:只有(氢氧化)钾、(氢氧化)钠、(氢氧化)钙、(氢氧化)钡溶。
2、八个常见的沉淀物:氯化银、硫酸钡碳酸银、碳酸钡、碳酸钙、氢氧化镁、氢氧化铜、氢氧化铁3、四微溶物Ca(OH)2(石灰水注明“澄清”的原因);CaSO4(实验室制二氧化碳时不用稀硫酸的原因);Ag2SO4(鉴别SO42-和Cl-时,不用硝酸银的原因);MgCO3(碳酸根离子不能用于在溶液中除去镁离子的原因)。
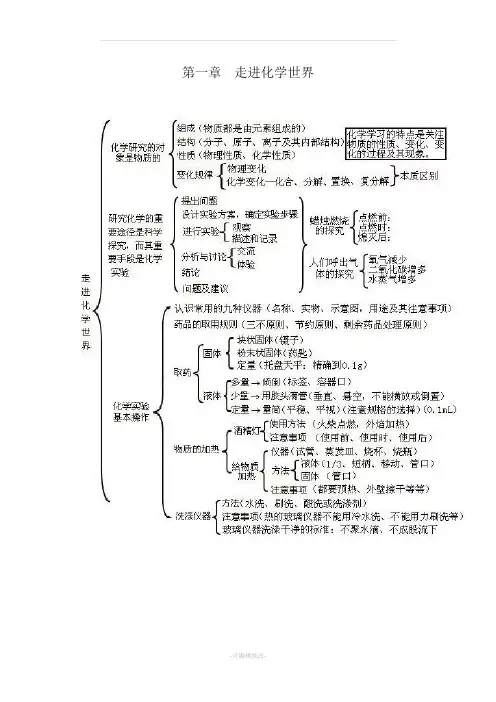
第一章走进化学世界第二章我们周围的空气第三章物质构成的奥秘第四章自然界的水第五章化学方程式第六章碳和碳的氧化物第七章燃料及其利用第八章金属和金属材料第九章溶液第十第十章酸碱盐一、化学用语1、电离方程式:H2SO4=2H++SO42-;NaOH=NA++OH-;Al2(SO4)=2Al3++3SO42-2、物质的俗称和主要成分:生石灰CaO;熟石灰、消石灰、石灰水的主要成分Ca(OH)2;石灰石、大理石CaCO3;食盐的主要成分NaCl ;纯碱、口碱Na2CO3;烧碱、火碱、苛性钠NaOH;胆矾、蓝矾CuSO4·5H2O;碳酸钠晶体Na2CO3·10H2O;氨水NH3H2O。
二、金属活动性1、金属活动性顺序:K>Ca>Na>Mg>Al>Zn>Fe>Sn>Pb(H)Cu>Hg>Ag>Pt>Au2、金属活动性顺序的意义:在金属活动性顺序中,金属位置越靠前,金属在水溶液(酸溶液或盐溶液)中就越容易失电子而变成离子,它的活动性就越强。
3、金属活动性顺序的应用:(1)排在氢前的金属能置换出酸里的氢(元素)。
(2)排在前面的金属才能把排在后面的金属从它们的盐溶液中置换出来(K、Ca、Na除外)。
三、酸、碱、盐的溶解性1、常见盐与碱的溶解性:钾(盐)、钠(盐)、铵盐全都溶,硝酸盐遇水影无踪。
硫酸盐不溶硫酸钡,氯化物不溶氯化银。
碳酸盐只溶钾(盐)、钠(盐)、铵(盐)。
碱类物质溶解性:只有(氢氧化)钾、(氢氧化)钠、(氢氧化)钙、(氢氧化)钡溶。
2、八个常见的沉淀物:氯化银、硫酸钡碳酸银、碳酸钡、碳酸钙、氢氧化镁、氢氧化铜、氢氧化铁。
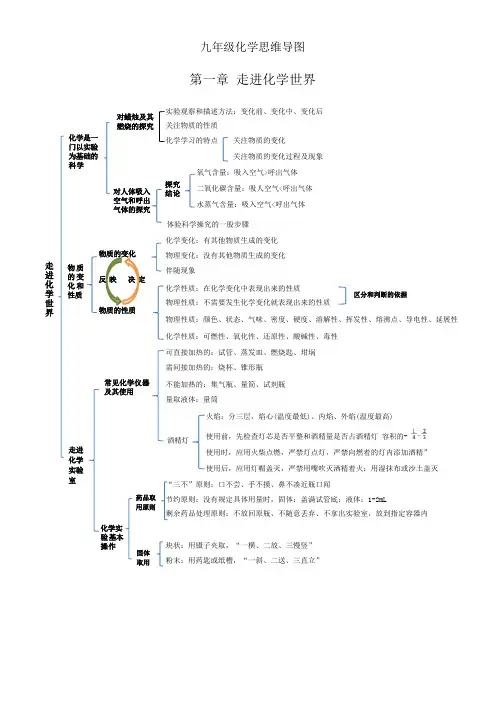
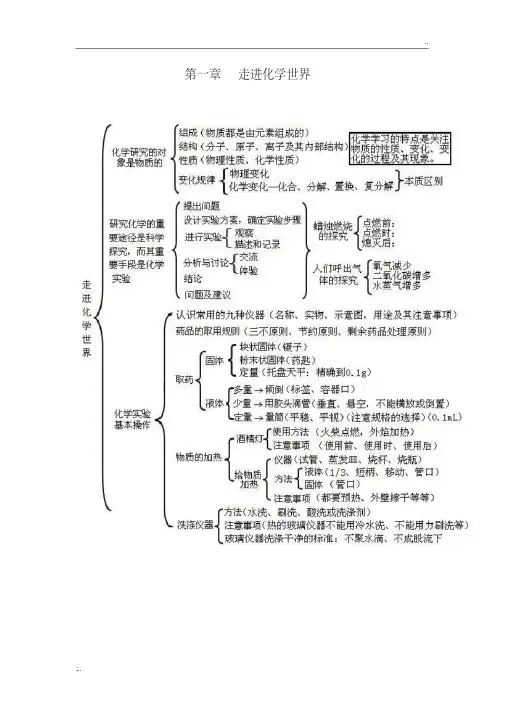
九年级化学思维导图第一章走进化学世界实验观察和描述方法:变化前、变化中、变化后关注物质的性质化学学习的特点关注物质的变化关注物质的变化过程及现象氧气含量:吸入空气>呼出气体二氧化碳含量:吸人空气<呼出气体水蒸气含量:吸入空气<呼出气体体验科学操究的一股步骤化学变化:有其他物质生成的变化物理变化:没有其他物质生成的变化伴随现象化学性质:在化学变化中表现出来的性质物理性质:不需要发生化学变化就表现出来的性质物理性质:颜色、状态、气味、密度、硬度、溶解性、挥发性、熔沸点、导电性、延展性化学性质:可燃性、氧化性、还原性、酸碱性、毒性可直接加热的:试管、蒸发皿、燃烧匙、坩埚需间接加热的:烧杯、锥形瓶不能加热的:集气瓶、量简、试剂瓶量取液体:量筒火焰:分三层,焰心(温度最低)、内焰、外焰(温度最高)使用前,先检查灯芯是否平整和酒精量是否占酒精灯容积的-使用时,应用火柴点燃,严禁灯点灯,严禁向燃着的灯内添加酒精”使用后,应用灯帽盖灭,严禁用嘴吹灭洒精着火:用湿抹布或沙土盖灭“三不”原则:口不尝、手不摸、鼻不凑近瓶口闻节约原则:没有规定具体用量时,固体:盖满试管底;液体:1-2mL剩余药品处理原则:不放回原瓶、不随意丢弃、不拿出实验室,放到指定容器内块状:用镊子夹取,“一横、二放、三慢竖”粉末:用药匙或纸槽,“一斜、二送、三直立”物质的变化反映决定物质的性质对人体吸入空气和呼出气体的探究化学是一门以实验为基础的科学化学实验基本操作常见化学仪器及其使用对蜡烛及其燃烧的探究走进化学世界物质的变化和性质走进化学实验室药品取用原则探究结论酒精灯区分和判断的依据固体取用第二章我们周围的空气性质:支持燃烧、供给呼吸用途:医疗急救、潜水、炼钢、航空航天等物理性质:通常状况下为无色、无味的气体,难溶于水性质化学性质:稳定,不易与其他物质反应用途:制造硝酸和氮肥;用作保护气;用于冷冻麻醉性质:通常状况下为无色、无味的气体,化学性质很不活泼,通电时发出不同颜色的光用途:制作电光源;用作保护气;氨用于制造低温环境二氧化碳(0.03%)其他气体和杂质(0.03%)装置(如右图)结论:氧气约占空气总体积的1/5混合物:由两种或两种以上的物质混合而成的物质,如空气、海水、合金等纯净物:只由一种物质组成的物质,如氧气、高锰酸钾等污染源:工厂废气、汽车尾气、化石燃料的燃烧污染物:可吸入颗粒物、有害气体危害:全球气候变暖、酸雨、臭氧层破坏加强空气质量监测消除污染源治理废气植树、造林、种草,改善环境物理性质:通常状况下为无色、无味的气体,密度比空气的咯大,不易溶于水。
第一章走进化学世界第二章我们周围的空气第三章物质构成的奥秘第四章自然界的水第五章化学方程式第六章碳和碳的氧化物第七章燃料及其利用第八章金属和金属材料第九章溶液第十第十章酸碱盐一、化学用语1、电离方程式:H2SO4=2H++SO42-;NaOH=NA++OH-;Al2(SO4)=2Al3++3SO42-2、物质的俗称和主要成分:生石灰CaO;熟石灰、消石灰、石灰水的主要成分Ca(OH)2;石灰石、大理石CaCO3;食盐的主要成分NaCl ;纯碱、口碱Na2CO3;烧碱、火碱、苛性钠NaOH;胆矾、蓝矾CuSO4·5H2O;碳酸钠晶体Na2CO3·10H2O;氨水NH3H2O。
二、金属活动性1、金属活动性顺序:K>Ca>Na>Mg>Al>Zn>Fe>Sn>Pb(H)Cu>Hg>Ag>Pt>Au2、金属活动性顺序的意义:在金属活动性顺序中,金属位置越靠前,金属在水溶液(酸溶液或盐溶液)中就越容易失电子而变成离子,它的活动性就越强。
3、金属活动性顺序的应用:(1)排在氢前的金属能置换出酸里的氢(元素)。
(2)排在前面的金属才能把排在后面的金属从它们的盐溶液中置换出来(K、Ca、Na除外)。
三、酸、碱、盐的溶解性1、常见盐与碱的溶解性:钾(盐)、钠(盐)、铵盐全都溶,硝酸盐遇水影无踪。
硫酸盐不溶硫酸钡,氯化物不溶氯化银。
碳酸盐只溶钾(盐)、钠(盐)、铵(盐)。
碱类物质溶解性:只有(氢氧化)钾、(氢氧化)钠、(氢氧化)钙、(氢氧化)钡溶。
2、八个常见的沉淀物:氯化银、硫酸钡碳酸银、碳酸钡、碳酸钙、氢氧化镁、氢氧化铜、氢氧化铁3、四微溶物Ca(OH)2(石灰水注明“澄清”的原因);CaSO4(实验室制二氧化碳时不用稀硫酸的原因);Ag2SO4(鉴别SO42-和Cl-时,不用硝酸银的原因);MgCO3(碳酸根离子不能用于在溶液中除去镁离子的原因)。
精心整理
第一章走进化学世界
第二章我们周围的空气
第三章物质构成的奥秘
第四章自然界的水
第五章化学方程式
第六章碳和碳的氧化物
第七章燃料及其利用
第八章金属和金属材料
第九章溶液
第十
第十章酸碱盐
一、化学用语
1、电离方程式:
H2SO4=2H++SO42-;NaOH=NA++OH-;Al2(SO4)=2Al3++3SO42-
2、物质的俗称和主要成分:
生石灰CaO;
熟石灰、消石灰、石灰水的主要成分Ca(OH)2;
石灰石、大理石CaCO3;
食盐的主要成分NaCl;
纯碱、口碱Na2CO3;
烧碱、火碱、苛性钠NaOH;
氨水
1
2
3
(1)
(2)Na除外)。
三、酸、碱、盐的溶解性
1、常见盐与碱的溶解性:
钾(盐)、钠(盐)、铵盐全都溶,硝酸盐遇水影无踪。
硫酸盐不溶硫酸钡,氯化物不溶氯化银。
碳酸盐只溶钾(盐)、钠(盐)、铵(盐)。
碱类物质溶解性:只有(氢氧化)钾、(氢氧化)钠、(氢氧化)钙、(氢氧化)钡溶。
2、八个常见的沉淀物:
氯化银、硫酸钡碳酸银、碳酸钡、碳酸钙、氢氧化镁、氢氧化铜、氢氧化铁
3、四微溶物
Ca(OH)2(石灰水注明“澄清”的原因);
CaSO4(
Ag2SO4(
MgCO3(
4
1
2
3、KNO
1
紫色的石蕊试液遇酸性溶液变红;遇碱性溶液变蓝;无色的酚酞试液只遇碱溶液变红。
注:不溶性碱与指示剂无作用;碱性溶液不一定是碱的溶液(特例:碳酸钠的水溶液显碱性)
2、pH值:溶液的酸碱度
pH<7溶液为酸性(越小酸性越强);
pH=7溶液为中性;
pH>7溶液为碱性(越大碱性越强)
六、离子的检验
Cl-(在溶液中):在被测溶液中加入硝酸银溶液,如果生成不溶于硝酸的白色沉淀,则原被测液中含氯离子。
SO42-(
CO32-
1.(
2.(
子。
注:
1
2
可能含银离子也可能含硫酸根离子。
七、物质的颜色
1、固体(多为白色)
黑色:CuO、C粉、MnO、2Fe3O4、
紫黑色:KMnO4
红色:Cu、Fe2O3
红褐色:Fe(OH)3
蓝色:Cu(OH)2、CuSO4.5H2O
绿色:Cu2(OH)2CO3
2、溶液(多为无色)
浅绿色溶液:(亚铁盐溶液)FeCl2溶液、FeSO4;
1
2
3
4
5
变质。
6
硫酸铜CuSO4.5H2O)。
7、碳酸钠:白色粉末,水溶液为碱性溶液(从溶液中析出的白色晶体为碳酸钠晶体Na2CO3.10H2O)。
8、氨水(NH3.H2O):属于碱的溶液。
九、酸与碱的通性和盐的性质
1、酸的通性
(1)酸溶液能使紫色的石蕊试液变红,不能使无色的酚酞试液变色;
(2)酸能与活泼金属反应生成盐和氢气;
(3)酸能与碱性氧化物反应生成盐和水;
(4)酸能与碱反应生成盐和水;
(5)酸能与某些盐反应生成新的盐和新的酸。
2
(1)
(2)
(3)
(4)
3
(1)
(2)
(3)。