2.影响盐类水解平衡的因素
- 格式:pptx
- 大小:1.11 MB
- 文档页数:8


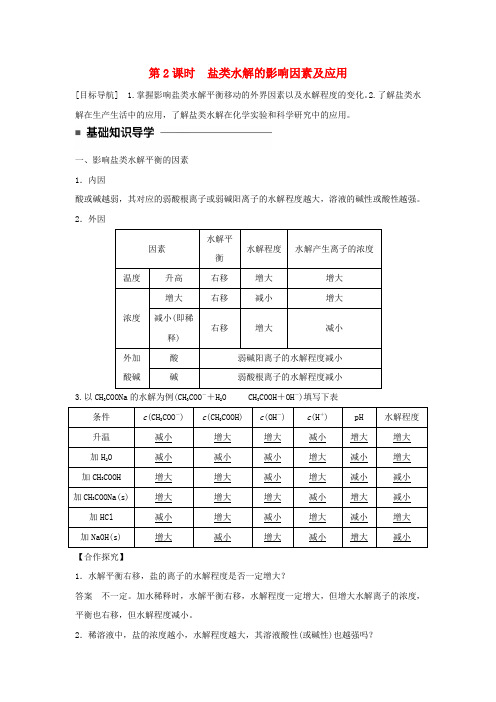
第2课时盐类水解的影响因素及应用[目标导航] 1.掌握影响盐类水解平衡移动的外界因素以及水解程度的变化。
2.了解盐类水解在生产生活中的应用,了解盐类水解在化学实验和科学研究中的应用。
一、影响盐类水解平衡的因素1.内因酸或碱越弱,其对应的弱酸根离子或弱碱阳离子的水解程度越大,溶液的碱性或酸性越强。
2.外因3.以CH3COONa的水解为例(CH3COO-+H2O CH3COOH+OH-)填写下表【合作探究】1.水解平衡右移,盐的离子的水解程度是否一定增大?答案不一定。
加水稀释时,水解平衡右移,水解程度一定增大,但增大水解离子的浓度,平衡也右移,但水解程度减小。
2.稀溶液中,盐的浓度越小,水解程度越大,其溶液酸性(或碱性)也越强吗?答案 盐溶液的浓度越小,水解程度越大,但由于溶液中离子浓度小是主要因素,故溶液酸性(或碱性)越弱。
3.有人认为,向CH 3COONa 溶液中加入少量冰醋酸,会与CH 3COONa 溶液水解产生的 OH -反应,使平衡向水解方向移动,这种说法对吗?为什么?答案 不对,原因是:体系中c (CH 3COOH)增大,抑制了水解,会使平衡CH 3COO -+H 2O CH 3COOH +OH -左移。
4.为使Na 2S 溶液中c (Na +)c (S 2-)的值减小,可以采取什么措施?加入NaOH 、NaHS 是否可以?答案 (1)降温 (2)加入KOH 或KHS 。
加入NaOH 、NaHS 不可以,因为水解平衡虽然左移,c (S 2-)增大,但c (Na +)增大更多,致使c (Na +)c (S 2-)增大。
二、盐类水解的应用 1.作净水剂铝盐、铁盐等部分盐类水解生成胶体,有较强的吸附性,常用作净水剂。
如明矾水解的离子方程式为Al 3++3H 2O Al(OH)3+3H +。
2.热碱水去油污 纯碱水解的离子方程式为 CO 2-3+H 2OHCO -3+OH -。
加热促进CO 2-3的水解,溶液碱性增强,去污能力增强。
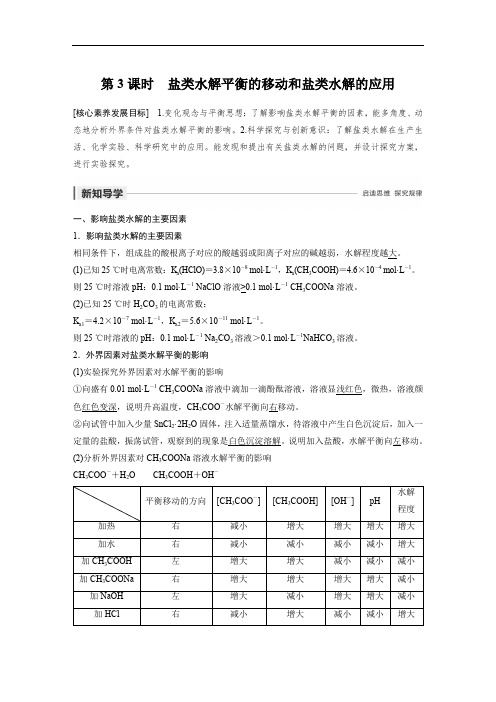
第3课时盐类水解平衡的移动和盐类水解的应用[核心素养发展目标] 1.变化观念与平衡思想:了解影响盐类水解平衡的因素,能多角度、动态地分析外界条件对盐类水解平衡的影响。
2.科学探究与创新意识:了解盐类水解在生产生活、化学实验、科学研究中的应用。
能发现和提出有关盐类水解的问题,并设计探究方案,进行实验探究。
一、影响盐类水解的主要因素1.影响盐类水解的主要因素相同条件下,组成盐的酸根离子对应的酸越弱或阳离子对应的碱越弱,水解程度越大。
(1)已知25 ℃时电离常数:K a(HClO)=3.8×10-8 mol·L-1,K a(CH3COOH)=4.6×10-4 mol·L-1。
则25 ℃时溶液pH:0.1 mol·L-1 NaClO溶液>0.1 mol·L-1 CH3COONa溶液。
(2)已知25 ℃时H2CO3的电离常数:K a1=4.2×10-7 mol·L-1,K a2=5.6×10-11 mol·L-1。
则25 ℃时溶液的pH:0.1 mol·L-1 Na2CO3溶液>0.1 mol·L-1NaHCO3溶液。
2.外界因素对盐类水解平衡的影响(1)实验探究外界因素对水解平衡的影响①向盛有0.01 mol·L-1 CH3COONa溶液中滴加一滴酚酞溶液,溶液显浅红色,微热,溶液颜色红色变深,说明升高温度,CH3COO-水解平衡向右移动。
②向试管中加入少量SnCl2·2H2O固体,注入适量蒸馏水,待溶液中产生白色沉淀后,加入一定量的盐酸,振荡试管,观察到的现象是白色沉淀溶解。
说明加入盐酸,水解平衡向左移动。
(2)分析外界因素对CH3COONa溶液水解平衡的影响CH3COO-+H2O CH3COOH+OH-外界因素对水解平衡的影响(1)温度:盐的水解是吸热反应,因此升高温度,水解平衡向水解方向移动,水解程度增大。

影响盐类水解的主要因素【学习目标】1、认识内因对盐类水解程度的影响;2、掌握外因对盐类水解程度的具体影响。
【要点梳理】要点一、影响盐类水解的因素1.内因:主要因素是盐本身的结构和性质,组成盐的酸根对应的酸越弱或阳离子对应的碱越弱,水解程度就越大(越弱越水解)。
例如:酸性HF>CH3COOH 水解程度NaF<CH3COONa多元弱酸正盐的水解,水解反应第一步远远大于第二步,原因是第一步水解产生的OH―对第二步水解的抑制作用,并且正盐阴离子与H+结合能力比酸式盐阴离子结合能力强。
2.外因①温度:水解过程一般是吸热过程,故升温使水解程度增大,反之则减小。
②浓度:盐的浓度越小,电解质离子相互碰撞结合成电解质分子的几率越小,水解程度越大。
3.溶液的酸碱性组成盐的离子能与水发生水解反应。
向盐溶液中加入H+,可抑制阳离子水解,促进阴离子水解;向盐溶液中加入OH―,能抑制阴离子水解,促进阳离子水解。
【规律总结】越弱越水解,越热越水解,越稀越水解,加酸碱抑制或促进水解。
4.典型实例:醋酸钠水解平衡的移动:CH3COO-+H2O CH3COOH+OH-1.互促水解的定义:弱酸弱碱盐溶液中,盐的阳离子结合水产生的OH-,盐的阴离子结合水产生的H+,相互促进水解,所以水解程度较大。
溶液的酸碱性取决于生成的弱酸和弱碱的相对强弱,若弱碱较强则溶液显碱性;若弱酸较强则溶液显酸性。
2.盐与盐混合时的互促水解问题盐与盐的反应又分以下几种情况:(1)两种水解情况相同的盐溶液的反应。
①NaHCO3和Na2SiO3的反应,NaSiO3的水解程度远大于NaHCO3的水解程度,因而Na2SiO3的水解抑制了NaHCO3的水解而促进了HCO3-的电离。
HCO3-H++CO32-,HCO3-的电离反过来又促进了SiO32-的水解,其反应为:Na2SiO3+2NaHCO3=H2SiO3↓+2Na2CO3同理:NaAlO2+NaHCO3+H2O=A1(OH)3↓+Na2CO3②硝酸银与氯化铝的反应,因两者水解都显酸性,相互抑制,不利于水解的进行,发生复分解反应生成难溶物(AgCl),因此发生的反应为3AgNO3+AlCl3=3AgCl↓+Al(NO3)3。

【高中化学】影响盐类水解的因素1.盐类的性质这是影响盐水解的内部因素。
盐的酸碱性越弱,盐的水解程度越大,盐溶液的碱度或酸度也越强。
例如:na2so3与na2s,若温度和物质的量浓度相同时,因na2s对应的弱酸(h2s)较na2so3对应的弱酸(h2so3)弱,所以s2?比so32?易水解,溶液的碱性越强,又如:mgso4和fe2(so4)3对应的弱碱的强弱不同,mg(oh)2的碱性比fe(oh)3强,所以盐mgso4和fe2(so4)3比较,fe2(so4)3溶液酸性较强。
2.盐溶液的浓度:稀释溶液可以促进水解,向右移动,水解的百分率增大;若增大盐的浓度,水解平衡虽然向右移动,但水解百分率反而下降。
例如,在制备FeCl3溶液时,为了防止FeCl3水解,制备的溶液一般为饱和溶液,因此水解程度小,避免浑浊。
注意:饱和fecl3水解程度虽然小,但其溶液呈酸性,而稀释时,其水解程度虽增大,但因本身浓度减小,其酸性反而增大了。
3.温度盐的水解反应是吸热反应,升高温度可促进盐的水解,使水解平衡向右移动,水解百分率增大。
例如,当FeCl 3溶液被加热时,其颜色加深并逐渐变得浑浊,最终沉淀,但由于水解度的增加,其溶液的酸度增强。
[思考]:将fecl3溶液充分加热,最终得到的产物是什么?另一个例子:0.1mol/l Na2CO3溶液,当在室温下添加酚酞时,溶液呈浅红色。
加热时,溶液的红色逐渐加深,盐的水解度增加,溶液的pH值增加。
4.溶液的酸碱性构成盐的离子可以与水一起水解。
在盐溶液中加入H+可以抑制阳离子的水解,促进阴离子的水解。
哦?,它能抑制阴离子水解,促进阳离子水解。
如:配制fecl3溶液时,一般加入少量的hcl,抑制fe3+的水解,因为fe3++3h2o?fe(oh)3+3h+;加入h+时,其浓度增大,平衡向右移动,fe3+水解程度减小了,如果加入oh?,h+与oh?反应,使h+浓度下降,溶液中的平衡向右移动,促进fe3+水解,会出现沉淀。
盐类的水解一、探究盐溶液的酸碱性【结论】盐溶液并不都显中性。
二、盐溶液呈现不同酸碱性的原因1.CH3COONa水溶液呈碱性的原因(1)电离方程式CH3COONa===CH3COO-+Na+、H2O H++OH-.(2)水电离平衡的影响CH3COO-能与H+结合生成弱电解质CH3COOH。
使水的电离平衡向电离的方向移动。
(3)溶液的酸碱性溶液中c(H+)减小,c(OH-)增大,c(H+)〈c(OH-),故CH3COONa溶液呈碱性.(4)水解方程式化学方程式:CH3COONa+H2O CH3COOH+NaOH。
离子方程式:CH3COO-+H2O CH3COOH+OH-。
2.NH4Cl溶液呈酸性的原因(1)电离方程式NH4Cl=NH错误!+Cl-、H2O H++OH-。
(2)水电离平衡的影响NH+4与OH-结合生成弱电解质NH3·H2O,使水的电离平衡向电离的方向移动。
(3)溶液的酸碱性溶液中c(OH-)减小,c(H+)增大,c(H+)〉c(OH-),故NH4Cl 溶液呈酸性。
(4)水解方程式化学方程式:NH4Cl+H2O NH3·H2O+HCl。
离子方程式:NH+,4+H2O NH3·H2O+H+.3.NaCl溶液呈中性的原因NaCl溶于水后电离产生Na+和Cl-,不能与水电离出的OH-、H +结合成难电离的物质,水的电离平衡不发生移动,c(H+)=c(OH -),溶液呈中性.4.盐类水解(1)盐类水解的实质在溶液中盐电离出来的离子(弱碱的阳离子或弱酸的阴离子)结合水电离出的OH-或H+生成弱电解质,破坏了水的电离平衡,促进了水的电离,使溶液显酸性、碱性或中性。
(2)盐类水解的规律在可溶性盐溶液中:有弱才水解,无弱不水解,越弱越水解,都弱都水解,谁强显谁性。
常见的“弱"离子弱碱阳离子:NH错误!、Al3+、Mg2+、Zn2+、Fe3+、Cu2+等。
弱酸根离子:CO错误!、SiO错误!、HCO错误!、AlO错误!、SO错误!、S2-、HS-、ClO-、CH3COO-、F-等。