焦亚硫酸钠含量的检测方法(2020年整理).pptx
- 格式:pptx
- 大小:33.74 KB
- 文档页数:5
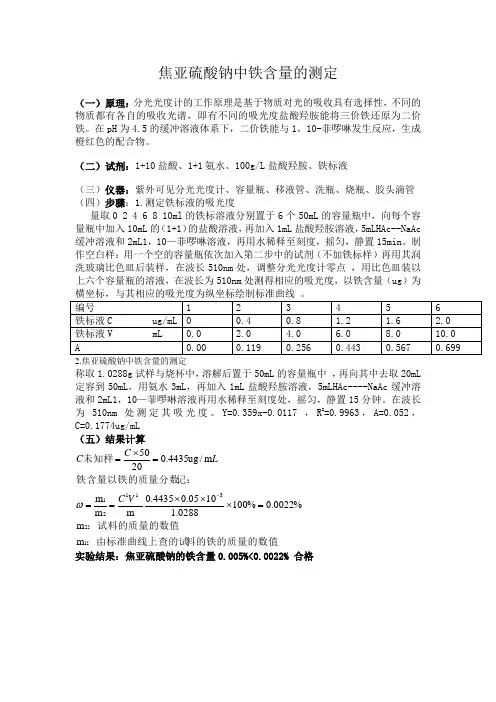
焦亚硫酸钠中铁含量的测定(一)原理:分光光度计的工作原理是基于物质对光的吸收具有选择性,不同的物质都有各自的吸收光谱,即有不同的吸光度盐酸羟胺能将三价铁还原为二价铁。
在pH 为4.5的缓冲溶液体系下,二价铁能与1,10-菲啰啉发生反应,生成橙红色的配合物。
(二)试剂:1+10盐酸、1+1氨水、100g/L 盐酸羟胺、铁标液(三)仪器:紫外可见分光光度计、容量瓶、移液管、洗瓶、烧瓶、胶头滴管(四)步骤:1.测定铁标液的吸光度量取0 2 4 6 8 10ml 的铁标溶液分别置于6个50mL 的容量瓶中,向每个容量瓶中加入10mL 的(1+1)的盐酸溶液,再加入1mL 盐酸羟胺溶液,5mLHAc--NaAc 缓冲溶液和2mL1,10—菲啰啉溶液,再用水稀释至刻度,摇匀,静置15min 。
制作空白样:用一个空的容量瓶依次加入第二步中的试剂(不加铁标样)再用其润洗玻璃比色皿后装样,在波长510nm 处,调整分光光度计零点 ,用比色皿装以上六个容量瓶的溶液,在波长为510nm 处测得相应的吸光度,以铁含量(ug )为横坐标,与其相应的吸光度为纵坐标绘制标准曲线 。
编号 1 2 3 4 5 6 铁标液C ug/mL 0 0.4 0.8 1.2 1.6 2.0 铁标液V mL 0.0 2.0 4.0 6.0 8.010.0 A 0.00 0.119 0.256 0.443 0.5670.6992.焦亚硫酸钠中铁含量的测定 称取1.0288g 试样与烧杯中,溶解后置于50mL 的容量瓶中 ,再向其中去取20mL 定容到50mL ,用氨水3mL ,再加入1mL 盐酸羟胺溶液,5mLHAc----NaAc 缓冲溶液和2mL1,10—菲啰啉溶液再用水稀释至刻度处,摇匀,静置15分钟。
在波长为510nm 处测定其吸光度。
Y=0.359x-0.0117 ,R 2=0.9963,A=0.052,C=0.1774ug/mL(五)结果计算料的铁的质量的数值:由标准曲线上查的试:试料的质量的数值记:铁含量以铁的质量分数未知样1231121m m %0022.0%1000288.11005.04435.0m m m m /ug 4435.02050=⨯⨯⨯===⨯=-V C L C C ω 实验结果:焦亚硫酸钠的铁含量0.005%<0.0022% 合格0.20.40.60.800.00050.0010.00150.0020.0025标准曲线y = 367.75x-0.0245 R^2 = 0.9952浓度吸光度系列1线性 (系列1)(六)注意事项1、在使用比色皿时,注意保护光学面2、在实验过程中,盐酸具有腐蚀性,防止溅到皮肤,伤害皮肤组织(七)实验讨论1、邻菲啰啉比比色测定铁的原理是什么?用该法测出的铁含量是否是式样中亚铁含量?答:因为亚铁与1,10—菲啰啉生成橙红色物质,便于分光光度计的检测。

焦亚硫酸钠检测标准焦亚硫酸钠是一种重要的化工原料,广泛应用于食品、医药、化工等领域。
为了确保产品质量和安全,对焦亚硫酸钠的检测标准十分重要。
本文将介绍焦亚硫酸钠的常见检测方法及标准,以供相关行业人士参考。
一、外观检测。
焦亚硫酸钠的外观检测是最基础的检测手段之一。
正常情况下,焦亚硫酸钠为白色结晶性粉末,无异物、结块或变色现象。
在进行外观检测时,应将样品置于干燥的容器中,对比标准样品进行观察,确保外观符合标准要求。
二、纯度检测。
焦亚硫酸钠的纯度检测是保证产品质量的关键环节。
常见的纯度检测方法包括滴定法、重量法和色度法等。
在进行纯度检测时,应根据具体情况选择合适的检测方法,并严格按照标准操作程序进行操作,确保测试结果准确可靠。
三、水分检测。
焦亚硫酸钠的水分含量直接影响其品质和稳定性。
常见的水分检测方法包括干燥法、滴定法和红外线法等。
在进行水分检测时,应注意样品的制备和操作过程,避免外界水分的干扰,确保测试结果准确可靠。
四、重金属检测。
焦亚硫酸钠中重金属元素的含量应符合国家标准要求,以保证产品的安全性和环保性。
常见的重金属检测方法包括原子吸收光谱法、电感耦合等离子体发射光谱法等。
在进行重金属检测时,应严格控制样品制备和检测条件,确保测试结果准确可靠。
五、杂质检测。
焦亚硫酸钠中的杂质含量应符合国家标准要求,以保证产品的纯度和稳定性。
常见的杂质检测方法包括色度法、比色法和滴定法等。
在进行杂质检测时,应注意样品的制备和操作过程,严格按照标准操作程序进行操作,确保测试结果准确可靠。
六、微生物检测。
焦亚硫酸钠产品中微生物的含量应符合国家标准要求,以保证产品的安全性和卫生性。
常见的微生物检测方法包括菌落总数检测、大肠菌群检测和霉菌检测等。
在进行微生物检测时,应严格控制样品制备和检测条件,确保测试结果准确可靠。
综上所述,焦亚硫酸钠的检测标准涉及外观、纯度、水分、重金属、杂质和微生物等多个方面。
在进行检测时,应选择合适的检测方法,并严格按照标准操作程序进行操作,确保测试结果准确可靠。
原料质量标准
1.理化性质
1.1 分子式:Na2S2O5
1.2 分子量:190.10
1.3 性状:本品为无色、白色或类白色结晶或结晶性粉末;有二氧化硫臭,味酸、咸。
在水中易溶,在乙醇中极微溶解。
2、检测项目
3.1 外观:本品为无色、白色或类白色结晶或结晶性粉末;有二氧化硫臭,味酸、咸。
3.2 鉴别
检查1:取碘试液,滴加本品的水溶液(1→20)适量,碘的颜色消失;所得溶液显硫酸盐的鉴别反应:取供试品溶液,滴加氯化钡试液,即生成白色沉淀;分离,沉淀在盐酸或硝酸中不溶解。
检查2:取铂丝,用盐酸湿润后,蘸取供试品,在无色火焰中燃烧,火焰显鲜黄色。
3.3酸度
取本品l.0 g,加水20ml溶解后,酸度计测定,pH值为3.5~5.0。
3.4澄清度
取本品l.0g,加水10ml溶解后,溶液应澄清无色。
3.5焦亚硫酸钠含量测定
取本品约0.15g,精密称定,置碘瓶中,精密加碘滴定液(0.05mol/L)50ml,密塞,振摇溶解后,加盐酸lml,用硫代硫酸钠滴定液(0.lmol/L)滴定,至近终点时,加淀粉指示液2ml,继续滴定到蓝色消失;并将滴定的结果用空白试验校正。
每lml碘滴定液(0.05mol/L)相当于4.752mg的Na2S2O5。
3.6重金属
取本品l.0g,加水10ml溶解后,加盐酸5ml,置水浴上蒸干,残渣加水15ml,缓缓煮沸2分钟,放冷,加溴试液适量使澄清,加热除去过剩的溴,放冷,加酚酞指示液1滴与氨试液适量至溶液显粉红色,加醋酸盐缓冲液(PH3.5) 2ml与水适量使成25ml,依法检査(附录ⅧH第一法),含重金属不得过百万分之二十。
![一种测定注射液中焦亚硫酸钠含量的方法[发明专利]](https://uimg.taocdn.com/96d297b6ed3a87c24028915f804d2b160a4e8642.webp)
(19)中华人民共和国国家知识产权局(12)发明专利申请(10)申请公布号 (43)申请公布日 (21)申请号 202011014550.0(22)申请日 2020.09.24(71)申请人 南京斯泰尔医药科技有限公司地址 210000 江苏省南京市栖霞区仙林街道纬地路9号29幢111、113室(72)发明人 周国才 雍永佳 (51)Int.Cl.G01N 30/02(2006.01)G01N 30/06(2006.01)G01N 30/54(2006.01)G01N 30/74(2006.01)(54)发明名称一种测定注射液中焦亚硫酸钠含量的方法(57)摘要本发明属于药品分析领域,开发了一种测定注射液中抗氧剂焦亚硫酸钠含量的方法,包括配液、分离测定、计算等步骤。
通过加入保护剂,增强焦亚硫酸钠对照品和供试品溶液的稳定性,以满足检测的要求。
本发明的方法操作简便,专属性强,灵敏度高,方法学验证表明精密度和准确度良好,可以满足注射液中抗氧剂焦亚硫酸钠的含量测定的要求。
权利要求书1页 说明书3页 附图2页CN 112326808 A 2021.02.05C N 112326808A1.一种测定注射液中焦亚硫酸钠含量的方法,其特征在于,(1)配液:对照品溶液:配制含有规定浓度的焦亚硫酸钠标准品和保护剂的溶液作为对照品溶液;供试品溶液:以规定浓度的保护剂溶液稀释注射液作为供试品溶液,(2)分离测定:分别取对照品溶液和供试品溶液,注入HPLC,获取对照品溶液和供试品溶液中焦亚硫酸钠峰的峰面积;(3)计算:按外标法代入对照品溶液和供试品溶液中焦亚硫酸钠峰的峰面积,计算焦亚硫酸钠的含量。
2.根据权利要求1所述的注射液中焦亚硫酸钠含量的测定方法,其特征在于步骤(1)中,焦亚硫酸钠标准品配制的浓度范围为0.05mg/ml~1mg/ml,保护剂配制的浓度范围为0.00mg/ml~1mg/ml,用于稀释注射液的保护剂溶液的浓度范围为0.00mg/ml~1mg/ml,稀释后的供试品溶液中焦亚硫酸钠的浓度范围为0.05mg/ml~1mg/ml,保护剂包括:亚硫酸钠、二丁基苯酚、亚硫酸氢钠、硫代硫酸钠、叔丁基对羟基茴香醚、维生素C、硫脲、没食子酸丙酯、α-生育酚。

MM_FS_CNG_0421食品添加剂焦亚硫酸钠MM_FS_CNG_0421食品添加剂焦亚硫酸钠1.适用范围本方法适用于食品添加剂焦亚硫酸钠,该产品主要用于食品加工中作防腐剂、漂白剂、疏松剂。
分子式:Na2S 2 O5相对分子质量:190.12(按1995年国际相对原子质量)2.要求2.1.外观:食品添加剂焦亚硫酸钠为白色或微黄色结晶粉末。
2.2.食品添加剂焦亚硫酸钠应符合表1要求:表项目指标主含量(以Na2S2O5计),%≥95.0铁含量(以Fe计),%≤0.005澄清度稍有微浊重金属含量(以Pb计),%≤0.001砷含量(以As计),%≤0.00023.3.1.鉴别3.1.1.试剂碘;碘化钾:360g/L溶液;盐酸;盐酸:1+3溶液;碘溶液:取1.4g碘,置于10mL碘化钾溶液中,加两滴盐酸,加水溶解,稀释至100mL,贮存于棕色瓶中避光保存;硝酸亚汞;汞;硝酸:1+9溶液;硝酸亚汞溶液:取15g硝酸亚汞,加90mL水、10mL硝酸溶液溶解后,加一滴汞,避光密塞保存待用。
3.1.2.鉴别试验3.1.2.1.本品呈亚硫酸盐特效反应:试样的水溶液加入碘溶液后黄色即褪。
试样的水溶液滴入1+3盐酸溶液后即有二氧化硫气体逸出,以硝酸亚汞溶液浸润的试纸检验,显黑色。
3.1.2.2.本品显钠盐特效反应:用盐酸浸润的铂丝先在无色火焰上燃烧至无色,再蘸取少许试样溶液,在无色火焰上燃烧,火焰即呈鲜黄色。
3.2.主含量的测定3.2.1.方法提要在弱酸性溶液中,用碘将亚硫酸盐氧化成硫酸盐。
以淀粉为指示剂,用硫代硫酸钠标准滴定溶液滴定过量的碘。
3.2.2.试剂碘标准滴定溶液:c(1/2I2)约0.1mol/L;冰乙酸:(1+3)溶液;硫代硫酸钠标准滴定溶液:c(Na2S2O3)约0.1mol/L;可溶性淀粉:5g/L溶液。
3.2.3.仪器、设备一般试验室仪器设备。
3.2.4.分析步骤移取50mL碘标准滴定溶液,置于碘量瓶中。


焦亚硫酸钠Jiaoya liusuannaSodium PyrosulfiteNa2S2O5190.10[7681-57-4]本品为氢氧化钠溶液或碳酸钠溶液通入二氧化硫,吸收饱和后制得亚硫酸氢钠,经分离、干燥、脱水制得。
含Na2S2O5不得少于95.0%。
【性状】本品为无色、白色或类白色结晶或结晶性粉末;有二氧化硫臭,味酸、咸。
本品在水中易溶,在乙醇中极微溶解。
【鉴别】(1)取碘试液,滴加本品的水溶液(1→20)适量,碘的颜色即消失;所得溶液显硫酸盐反应(《中国药典》2010年版二部附录Ⅲ)。
(2)本品显钠盐的火焰反应(《中国药典》2010年版二部附录Ⅲ)。
【检查】酸度取本品1.0g,加水20ml溶解后,依法测定(附录VI H),pH 值应为3.5~5.0。
溶液的澄清度与颜色取本品1.0g,加水10ml溶解后,溶液应澄清无色。
硫代硫酸盐取本品2.2g,缓缓加稀盐酸10ml,溶解后,置水浴中加热10分钟,放冷,移置比色管中,加水至20ml,如显浑浊,与硫代硫酸钠滴定液(0.1mol/L)0.1ml用同一方法制成的对照液比较,不得更浓(0.05%)。
铁盐取本品1.0g,加水5ml与盐酸2ml溶解后,置水浴上蒸干,残渣加水15ml 与盐酸2ml,溶解后,加溴试液适量使溶液显微黄色,加热除去过剩的溴,放冷,加水至25ml,依法检查(《中国药典》2010年版二部附录ⅧG),与标准铁溶液2.0ml制成的对照液比较,不得更深(0.002%)重金属取本品1.0g,加水10ml溶解后,加盐酸5ml,置水浴上蒸干,残渣加水15ml,缓缓煮沸2分钟,放冷,加溴试液适量使澄清,加热除去过剩的溴,放冷,加酚酞指示液1滴与氨试液适量至溶液显粉红色,加醋酸盐缓冲液(pH3.5)2ml与水适量使成25ml,依法检查(《中国药典》2010年版二部附录ⅧH第一法),含重金属不得过百万分之二十。
砷盐取本品1.0g,加水4ml溶解后,缓缓滴加硝酸3ml,置水浴上蒸干,残渣加盐酸5ml与水23ml,溶解后,依法检查(《中国药典》2010年版二部附录ⅧJ 第一法),应符合规定(0.0002%)。

焦亚硫酸钠试验方法1引用标准当以下标准被修订时,使用本细则的各方应探讨使用下列标准最新版本的可能性 GB/T 601-2002 化学试剂 滴定标准溶液的制备GB/T 603-2002 化学试剂 试验方法中所用制剂及制品的制备(neq ISO 6353-1:1982) GB/T 6678-2003 化工产品采样总则GB/T 6682-2008 分析实验室用水规格和试验方法(neq ISO 3696:1987)HG/T 2826-2008 工业焦亚硫酸钠2外观工业焦亚硫酸钠为白色或微黄色结晶粉末。
3主含量的测定3.1方法提要在弱酸性溶液中,用碘将焦亚硫酸钠氧化成硫酸盐。
以淀粉为指示剂,用硫代硫酸钠标准滴定溶液滴定过量的碘。
3.2试剂和材料碘标准滴定溶液c(1/2I 2)约0.1mol/L ;冰乙酸溶液:1+3;硫代硫酸钠标准滴定溶液:c(Na 2S 2O 3)约0.1mol/L ;可溶性淀粉溶液:5g/L3.3仪器、设备一般实验室仪器和设备3.4分析步骤迅速称取约0.1g 试样(精确至0.0002g),置于预先用移液管加入50mL 碘标准滴定溶液及30mL 水的250mL 碘量瓶中,置于碘量瓶中,加入5mL 冰乙酸,立刻盖上瓶盖,水封,缓缓摇动溶解后,置于暗处放置5min 。
以硫代硫酸钠标准滴定溶液滴定,近终点时,加入2mL 淀粉指示剂,继续滴定至溶液蓝色消失为终点。
同时用移液管移取50mL 碘标准滴定溶液,按同样条件,进行空白试验。
3.5分析结果的表述以焦亚硫酸钠(Na 2S 2O 5)质量百分数表示主含量1w ,按式(1)计算:1w =01(-)×100%1000c V V M m (1)式中: c -硫代硫酸钠标准滴定溶液的浓度,mol/L ;1V -滴定试验溶液所消耗的硫代硫酸钠标准溶液的体积,mL ;V-空白试验溶液所消耗的硫代硫酸钠标准溶液的体积,mL;m-试样的质量,g;M-焦亚硫酸钠(1/4Na2S2O5)的摩尔质量,g/mol,(M=47.52)。

MM_FS_CNG_0421食品添加剂焦亚硫酸钠MM_FS_CNG_0421食品添加剂焦亚硫酸钠1.适用范围本方法适用于食品添加剂焦亚硫酸钠,该产品主要用于食品加工中作防腐剂、漂白剂、疏松剂。
分子式:Na2S 2 O5相对分子质量:190.12(按1995年国际相对原子质量)2.要求2.1.外观:食品添加剂焦亚硫酸钠为白色或微黄色结晶粉末。
2.2.食品添加剂焦亚硫酸钠应符合表1要求:表3.3.1.鉴别3.1.1.试剂碘;碘化钾:360g/L溶液;盐酸;盐酸:1+3溶液;(1体积水3体积浓盐酸。
)碘溶液:取1.4g碘,置于10mL碘化钾溶液中,加两滴盐酸,加水溶解,稀释至100mL,贮存于棕色瓶中避光保存;硝酸亚汞;Hg2(NO3)2汞;硝酸:1+9溶液;(1体积水9体积浓硝酸。
)硝酸亚汞溶液:取15g硝酸亚汞,加90mL水、10mL硝酸溶液溶解后,加一滴汞,避光密塞保存待用。
3.1.2.鉴别试验3.1.2.1.本品呈亚硫酸盐特效反应:试样的水溶液加入碘溶液后黄色即褪。
试样的水溶液滴入1+3盐酸溶液后即有二氧化硫气体逸出,以硝酸亚汞溶液浸润的试纸检验,显黑色。
3.1.2.2.本品显钠盐特效反应:用盐酸浸润的铂丝先在无色火焰上燃烧至无色,再蘸取少许试样溶液,在无色火焰上燃烧,火焰即呈鲜黄色。
3.2.主含量的测定3.2.1.方法提要在弱酸性溶液中,用碘将亚硫酸盐氧化成硫酸盐。
以淀粉为指示剂,用硫代硫酸钠标准滴定溶液滴定过量的碘。
3.2.2.试剂碘标准滴定溶液:c(1/2I2)约0.1mol/L;冰乙酸:无水乙酸CH3COOH(1+3)溶液;亚硫酸钠又称硫代硫酸钠标准滴定溶液:c(Na2S2O3)约0.1mol/L;可溶性淀粉:5g/L溶液。
3.2.3.仪器、设备一般试验室仪器设备。
3.2.4.分析步骤移取50mL碘标准滴定溶液,置于碘量瓶中。
称取约0.2g试样,精确至0.000 2g,加入到碘溶液中,加塞后在暗处放置5min。

焦亚硫酸钠的测定方法测定方法方法原理方法名称:焦亚硫酸钠---焦亚硫酸钠的测定---氧化还原滴定法应用范围:该方法采用滴定法测定焦亚硫酸钠的含量。
该方法适用于焦亚硫酸钠。
供试品置碘瓶中,精密加碘滴定液(0.05 mol/L)50mL,密塞,振摇使溶解,加盐酸1mL,用硫代硫酸钠滴定液(0.1 mol/L)滴定,近终点时加淀粉指示液1mL,继续滴定至蓝色消失,计算焦亚硫酸钠的含量。
试剂:1.碘滴定液(0.05mol/L)2.硫代硫酸钠滴定液(0.1 mol/L)3.淀粉指示液4.盐酸仪器设备试样制备:1.碘滴定液(0.05mol/L)配制:取碘13.0g,加碘化钾36g与水50mL溶解后,加盐酸3滴与水适量使成1000mL,摇匀,用垂熔玻璃滤器滤过。
标定:取在105ºC干燥至恒重的基准三氧化二砷约0.15g,加氢氧化钠滴定液(1mol/L)10mL,微热使溶解,加水20mL与甲基橙指示液1滴,加硫酸滴定液(0.5mol/L)适量使黄色转变为粉红色,再加碳酸氢钠2g、水50mL与淀粉指示液2mL,用本液滴定至溶液显浅蓝紫色。
每1mL碘滴定液(0.05mol/L)相当于4.946三氧化二砷。
根据本液的消耗量和三氧化二砷的取用量,算出本液的浓度,即得。
如需用碘滴定液(0.025mol/L)时,可取碘滴定液(0.05mol/L)加水稀释制成。
贮藏:置玻璃塞的棕色玻璃瓶中,密闭,在凉处保存。
⒉硫代硫酸钠滴定液(0.1 mol/L)配制:取硫代硫酸钠26g与无水碳酸钠0.20g,加新沸过的冷水适量使溶解成1000mL,摇匀,放置1个月后滤过。
标定:取在120℃干燥恒重的基准重铬酸钾约0.15g,精密称定,置碘瓶中,加水50mL使溶解,加碘化钾2.0g ,轻轻振摇使溶解,加稀硫酸40mL,摇匀,密塞;在暗处放置10分钟后,加水250mL稀释,用本液滴定至近终点时,加淀粉指示液3mL,继续滴定至蓝色消失而显亮绿色,并将滴定的结果用空白试验校正。

焦亚硫酸钠的含量测定焦亚硫酸钠,听起来是不是有点儿生僻?它在我们生活中可没那么遥远。
想想看,咱们在超市里买的那些果干、蔬菜,很多都用它来保鲜,真是个好帮手。
不过,今天咱们聊的不是它的用途,而是怎么测定它的含量。
哎,科学这东西,虽然看起来复杂,但咱们可以轻松点儿来搞定。
咱们得准备一些工具,别担心,这些东西在实验室里都能找到。
你需要一些试剂,比如碘溶液,这可是测定焦亚硫酸钠的“好伙伴”。
不过,咱们可不能直接把它们放在一起,得先溶解焦亚硫酸钠,这样才方便测量。
你想象一下,像在调配饮料一样,把它搅拌均匀,确保每一颗粒都能参与到这个大派对中来。
别着急,慢慢来,稳住,结果才会更准确。
咱们就要开始“较量”了。
把准备好的溶液放在滴定管里,慢慢地滴入碘溶液。
看着颜色的变化,简直像是在看魔术!你会看到,随着滴定的进行,溶液的颜色逐渐变成深蓝色。
这个过程真是让人兴奋,心里都在想:“哎呀,快来,快来,让我看看最终结果!”不过,这个变色不是随便的,要仔细观察。
颜色一旦变深,就得赶紧停手,说明焦亚硫酸钠的含量差不多到了。
记得做好记录哦!这一步至关重要,别到最后搞得一头雾水,真是得不偿失。
你要把每次滴入的量都记下来,这样才能算出焦亚硫酸钠的最终含量。
也许你会想,这么麻烦干嘛?掌握了这些细节,后续的工作就会简单多了。
就像是搭积木,基础打好了,上面才能稳稳当当。
在整个过程中,注意安全哦!化学反应可不是闹着玩的,手套和护目镜是你的好朋友。
每次实验前都要检查一下设备,确保万无一失。
这个时候,可别心急,慢慢来,安全第一。
毕竟,咱们不是为了冒险,而是为了追求准确和可靠的结果。
说到这里,很多人可能会觉得化学有点无聊,其实不然!这过程就像一场探险,遇到困难时,咱们可以调整策略,试试不同的实验方法。
比如,有时候用不同浓度的碘溶液,可以让结果更加精确,真的是乐趣无穷。
焦亚硫酸钠的测定,不仅仅是个技术活,还是个思维的挑战。
想一想,这背后有多少科学原理在支撑着。
一种测定注射液中焦亚硫酸钠含量的方法测定注射液中焦亚硫酸钠含量的方法
焦亚硫酸钠是一种常用的消毒剂,广泛应用于医疗领域。
为了保证注射液中焦亚硫酸钠的含量符合安全标准,我们需要采用可靠准确的方法进行测定。
下面我将介绍一种可行的测定方法。
首先,我们需要准备以下试剂和设备:
1. 注射液样品
2. 过氯化钠溶液
3. 0.1mol/L 硫代硫酸钠标准溶液
4. 硝基二甲苯指示剂
5. 采样瓶
6. 试管、容量瓶、移液管等常用实验室仪器
接下来,按照以下步骤进行测定:
1. 取一定量的注射液样品,使用过氯化钠溶液将其中的焦亚硫酸钠转化为亚硫酸钠。
过氯化钠的加入可以保证亚硫酸钠除去焦亚硫酸钠后成为标准反应产物。
2. 在试管中加入转化后的样品,然后加入硝基二甲苯指示剂。
亚硫酸钠会与指示剂发生反应,溶液由无色变为红色或棕褐色。
3. 准备标准溶液,使用硫代硫酸钠标准溶液进行稀释,制备一系列不同浓度的标准溶液。
4. 取同样体积的不同浓度标准溶液进行比色测定,绘制浓度与吸光度之间的标准曲线。
5. 测量样品的吸光度,并使用标准曲线确定样品中亚硫酸钠的浓度。
6. 计算样品中焦亚硫酸钠的含量,根据测定结果进行调整。
这种测定注射液中焦亚硫酸钠含量的方法可以提供准确的结果,能够满足临床
和医疗行业的需求,保障患者的安全使用。
通过定期进行检测,可以及时发现问题,并采取相应措施来调整生产工艺,确保产品质量达标。
某注射液中焦亚硫酸钠含量测定方法的研究
注射液中焦亚硫酸钠是一种常用的防腐剂和消毒剂,它能有效杀灭细菌和病毒,保证注射液的质量。
因此,了解焦亚硫酸钠含量是非常必要的。
本文将介绍一种测定注射液中焦亚硫酸钠含量的方法。
实验步骤:
步骤一:准备试样
取适量的注射液样品,精确称量并转移至50ml容量瓶中,加入约40ml去离子水,振荡均匀,再用去离子水定容至刻度。
步骤二:取样
取适量的样品继续进行下一步操作。
步骤三:准备处理液
将0.2mol/L碘酸钾溶液和0.3mol/L硫酸溶液按照3:17的比例混合,作为处理液备用。
步骤四:反应
取一定量的样品放入含有适量处理液的量筒中,加入稀硫酸溶液调节pH值,同时加入淀粉试剂滴到试管中,用硫酸调节pH值,溶液由无色变为深蓝色。
过程中应进行短暂剧烈振荡。
步骤五:标准工作液配制
称取适量的焦亚硫酸钠溶液,并用去离子水定容至100ml,作为标准工作液,标准工作液浓度为1mg/ml。
步骤六:检测
取焦亚硫酸钠标准工作液5ml,加入量筒中,用加水至25ml的液体调节液位,然后按上述方法进行反应。
反应结束后,将量筒置于比色皿上,比色皿中加25ml 去离子水,以配成标准曲线。
步骤七:测定样品中焦亚硫酸钠的含量
将上述处理完毕后的样品取出,用石英比色皿比较颜色,在标准曲线上查出样品中焦亚硫酸钠的含量,即可计算出注射液中焦亚硫酸钠的含量。
结论:
通过上述方法测定出焦亚硫酸钠含量为Xmg/mL,该方法简单可靠,重复性好,适用于注射液中焦亚硫酸钠含量的快速测定。
焦亚硫酸钠的测定方法1. Introduction2. Principle3. Reagents(1) 0.01mol/L NaOH solution (prepare by accurately weighing an appropriate amount of sodium hydroxide, and then dissolve in pure water to make up to 1L in volumetric flask).(2) 0.05mol/L HCl (made into 1L in volumetric flask).(3) 0.25mol/L I2 solution (accurately weigh about 0.6g of iodine, and then dissolve it in pure water to make up to 1L in volumetric flask).(4) 0.1mol/L Na2S2O3 solution (take about 0.1g of sodium sulfite, accurately weigh it and dissolve it in pure water to make up to 1L in volumetric flask).(5) 0.02mol/L Starch indicator (dissolve 8g of soluble starch in 200mL of warm water, cool down to room temperature, filter out the precipitate, and make up to 1L in volumetric flask).4. Apparatus(1) Analytical balance.(2) 25mL burette.(3) 100mL volumetric flask.(4) Magnetic stirrer.(5) 50mL beaker.5. Operation(2) Transfer the solution into a 100mL volumetric flask, add some 0.05 mol/L hydrochloric acid and some 0.01mol/L sodium hydroxide solution to adjust the pH value of the solution to1.5-2.0, and then make up to the mark with pure water.(3) Take 25mL of the solution into a 25mL burette, andtitrate with 0.25mol/L iodine solution. The end point is marked with 0.02mol/L starch indicator, and the volume consumed by the iodine solution is recorded.(4) Calculate the content of the sodium sulfite according to the formula:The mass of sodium sulfite in the sample (g) = Volume of iodine consumed (ml) × 0.25mol/L × 126.04/10006. ResultsThe mass of sodium sulfite in the sample (g) = Volume of iodine consumed (ml) × 0.25mol/L × 126.04/1000The mass of sodium sulfite in the sample is XXX g/100mL.7. PrecisionThe precision of the method is analyzed by the method of standard addition, taking the sample as the base, adding three different amounts of sodium sulfite standard solution respectively, and then determining the amount of sodium sulfite added according to the same method as above. The results are shown in Table 1:Table 1 Results of Standard Addition TestAdded amount/g/100mL Sodium sulfite content/g/100mL 0 XXX 1 XXX 2 XXX 3 XXXThe results of the standard addition test show that the precision of the method is acceptable.8. ConclusionThe determination of sodium sulfite by iodometric titration is simple and accurate, and the amount of sodium sulfite can be accurately calculated according to the formula. The results of the standard addition test show that the precision of the method is acceptable.。
副产品废水中亚硫酸钠含量测定方法
原理:在弱酸性溶液中,用碘将亚硫酸盐氧化成硫酸盐。
以淀粉为指示剂,用硫代硫酸钠溶液滴定过量的碘。
试剂:
盐酸溶液:1+1 (用Ph试纸检测试样溶液,弱酸性时可以不加盐酸溶液)
碘标准滴定溶液: (1/2 12) ~ L
硫代硫酸钠标准滴定液:c ( Na2 S2O3 - L
淀粉指示液:5g/L (使用期为2周)
分析步骤:称取约样品溶液,精密称定,置于250ml碘量瓶中,用滴定管加入碘溶液及
30ml-50ml水,立即盖上瓶塞,(试样为弱酸性时,可不加入2ml盐酸溶液),水封,缓缓摇动溶解后,置于暗处放置5分钟。
以硫代硫酸钠标准滴定液滴定至淡黄色时,加入约3ml淀粉指示液,继续滴定至蓝色消失即为终点。
同时进行空白试验。
空白试验是除不加入试样外,其他操作和加入的试剂与试验溶液相同(标准滴定溶液除外)。
结果计算:
亚硫酸钠含量以亚硫酸钠(Na2SO3的质量分数计,数值以%表示,按下式计算:
w1= ( V2-V1 ) CM/1000mX 100
式中:
C—硫代硫酸钠标准滴定溶液的浓度的标准数值,单位为摩尔每升(mol/L);
V1—滴定试验溶液消耗硫代硫酸钠标准滴定液的体积的数值,单位为毫升(ml);
V2—滴定空白试验溶液消耗硫代硫酸钠标准滴定溶液的体积的数值,单位为毫升(ml);
m—待测样品质量的数值,单位为克(g);
M—亚硫酸钠(1/2Na2SO3的摩尔质量的数值,单位为克每摩尔(g/mol)(M=o取平行测定结
果的算术平均值为测定结果,两次平行测定结果的绝对差值不大于%.。
某注射液中焦亚硫酸钠含量测定方法的研究胡慧;宗珍;汪美芳;宗清文【期刊名称】《求医问药(学术版)》【年(卷),期】2013(011)002【摘要】焦亚硫酸钠在药物中作为抗氧化剂,其含量的多少对药物的有效性和安全性都十分重要,因此我们需要对药物中焦亚硫酸钠的含量进行监控.目前检测焦亚硫酸钠的方法主要有比色法、滴定法、速率常数法、玫瑰苯胺法、蒸馏法、离子色谱法和电石色谱法.在这些检测方法中,最常用也是最准确的方法是紫外分光光度法.笔者应用紫外分光光度法对某注射液中焦亚硫酸钠的含量进行了测定分析.其结果为:样品在0.10~3.09?g/ml范围内呈线性关系;回归方程为:A=0.3905c-0.0007(r=0.9998);回收率为:三种不同浓度的注射液其焦亚硫酸钠的平均回收率分别为70%的99.24%、100%的100.19%、130%的99.78%,RSO为0.6%,结论:应用紫外分光光度法检测注射液中的焦亚硫酸钠含量具有线性好、准确度高、专属性强和操作简便等优点,是一种值得推广和应用的焦亚硫酸钠含量测定法.【总页数】2页(P221-222)【作者】胡慧;宗珍;汪美芳;宗清文【作者单位】江苏南京先声东元制药有限公司江苏南京211800;浙江杭州市第二人民医院浙江杭州310015;安徽皖南医学院化学教研室安徽芜湖241001【正文语种】中文【中图分类】R927.2【相关文献】1.原料乳中焦亚硫酸钠与硫代硫酸钠定性检测方法的改进研究 [J], 刘美霞;王丹慧;李梅2.紫外分光光度法测定长春西汀注射液中焦亚硫酸钠含量 [J], 郑稳生;王璐璐;陈少华;相莉3.比色法测定复方氨基酸注射液(18AA-Ⅰ)中焦亚硫酸钠的含量 [J], 吴小曼;纪宇4.影响复方氨基酸注射液中焦亚硫酸钠含量测定的因素 [J], 姚克荣;徐连连5.紫外-可见分光光度法测定复方氨基酸注射液中焦亚硫酸钠的含量分析 [J], 周秋云;黄绮红因版权原因,仅展示原文概要,查看原文内容请购买。