界面法测定离子迁移数
- 格式:doc
- 大小:78.50 KB
- 文档页数:5


七、电解质溶液(293题)一、选择题( 共92 题)1. (3611) H2S2O8可由电解法制取,阳极反应为:2H2SO4 →H2S2O8 + 2H+ + 2e-,阳极副反应为O2的析出。
阴极析氢效率为100%,已知电解产生H2,O2的气体体积分别为9.0 L和2.24 L(标准态下),则生成H2S2O8的物质的量为:(C)(A) 0.1 mol (B) 0.2 mol (C) 0.3 mol (D) 0.4 mol2. (3612) 法拉第电解定律限用于:(C )A液态电解质B无机液态或固态电解质C所有液态或固态电解质D所有液态、固态导电物质3. (3613) 将铅酸蓄电池在10.0 A电流下充电1.5 h,则PbSO4分解的质量为(B )(A) 84.8 g (B) 169.6 g (C) 339.2 g (D) 无法确定(已知M r(PbSO4) = 303)4. (3614) 按物质导电方式的不同而提出的第二类导体,下述对它特点的描述,哪一点是不正确的?(A )(A)其电阻随温度的升高而增大B其电阻随温度的升高而减小C其导电的原因是离子的存在D当电流通过时在电极上有化学反应发生5. 2 分(3615)描述电极上通过的电量与已发生电极反应的物质的量之间的关系的是:(C )(A) 欧姆定律(B)离子独立运动定律(C)法拉第定律(D)能斯特定律6. 2 分(3617)当一定的直流电通过一含有金属离子的电解质溶液时,在阴极上析出金属的量正比于:( C )(A) 阴极的表面积(B) 电解质溶液的浓度(C) 通过的电量(D) 电解质溶液的温度7. 2 分(3618)电解熔融NaCl时,用10 A的电流通电5 min,能产生多少金属钠?(A)(A) 0.715 g (B) 2.545 g (C) 23 g (D) 2.08 g8. 2 分(3619)下列物理量除哪一个外,均与粒子的阿伏加德罗数有关:( D )(A) 法拉第(B)标准状态下22.4 dm3气体(C) 摩尔(D)库仑9. 2 分(3620)在CuSO4溶液中用铂电极以0.1 A的电流通电10 min,在阴极上沉积的铜的质量是:( A )(A) 19.9 mg (B) 29.0 mg (C) 39.8 mg (D) 60.0 mg10. 2 分(3608)电解时,主要承担电量迁移任务的离子与首先在电极上发生反应的离子间有什么关系?( B )(A)没有任何关系(B)有某种关系(C)有无关系视相对电迁移率的大小而定(D)两者总是一致的11. 2 分(3610)已知Cu的相对原子量为64,用0.5法拉第电量可从CuSO4溶液中沉淀出多少Cu?(A)(A) 16 g (B) 32 g (C) 64 g (D) 127 g12. 2 分(3621)在NiI2的水溶液中,通过24 125 C的电量后,沉积出金属镍(M r=58.7)的质量最接近于:( A )(A) 7.3 g (B) 14.6 g (C) 29.2 g (D) 58.7 g13. 2 分(3622)电解硫酸铜溶液时,析出128 g铜(M r =64),需要通入多少电量?( C )(A) 96 500 C (B) 48 250 C (C) 386 000 C (D) 24 125 C14. 2 分(3623)1 mol电子电量与下列哪一个值相同?( C )(A) 1安培·秒(B) 1库仑(C) 1法拉第(D) 1居里15. 2 分(3624)使2000 A的电流通过一个铜电解器,在1 h 内,能得到铜的质量是:( D )(A) 10 g (B) 100 g (C) 500 g (D) 2 700 g16. 2 分(3625)用0.1 A的电流,从200 ml 浓度为0.1 mol·dm-3的AgNO3溶液中分离Ag,从溶液中分离出一半银所需时间为:( B )(A) 10 min (B) 16 min (C) 100 min (D) 160 min17. 2 分(3651)离子电迁移率的单位可以表示成( C )(A) m·s-1(B) m·s-1·V-1(C) m2·s-1·V-1(D) s-118. 2 分(3652)z B、r B及c B分别是混合电解质溶液中B 种离子的电荷数、迁移速率及浓度,对影响B 离子迁移数(t B) 的下述说法哪个对? ( D )(A) │z B│愈大,t B愈大(B) │z B│、r B愈大,t B愈大(C) │z B│、r B、c B愈大,t B愈大(D) A、B、C 均未说完全19. 2 分(3653)水溶液中氢和氢氧根离子的电淌度特别大,究其原因,下述分析哪个对?(B )(A) 发生电子传导(B) 发生质子传导(C) 离子荷质比大(D) 离子水化半径小20. 1 分(3654)在一定温度和浓度的水溶液中,带相同电荷数的Li+、Na+、K+、Rb+、…,它们的离子半径依次增大,但其离子摩尔电导率恰也依次增大,这是由于:( B )(A) 离子淌度依次减小(B) 离子的水化作用依次减弱(C) 离子的迁移数依次减小(D) 电场强度的作用依次减弱21. 1 分(3666)电解质溶液中离子迁移数(t i) 与离子淌度(U i) 成正比。

1.下列溶液中哪个溶液的摩尔电导最大:参考答案: B(A) 0.1M KCl水溶液;(B)0.001M HCl水溶液;(C) 0.001M KOH水溶液;(D) 0.001M KCl水溶液。
2. 离子电迁移率的单位可以表示成: ( ) 参考答案: C(A) m·s-1(B) m·s-1·V-1(C) m2·s-1·V-1(D) s-13.在一定温度和较小的浓度情况下,增大强电解质溶液的浓度,则溶液的电导率κ与摩尔电导Λm变化为:参考答案: B(A) κ增大,Λm增大;(B) κ增大,Λm减少;(C) κ减少,Λm增大;(D) κ减少,Λm减少。
4.水溶液中氢和氢氧根离子的电淌度特别大,究其原因,下述分析哪个对? ( )参考答案: B(A) 发生电子传导(B) 发生质子传导(C) 离子荷质比大(D)离子水化半径小5.分别将CuSO4、H2SO4、HCl、NaCl从0.1mol·dm-3 降低到0.01mol·dm-3,则Λm变化最大的是:参考答案: A(A) C uSO4 ;(B) H2SO4 ;(C) NaCl ;(D) HCl 。
6.电解质溶液中离子迁移数 (ti) 与离子淌度 (Ui) 成正比。
当温度与溶液浓度一定时,离子淌度是一定的,则 25℃时,0.1 mol·dm-3NaOH 中 Na+的迁移数 t1 与 0.1mol·dm-3NaCl 溶液中 Na+的迁移数 t2,两者之间的关系为:参考答案: C(A) 相等(B) t1> t2(C) t1< t2 (D) 大小无法比较7.用同一电导池测定浓度为0.01和0.10mol·dm-3的同一电解质溶液的电阻,前者是后者的10倍,则两种浓度溶液的摩尔电导率之比为:参考答案: A(A) 1∶1 ; (B) 2∶1 ; (C) 5∶1 ; (D) 10∶1 。

第八章电解质溶液上一章下一章返回1.柯尔拉乌希经验公式适用条件和范围是什么?柯尔拉乌希离子独立运动定律的重要性何在?答:柯尔拉乌希经验公式:,适用于强电解质水溶液,浓度低于0.01mol·dm-3的稀溶液。
根据离子独立移动定律,可以从相关的强电解质的Λ∞来计算弱电解质的Λ∞。
或由离子电导数值计算出电解质的无限稀释时摩尔电导。
2.电导率与摩尔电导概念有何不同? 它们各与哪些因素有关?答:电导率κ是:两极面积各为1m2,并相距1m时,其间溶液所呈的电导;而摩尔电导是在相距1m的两电极间含有1mol溶质的溶液所呈的电导,摩尔电导用Λm表示Λm=κ/c,电导率κ与电解质本性有关,与温度有关,与电解质浓度有关;摩尔电导与电解质本性有关,与温度有关,与电解质浓度有关。
3.为什么用交流电桥测定溶液的电导? 为什么用1000H z(即c/s,周每秒)频率测定溶液的电导? 为什么在未知电阻的线路上并联一电容? 测准溶液电导的关键是什么?答:用交流电流测溶液的电导,可以避免电解作用而改变电极本性,并且可以消除电极的极化作用。
用1000Hz的交流频率可防止电极上的极化作用,并可用耳机检零。
并联电容是为了消除电导池的电容的影响。
测准电导的关键是在各接触点均接触的条件下,电桥平衡,正确检零。
4.当一定直流电通过一含有金属离子的溶液时,在阴极上析出金属的量正比于:(1) 金属的表面积; (2) 电解质溶液的浓度;(3) 通入的电量; (4) 电解质溶液中离子迁移的速度。
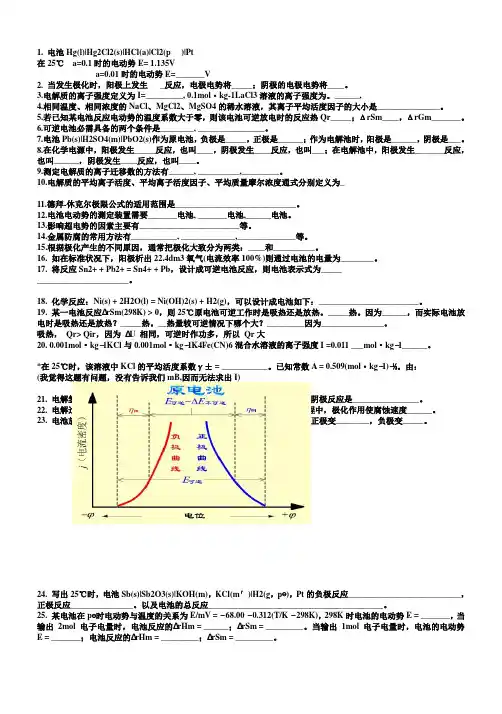
答:(3).5.在界面移动法测定离子迁移数的实验中,其结果是否正确,最关键是决定于:(1) 界面移动的清晰程度; (2) 外加电压的大小;(3) 阴、阳离子迁移速度是否相同; (3) 阴、阳离子的价数是否相同。
答:(1)6.电解质在水溶液中时,作为溶剂的水电离为 H+、OH-离子,为什么一般不考虑它们的迁移数?影响离子迁移数的主要因素是什么?答:因为水中H+与OH-的浓度甚低,K sp=10-14,其迁移数极小,不考虑不会影响测量结果。

第九章电解质溶液练习题一、判断题:1.溶液是电中性的,正、负离子所带总电量相等,则正、负离子离子的迁移数也相等。
2.离子迁移数与离子速率成正比,某正离子的运动速率一定时,其迁移数也一定。
3.离子的摩尔电导率与其价态有关系。
4.电解质溶液中各离子迁移数之和为1。
5.电解池通过l F电量时,可以使1mol物质电解。
6.因离子在电场作用下可以定向移动,所以测定电解质溶液的电导率时要用直流电桥。
7.无限稀电解质溶液的摩尔电导率可以看成是正、负离子无限稀摩尔电导率之和,这一规律只适用于强电解质。
8.电解质的无限稀摩尔电导率Λ∞m可以由Λm作图外推到c1/2 = 0得到。
下列关系式是否正确:(1) Λ∞,1<Λ∞,2<Λ∞,3<Λ∞,4(2)κ1=κ2=κ3=κ4(3)Λ∞,1=Λ∞,2=Λ∞,3=Λ∞,4(4)Λm,1=Λm,2=Λm,3=Λm,410.德拜—休克尔公式适用于强电解质。
11.对于BaCl2溶液,以下等式成立:(1) a = γb/b0;(2) a = a+²a - ; (3) γ± = γ+²γ - 2;(4) b = b+²b-;(5) b±3 = b+²b-2; (6) b± = 4b3。
12.若a(CaF2) = 0.5,则a(Ca2+) = 0.5 ,a(F-) = 1。
二、单选题:1.下列溶液中哪个溶液的摩尔电导最大:(A) 0.1M KCl水溶液;(B) 0.001M HCl水溶液;(C) 0.001M KOH水溶液;(D) 0.001M KCl水溶液。
2.对于混合电解质溶液,下列表征导电性的量中哪个不具有加和性:(A) 电导;(B) 电导率;(C) 摩尔电导率;(D) 极限摩尔电导。
3.在一定温度和较小的浓度情况下,增大强电解质溶液的浓度,则溶液的电导率κ与摩尔电导Λm变化为:(A) κ增大,Λm增大;(B) κ增大,Λm减少;(C) κ减少,Λm增大;(D) κ减少,Λm减少。

第七章电化学思考题1.导体分几类,它们间有何不同?答:导体分两类,第一类导体,又称电子导体,如金属、石墨等。
传导电流靠自由电子作定向运动;导电后导体本身不发生变化;温度升高,电阻变大;所导电量全部由自由电子承担;第二类导体,又称离子导体,如电解质溶液、熔融电解质等。
传导电流靠正、负离子作反向运动完成;导电离子可能在电极上发生反应;温度升高,电阻反而变小;所导电量由正、负离子分担。
2.测定离子的迁移数有几种方法?答:通常有三种方法:1. Hittorf 法;2. 界面移动法;3. 电动势测定法。
3.在电镀工业上一般都用钾盐而不用钠盐?答:钠离子的半径虽然比钾离子小,但钠离子的水合作用却强得多,因而迁移速率比较慢。
因此,在电镀工业上,为了减少电解液的电阻,一般都选用钾盐。
4.在电迁移率、电导率、摩尔电导率、离子摩尔电导率、电解质扩散系数、离子扩散系数等性质中,哪些与选择基本单元有关,哪些与选择基本单元无关? 答:与基本单元选择无关的性质有:电迁移率,电导率,电解质扩散系数;与基本单元选择有关的性质有:摩尔电导率,离子摩尔电导率,离子扩散系数。
5.极限摩尔电导率是无限稀释时电解质溶液的摩尔电导率。
既然溶液已经“无限稀释”,为什么还会有摩尔电导率?此时溶液的电导率应为多少?答:根据摩尔电导率的概念,极限摩尔电导率虽然要求溶液无限稀释,但仍要求溶液中有1 mol电解质,即对应的溶液体积应为无限大,此时离子之间已没有相互作用,因此,电解质的摩尔电导率达最大值。
但这时溶液的电导率趋于纯溶剂的电导率。
6.柯尔劳施经验公式适用条件和范围是什么?柯尔劳施离子独立运动定律的重要性何在?答:柯尔劳施经验公式:c A −Λ=Λ∞m m ,适用于强电解质水溶液,浓度低于0.01 mol·dm −3的稀溶液。
根据离子独立移动定律,可以从相关的强电解质的∞Λm 来计算弱电解质的∞Λm ,或由离子电导数值计算出电解质的无限稀释时摩尔电导。

第七章(一)电解质溶液练习题一、判断题:1.溶液是电中性的,正、负离子所带总电量相等,则正、负离子离子的迁移数也相等。
2.离子迁移数与离子速率成正比,某正离子的运动速率一定时,其迁移数也一定。
3.离子的摩尔电导率与其价态有关系。
4.电解质溶液中各离子迁移数之和为1。
5.电解池通过l F电量时,可以使1mol物质电解。
6.因离子在电场作用下可以定向移动,所以测定电解质溶液的电导率时要用直流电桥。
7.无限稀电解质溶液的摩尔电导率可以看成是正、负离子无限稀摩尔电导率之和,这一规律只适用于强电解质。
8.电解质的无限稀摩尔电导率Λ m可以由Λm作图外推到c1/2 = 0得到。
9.不同浓度的醋酸溶液的电导率、摩尔电导率和极限摩尔电导率的数值如下:下列关系式是否正确:(1) ?∞,1<?∞,2<?∞,3<?∞,4(2)κ1=κ2=κ3=κ4(3) ?∞,1=?∞,2=?∞,3=?∞,4(4)?m,1=?m,2=?m,3=?m,410.德拜—休克尔公式适用于强电解质。
11.对于BaCl2溶液,以下等式成立:(1) a = γb/b0;(2) a = a+·a - ;(3) γ± = γ+·γ - 2;(4) b = b+·b-;(5) b±3 = b+·b-2;(6) b± = 4b3。
12.若a(CaF2) = ,则a(Ca2+) = ,a(F-) = 1。
二、单选题:1.下列溶液中哪个溶液的摩尔电导最大:(A) KCl水溶液;(B) HCl水溶液;(C) KOH水溶液;(D) KCl水溶液。
2.对于混合电解质溶液,下列表征导电性的量中哪个不具有加和性:(A) 电导;(B) 电导率;(C) 摩尔电导率;(D) 极限摩尔电导。
3.在一定温度和较小的浓度情况下,增大强电解质溶液的浓度,则溶液的电导率κ与摩尔电导Λm变化为:(A) κ增大,Λm增大;(B) κ增大,Λm减少;(C) κ减少,Λm增大;(D) κ减少,Λm减少。
1. 电池Hg(l)|Hg2Cl2(s)|HCl(a)|Cl2(p )|Pt在25℃a=0.1时的电动势E= 1.135Va=0.01时的电动势E=_______V2. 当发生极化时,阳极上发生_反应,电极电势将_____;阴极的电极电势将____。
3.电解质的离子强度定义为I=_________, 0.1mol·kg-1LaCl3溶液的离子强度为。
______,4.相同温度、相同浓度的NaCl、MgCl2、MgSO4的稀水溶液,其离子平均活度因子的大小是_______________。
5.若已知某电池反应电动势的温度系数大于零,则该电池可逆放电时的反应热Qr_____;ΔrSm____,ΔrGm_______。
6.可逆电池必需具备的两个条件是________, ________________。
7.电池Pb(s)|H2SO4(m)|PbO2(s)作为原电池,负极是_____,正极是______;作为电解池时,阳极是______,阴极是___。
8.在化学电源中,阳极发生_____反应,也叫____,阴极发生____反应,也叫___;在电解池中,阳极发生_______反应,也叫______,阴极发生____反应,也叫____。
9.测定电解质的离子迁移数的方法有______, __________,_________。
10.电解质的平均离子活度、平均离子活度因子、平均质量摩尔浓度通式分别定义为_11.德拜-休克尔极限公式的适用范围是_____________________________。
12.电池电动势的测定装置需要_______电池, _______电池,______电池。
13.影响超电势的因素主要有________________________等。
14.金属防腐的常用方法有___________, _____________,______________等。
15.根据极化产生的不同原因,通常把极化大致分为两类:____和__________。

实验11 离子迁移数的测定注意事项:1.离子迁移管中装溶液时沿玻璃棒缓慢加入,避免有气泡产生。
2.取下阴极铜片按要求处理后放入干净烧杯或者垫称量纸准确称量,不可直接放在天平托盘上称量,以免污染铜片。
3.两极点击秩序轻轻放入即可,不要用力往下压。
加电流时需缓慢旋转调节旋钮至电流强度缓慢升至12mA。
4.如果旋转电流调节旋钮电流示数始终为零,或者通电过程中电流由12mA突然降为零,请检查a. 迁移管中是否有气泡;b. 接入迁移管阳极区和阴极区的电极是否按得太紧;c.线路是否连接好。
5.实验过程中避免任何有可能扰动溶液引起溶液扩散的操作。
6.停止通电后必须先关闭活塞10(中间区和阴阳极区相连的活塞),然后才可以测量阴/阳区溶液。
实验步骤:1. 配制0.05 mol/L的CuSO4溶液取25 ml 0.5 mol.L-1硫酸铜溶液于250ml干净容量瓶中,稀释至刻度,得0.05 mol/L的CuSO4溶液。
2.离子迁移数测定装置安装(1)检查活塞是否漏水,用水洗清迁移管,然后用0.05 mol/L的CuSO4溶液洗涤两次,用该溶液充满迁移管,安装到迁移管固定架上。
注意管中不能有气泡,电极表面有氧化层用细砂纸打磨(2)将铜电量计中阴极铜片取下,先用细砂纸磨光,除去表面氧化层,再蒸馏水洗净,用乙醇淋洗并吹干,在分析天平上称重,装入电量计中。
在库仑计中装入大于1/2体积的饱和硫酸铜溶液。
(3)按图11-1所示连接好迁移管、离子迁移数测定仪和铜电量计,其中接入迁移管阳极区和阴极区的电极只需轻轻放入即可,不要用力往下按。
(4)接通电源,缓慢调节电流强度至12mA,连续通电60min。
3.通电前CuSO4溶液的滴定(1)用移液管移取10.00ml 0.5000 mol/L-1 Na2S2O3溶液于100ml干净容量瓶中,稀释至刻度,得0.0500 mol/L 的Na2S2O3溶液。
(2)用移液管从250ml容量瓶中移取10.00mL 0.05mol/L的CuSO4溶液于具塞锥形瓶中,加入5mL 1mol/L 的HAc溶液,加入3mL 10%的KI溶液,塞好瓶盖,振荡,置暗处5-10min,以0.0500 mol/L的Na2S2O3标准溶液滴定至溶液呈淡黄色,然后加入1mL淀粉指示剂,继续滴定至蓝色恰好消失(乳白色),记录消耗的Na2S2O3标准溶液体积。

I 练习题一、填空题电解质溶液1. Pt|Cu 2+,Cu + 电极上的反应为Cu 2+ + e -→Cu +,当有1F 的电量通过电池时,发生反应的Cu 2+ 的物质的量为________。
2. 同一电导池测得浓度为0.01mol·dm -3的A 溶液和浓度为0.1 mol·dm -3的B 溶液的电阻分别为1000Ω和500Ω,则它们的摩尔电导率之比Λm (A )/Λm (B )等于________。
3. 已知m Λ∞(Na +)=50.11×10-4S·m 2·mol -1,m Λ∞(OH -)=198.0×10-4S·m 2·mol -1,在无限稀释的NaOH 溶液中t ∞(Na +)等于________,t ∞(OH -)等于________。
4. 25℃时,在0.002mol·kg -1CaCl 2水溶液中离子平均活度系数为γ±1,在0.002mol·kg -1CuSO 4水溶液中离子平均活度系数为γ±2,则γ±1_______γ±2。
5. 已知NaAc 、NaCl 、HCl 水溶液无限稀释时的摩尔电导率分别为Λ1,Λ2,Λ3,则HAc的摩尔电导率为________________。
6. 25℃时,1mol·kg -1的BaCl 2水溶液的γ±=0.399,则a ±= 。
7. 相同温度、相同浓度的NaCl ,MgCl 2,MgSO 4的稀水溶液,其离子平均活度因子的大小是:γ±(NaCl ) γ±(MgCl 2) γ±(MgSO 4)(选填<,=,>)。
8. 电解质的离子强度定义为I = ,1 mol·kg -1的CaCl 2水溶液的I =mol·kg -1。
9. 等量的0.05 mol·kg -1的LaCl 3水溶液及0.05 mol·kg -1的NaCl 水溶液混合后,溶液的离子强度I = 。
离⼦迁移数的测量离⼦迁移数的测量1、电解重量分析法将三个表⾯经抛光的固体电解质⽚串接在两电极之间,通直流电电解,经⼀定时间后,根据法拉第定律计算并分析各个电解质⽚的重量,可确定离⼦迁移数和电⼦迁移数。
通电后导电离⼦迁移,会改变电解质⽚的重量,如果重量的变化量与根据法拉第定律计算的数量相等,则离⼦迁移数为1;如果重量差⼩于法拉第定律的计算量,则离⼦迁移数⼩于1。
离⼦迁移数为:t i = W/QM也可⽤此法鉴别导电离⼦种类:将两⽚电解质⽚固定在两⾦属电极之间;⾦属电极的成分是电解质的⼀个组分。
若是阴离⼦导体;通电后,阴离⼦向阳极迁移,与阳极⾦属离⼦化合,使靠近阳极的电解质⽚增重,靠近阴极的电解质⽚减轻;若是阳离⼦导体,则阳离⼦迁移到阴极,使阴极增重,阳极则被电解减轻。
不仅可判断导电离⼦种类,还可计算出离⼦迁移数。
2、电池电动势测量法当固体电解质置于两个已知的参考电极之间,形成⼀可逆电池。
此时,两电极间产⽣⼀固定的符合热⼒学的电动势E。
若存在电⼦导电时,产⽣的电动势被电⼦导电产⽣的短路电流所减低。
实际测量的电动势为E'将低于电池热⼒学理论电动势E。
L为电解质的厚度,L/σI为电解质的离⼦阻抗,L/σe为电解质的电⼦阻抗,E'= E - I i L/σI = I e L/σe因为测量的是开路电压,所以有I i=I e,可得: I=Eσiσe/L(σe+σI) 消去I e 和I iE'=Eσi /(σe +σI)=Et i t i = E'/EE是电解质电池的理论热⼒学电动势,可由电池反应的⾃由焓变化?G?计算:E=-?G?/nF。
(n为导电离⼦的电荷数)电解质存在电⼦导电时测量到的电动势E'低于热⼒学电动势E。
由已知的热⼒学数据,和测量的电动势可从上式计算出电解质的离⼦迁移数t i和电⼦迁移数t e。
(t e=I-t i)电池电动势法测量离⼦迁移数,快速,简单,精确度较⾼。
被⼴泛应⽤。
3、直流极化(Wagner极化)法测量测量固体电解质低电⼦电导时,最好⽤Wagner极化电池法。
一、填空题1. 在电化学装置中,规定电势高的电极是极,规定发生还原反应的电极是极。
2. 在电化学装置中,规定电势低的电极是极,规定发生氧化反应的电极是极。
3. 在电化学装置中,发生氧化反应的电极是,电势高的电极是。
4. 电解质溶液通过溶液中的的定向迁移导电。
5. 在有电流通过电化学装置时,电极会发生极化,极化可以分为浓差极化和。
6. 电化学装置中,化学能转变为电能的是。
7. 在电化学装置中,发生还原反应的电极是,电势低的电极是。
8. 电解质溶液通过溶液中的正负离子的定向导电。
9. 在有电流通过电化学装置时,电极会发生极化,极化可以分为和电化学极化。
10. 电化学装置中,电能转变为化学能的是。
11. 在电化学装置中,发生氧化反应的电极是极,发生还原反应的电极是极。
12. 电池电极极化,使正极的电极电势变得更 , 负极的电极电势变得更。
11. 在电化学装置中,规定电势低的电极是极,规定发生还原反应的电极是极。
二、判断如下问题的正误,分别在题后的括号内用“√”表示正确、“×”表示错误1. 在电化学中,规定标准氢电极的电极电势为零。
()2. 电化学中阳极极化,电极电势变得更大。
()3. 任意氢电极的电极电势为零。
()4. 极化现象总是不利于电化学过程的。
()5. 电解质溶液导电是正负离子的分别向负极、正极定向迁移而实现的。
()6. 电解质溶液的摩尔电导率都与其浓度成正比。
()7. 电解池是指将电能转换成化学能的装置。
()8. 根据电池书写表示的电池电动势的值可能是正值,也可能是负值。
()9. 金属的化学腐蚀比电化学腐蚀普遍。
10. 电解质溶液的电导率都与其浓度成正比。
()11. 应用能斯特方程计算出电池E<0,这表示电池的反应是反向自发进行。
( )三、选择题1.原电池是指( )(a) 将电能转换成化学能的装置;(b) 将化学能转换成电能的装置(c) 可以对外做电工的装置;(d) 对外做电工同时从环境吸热的装置2. 用对消法(补偿法)测定可逆电池的电动势,主要为了( )(a) 消除电极上的副反应(b) 减少标准电池的损耗(c) 在可逆情况测定电池电动势(d) 简便易行3. 一个电池反应确定的电池,E值的正或负可用来说明( )(a) 电池是否可逆; (b) 电池反应自发进行的方向和限度;(c) 电池反应自发进行的方向; (d) 电池反应是否达到平衡4. 电解池是指( )(a) 将电能转换成化学能的装置;(b) 将化学能转换成电能的装置(c) 可以对外做电工的装置;(d) 对外做电工同时从环境吸热的装置5. 应用能斯特方程计算出电池E<0,这表示电池的反应是( )(a) 不可能进行 (b) 反向自发进行 (c )正向自发进行 (d) 反应方向不确定6. 已知在25°C 时下列电极反应的标准电极电势:电极反应(1) Cu + + e - = Cu(s) /0.521Cu Cu V ϕ+=电极反应(2) Cu 2+ + e - = Cu + 2/0.16Cu Cu V ϕ++=则在25°C 时电极反应(3) Cu 2+ + 2e - = Cu(s) 2/?Cu Cu ϕ+= ( )(a) 0.34V (b) 0.68V (c) 0.36V (d) 1.36V7. 下图哪一个是电池的极化曲线? ( ) (a) (b) (c) (d)8. 下图哪一个是电解池的极化曲线? ( ) (a) (b) (c) (d)9. 298.K 时,NaCl 、NaOH 和 NH 4Cl 的m ∞Λ分别为221.49910/S m mol -⨯⋅、222.48710/S m mol-⨯⋅和221.28510/S m mol -⨯⋅,则NH 4OH 的m∞Λ为: ( ) (a)222.70110/S m mol -⨯⋅ (b)220.29710/S m mol -⨯⋅(c )222.27310/S m mol -⨯⋅ (d) 无法求得四、简答题1.柯尔拉乌希经验公式适用条件和范围是什么?柯尔拉乌希离子独立运动定律的重要性何在?答:柯尔拉乌希经验公式:c A -Λ=Λ∞m , 适用于强电解质水溶液,浓度低于0.01mol·dm -3的稀溶液。
电解质溶液习题及答案 Document number:WTWYT-WYWY-BTGTT-YTTYU-2018GT第七章(一)电解质溶液练习题一、判断题:1.溶液是电中性的,正、负离子所带总电量相等,则正、负离子离子的迁移数也相等。
2.离子迁移数与离子速率成正比,某正离子的运动速率一定时,其迁移数也一定。
3.离子的摩尔电导率与其价态有关系。
4.电解质溶液中各离子迁移数之和为1。
5.电解池通过l F电量时,可以使1mol物质电解。
6.因离子在电场作用下可以定向移动,所以测定电解质溶液的电导率时要用直流电桥。
7.无限稀电解质溶液的摩尔电导率可以看成是正、负离子无限稀摩尔电导率之和,这一规律只适用于强电解质。
8.电解质的无限稀摩尔电导率Λ m可以由Λm作图外推到c1/2 = 0得到。
下列关系式是否正确:(1) ∞,1<∞,2<∞,3<∞,4(2)κ1=κ2=κ3=κ4(3)∞,1=∞,2=∞,3=∞,4(4) m,1=m,2=m,3=m,410.德拜—休克尔公式适用于强电解质。
溶液,以下等式成立:11.对于BaCl2(1) a = γb/b0;(2) a = a+·a - ; (3) γ± = γ+·γ2;-(4) b = b+·b-;(5) b±3 = b+·b-2; (6) b± = 4b3。
12.若a(CaF2) = ,则a(Ca2+) = ,a(F-) = 1。
二、单选题:1.下列溶液中哪个溶液的摩尔电导最大:(A) KCl水溶液;(B) HCl水溶液;(C) KOH水溶液;(D) KCl水溶液。
2.对于混合电解质溶液,下列表征导电性的量中哪个不具有加和性:(A) 电导;(B) 电导率;(C) 摩尔电导率;(D) 极限摩尔电导。
3.在一定温度和较小的浓度情况下,增大强电解质溶液的浓度,则溶液的电导率κ与摩尔电导Λm变化为:(A) κ增大,Λm增大;(B) κ增大,Λm 减少;(C) κ减少,Λm增大;(D) κ减少,Λm减少。
实验名称:界面法测定离子迁移数 实验类型:________________同组学生姓名:__________
一、实验目的和要求(必填) 二、实验内容和原理(必填)
三、主要仪器设备(必填) 四、操作方法和实验步骤
五、实验数据记录和处理 六、实验结果与分析(必填)
七、讨论、心得
一、实验目的和要求
1.掌握界面移动法测定离子迁移数的原理和方法;
2.掌握图解积分测定电荷的方法。
二、实验内容和原理
当电流通过电解质溶液时,在两电极上发生法拉第或非法拉第过程,溶液中承担导电任务的阴、阳离
子分别向阳、阴两极移动。阴、阳离子迁移的电量总和恰好等于通入溶液的总电量,即:
但由于各种离子的迁移速率不同,各自所迁移的电量也必然不同,将某种离子传递的电量与总电量之
比,称为离子迁移数,则阴、阳离子的迁移数分别为:
,并且 t+ + t- = 1
若溶液中含有数种阴、阳离子,则t+、t-各为所有阴、阳离子的迁移数之和。一般讲来,某种离子浓
度增加,其相应的离子迁移数也有所增加,但也不尽然,由于离子之间的引力场影响的大小随离子的种类
不同,所以离子迁移数的改变可能由正负之别,还要视离子的种类及周围环境而定,另外,迁移数也要受
温度影响,一般温度升高,t+和t-的差别减小。
测定迁移数的方法有两种,一种是界面移动
法,一种为电解法(即希托夫法)。本实验采用界
面移动法测定盐酸中H+的迁移数,迁移管中离子
迁移示意图见图1,装置如图2所示。
图1 迁移管中的电位梯度 图2 界面法测离子迁移数装置
界面移动法测离子迁移数有两种,一种是用两个指示离
子,造成两个界面;另一种是用一种指示离子,只有一个界面。
本实验是用后一方法,以镉离子作为指示离子,测某浓度的盐
酸溶液中氢离子的迁移数。
在一截面清晰的垂直迁移管中,充满HCl溶液,通以电
流,当有电量为Q的电流通过每个静止的截面时 摩尔量的
H+通过界面向上走, 摩尔量的Cl–通过界面往下行。假定
在管的下部某处存在一界面(aa’),在该界面以下没有H+存
在,而被其他的正离子(例如 )取代,则此界面将随着
往上迁移而移动,界面的位置可通过界面上下溶液性质的差异
而测定。例如,若在溶液中加入酸碱指示剂,则由于上下层溶
液pH的不同而显示不同的颜色,形成清晰的界面。在正常条
件下,界面保持清晰,界面以上的一段溶液保持均匀,H+往
上迁移的平均速率,等于界面向上移动的速率。在某通电的时
间(t)内,界面扫过的体积为V, 输运电荷的数量为在该
体积中H+带电的总数,根据迁移数定义可得:
式中,C为 的浓度,A为迁移管横截面积,l为界面移动的
距离,I为通过的电流,t为迁移的时间,F为法拉第常数。
欲使界面保持清晰,必须使界面上、下电解质不相混合,
可以通过选择合适的指示离子在通电情况下达到。CdCl2溶液
能满足这个要求,因为 电迁移率(U)较小,即
在图1的实验装置中,通电时,H+向上迁移,Cl–向下迁
移,在Cd阳极上Cd氧化,进入溶液生成CdCl2,逐渐顶替
HCl溶液,在管外形成界面。由于溶液要保持电中性,且任一
截面都不会中断传递电流,H+迁移走后的区域, 紧紧跟
上,离子的迁移速率 是相等的,即 。由此可得:
所以 。
即在CdCl2溶液中电位梯度是较大的,如图4.1所示。因
此若H+因扩散作用落入CdCl2溶液层,它就不仅比 迁移
的快,而且比界面上的H+也要快,能赶回到HCl 层。同样
若任何 进入低电位梯度的HCl溶液,它就要减速,一直
到它们重又落后于 为止,这样界面在通电过程中保持清晰。
三、主要仪器设备
仪器:迁移管1支(用1mL刻度移液管及恒温回流管和注液小漏斗组成);-1~+4mV记录仪1台;镉电极
和铜电极;超级恒温槽1台;带尼龙管的5mL针筒2只;50mL小烧杯两只;晶体管直流稳压电源1台;
接线匣1只;导线若干;停表;废液缸1个;砂纸若干。
试剂:含甲基紫的HCl溶液(0.1mol.L–1)。
四、操作方法和实验步骤
1.按图2装置仪器,用带尼龙管的针筒吸取蒸馏水洗迁移管两次并检查迁移管是否漏水,吸取少量
的含甲基紫的HCl溶液(待测液),直接插入到迁移管的最下端,将迁移管洗涤两次,然后将待测液慢慢
加入迁移管中,装入溶液量以插入上端铜电极时,能浸过电极为限。
2.按照图2接好线路,检查无误后,再开始实验。调节恒温槽温度为25℃,待温度恒定后,并调节
电流至3.5mA左右。打开记录仪开关,随着电解进行,Cd阳极会不断溶解变为 。由于 的迁移
速度小于 ,因而,过一段时间后,在迁移管下部就会形成一个清晰的界面,并渐渐地向上移动,当界
面移动到某一可清晰观测的刻度时,打开停表开始记时。此后,每当界面移动0.05mL,记下相应的时间
和电压读数,直到界面移动0.5mL。
3.调节恒温槽温度为35℃,测定0.1mol.L-1盐酸 中H+的迁移数。
4.实验完毕,将迁移管溶液倒入指定回收瓶中,洗迁移管的初次废液也应注入回收瓶中。迁移管洗
净后,装满蒸馏水,放回原处。
五、实验数据记录和处理
室温:13.5℃;HCl浓度:0.1017mol.L-1;标准电阻:1 欧姆
表一25℃和35℃HCl溶液H+离子迁移数测定实验数据
25℃ t/s E/mV V/mL Q/mc 35℃
t/s E/mV V/mL Q/mc
0 3.73 0 0 0 3.53 0 0
158.74 3.65 0.05 585.75 164.89 3.47 0.05 577.12
321.27 3.57 0.10 586.73 336.21 3.42 0.10 590.20
483.55 3.50 0.15 573.66 506.99 3.37 0.15 579.80
651.64 3.43 0.20 582.43 684.21 3.31 0.20 591.91
821.64 3.37 0.25 578.00 853.89 3.26 0.25 557.40
993.24 3.30 0.30 572.29 1035.14 3.20 0.30 585.44
1165.74 3.25 0.35 564.94 1216.33 3.15 0.35 575.28
1335.02 3.19 0.40 545.08 1393.80 3.11 0.40 555.48
1514.89 3.13 0.45 568.39 1587.77 3.06 0.45 598.40
1699.96 3.08 0.50 574.64 1775.52 3.01 0.50 569.82
Q(总) 5731.91 Q(总)
5780.85
六、实验结果与分析
由实验数据可知:
25℃时,
V=0.50mL,c(H+)=0.1017mol.L-1, F=96500c/mol, Q=5.73191c
所以,H+离子所迁移的分电荷q+=V c(H+) F= 4.907025c
H+的迁移数t(H+)= q+/ Q=0.856
由实验室提供,此时H+的迁移数的文献值t(文)=0.82
所以,相对误差E=|t(文)-t(H+)|/t(文)*100%=4%。
35℃时,
V=0.50mL,c(H+)=0.1017mol.L-1, F=96500c/mol, Q=5.78085c
所以,H+离子所迁移的分电荷q+=V c(H+) F= 4.907025c
H+的迁移数t(H+)= q+/ Q=0.849
误差分析:1. 实验装置的所带有的系统误差;
2. 因放置时间过长等原因使实验所用的0.1mol.L–1含甲基紫的HCl溶液的浓度发生变化,与
所标定的值不同;
3. 迁移管上刻度模糊,对界面移动刻度的判断有所偏差,使实验结果产生误差;
4. 实验过程中,由桌面振动或碰触仪器等原因,使迁移管产生振动,产生误差。
七、讨论、心得
实验心得:通过本实验,我主要了解了界面移动法测定离子迁移数的原理和方法,实验操作较简单,但要
注意操作的规范,为了保证实验结果的正确与准确,有以下几点需要注意:
1.实验的准确性、成败关键主要取决于移动界面的清晰程度。若界面不清晰,则迁移体积测量不准,
导致迁移数测量不准确。因此,实验过程中应避免桌面振动。
2.实验过程中凡是能引起溶液扩散,搅动,对流等因素都要避免。
3.中间管与阴极管、阳极管连接处不留气泡。
4.电极的正负极不要颠倒。
5.上端的塞子不能塞紧,要留有缝隙。
6.镉化物有毒,要注意废液的处理。
思考题:1.离子迁移数与那些因素有关?
答:影响离子迁移数的主要因素有温度、溶液浓度、离子本性、溶剂性质,温度越高,阴、阳离
子的迁移数趋于相等。
2.保持界面清晰的条件是什么?
答:实验的准确性、成败关键主要取决于移动界面的清晰程度。若界面不清晰,则迁移体积测量
不准,导致迁移数测量不准确。因此,实验过程中凡是能引起溶液扩散,搅动,对流等因素都要
避免,如应避免桌面振动。欲使界面保持清晰,必须使界面上下电解质不相混合,这可以通过选
择合适的指示离子在通电情况下达到。
3.实验过程中电流值如何变化?迁移管的电极接反将产生什么现象?为什么?
答:通电后由于CdCl2层的形成,使电阻加大,电流会渐渐变小。迁移管的电极反接,会使迁
移管底部产生气泡,使电路断路。