电池的种类及使用
- 格式:ppt
- 大小:3.65 MB
- 文档页数:39

电池知识大全电池是一种能够将化学能转化为电能的装置,被广泛应用于各种电子设备、交通工具和能源储备系统中。
下面是关于电池的综合知识大全,涵盖了电池的种类、工作原理、应用领域以及相关的环保和安全问题。
一、电池的种类1. 干电池:干电池是一种不可充电的电池,内部使用干态电解质。
最常见的干电池包括碱性电池(如碱性锰电池)、锌碳电池和银氧化锌电池。
2. 镍镉电池(Ni-Cd电池):镍镉电池是一种可充电电池,由金属镍、金属镉和碱性电解液构成。
它具有较高的能量密度和较长的寿命,但含有有毒的重金属镉,对环境造成污染。
3. 镍氢电池(Ni-MH电池):镍氢电池是一种可充电电池,使用金属氢化物作为负极材料,金属镍作为正极材料,碱性电解液导电。
相较于镍镉电池,镍氢电池具有更高的能量密度和较少的环境污染。
4. 锂离子电池(Li-ion电池):锂离子电池是一种常见的可充电电池,使用锂离子在正负极之间的迁移实现电荷和放电。
它具有高能量密度、轻量化和无记忆效应等优点,在移动设备、电动汽车等领域得到广泛应用。
5. 钠离子电池(Na-ion电池):钠离子电池类似于锂离子电池,但使用钠离子作为电荷的传输媒介。
相较于锂离子电池,钠离子电池有较低的成本和更广泛的资源供应,但能量密度稍低。
6. 燃料电池:燃料电池将化学能直接转化为电能,通常使用氢气作为燃料和氧气作为氧化剂。
燃料电池具有高效率、无污染排放和可持续性等优点,适用于电动汽车和能源储备系统。
二、电池的工作原理电池的工作原理基于电化学反应。
它由两个电极(正极和负极)以及介于两者之间的电解质组成。
当电池连接外部电路时,化学反应发生,产生电流。
1. 非可充电电池工作原理:- 正极反应:正极材料中的化学物质氧化,释放出电子和金属离子。
例如,在碱性锰电池中,正极材料为二氧化锰(MnO2),反应为:MnO2 + H2O + e- → MnO(OH) + OH-- 负极反应:负极材料中的化学物质还原,吸收电子。

电池的工作原理和种类电池是一种能将化学能转化为电能的装置。
它被广泛应用于各个领域,如电子设备、交通工具、能源储备等。
本文将介绍电池的工作原理和不同种类。
一、工作原理电池的工作原理基于化学反应。
通常,电池由两个电极和介质电解质组成。
电池中的一个电极是阳极,另一个是阴极。
电解质是两个电极之间的导电介质。
当电池接通电路时,化学反应在电池内部发生。
在阳极,发生氧化反应,导致电子的流失。
同时,在阴极,发生还原反应,导致电子的吸收。
这样的电子流便通过外部电路流动,形成电流。
化学反应导致电池两极之间形成了电势差,也就是电压。
这个电压可以驱动电荷在电路中运动,完成各种电力工作。
二、种类1.原电池原电池是指一次性使用后不能再次充电的电池。
常见的原电池有碱性电池、锂电池、铅酸电池等。
碱性电池是最常见的一种原电池。
它使用氢氧化钾作为电解质,锌作为阳极,二氧化锰作为阴极。
碱性电池广泛应用于电子设备、灯具等。
锂电池则使用锂离子进行电荷和放电。
它具有高能量密度、轻量化和长寿命等优势,被广泛用于手机、电动汽车等领域。
铅酸电池是一种应用历史最久远的电池类型。
它主要由铅、铅过氧化物和稀硫酸组成,具有较低的能量密度和较短的寿命。
铅酸电池常用于汽车启动、应急照明等场合。
2.蓄电池蓄电池是可以通过反向化学反应进行充电的电池。
它可以重复使用,并且在充电时将化学能转化为电能,而在放电过程中将电能转化为化学能。
铅酸蓄电池是最常见的一种蓄电池。
它使用铅、铅过氧化物和稀硫酸作为主要材料,具有较高的能量密度和寿命,广泛应用于汽车、UPS 电源等领域。
钙钛酸锂蓄电池是新型的蓄电池技术,具有高能量密度和长循环寿命的特点。
它被认为是下一代电动汽车和储能系统的重要选择。
3.燃料电池燃料电池利用化学氧化反应直接将燃料的化学能转化为电能。
常见的燃料电池包括氢燃料电池、甲醇燃料电池等。
氢燃料电池使用氢气作为燃料,通过氧化反应产生电能。
它具有高效率、零排放和可持续能源的优势,被视为清洁能源的未来。

电池的种类原电池和可充电电池电池的种类:原电池和可充电电池电池是一种将化学能转换为电能的装置。
根据其能否重复使用和充电特性的不同,电池可以分为原电池和可充电电池两种主要类型。
一、原电池原电池,又称为一次性电池或非充电电池,是一种使用后无法充电的电池。
它的极性是事先确定的,并被永久封装。
原电池通过化学反应产生电能,反应过程中,原电池逐渐耗尽其内部的化学物质,电能也随之减弱,直至无法再产生电流。
原电池的种类多样,常见的有碱性电池、锂离子电池、铅酸电池等。
碱性电池是应用最广泛的原电池之一,常见规格包括碱性干电池和碱性纽扣电池,能满足人们日常生活中的各种电器需求。
锂离子电池具有高能量密度,如手机电池、笔记本电脑电池等,广泛用于便携式电子设备中。
铅酸电池主要用于汽车启动、太阳能储能和应急电源等领域。
原电池相对便宜、易于携带,因为使用后不需要进行充电,可以直接丢弃。
然而,由于无法充电,原电池的使用寿命有限,对环境产生一定的污染。
二、可充电电池可充电电池,也称为二次电池或蓄电池,是可以多次充放电的电池。
这种电池采用反应物质可逆转的原理,在正常使用后,可通过外部电源或特定充电设备重新输入电能,使其恢复到原有状态。
可充电电池的种类也很丰富,常见的有镍镉电池、镍氢电池、锂离子电池等。
镍镉电池充电效率高、寿命长,但对环境有一定的污染,因此逐渐被取代。
镍氢电池则具有更高的能量密度和更长的使用寿命,广泛用于无线电通信、消费电子、电动工具等领域。
锂离子电池因其高能量密度、轻量级和低自放电率等优势而备受青睐,广泛应用于电动汽车、移动设备等领域。
可充电电池较为环保,可以反复使用并且对环境的影响较小。
然而,由于其充电和放电的过程需要额外的设备和电源支持,使用上相对不太便利。
综上所述,原电池和可充电电池是目前应用最广泛的两种电池类型。
根据个人需求和使用场景的不同,我们可以选择适合的电池种类来满足我们的电力需求。
在使用电池时,我们应当根据不同种类电池的特性和规定进行正确的使用、充电和处理,以确保电池的安全与环保。

电池的种类、型号、用途种类1. 化学电池化学电池,是指通过电化学反应,把正极、负极活性物质的化学能,转化为电能的一类装置经过长期的研究、发展,化学电池迎来了品种繁多,应用广泛的局面。
大到一座建筑方能容纳得下的巨大装置,小到以毫米计的品种。
无时无刻不在为我们的美好生活服务。
现代电子技术的发展,对化学电池提出了很高的要求。
每一次化学电池技术的突破,都带来了电子设备革命性的发展。
现代社会的人们,每天的日常生活中,越来越离不开化学电池了。
现在世界上很多电化学科学家,把兴趣集中在做为电动汽车动力的化学电池领域2.干电池和液体电池干电池和液体电池的区分仅限于早期电池发展的那段时期。
最早的电池由装满电解液的玻璃容器和两个电极组成。
后来推出了以糊状电解液为基础的电池,也称做干电池。
现在仍然有“液体”电池。
一般是体积非常庞大的品种。
如那些做为不间断电源的大型固定型铅酸蓄电池或与太阳能电池配套使用的铅酸蓄电池。
对于移动设备,有些使用的是全密封,免维护的铅酸蓄电池,这类电池已经成功使用了许多年,其中的电解液硫酸是由硅凝胶固定或被玻璃纤维隔板吸付的。
3.一次性电池和可充电电池一次性电池俗称“用完即弃”电池,因为它们的电量耗尽后,无法再充电使用,只能丢弃。
常见的一次性电池包括碱锰电池、锌锰电池、锂电池、银锌电池、锌空电池、锌汞电池和镁锰电池。
可充电电池按制作材料和工艺上的不同,常见的有铅酸电池、镍镉电池、镍铁电池、镍氢电池、锂离子电池。
其优点是循环寿命长,它们可全充放电200多次,有些可充电电池的负荷力要比大部分一次性电池高。
普通镍镉、镍氢电池使用中,特有的记忆效应,造成使用上的不便,常常引起提前失效。
4.燃料电池燃料电池是一种将燃料的化学能透过电化学反应直接转化成电能的装置5.染料敏化太阳能电池电池型号电池型号分为一般分为:1、2、3、5、7号,其中5号和7号尤为常用,所谓的AA电池就是5号电池,而AAA电池就是7号电池!5号电池,一般尺寸为:直径14mm,高度49mm; 7号电池,一般尺寸为:直径11mm,高度44mm.常见的“AAAA,AAA,AA,A,SC,C,D,N,F”这些型号 AAAA型号少见,一次性的AAAA劲量碱性电池偶尔还能见到,一般是电脑笔里面用的。

电池的种类干电池和充电电池的区别与用途电池的种类:干电池和充电电池的区别与用途电池作为现代化生活中不可或缺的能源供应装置,广泛应用于各种电子设备中。
根据电池的工作原理和电能储存方式的不同,可以将电池分为干电池和充电电池。
本文将就这两种电池的区别与用途进行阐述。
一、干电池干电池,又称为非充电电池或干性电池,是一种能够在使用过程中将化学能转化为电能的装置。
干电池的主要特点是不可充电,也即一旦能量消耗完毕,就需要更换新的电池。
干电池的种类繁多,常见的有碱性电池(如碱性锰电池、碱性锌电池)和铅酸电池等。
1. 化学反应方式干电池的化学反应方式主要是一种不可逆的化学反应。
在放电过程中,电极上的活性物质会与电解液中的某些成分发生化学反应,释放出电子和离子,形成电流。
这种反应是一次性的,无法逆向进行。
2. 充放电性能干电池的电能是通过一次性的化学反应转化而来,不可充电。
一旦电池内的化学物质耗尽,就无法再产生电能,需要更换新的电池。
3. 用途干电池适用于那些需求不大、使用时间短暂的电子设备。
由于其安全性高、使用方便,常被应用于遥控器、手电筒、电子玩具等小型电子设备中。
二、充电电池充电电池,又称为可充电电池、蓄电池,是一种能够通过外部电源进行二次充电的电池。
充电电池的主要特点是可重复充放电,能够对电池进行再次储能。
常见的充电电池有镍镉电池、锂离子电池等。
1. 化学反应方式充电电池的化学反应方式是可逆的,既可以在放电过程中将化学能转化为电能,也可以通过外部电源的充电作用将电能转化为化学能。
这种可逆反应使得充电电池能够多次充放电,延长了电池的使用寿命。
2. 充放电性能充电电池可以通过外部电源进行充电,将电能重新储存起来。
这使得充电电池具有了可重复使用的特点,并且相对于干电池,充电电池的能量密度更高,能够提供更长的使用时间。
3. 用途充电电池适用于各种高能耗、持续使用时间较长的电子设备。
例如,手机、笔记本电脑、电动车等设备广泛采用锂离子电池,因为锂离子电池具有较高的能量密度和较长的使用寿命。
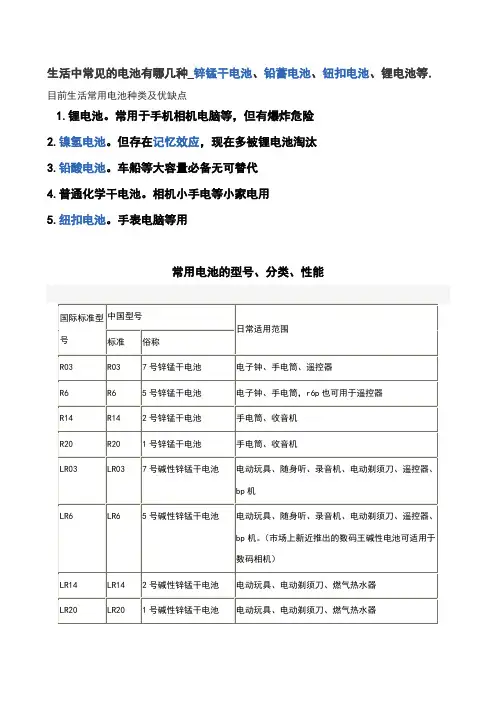
注:注:1、r表示圆柱型电池,l表示电池中电解质是碱性液体。
2、r6、r14、r20三种型号后加上s、c、p后均有三种类型。
如r6有r6s、r6c、r6p三种。
s表示为糊式电池、c表示为高容量纸板电池、p表示为高功率纸板电池。
3、s型糊式电池容量低,在电池使用末期,极易漏液,但价格便宜。
4、c型(高容量)电池适用于小电流放电方式。
5、p型(高功率)电池放电容量较前两种均有较大的提高,该类电池耐漏液性能好,且适合大电流连续放电。
6、碱性电池的容量是前面提到的同尺寸电池的3~7倍,且可以大电流连续放电,具有耐漏液性能极好的特点。
常用电池分类及性能一:碳性电池锌锰电池,俗称碳性电池。
是目前最便宜的一种电池。
这种电池容量低,容易漏液。
是过时产品。
目前常见于电视遥控器等产品里使用。
常见产品:1号、2号、5号、7号、纽扣式等。
一次电池。
电压:二:碱性电池碱性电池是目前最常用的电池。
优点在于耐久的电量,可以做到碳性电池电量的7倍。
电流输出稳定,不漏液。
可用于耗电量比较大的仪器设备里使用。
常见产品:1号、2号、5号、7号、纽扣式等。
一次电池。
电压:三:镍镉电池:镍镉电池的缺点:体积大、分量重、容量小、自放电、有记忆效应、不环保。
有点在于:可以反复充电5 00次以上,非常经济。
耐过冲过放,使用操作简单。
内阻小,可以大电流放电,所以该产品常见于电动工具重使用。
常见产品:1号(D型)、2号(C型)、5号(AA)、7号(AAA)、纽扣式和各种非标型号。
可充电电池。
电压:四:镍氢电池:镍氢电池和镍镉电池比较下缺点在于不能大电流放电(目前已经有工厂生产大电流放电的镍氢电池)。
优点在于同样体积容量高出镍镉一倍以上,记忆效应小,无污染称为绿色环保电池。
常见产品:1号(D型)、2号(C型)、5号(AA)、7号(AAA)、纽扣式和各种非标型号。
可充电电池。
电压:五:锂离子电池:锂离子电池外壳有钢壳和铝壳,铝壳比钢壳容量高10%--15%优点:体积小,容量高,电压高。

电池的种类和用途电池是一种能够将化学能转换成电能的装置,是现代生活和工作中必不可少的电源之一。
电池已被广泛应用在各个领域,包括通讯、军事、医疗、工业、家庭等等。
以下是几种常见的电池种类和其用途。
一、碱性电池碱性电池是目前市场占有率最高的一种消耗性电池,常见型号有AA、AAA、C、D。
其主要优点是寿命长、容量大、成本低。
碱性电池适用于低功率的设备,例如手电筒、遥控器、闹钟、玩具等等。
二、镍氢电池镍氢电池是一种充电电池,具有高容量、大电流和长寿命的特点。
它的最大特点是能够多次充放电,使用寿命比碱性电池要长。
因此,镍氢电池适用于高功率的设备,例如数码相机、笔记本电脑、移动电源等等。
三、锂离子电池锂离子电池是一种高性能、轻量级的电池,拥有高容量、长寿命的特点。
锂离子电池充电时间短、能量密度高,适用于高度移动的设备。
例如智能手机、平板电脑、电动脚踏车等等。
四、铅酸电池铅酸电池是一种重量较重、体积较大的电池,主要应用于需要大量电能支持的场合。
铅酸电池分为免维护型和液体密封型两种,适用于太阳能电站、以及UPS不间断电源系统等。
五、锂聚合物电池锂聚合物电池是一种轻质高能密度的电池,能够在较小的时间内给设备提供高、稳定的电压。
锂聚合物电池可应用于薄型设备、如手机等,它不容易燃烧爆炸,安全性能也相对较高。
六、银氧电池银氧电池是一种高品质的电池,具有高能量密度、低自放电率、高温性能稳定等特点。
银氧电池适用于高精度仪器仪表、医疗设备、电动玩具等高端设备。
总之,不同种类的电池都有各自的优点和适用范围。
使用者在选择电池时需要了解设备的需求和电池的性能,以便选择最适合的电池来满足需求。
同时,使用者也应注意合理使用和存储电池,以保证其安全和寿命。

电化学电池的种类
电化学电池是一种将化学能转化为电能的装置,由一个或多个半电池组成。
根据其化学反应和构造方式的不同,电化学电池可以分为以下几类:
1. 干电池:干电池是一种常见的非可充电电池,内部通常由锌、二氧化锰、铜和碳等材料组成。
其优点是价格便宜、使用方便,适用于一次性使用。
2. 碱性电池:碱性电池也是一种非可充电电池,内部由锌、锰氧化物和碱性电解液组成。
相对于干电池,碱性电池具有更高的能量密度和更长的使用寿命。
3. 镍镉电池:镍镉电池是一种可充电电池,内部由镉、镍和碱性电解液组成。
具有较高的能量密度和长寿命,但存在较严重的环保问题。
4. 镍氢电池:镍氢电池也是一种可充电电池,内部由氢气、氢氧化镍和钴等元素组成。
相对于镍镉电池,镍氢电池环保性更好,但成本较高。
5. 锂离子电池:锂离子电池是一种可充电电池,内部由锂离子和电解质组成。
具有高能量密度、长寿命和较低的自放电率,已成为大部分电子设备和电动工具的主要动力来源。
6. 铅酸电池:铅酸电池是一种常见的蓄电池,内部由铅和铅氧化物、硫酸电解质组成。
具有价格便宜、使用寿命长等优点,常用于汽车、UPS等领域。
以上是电化学电池的几种常见类型,不同类型的电池适用于不同的场合,需要根据实际需求选择合适的电池。

化学电池的种类下面介绍化学电池的种类:1.干电池:普通锌锰干电池的简称,在一般手电筒中使用锌锰干电池,是用锌皮制成的锌筒作负极兼做容器,中央插一根碳棒作正极,碳棒顶端加一铜帽。
在石墨碳棒周围填满二氧化锰和炭黑的混合物,并用离子可以通过的长纤维纸包裹作隔膜,隔膜外是用氯化锌、氯化铵和淀粉等调成糊状作电解质溶液;电池顶端用蜡和火漆封口。
在石墨周围填充ZnCl2、NH4Cl和淀粉糊作电解质,还填有MnO2作去极化剂(吸收正极放出的H2,防止产生极化现象,即作去极剂),淀粉糊的作用是提高阴、阳离子在两个电极的迁移速率。
电极反应为:负极 Zn-2 e-=Zn2+正极 2 NH4+ +2 e-=2NH3+H2H2+2MnO2=Mn2O3+H2O正极产生的NH3又和ZnCl2作用:Zn2++4NH3=[Zn(NH3)4]2+干电池的总反应式:Zn+2NH4Cl+2MnO2=Zn(NH3)2Cl2+Mn2O3+H2O或 2Zn+4NH4Cl+2MnO2=[Zn(NH3)2]Cl2+ZnCl2+Mn2O3+H2O 正极生成的氨被电解质溶液吸收,生成的氢气被二氧化锰氧化成水。
干电池的电压1.5 V—1.6 V。
在使用中锌皮腐蚀,电压逐渐下降,不能重新充电复原,因而不宜长时间连续使用。
这种电池的电量小,在放电过程中容易发生气涨或漏液。
而今体积小,性能好的碱性锌—锰干电池是电解液由原来的中性变为离子导电性能更好的碱性,负极也由锌片改为锌粉,反应面积成倍增加,使放电电流大加幅度提高。
碱性干电池的容量和放电时间比普通干电池增加几倍。
2.铅蓄电池:铅蓄电池可放电亦可充电,具有双重功能。
它是用硬橡胶或透明塑料制成长方形外壳,用含锑5%~8%的铅锑合金铸成格板,在正极格板上附着一层PbO2,负极格板上附着海绵状金属铅,两极均浸在一定浓度的硫酸溶液(密度为1.25—1.28 g / cm3)中,且两极间用微孔橡胶或微孔塑料隔开。
放电的电极反应为:负极:Pb+SO42- -2e- =PbSO4↓正极:PbO2+4H++SO42- +2e- =PbSO4↓+2H2O 铅蓄电池的电压正常情况下保持2.0 V,当电压下降到1.85 V时,即当放电进行到硫酸浓度降低,溶液密度达1.18 g / cm3时即停止放电,而需要将蓄电池进行充电,其电极反应为:阳极:PbSO4+2H2O-2e- =PbO2+4H++SO42-阴极:PbSO4+2e- =Pb+SO42-当密度增加至1.28 g / cm3时,应停止充电。


电池的种类及使用电池是一种将化学能转化为电能的电力装置,广泛应用于电子设备、交通工具、电力系统和航天航空等领域。
根据不同的原理和用途,电池可以分为多种不同的类型。
本文将介绍几种常见的电池类型及其使用。
一、碱性电池碱性电池是最常见的一种电池类型,也是我们生活中常用的电池。
它以碱性电解液为电解质,使用锌作为负极和锰氧化物或氧化镍作为正极,由于其具有成本低、容量大、使用寿命长等优点,因此被广泛应用于各种低功率设备,如遥控器、手电筒、闹钟等。
二、镍镉电池镍镉电池是一种可充电电池,由于其具有较高的能量密度和长寿命,曾经是最常见的可充电电池类型。
镍镉电池以氢氧化镉作为负极,氢氧化镍作为正极,中间以氢氧化钾或氢氧化钠作为电解液。
但是,由于镍镉电池中的镍和镉对环境产生严重的污染,随着环保意识的增强,镍镉电池的使用逐渐减少。
三、锂离子电池锂离子电池是一种目前最常用的可充电电池类型,其具有高能量密度、轻量化、无记忆效应等特点。
锂离子电池以锂化合物作为正极,碳材料为负极,电解液通常是有机溶液。
锂离子电池广泛应用于手机、平板电脑、笔记本电脑等便携式电子设备,还被用作电动汽车和储能设备的动力源。
四、铅酸蓄电池铅酸蓄电池是一种常见的紧凑蓄电池,具有低成本、高放电电流、较长寿命等特点,适用于启动、短时间高电流放电等应用。
铅酸蓄电池以铅作为负极,以氧化铅作为正极,电解液是硫酸溶液。
铅酸蓄电池被广泛应用于汽车、UPS不间断电源、太阳能储能系统等领域。
五、锂聚合物电池锂聚合物电池是一种新型的锂离子电池,其使用具有高能量密度的聚合物凝胶作为电解质,相对于传统的液体电解质,锂聚合物电池更安全稳定。
锂聚合物电池具有超薄设计、便携性好、低自放电等优点,被广泛应用于智能手机、平板电脑、可穿戴设备等领域。
总结而言,电池是一种将化学能转化为电能的装置,主要有碱性电池、镍镉电池、锂离子电池、铅酸蓄电池和锂聚合物电池等几种常见类型。
这些电池类型在不同的应用领域有着各自的特点和优势,同时也有其相应的劣势,因此在选择和使用电池时需要根据应用场景和需求进行综合考虑。
各种电池型号用途电池是一种常用的能源存储装置,广泛应用于生活和工业领域。
它们的不同型号和种类适用于不同的用途。
以下是一些常见电池型号及其用途:1. 碱性电池:碱性电池是最常见的一种电池,常见的型号包括AA、AAA、C和D等。
它们广泛用于家庭电器、玩具、遥控设备和手持小型电子设备等。
碱性电池具有较高的能量密度和较低的成本,并且很容易找到和更换。
2. 锂离子电池:锂离子电池是目前应用最广泛的可充电电池,常见的型号包括18650和26650。
它们常用于移动电子设备,如手机、平板电脑和笔记本电脑。
锂离子电池具有高能量密度、轻量化和长寿命的特点,因此成为了便携式电子设备的首选能源。
3. 镍氢电池:镍氢电池是另一种常见的可充电电池,常见的型号包括AA和AAA。
它们常用于数码相机、遥控器、无线麦克风等设备。
镍氢电池具有较高的能量密度、较长的使用寿命和较低的自放电率。
4. 镍镉电池:镍镉电池是一种较老的可充电电池,常见的型号包括AA和AAA。
由于其对环境的影响较大,逐渐被新型电池所替代。
镍镉电池在较大电流下有较好的性能,并广泛用于应急照明、动力工具和军事设备等。
5. 铅酸电池:铅酸电池是一种较为成熟的可充电电池,常见的型号包括6V和12V。
它们被广泛应用于汽车起动电池、不间断电源和太阳能储能系统等。
铅酸电池具有较低的能量密度和短的寿命,但成本相对较低,大电流放电能力较强。
6. 锂聚合物电池:锂聚合物电池是一种新型的可充电电池,常见的型号包括薄型电池片和软包电池。
它们被广泛应用于便携式电子设备、智能手表、无人机和电动汽车等。
锂聚合物电池具有更高的能源密度、更轻薄的设计和较高的安全性能。
此外,还有其他种类的电池根据不同的用途而开发,如太阳能电池、钴酸锂电池、银锌电池等,它们适用于太阳能发电、医疗设备、火灾报警器等特定领域。
总之,电池在我们的日常生活和工业生产中起到了至关重要的作用,不同的电池型号能够满足各种不同应用需求,提供便利和能源支持。
1 一次电池:用完即丢,无法重复使用者。
碳锌电池、碱性电池、糊式锌锰电池、纸板锌锰电池、碱性锌锰电池、扣式电池(扣式锌银电池、扣式锂锰电池、扣式锌锰电池)、锌空气电池、一次锂锰电池等、水银电池。
按使用隔离层区分为糊式和板式电池两种,板式又按电解质液不同分C型(铵型)和P型(锌型)纸板电池两种。
传统的糊式锌锰干电池,其正极材料采用活性较低的天然二氧化锰,隔离物是淀粉和面粉的浆糊隔离层,电解液是以H4CL为主的氯化铵、氯化锌水溶液,负极是锌筒,其放电性能一般较差,容量较低,电池使用末期易漏液,但价格便宜。
C型(铵型)纸板电池是在糊式电池的基础上用浆层纸代替了浆糊纸,不但正极填充量提高30%左右,而且用30-70%的高活性锰代替了天然锰,所以容量得以提高,使用范围得以扩大,多用于小电流放电场合,如用于钟表、遥控器、收音机、手电筒等场合。
P型(锌型)纸板电池采用氯化锌为主的电解液,正极材料全部采用高活性的锰粉,如电解锰、活性锰等,其防漏性能远高于糊式和C型电池,多用于大电流连续放电场合,如用于照相机、闪光订、收录机、剃须刀、电动玩具等。
圆柱型碱性锌锰电池alkaline,又称碱锰电池,俗称碱性电池,是锌锰电池系列中性能最优的品种。
20世纪中期在锌锰电池基础上发展起来的,是锌锰电池的改进型。
电池使用氢氧化钾(KOH)或氢氧化钠(NaOH)的水溶液做电解质液,采用了与锌锰电池相反的负极结构,负极在内为膏状胶体,用铜钉做集流体,正极在外,活性物质和导电材料压成环状与电池外壳连接,正、负极用专用隔膜隔开制成。
其外壳一般由08F镀镍钢带经冷轧冲压制成,同时兼作正极集流体,电解二氧化锰正极材料压成圆环紧贴在柱体内壁,以保证良好的接触,其负极采用粉状锌粒并制成膏剂,处于电池的中间,其间插入负极集流体(负极一般为铜钉),集流体与负极底部相连,在电池内部,正极间用隔膜(隔离层)隔开,其外部用尼龙或聚丙烯密封圈隔开,同时实现电池的密封,电池外部与一般电池几乎相同。
电池的种类及使用资料电池是一种能够将化学能转化为电能的设备,广泛应用于各种电子设备和机械设备中。
根据不同的化学反应原理,电池可以分为多种类型。
本文将从常见电池的分类和原理、使用注意事项以及电池的环保问题这三个方面介绍电池的种类及使用资料。
一、电池的分类和原理1. 锂离子电池(Li-ion Battery)锂离子电池是目前应用最广泛的电池之一,具有高能量密度、长循环寿命和较低自放电率的特点。
它采用锂离子在正负极之间往返移动来储存和释放电能。
锂离子电池包括锂聚合物电池和锂离子磷酸铁锂电池等。
2. 镍氢电池(Ni-MH Battery)镍氢电池是一种环保型的电池,相对于镍镉电池来说具有更高的能量密度和更低的自放电率。
镍氢电池采用氢化物和氢氧化镍作为正负极材料,它和锂离子电池一样都是可充电电池。
3. 镉镍电池(Ni-Cd Battery)镉镍电池是一种早期应用较广的可充电电池,具有优秀的充放电性能和较长的循环寿命。
然而,由于镉元素具有很高的毒性,镉镍电池的使用受到了限制,并逐渐被环保型电池所取代。
4. 锂聚合物电池(Li-polymer Battery)锂聚合物电池是一种比较新的电池技术,在尺寸和重量上更加灵活,可以根据需要进行各种形状的设计。
它采用了聚合物电解质,相对于锂离子电池来说具有更高的安全性和稳定性。
5. 铅酸电池(Lead-acid Battery)铅酸电池是一种成熟的电池技术,广泛应用于汽车、UPS等领域。
铅酸电池以铅和铅的氧化物作为电极材料,硫酸作为电解液。
铅酸电池具有低成本、高放电能力和稳定性好的特点。
二、电池的使用注意事项1.正确连接极性在安装电池时,要确保正负电极的连接是正确的,避免发生短路或电池损坏的情况。
2.控制充电时间对于可充电电池,要按照生产商提供的充电时间进行充电,不要过度充电或过度放电,以防止电池容量的减少或损坏。
3.避免高温和高湿环境电池对于高温和高湿的环境非常敏感,会导致电池容量的降低、短路等问题,因此应尽可能避免将电池放置在此类环境中。
锂离子电池的种类锂离子电池是一种常见的可充电电池,广泛应用于移动电子设备、电动汽车等领域。
根据不同的材料组成和工作原理,可以将锂离子电池分为多种类型。
本文将就锂离子电池的种类进行详细介绍。
一、锰酸锂电池锰酸锂电池是锂离子电池中最早被商业化应用的类型之一。
它的正极材料是锰酸锂(LiMn2O4),负极则是石墨。
锰酸锂电池具有较高的能量密度和较低的成本,但充放电循环次数较少,容量衰减较快。
因此,锰酸锂电池主要应用于一次性使用的电子产品,如手机、笔记本电脑等。
二、钴酸锂电池钴酸锂电池的正极材料是钴酸锂(LiCoO2),负极材料仍然是石墨。
钴酸锂电池具有较高的能量密度和较好的循环寿命,因此被广泛应用于移动电子设备。
然而,钴酸锂电池的成本较高,且钴资源有限,存在一定的环境问题。
因此,近年来人们开始研究开发其他类型的锂离子电池。
三、磷酸铁锂电池磷酸铁锂电池的正极材料是磷酸铁锂(LiFePO4),负极材料仍然是石墨。
磷酸铁锂电池具有较高的安全性、较长的循环寿命和较低的成本,成为一种备受关注的锂离子电池类型。
磷酸铁锂电池广泛应用于电动汽车、储能系统等领域。
四、三元材料电池三元材料电池的正极材料是镍钴锰酸锂(LiNiCoMnO2),负极材料仍然是石墨。
三元材料电池兼具了钴酸锂电池和锰酸锂电池的优点,具有较高的能量密度和较好的循环寿命。
三元材料电池被广泛应用于电动汽车领域,成为动力电池的主流技术。
五、硅基锂离子电池硅基锂离子电池是一种新型的锂离子电池类型。
传统的锂离子电池负极材料是石墨,而硅基锂离子电池的负极材料是硅。
由于硅具有较高的储锂容量,硅基锂离子电池具有更高的能量密度和更长的续航里程。
然而,硅材料的膨胀性和容量衰减等问题也给硅基锂离子电池的研发带来了一定的挑战。
锂离子电池的种类多种多样,每种类型都有其独特的优势和应用领域。
随着科技进步和需求的不断变化,人们对锂离子电池的研发和改进也在持续进行,相信未来会有更多新型的锂离子电池问世,为各个领域的电子设备和交通工具提供更可靠、更高效的能源解决方案。