食品中乳酸菌地检测
- 格式:doc
- 大小:106.50 KB
- 文档页数:9

食品中乳酸菌的分离鉴定及功能研究近年来,随着人们健康意识的提高,对于食品中乳酸菌的分离鉴定及功能的研究逐渐受到关注。
乳酸菌是一类广泛存在于食品中的有益菌群,具有许多对人体有益的功效,其鉴定与功能研究对于食品质量的提升和人类健康至关重要。
首先,乳酸菌的分离鉴定是研究乳酸菌功能的基础。
在食品中分离鉴定乳酸菌,可以帮助我们了解不同种类、不同来源食品中乳酸菌的种类和数量。
常见的分离鉴定方法包括传统的培养分离方法、分子生物学方法和基因测序技术等。
其中,传统的培养分离方法是最常用的一种方法。
通过在不同的培养基上进行培养,分析菌落形态、生理和生化特性,可以初步鉴定出乳酸菌的种类。
而分子生物学方法则可通过引物对乳酸菌特异基因进行扩增和检测,进一步确定其种类。
基因测序技术则可以更加准确地鉴定不同乳酸菌的种类和亲缘关系,为进一步深入研究乳酸菌功能奠定基础。
其次,乳酸菌的功能研究主要包括保健、抗菌和抗氧化等方面。
乳酸菌具有胃肠道保健功能,可以维护肠道的健康平衡,促进食物的消化吸收,降低胃肠道疾病的风险。
此外,乳酸菌还具有抗菌作用,特别是对肠道中的有害菌起到抑制作用,有利于维持肠道菌群的稳定。
同时,乳酸菌还具有一定的抗氧化功能,可以清除自由基、减少氧化应激,保护人体细胞免受氧化损伤。
乳酸菌的功能主要通过其代谢产物来实现。
乳酸菌代谢产物包括乳酸、抗菌物质、挥发性化合物和细胞外多糖等。
其中,乳酸是乳酸菌最主要的代谢产物之一,可以维持肠道的酸碱平衡,抑制有害菌的生长。
抗菌物质则可以直接杀灭或抑制有害菌的生长。
挥发性化合物则赋予乳酸菌独特的风味和香气,为食品增色不少。
细胞外多糖则具有一定的黏附能力,有助于乳酸菌在肠道中生存和繁殖。
针对乳酸菌的功能研究还包括乳酸菌的应用。
乳酸菌可以被广泛应用于食品工业,通过发酵食品,不仅可以制造出更多种类的美味食品,还可以增加食品的营养价值和保质期。
此外,乳酸菌在医学领域也有着广泛的应用前景。
研究表明,乳酸菌在预防和治疗肠道疾病、免疫调节、降低胆固醇、抑制肿瘤等方面具有潜在疗效。

分析食品检验中乳酸菌的鉴定方法作者:曹敬慧来源:《科学与财富》2019年第09期摘要:近年来,随着人民生活水平的不断提升,人们对于食品安全问题的重视程度也随之不断提升。
食品检验与人民的身体健康和生命安全有着极为密切的关系,完善现有的食品检验标准和方式是十分必要的。
本文就针对食品检验中乳酸菌的鉴定方法进行了简要的探讨分析,立足于我国当前的乳酸菌鉴定标准,分析在食品检验过程中实用性较强的乳酸菌鉴定方法,希望可以为保证食品安全贡献一份力量。
关键词:食品检验;微生物检测技术一、引言常见的乳酸菌包括多个种类,且应用较为广泛。
乳酸菌不仅可以改善食物的味道,同时也可以提升食品的营养价值,延长其储存时间。
它们不仅是研究分类、生化、遗传、分子生物学和基因工程的理想材料,在理论上具有重要的学术价值,而且在工业、农牧业、食品和医药等与人类生活密切相关的重要领域应用价值也极高。
在我们日常生活中,经常食用的食品当中都有乳酸菌的存在。
摄入一定量的乳酸菌,一方面可以改善人体的肠道功能,另一方面也可以降低人体内的血清胆固醇,从而起到保障人体健康、预防各类疾病的作用。
在对乳酸菌进行鉴定时,应当依据乳酸菌的不同形态以及其生物特性进行具体的划分,并有针对性地采取适当的鉴定方法,从而确保鉴定结果的精准性和可靠性。
二、乳酸菌的鉴定简单来说,乳酸菌就是一种可以充分利用可发酵碳水化合物而形成的乳酸细菌,乳酸菌种类多样,且在人们日常的生活中发挥着较为重要的作用。
当前阶段已知的乳酸菌类型已达数百种,大部分乳酸菌都可以起到改善人体机能的作用。
我们可以将乳酸菌细分为动物源乳酸菌以及植物源乳酸菌两大类。
对比两类乳酸菌,人体在摄入乳酸菌时,对于植物源乳酸菌具备更强的吸收能力。
加之,植物乳酸菌的活性明显强于动物乳酸菌,因而在各类食品的生产过程中,往往更加青睐于使用植物乳酸菌。
乳酸菌鉴定,简单来说,就是指通过以不同种类的乳酸菌形态及其他特性为基础,充分利用先进的检验方法,分析乳酸菌的类型以及其中含有的各类元素。

食品中乳酸菌的筛选与活性鉴定乳酸菌是一类对人体健康具有益处的细菌,在许多食物中都可以找到它们的踪迹。
从酸奶到发酵食品,乳酸菌都发挥着重要的作用。
然而,如何筛选出具有较高活性的乳酸菌,并对其进行鉴定,这是一个令人感兴趣的话题。
首先,我们需要选择适当的食品样本进行筛选。
常见的食品包括酸奶、奶酪、纳豆等发酵产品。
这些食品中含有大量的乳酸菌,因此是我们进行筛选的理想选择。
此外,还可以考虑其他一些食物,如蔬菜和肉类,它们也可能含有乳酸菌。
接下来,我们需要从样本中分离出乳酸菌。
这可以通过培养基选用和分离培养来实现。
培养基的选用非常重要,它应提供乳酸菌所需要的营养物质。
我们可以选择常用的乳酸菌培养基,如MRS培养基。
通过将样品接种于MRS培养基中,我们可以让乳酸菌生长并形成可见的菌落。
然后,通过将这些菌落转移至其他培养基中,可以进行单菌落分离,确保我们获得的是纯种的乳酸菌菌株。
鉴定乳酸菌的活性也是我们的重点之一。
活性乳酸菌可以产生乳酸、酶和抗菌物质,这些物质对人体健康有益。
因此,我们想要筛选出活性较高的乳酸菌菌株。
常见的活性鉴定方法包括测定乳酸产量、酶活性和抗菌活性。
乳酸产量是乳酸菌活性的重要指标之一。
我们可以通过高效液相色谱法(HPLC)来测定乳酸的含量。
通过将培养基或发酵物转移到HPLC系统中,我们可以分析出乳酸的浓度。
通过与不同菌株之间的比较,我们可以确定哪些菌株产乳酸的能力更强。
酶活性是另一个衡量乳酸菌活性的重要指标。
乳酸菌常常能够产生多种酶,如蛋白酶和纤维素酶。
我们可以使用相应的酶活性试剂盒来检测其酶活性。
高酶活性的乳酸菌意味着它们能够更好地消化蛋白质和纤维素,从而提高食物的可消化性和营养吸收能力。
除了乳酸和酶活性外,抗菌活性也是评估乳酸菌活性的重要指标之一。
乳酸菌可以产生抗菌物质,对抗病原菌的侵袭。
我们可以通过抗菌活性试验来评估乳酸菌的抗菌能力。
将不同乳酸菌菌株与病原菌一起接种在琼脂平板上,观察是否形成抑制区域。

酸奶中乳酸菌的检测与酸奶的制作综合性实验报告组员:摘要:以奶粉为原料,蒙牛酸奶为接种剂自制酸奶并进行感官评价。
用稀释倒平皿法和划线分离法分离出蒙牛酸奶中的乳酸菌。
分别用改良MC培养基和改良TJA培养基培养一段时间后观察菌落形态并进行菌落计数。
再挑取少许不同培养基上的菌落用革兰氏染色法染色,观察乳酸菌的个体形态。
关键词:酸奶制作、乳酸菌菌落形态及总数、MC培养基、TJA培养基、革兰氏染色、乳酸菌个体形态1 前言酸奶是以新鲜的牛奶为原料经过巴氏杀菌后再向牛奶中添加有益菌(发酵剂),经发醇后,再冷却灌装的一种牛奶制品。
按是否加糖,酸奶可分为淡酸奶和加糖酸奶两种,我国常见的酸奶制品是加糖酸奶,即在制作酸奶的原料乳中加入一定量的白糖进行发酵得到的酸奶产品。
酸奶营养丰富,其蛋白质和钙质较鲜乳更易消化吸收,抑制腐败细菌的繁殖,降低肠道内毒素浓度。
酸奶内含乳酸菌并在发酵过程中产生乳酸及族维生素等,能增强消化,促进肠道蠕动和机体物质的代谢,提高人的免疫力, 长期饮用即可保证钙质的需求, 又可健肠胃, 是一种对人体肠胃非常有益的保健食品。
2 材料与方法2.1 仪器与器材温箱:47℃、冰箱: 4℃、电磁炉、锅吸管:容量为1,10和25mL、广口瓶或三角瓶:容量为500mL、平皿:直径为9cm、试管(带试管塞):18×180mm、显微镜、带玻璃珠的三角瓶、移液枪、移液管、恒温箱、电磁炉、平底锅、2个奶瓶、保鲜膜、接种环、酒精灯。
2.2 培养基和试剂培养基:改良MC 培养基,改良TJA培养基。
材料:番茄汁、革兰氏染色液、蒙牛酸奶、脱脂奶粉、白砂糖。
2.3 方法2.3.1 无菌水和培养基的制备(1)无菌水:将20支试管分别用移液枪注入9ml的自来水,塞上试管塞,分10支捆成一扎并用牛皮纸包好。
将2个三角瓶分别注入150ml的自来水,塞上瓶塞,分别用牛皮纸封好。
将上述的试管以及三角瓶一起高压蒸汽灭菌。
(2)培养基:MC培养基:称取16g改良MC培养基粉末加200mL水置于电炉上小火加热溶解;TJA培养基:称取12g改良TJA培养基粉末加10mL茄汁和200mL水置于电炉上小火加热溶解,分别制得。

发酵食品中乳酸菌的分离与鉴定乳酸菌是一类重要的微生物,在食品发酵过程中扮演着不可替代的角色。
乳酸菌不仅能够提高食品的营养价值,还具有促进肠道健康、增强免疫力等益生作用。
因此,分离和鉴定发酵食品中的乳酸菌是食品科学领域中的一项重要研究内容。
要进行乳酸菌的分离与鉴定,首先需要从发酵食品样品中分离乳酸菌。
一般而言,我们可以选择将样品通过稀释后接种于选择性培养基上,以便只有乳酸菌能够生长。
接种后,将培养基放置于适宜的温度下,培养一段时间。
乳酸菌具有较强的酸性产生能力,因此在培养过程中会形成明显的酸性环境。
可通过测量培养基的pH值来初步判断是否有乳酸菌生长。
在分离乳酸菌的培养基上,我们可能会观察到许多不同形态的菌落。
这些菌落在形状、颜色、质地等方面可能存在差异。
我们可以选择几个具有代表性的菌落进行后续的鉴定。
对于乳酸菌的鉴定,有许多方法可供选择。
一种常用的鉴定方法是形态学观察。
乳酸菌具有一些特征性的形态特征,如菌落的形状、边缘的特点、质地的柔软程度等。
此外,乳酸菌的细胞形态也具有一定的特征,如形状、大小、胞内结构等。
通过在显微镜下观察乳酸菌的形态特征,可以初步判断其种属。
除了形态学观察外,乳酸菌的生理生化特性也是鉴定的重要依据。
例如,乳酸菌通常能够在不产生气体的条件下发酵葡萄糖。
此外,乳酸菌对于一些特定的碳源、氮源等具有较强的利用能力。
通过对乳酸菌进行代谢特性的测试,可以进一步确认其种属。
分子生物学方法也为乳酸菌的鉴定提供了新的手段。
通过对乳酸菌的DNA进行提取和PCR扩增,可以得到乳酸菌的16S rRNA序列。
将这些序列与已知种属的乳酸菌进行比对,可以准确鉴定乳酸菌的种属。
在发酵食品中,常常存在多种乳酸菌同时存在的情况。
因此,对于从发酵食品中分离到的乳酸菌,进行种属鉴定是至关重要的。
只有确定了乳酸菌的种属,才能更好地利用其在食品工业中的潜力。
发酵食品中乳酸菌的分离与鉴定是一项科学而有趣的工作。
通过对乳酸菌的研究,我们可以更好地了解乳酸菌在食品发酵过程中的功能和作用,为食品工业的发展提供更多的可能性。



酸菜食品发酵中防腐乳杆菌的检测与筛选酸菜是一种以青菜为原料,经过盐腌、发酵而成的食品,具有浓郁的口感和酸爽的味道,深受人们喜爱。
而在酸菜的发酵过程中,乳酸菌是一种非常重要的菌种,它不仅有利于酸菜的发酵和保存,还对人体健康有益,因此在酸菜食品发酵中防腐乳杆菌的检测与筛选成为了一个重要的研究课题。
一、乳酸菌对酸菜的重要性乳酸菌是一类革兰氏阳性菌,主要包括嗜酸乳杆菌、乳酸杆菌等多种,它们具有优良的发酵能力,能够将蔬菜中的糖类发酵成乳酸,从而降低pH值,产生特有的酸味。
在酸菜的发酵过程中,乳酸菌不仅能够提高食品的风味和营养,还能够抑制有害菌的生长,达到保鲜和防腐的作用,因此它是酸菜发酵中不可或缺的菌种。
二、乳酸菌的检测方法乳酸菌的检测方法主要包括传统的培养法和分子生物学方法两种。
1.培养法培养法是最为常见和传统的乳酸菌检测方法。
首先是样品的处理,将酸菜样品加入生理盐水中进行搅拌,再进行一定的稀释,将样品接种在适宜的培养基上,通过一定的温度和时间进行培养。
最后通过肉眼观察和显微镜检查菌落的数量和形态特征,来判断样品中乳酸菌的含量和种类。
2.分子生物学方法分子生物学方法是近年来发展起来的一种新型检测方法,其主要包括PCR技术、实时荧光定量PCR技术和基因测序技术。
这些方法通过检测样品中特定的乳酸菌基因序列,来确定其种类和含量,具有准确、灵敏、高通量等优点。
三、乳酸菌的筛选方法酸菜的发酵中选择适宜的乳酸菌菌种至关重要,而乳酸菌的筛选主要包括筛选菌株、筛选菌种、筛选发酵工艺三个方面。
1.筛选菌株筛选菌株是乳酸菌筛选的第一步,通常可以通过对多种来源的酸菜样品进行采样和分离,然后在适宜的培养条件下进行发酵,并观察其酸度、口感、保存性等指标,最终选出具有较好特性的菌株。
2.筛选菌种在确定了优良的菌株后,还需要通过分子生物学手段对其进行鉴定和分类,进而确定其属于哪种菌种,这有助于更好地掌握和利用其生物特性。
3.筛选发酵工艺在确定了优秀的乳酸菌菌种后,还需要对其进行发酵工艺的优化和选择,包括发酵温度、发酵时间、发酵pH值等因素,以期使其发挥出最佳的发酵效果。

《食品安全国家标准食品微生物学检验乳酸菌检验》(征求意见稿)编制说明一、标准起草的基本情况(包括简要的起草过程、主要起草单位、起草人等)1、任务来源受国家卫生和计划生育委员会食品安全标准与监测评估司委托,根据《中华人民共和国食品安全法》和国务院部署,按照《食品安全国家标准整合工作方案(2014年- 2015年)》的原则要求,按照国家卫生和计划生育委员会食品安全标准与监测评估司的工作安排,对该标准进行整合。
标准整合项目编号为ZHENGHE-2014-408和ZHENGHE-2015-408。
2、标准起草单位、协作单位、主要起草人本标准起草单位为:国家食品安全风险评估中心;主要起草人为:徐进、董银苹、李志刚、杜春明、王伟。
3、简要起草过程(1)2014年7月标准整合人员进行了实地学习、交流,对整合原则、技术要求和实施细则进行了讨论,2014年12月底完成数据的汇总。
(2)2014月10月31日武汉第一届食品安全国家标准评审委员会检验方法与规程分委会第十五次会议上审评委员会专家对乳酸菌标准进行了讨论,并提出了完善建议。
(3)根据初审意见继续完善标准文本。
2015月5月11日起草组在南宁标准研讨会上对形成的标准文本再次进行了讨论。
(4)提交《食品安全国家标准食品微生物学检验乳酸菌检验》(征求意见稿)、《编制说明》供公开征求意见。
二、标准的重要内容及主要修改情况1、标准的制(修)订与起草原则(1)与国际接轨的原则,该标准的起草内容主要参考了以下ISO方法:ISO 8261:Milk and milk products — General guidancefor the preparation of test samples, initial suspensions and decimal dilutions formicrobiological examinationISO 7889:Yghurt-Eumeration of characteristic microorganisms-Clony-count technique at 37℃ISO 20128: Milk products- Eumeration of presumptive lactobacillus acidophilus on a selective medium- Clony-count technique at 37℃ISO 29981: Milk products — Enumeration of presumptive bifidobacteria —Colony count technique at 37℃尽量做到与国际上的乳酸菌检测方法相统一,便于与国际乳酸菌检测接轨。

食品中乳酸菌的分离与鉴定乳酸菌是一类重要的微生物,在食品加工和保质过程中起着关键作用。
乳酸菌具有产生乳酸的能力,能够抑制有害菌的生长,提高食品的质量和安全性。
因此,乳酸菌的分离与鉴定对于食品工业具有重要意义。
乳酸菌的分离方法多种多样,常用的有直接涂布法、稀释涂布法和差减分离法等。
其中,直接涂布法是最常用的方法之一。
直接涂布法是将食品样品均匀涂布于含有特定培养基的琼脂平板上,利用乳酸菌对特定培养基的选择性生长来分离乳酸菌。
稀释涂布法则是将食品样品稀释到一定程度后,涂布于琼脂平板上进行分离。
差减分离法是相对于稀释涂布法的一种改进方法,通过两个不同培养基的对比,进一步筛选出乳酸菌。
乳酸菌的鉴定方法主要包括形态学观察、生理生化特性鉴定和分子生物学鉴定等。
形态学观察是最基本的鉴定手段之一,通过显微镜观察菌落和细胞形态特征,可以初步判断出乳酸菌的种类。
生理生化特性鉴定是将分离出的菌株在不同条件下进行相关实验,如气体产生、温度耐受性、胞外酶产生等,通过对比不同特性的表现,进一步鉴定乳酸菌的种类。
而分子生物学鉴定则能够更准确地确定乳酸菌的种属和亚属,如通过PCR扩增特定基因序列,利用DNA测序技术进行序列比对,从而鉴定乳酸菌的种类。
乳酸菌的分离与鉴定在实际食品加工中具有重要意义。
首先,通过分离和鉴定乳酸菌,可以确定食品中乳酸菌的种类和数量,进而判断食品是否存在质量和安全性问题。
其次,乳酸菌的鉴定有助于选择合适的培养条件,促进乳酸菌的生长和产酸过程,从而提高食品品质。
此外,乳酸菌的鉴定也有利于乳品行业中的产品研发和工艺改进,为创新和提高乳制品的营养和口感贡献力量。
然而,乳酸菌的分离与鉴定也面临一些挑战。
首先,食品中的乳酸菌种类繁多,分离出纯种菌株的难度较大。
其次,乳酸菌的生理生化特性相似,需要较为精确的实验手段和技术设备来进行鉴定。
此外,乳酸菌与其他微生物的相互作用也需要考虑,有时候必须结合其他鉴定方法才能得出准确结论。
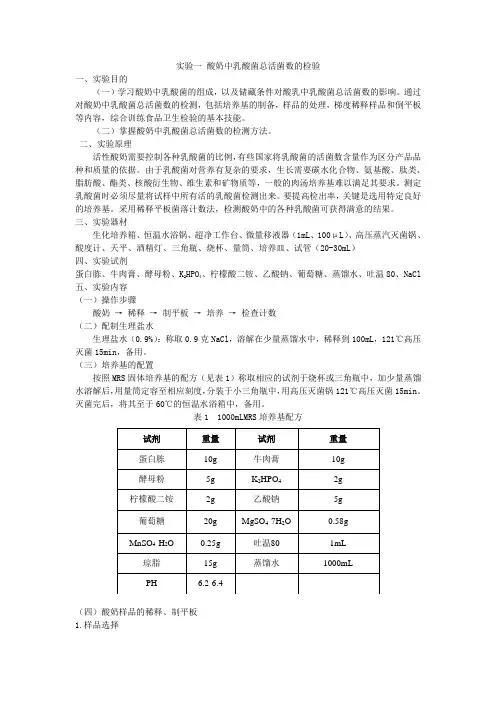
实验一酸奶中乳酸菌总活菌数的检验一、实验目的(一)学习酸奶中乳酸菌的组成,以及储藏条件对酸乳中乳酸菌总活菌数的影响。
通过对酸奶中乳酸菌总活菌数的检测,包括培养基的制备,样品的处理,梯度稀释样品和倒平板等内容,综合训练食品卫生检验的基本技能。
(二)掌握酸奶中乳酸菌总活菌数的检测方法。
二、实验原理活性酸奶需要控制各种乳酸菌的比例,有些国家将乳酸菌的活菌数含量作为区分产品品种和质量的依据。
由于乳酸菌对营养有复杂的要求,生长需要碳水化合物、氨基酸、肽类、脂肪酸、酯类、核酸衍生物、维生素和矿物质等,一般的肉汤培养基难以满足其要求。
测定乳酸菌时必须尽量将试样中所有活的乳酸菌检测出来。
要提高检出率,关键是选用特定良好的培养基。
采用稀释平板菌落计数法,检测酸奶中的各种乳酸菌可获得满意的结果。
三、实验器材生化培养箱、恒温水浴锅、超净工作台、微量移液器(1mL、100μL)、高压蒸汽灭菌锅、酸度计、天平、酒精灯、三角瓶、烧杯、量筒、培养皿、试管(20-30mL)四、实验试剂蛋白胨、牛肉膏、酵母粉、K2HPO4、柠檬酸二铵、乙酸钠、葡萄糖、蒸馏水、吐温80、NaCl 五、实验内容(一)操作步骤酸奶→稀释→制平板→培养→检查计数(二)配制生理盐水生理盐水(0.9%):称取0.9克NaCl,溶解在少量蒸馏水中,稀释到100mL,121℃高压灭菌15min,备用。
(三)培养基的配置按照MRS固体培养基的配方(见表1)称取相应的试剂于烧杯或三角瓶中,加少量蒸馏水溶解后,用量筒定容至相应刻度,分装于小三角瓶中,用高压灭菌锅121℃高压灭菌15min。
灭菌完后,将其至于60℃的恒温水浴箱中,备用。
表1 1000mLMRS培养基配方(四)酸奶样品的稀释、制平板1.样品选择酸奶样品分两类,一类是室温放置一周的酸奶,一类是4℃存放的酸奶。
对两类酸奶的样品处理均一致。
2.样品稀释先将酸奶样品搅拌均匀,用移液器取1mL酸奶样品于9mL的灭菌生理盐水试管中,充分摇匀,务必使样品均匀分散,即为10-1的样品稀释液,连续稀释至10-9。
乳酸菌检验的方法要点乳酸菌不是分类学上的名称,它是指一群能分解葡萄糖或乳糖产生乳糖产生乳酸、需氧和兼性厌氧、多数无动力、过氧化氢酶阴性、革兰氏阳性的无芽孢杆菌和球菌。
这类细菌在自然界分布广泛,可栖居在人和各种动物的口腔、肠道等器官内,在土壤、食品、饲料、水及一些临床标本中都有乳酸菌的存在。
乳酸菌在工业、农业和医药等与人类生活密切相关的领域应用价值很高,相当多的乳酸菌对人、畜的健康起着有益的作用,但个别菌种能对人畜致病,乳酸菌主要包括23个属的细菌。
乳酸菌的检测流程:1、乳酸菌悬液的制备:将待检测的样品,准确称取0.5克,量取99.5mL无菌生理盐水稀释,(此次稀释了200倍,即0.5克样品,稀释到了100克水溶液),再加入灭菌玻璃珠20~30粒于250mL三角瓶中,置于振荡器或摇床上剧烈摇晃30分钟以上,目的是将粘连在一起的乳酸菌细胞打散从而分散开来。
2、稀释到适当倍数:根据所待检测的样品可能的乳酸菌含量,进行适当的稀释操作,例如如果估计样品的含乳酸菌活菌数为200亿/克左右,则建议稀释2亿倍,这样将来在90mm平板上培养时会长出大约100个乳酸菌落,比较便于计数,总之控制平板培养皿上的乳酸菌落数量在30~300个的范围内,比较便于计数。
3、倒制平板即“接种”:倒制平板在超净工作台上进行,养殖户可使用一盏简单的酒精灯和一个干净的操作台就可操作。
即事先配制好并灭菌处理的检测用琼脂培养基,在水浴锅内保持50℃的温度,使琼脂培养基呈溶解状态,置于操作台旁边备用。
(养殖户可先不从压力锅中取出,在压力锅维持一定的温度,从而也不会凝固。
)取事先干热灭菌处理后的90mm培养皿(也叫平板)若干、1mL移液管若干,置于操作台上备用。
(养殖户的培养皿平板可在压力锅中进行蒸汽灭菌处理。
)在无菌条件下(打开超净工作台无菌风,或养殖户点上酒精灯),将稀释了2亿倍的乳酸菌液,用移液管移取1mL,于培养皿中,再在此培养皿中倒入前述保持溶解状态的检测培养基液15mL左右(倒培养基时,估计能覆盖满平皿的液体量即可),然后,盖好培养皿盖,轻轻转动平皿,原地转几圈,使培养基液与乳酸菌液混合均匀,等数分钟后,待培养基凝固后,可移入培养箱中进行培养;4、在培养箱中进行培养:将前面倒制好的平板倒转(即盖子在下面),放于培养箱中于33℃温度下培养2~3天,待培养皿平板中长出比较明显的带有透明圈的菌落时,即可进行计数得出检测结果。
食品加工中乳酸菌的筛选与应用食品加工是人们日常生活中不可或缺的一部分。
随着人们对食品质量和健康的关注度不断提高,乳酸菌作为一种有益微生物备受关注。
乳酸菌的筛选与应用对于食品加工行业来说具有重要意义,下面我们来了解一下乳酸菌筛选的方法以及其在食品加工中的应用。
一、乳酸菌的筛选方法乳酸菌是一类常见的益生菌,具有抗菌、抗肿瘤、降血脂等多种功能。
在食品加工中,需要选用菌株进行乳制品、酸奶、发酵蔬菜等食品的制作,因此,乳酸菌的筛选非常重要。
目前,常用的乳酸菌筛选方法主要有以下几种。
首先是酸奶乳酸菌的筛选。
酸奶是一种常见的乳制品,乳酸菌在其中起到发酵作用。
筛选酸奶乳酸菌主要依靠其形态特征和代谢产物。
乳酸菌通常呈链状、球状等形态,也会产生乳酸和醋酸。
通过观察菌落形态和酸度的变化,可以初步确定乳酸菌的种类。
其次是发酵蔬菜中的乳酸菌筛选。
发酵蔬菜是另外一种常见的食品,其中的乳酸菌对保持蔬菜的新鲜度和产生特殊的风味有着重要作用。
筛选发酵蔬菜中的乳酸菌主要依靠发酵过程中的酸度和气味变化。
乳酸菌可以产生乳酸和一些挥发性化合物,通过观察酸度的变化和气味的特殊性,可以初步确定乳酸菌的种类。
最后是基因分析法。
随着科技的不断进步,乳酸菌的筛选越来越多地采用基因分析法。
基因分析法通过对乳酸菌的基因组进行测序和分析,可以准确地确定其物种和亲缘关系。
这种方法不仅可以快速准确地筛选乳酸菌,还可以为乳酸菌的进一步研究提供数据支持。
二、乳酸菌在食品加工中的应用乳酸菌在食品加工中具有广泛的应用价值。
首先是酸奶制作。
酸奶是一种受人们喜爱的乳制品,其中含有丰富的乳酸菌。
乳酸菌能够将乳糖转化为乳酸,降低酸奶的pH值,抑制有害菌的生长,同时还赋予酸奶独特的口感和风味。
其次是乳制品的保鲜。
乳酸菌产生的乳酸具有抗菌作用,可以抑制一些有害菌和腐败菌的生长,延长乳制品的保质期。
乳酸菌还可以产生一些挥发性化合物,赋予乳制品特殊的风味和香味。
此外,乳酸菌还可以用于发酵蔬菜的制作。
酸菜食品发酵中防腐乳杆菌的检测与筛选酸菜是一种经过发酵制作的食品,具有浓厚的风味和独特的口感,深受人们喜爱。
酸菜的制作过程中,乳酸菌是起着重要作用的发酵菌种之一,可以促进酸菜的发酵过程,增强其口感和风味。
随着酸菜生产规模的不断扩大,发酵中产生的微生物问题在保质期和产品质量方面也逐渐凸显出来。
由于发酵过程中存在多种微生物群落,其中包括一些产生有害物质的微生物,因此如何进行发酵中的防腐乳杆菌检测与筛选就显得尤为重要。
在酸菜的发酵过程中,乳酸菌是一种重要的发酵菌种,是产生酸菜特有风味和酸菜质地的关键菌种。
乳酸菌主要通过在酸菜生产过程中的发酵活动产生大量乳酸,降低环境pH 值,抑制其它微生物的生长,从而保持酸菜的稳定性和可食性。
检测酸菜中的发酵防腐乳杆菌就显得尤为重要。
1.传统的检测方法目前,市面上主要采用传统的微生物学检测方法来检测酸菜中的发酵防腐乳杆菌。
这种方法主要是通过对酸菜样品进行菌落计数或鉴定酸菜中的微生物群落结构,来判断酸菜中的发酵防腐乳杆菌的数量和种类。
常用的检测方法包括菌落计数法、PCR扩增方法、实时定量PCR技术、荧光原位杂交技术、生物传感器技术等。
在常规的微生物学检测方法中,菌落计数法是最为常见的一种。
该方法通过将酸菜样品分离培养,然后对菌落进行计数。
传统的菌落计数法需要较长的培养时间,且结果不够准确、灵敏,难以对酸菜样品中存在的微生物进行全面而迅速的检测。
2.基于生物技术的检测方法酸菜中发酵防腐乳杆菌的检测和筛选,近年来逐渐倾向于采用基于生物技术的方法,这些方法具有高效、准确、快速等特点。
其中最突出的技术包括酶联免疫吸附测定法(ELISA)和基因测序技术。
酶联免疫吸附测定法是一种先进的生物技术方法,它是一种高效、灵敏、快速、准确和可靠的定性和定量的分析方法。
其原理是利用酶标记抗体或抗原与患者血清中的抗原或抗体结合,再用底物染色产生颜色,进行半定量分析,测定微生物含量。
这种方法不仅可以对酸菜中的发酵防腐乳杆菌进行快速准确地检测,还可以大大降低误判率,提高检测效率。
发酵食品中乳酸菌的功能鉴定与筛选在我们的日常生活中,发酵食品是不可或缺的一部分。
无论是酸奶、酸菜还是啤酒,它们都是通过乳酸菌的发酵作用而产生的。
但是,我们知道乳酸菌不仅仅只有发酵的功能,它还具备着许多其他的益处。
因此,对于发酵食品中乳酸菌的功能鉴定与筛选,具有重要的意义。
功能鉴定是指通过实验和测试,了解乳酸菌在食品中的具体功能和效果。
首先,鉴定乳酸菌的抗菌能力是一项重要的功能。
通过抑制其他有害菌的生长,乳酸菌能够保持食品的卫生安全。
其次,乳酸菌的产酸能力也是功能鉴定的重点之一。
乳酸的产生会使食物呈现出酸性,这不仅有助于保持食品的新鲜度,还能抑制有害菌的生长。
最后,功能鉴定还包括乳酸菌的抗氧化能力、调节肠道菌群平衡等。
当我们完成了乳酸菌的功能鉴定后,接下来就需要进行筛选,以选出优质的乳酸菌菌种。
筛选的方法有很多种,其中最常用的是理化指标法和生物学指标法。
理化指标法主要是通过测定乳酸菌产酸、产气、耐酸和耐热等性能来筛选合适的菌株。
这种方法能够对乳酸菌的基本性质进行初步评估,并快速进行筛选。
而生物学指标法则是通过检测乳酸菌对人体健康的影响来筛选菌种。
例如,观察乳酸菌对肠道菌群平衡的调节效果、对免疫系统的影响等。
这些生物学指标可以更好地衡量乳酸菌菌种的功能和效果。
在功能鉴定和筛选乳酸菌菌种的过程中,我们也需要注意一些问题。
首先,在筛选乳酸菌时,要考虑到乳酸菌的耐受能力。
有一些菌株在强酸或高温条件下表现出较强的耐受能力,这对于发酵食品的质量和储存稳定性都是至关重要的。
其次,在饮食习惯和健康需求方面,也需要进行相应的筛选。
不同的人群对于乳酸菌的需求和反应可能有所不同,因此要选择适合的乳酸菌菌种。
发酵食品中乳酸菌的功能鉴定与筛选,是一个需要科学、精确和细致的过程。
它涉及到食品的质量和安全问题,也关系到人们的健康和生活质量。
因此,在进行功能鉴定和筛选时,我们需要综合考虑多个因素,如抗菌能力、产酸能力、抗氧化能力、调节肠道菌群平衡等。
食品检验中乳酸菌鉴定方法的探讨作者:周卫华来源:《中小企业管理与科技·中旬刊》2018年第06期【摘要】食品检验是关乎人民身体健康与生命安全的重要工作,通过对食品检验标准与方法的不断完善,能够为食品安全与健康提供保障。
论文阐述了乳酸菌及其鉴定的相关理论,简要叙述了目前我国使用的乳酸菌鉴定标准,重点分析了食品检验中不同种类的乳酸菌鉴定方法,旨在明确食品检验中乳酸菌鉴定的地位与鉴定方式,为食品安全检验工作奠定更加丰富的基础。
【Abstract】 Food inspection is an important work related to people's health and safety. Through the continuous improvement of food inspection standards and methods, food safety and health can be guaranteed. The paper expounds the related theory of lactobacillus and its identification, briefly describes the current identification standards of lactobacillus used in China, and mainly analyzes the identification method of different kinds of lactobacillus in food inspection. The purpose of this paper is to clarify the status and identification method of lactobacillus in food inspection, and lay a more abundant foundation for food safety inspection.【关键词】食品检验;乳酸菌;鉴定方法【Keywords】 food inspection; lactobacillus; identification method【中图分类号】TS252.1 【文献标志码】A 【文章编号】1673-1069(2018)06-0169-021 引言乳酸菌种类繁多、应用广泛,目前在保健食品、婴幼儿食品生产中被广泛应用,对乳酸菌种类和水平进行鉴定是保证食品安全的重要前提。
食品检验中乳酸菌的鉴定方法新思考摘要:食品是人们生存不可或缺的重要物品,对人们的身体健康等方面具有重要的影响。
因此需要对食品进行相应的检验,明确其中的成分和含量,从而保障食品的卫生和安全。
其中对乳酸菌进行检定具有重要意义,关于鉴定方法应引起相关工作人员的重视。
关键词:食品检验;乳酸菌;鉴定方法一、研究背景乳酸菌具有较多的种类,并且具有较多的用途。
当前阶段主要广泛应用到婴幼儿的食品以及保健食品中,为保障使用者的身体健康和生命安全,对食品中含有的乳酸菌种类、含量等进行鉴定具有一定的必要性。
通过添加乳酸菌有利于视屏的营养价值提高,并且对食品味道和储藏等具有较好的改善作用,因此其在食品生产行业得到了广泛的应用,并具有较高的应用价值。
乳酸菌具有调节肠道的功能,并且有利于人体血清胆固醇的降低,因此可以起到较好的预防疾病、保障人体健康的作用。
通过对食品中含有的乳酸菌进行鉴定,可以明确乳酸菌的种类及含量,受乳酸菌自身形态的影响,可通过理化特征、生物特征等均分乳酸菌并进行相应的鉴定,从而使乳酸菌的应用符合相关的规定,应用范围具有合理性进而保障其使用功能的充分发挥。
有利于促进食品检验行业的进一步发展,切实保障使用者的身体健康、生命安全。
二、乳酸菌及鉴定相关概述乳酸菌可通过将碳水化合物发酵形成乳酸,本质上是一种细菌,具有较多的种类,并且分布范围相对广泛。
当前已经有上百种的乳酸菌种类被人们所知,其中大部分的种类对人体的肠道运行具有较好的促进作用,并有利于对人体的机能进行调整。
可将乳酸菌分成以下几个类型,即动物源乳酸菌、植物源乳酸菌。
其中植物源乳酸菌更易被人体认可和接受,植物源乳酸菌具有较高的活性,因此应用到人体中发挥的生物功效更具稳定性。
对乳酸菌进行鉴定,主要是依据不同种类的乳酸菌其形态、生物特征和理化特征等方面也不相同,因此通过现代化的方法对其进行检测,便可明确食品中所含的乳酸菌的类型、含量。
当前阶段主要通过以下两种方法对食品中的乳酸菌进行鉴定,其一便是通过生理生化的方法进行鉴定。
1 围本标准规定了含乳酸菌食品中乳酸菌(lactic acid bacteria)的检验方法。
本标准适用于含活性乳酸菌的食品中乳酸菌的检验。
2 规性引用文件本标准中引用的文件对于本标准的应用是必不可少的。
凡是注日期的引用文件,仅所注日期的版本适用于本标准。
凡是不注日期的引用文件,其最新版本(包括所有的修改单)适用于本标准。
3 术语和定义3.1 乳酸菌 lactic acid bacteria一类可发酵糖主要产生大量乳酸的细菌的通称。
本标准中乳酸菌主要为乳杆菌属(Lactob acillus)、双歧杆菌属(Bifidobacterium)和链球菌属(Streptococcus)。
4 设备和材料除微生物实验室常规灭菌及培养设备外,其他设备和材料如下:4.1 恒温培养箱:36 ℃±1 ℃。
4.2 冰箱:2 ℃~5 ℃。
4.3 均质器及无菌均质袋、均质杯或灭菌乳钵。
4.4 天平:感量0.1 g。
4.5 无菌试管:18 mm×180 mm、15 mm×100 mm。
4.6 无菌吸管:1 mL(具0.01 mL刻度)、10 mL(具0.1 mL刻度)或微量移液器及吸头。
4.7 无菌锥形瓶:500 mL、250 mL。
5 培养基和试剂5.1 MRS(Man Rogosa Sharpe)培养基及莫匹罗星锂盐(Li-Mupirocin)改良MRS培养基:见附录A中A.1。
5.2 MC培养基(Modified Chalmers 培养基):见附录A中A.2。
5.3 0.5%蔗糖发酵管:见附录A中A.3。
5.4 0.5%纤维二糖发酵管:见附录A中A.3。
5.5 0.5%麦芽糖发酵管:见附录A中A.3。
5.6 0.5%甘露醇发酵管:见附录A中A.3。
5.7 0.5%水苷发酵管:见附录A中A.3。
5.8 0.5%山梨醇发酵管:见附录A中A.3。
5.9 0.5%乳糖发酵管:见附录A中A.3。
5.10 七叶苷发酵管:见附录A中A.45.11 革兰氏染色液:见附录A中A.5。
5.12莫匹罗星锂盐(Li-Mupirocin):化学纯。
5.13 半胱氨酸盐酸盐(Cysteine Hydrochloride):纯度>99%。
6 检验程序乳酸菌检验程序见图1。
7 操作步骤7.1样品制备7.1.1 样品的全部制备过程均应遵循无菌操作程序。
7.1.2 冷冻样品可先使其在2 ℃~5 ℃条件下解冻,时间不超过18 h,也可在温度不超过4 5 ℃的条件解冻,时间不超过15 min。
7.1.3 固体和半固体食品:以无菌操作称取25 g样品,置于装有225 mL生理盐水的无菌均质杯,于8000 r/min~10000 r/min均质1 min~2 min,制成1:10样品匀液;或置于225 mL生理盐水的无菌均质袋中,用拍击式均质器拍打1 min~2 min制成1:10的样品匀液。
7.1.4 液体样品:液体样品应先将其充分摇匀后以无菌吸管吸取样品25 mL放入装有225 mL生理盐水的无菌锥形瓶(瓶预置适当数量的无菌玻璃珠)中,充分振摇,制成1:10的样品匀液。
7.2 步骤7.2.1 用1 mL无菌吸管或微量移液器吸取1:10样品匀液1 mL,沿管壁缓慢注于装有9 m L生理盐水的无菌试管中(注意吸管尖端不要触及稀释液),振摇试管或换用1支无菌吸管反复吹打使其混合均匀,制成1:100的样品匀液。
7.2.2 另取1 mL无菌吸管或微量移液器吸头,按上述操作顺序,做10倍递增样品匀液,每递增稀释一次,即换用1次1 mL灭菌吸管或吸头。
7.2.3 乳酸菌计数7.2.3.1 乳酸菌总数根据待检样品活菌总数的估计,选择2个~3个连续的适宜稀释度,每个稀释度吸取1 mL样品匀液于灭菌平皿,每个稀释度做两个平皿。
稀释液移入平皿后,将冷却至50℃的M RS琼脂培养基倾注入平皿约15mL,转动平皿使混合均匀。
36℃±1℃厌氧培养48 h±2 h,培养后计数。
从样品稀释到平板倾注要求在15min完成。
7.2.3.2 双歧杆菌计数根据对待检样品双歧杆菌含量的估计,选择2个~3个连续的适宜稀释度,每个稀释度吸取1 mL样品匀液于灭菌平皿,每个稀释度做两个平皿。
稀释液移入平皿后,将冷却至50℃的莫匹罗星锂盐和半胱氨酸盐酸盐的MRS培养基倾注入平皿约15mL,转动平皿使混合均。
36℃±1℃厌氧培养48 h±2 h,培养后计数平板上的所有菌落数。
从样品稀释到平板倾注要求在15 min完成。
7.2.3.3 嗜热链球菌计数根据待检样品嗜热链球菌活菌数的估计,选择2个~3个连续的适宜稀释度,每个稀释度吸取1 mL样品匀液于灭菌平皿,每个稀释度做两个平皿。
稀释液移入平皿后,将冷却至50℃的MC培养基倾注入平皿约15mL,转动平皿使混合均匀。
36℃±1℃需氧培养48 h±2h,培养后计数。
嗜热链球菌在MC琼脂平板上的菌落特征为:菌落中等偏小,边缘整齐光滑的红色菌落,直径2 mm±1 mm,菌落背面为粉红色。
从样品稀释到平板倾注要求在15 min完成。
7.2.3.4 乳杆菌计数7.2.3.1 项乳酸菌总数结果减去7.2.3.2 项双歧杆菌与7.2.3.3 项嗜热链球菌计数结果之和即得乳杆菌计数。
7.3 菌落计数可用肉眼观察,必要时用放大镜或菌落计数器,记录稀释倍数和相应的菌落数量。
菌落计数以菌落形成单位(colony-forming units,CFU)表示。
7.3.1 选取菌落数在30 CFU~300 CFU之间、无蔓延菌落生长的平板计数菌落总数。
低于30 CFU的平板记录具体菌落数,大于300 CFU的可记录为多不可计。
每个稀释度的菌落数应采用两个平板的平均数。
7.3.2 其中一个平板有较大片状菌落生长时,则不宜采用,而应以无片状菌落生长的平板作为该稀释度的菌落数;若片状菌落不到平板的一半,而其余一半中菌落分布又很均匀,即可计算半个平板后乘以2,代表一个平板菌落数。
7.3.3 当平板上出现菌落间无明显界线的链状生长时,则将每条单链作为一个菌落计数。
7.4 结果的表述7.4.1 若只有一个稀释度平板上的菌落数在适宜计数围,计算两个平板菌落数的平均值,再将平均值乘以相应稀释倍数,作为每g(mL)中菌落总数结果。
7.4.2 若有两个连续稀释度的平板菌落数在适宜计数围时,按公式(1)计算:式中:N——样品中菌落数;∑C——平板(含适宜围菌落数的平板)菌落数之和;n1——第一稀释度(低稀释倍数)平板个数;n2——第二稀释度(高稀释倍数)平板个数;d——稀释因子(第一稀释度)。
7.4.3 若所有稀释度的平板上菌落数均大于300 CFU,则对稀释度最高的平板进行计数,其他平板可记录为多不可计,结果按平均菌落数乘以最高稀释倍数计算。
7.4.4 若所有稀释度的平板菌落数均小于30 CFU,则应按稀释度最低的平均菌落数乘以稀释倍数计算。
7.4.5 若所有稀释度(包括液体样品原液)平板均无菌落生长,则以小于1乘以最低稀释倍数计算。
7.4.6 若所有稀释度的平板菌落数均不在30 CFU~300 CFU之间,其中一部分小于30 CFU 或大于300 CFU时,则以最接近30 CFU或300 CFU的平均菌落数乘以稀释倍数计算。
7.5 菌落数的报告7.5.1 菌落数小于100 CFU时,按“四舍五入”原则修约,以整数报告。
7.5.2 菌落数大于或等于100 CFU时,第3位数字采用“四舍五入”原则修约后,取前2位数字,后面用0代替位数;也可用10的指数形式来表示,按“四舍五入”原则修约后,采用两位有效数字。
7.5.3 称重取样以CFU/g为单位报告,体积取样以CFU/mL为单位报告。
8 结果与报告根据菌落计数结果出具报告,报告单位以CFU/g(mL)表示。
9 乳酸菌的鉴定(可选做)9.1 纯培养挑取3个或以上单个菌落,嗜热链球菌接种于MC琼脂平板,乳杆菌属接种于MRS琼脂平板,置36 ℃±1 ℃厌氧培养48 h。
9.2 鉴定9.2.1 双歧杆菌的鉴定按GB 4789.34的规定操作。
9.2.2 涂片镜检:乳杆菌属菌体形态多样,呈长杆状、弯曲杆状或短杆状。
无芽胞,革兰氏染色阳性。
嗜热链球菌菌体呈球形或球杆状,直径为0.5 μm~2.0 μm,成对或成链排列,无芽胞,革兰氏染色阳性。
9.2.3 乳酸菌菌种主要生化反应见表1和表2。
附录 A培养基及试剂A.1 MRS培养基A.1.1 成分蛋白胨10.0 g 牛肉粉 5.0 g 酵母粉 4.0 g 葡萄糖20.0 g 吐温80 1.0 mL K2HPO4·7H2O 2.0 g 醋酸钠·3H2O 5.0 g 柠檬酸三铵 2.0 g MgSO4·7H2O0.2 g MnSO4·4H2O0.05 g 琼脂粉15.0 gA.1.2 制法将上述成分加入到1 000 mL蒸馏水中,加热溶解,调节pH,分装后121 ℃高压灭菌15 min~20 min。
A.1.3 莫匹罗星锂盐和半胱氨酸盐酸盐改良MRS培养基A.1.3.1 莫匹罗星锂盐储备液制备:称取50mg莫匹罗星锂盐加入到50 mL蒸馏水中,用0.22 μm微孔滤膜过滤除菌。
A.1.3.2半胱氨酸盐酸盐储备液制备:称取250mg莫匹罗星锂盐加入到50 mL蒸馏水中,用0.22 μm微孔滤膜过滤除菌。
A.1.3.2 制法将A.1.1 成分加入到950 mL蒸馏水中,加热溶解,调节pH,分装后121 ℃高压灭菌1 5 min~20 min。
临用时加热熔化琼脂,在水浴中冷至48 ℃,用带有0.22 μm微孔滤膜的注射器将莫匹罗星锂盐储备液及半胱氨酸盐酸盐储备液制备加入到熔化琼脂中,使培养基中莫匹罗星锂盐的浓度为50 μg/mL,半胱氨酸盐酸盐的浓度为500μg/mL。
A.2 MC培养基A.2.1 成分大豆蛋白胨 5.0 g牛肉粉 3.0 g酵母粉 3.0 g葡萄糖20.0 g乳糖20.0 g碳酸钙10.0 g琼脂15.0 g蒸馏水 1 000 mL1%中性红溶液5.0 mLpH6.0A.2.2 制法将前面7种成分加入蒸馏水中,加热溶解,调节pH,加入中性红溶液。
分装后121 ℃高压灭菌15 min~20 min。
A.5.1.2 制法将结晶紫完全溶解于乙醇中,然后与草酸铵溶液混合。
A.5.2.2 制法将碘与碘化钾先进行混合,加入蒸馏水少许充分振摇,待完全溶解后,再加蒸馏水至300 mL。
A.5.3 沙黄复染液A.5.3.1 成分沙黄0.25 g95%乙醇10 mL蒸馏水90 mLA.5.3.2 制法将沙黄溶解于乙醇中,然后用蒸馏水稀释。