4-0.2M碳酸钠溶液配制操作规程
- 格式:docx
- 大小:14.10 KB
- 文档页数:2

配制500ml,0.1mol/l碳酸钠溶液步骤及注意事项所需的仪器:烧杯、容量瓶、玻璃棒、胶头滴管、分析天平、药匙、量筒步骤:第一步:计算:所需碳酸钠的质量=0.5*0.1*106=5.3克。
第二步:称量:在天平上称量5.3克碳酸钠固体,并将它倒入小烧杯中。
第三步:溶解:在盛有碳酸钠固体的小烧杯中加入适量蒸馏水,用玻璃棒搅拌,使其溶解。
第四步:移液:将溶液沿玻璃棒注入500ml容量瓶中。
第五步:洗涤:用蒸馏水洗烧杯2—3次,并倒入容量瓶中。
第六步:定容:倒水至刻度线1—2cm处改用胶头滴管滴到与凹液面平直。
第七步:摇匀:盖好瓶塞,上下颠倒、摇匀。
第八步:装瓶、贴签。
误差分析:固体药品的称量与液体药品的量取是否准确;把溶液向容量瓶中转移,溶液洒了;未洗涤烧杯和玻璃棒;用待配液润洗了容量瓶;定容时水加多了或加少了;定容时未平视刻度线。
仰视、俯视对溶液浓度有何影响?★俯视刻度线,实际加水量未到刻度线,使溶液的物质的量浓度增大;★仰视刻度线,实际加水量超过刻度线,使溶液的物质的量浓度减小。
三、容量瓶的使用六忌:★一忌用容量瓶进行溶解(体积不准确)★二忌直接往容量瓶倒液(洒到外面)★三忌加水超过刻度线(浓度偏低)★四忌读数仰视或俯视(仰视浓度偏低,俯视浓度偏高)★五忌不洗涤玻璃棒和烧杯(浓度偏低)★六忌标准液存放于容量瓶(容量瓶是量器,不是容器)1 mol/L的氢氧化钠溶液250mL,完成下列步骤:①用天平称取氢氧化钠固体克。
②将称好的氢氧化钠固体放入烧杯中加少量蒸馏水将其溶解,待完全溶解后将溶液沿玻璃棒移入250mL的容量瓶中。
③用少量蒸馏水冲洗2-3次,将冲洗液移入容量瓶中,在操作过程中不能损失点滴液体,否则会使溶液的浓度偏低。
④向容量瓶内加水至刻度线1-2cm时,改用胶头滴管小心地加水至溶液凹液面与刻度线相切,若加水超过刻度线,会造成溶液浓度偏低应该重新配制。
⑤最后盖好瓶盖,摇匀,将配好的溶液移入试剂瓶中贴好标签。

常用缓冲液的配置方法缓冲液是一种能在加入少量酸或碱时抵抗pH改变的溶液。
PH缓冲系统对维持生物的正常pH值,正常生理环境起重要作用。
多数细胞仅能在很窄的pH范围内进行活动,而且需要有缓冲体系来抵抗在代谢过程中出现的pH变化。
在生物体中有三种主要的pH缓冲体系,它们时蛋白质、重碳酸盐缓冲体系。
每种缓冲体系所占的分量在各类细胞和器官中是不同的。
在生化研究工作中,常常要用到缓冲溶液来维持实验体系的酸碱度。
研究工作的溶液体系pH值的变化往往直接影响到我们工作的成效。
如果提取酶实验体系的pH值变化或变化过大,会使酶活性下降甚至完全失活。
所以我们要学会配制缓冲溶液。
由弱酸及其盐组合一起使具有缓冲作用。
生化实验室常常用的缓冲系主要有磷酸、柠檬酸、碳酸、醋酸、巴比妥酸、Tiris(三羟甲基氨基甲烷)等系统,在生化实验或研究工作中要慎重地选择缓冲体系,因为有时影响实验结果的因素并不是缓冲液的pH值,而是缓冲液中的某种离子。
如硼酸盐、柠檬酸盐、磷酸盐和三羟甲基甲烷等缓冲剂都可能产生不需要的反应。
硼酸盐:硼酸盐与许多化合物形成复盐、如蔗糖。
柠檬酸盐:柠檬酸盐离子容易与钙结合,所以存在有钙离子的情况下不能使用。
磷酸盐:在有些实验,它是酶的抑止剂或甚至是一个代谢物,重金属易以磷酸盐的形式从溶液中沉淀出来。
而且它在pH7.5以上时缓冲能力很小。
三羟甲基氨基甲烷:它可以和重金属一起作用,但在有些系统中也起抑止的作用。
其主要缺点时温度效应。
这点往往被忽视,在室温pH是7.8的Tris一缓冲液,在4℃时是8.4,在37℃时是7.4,因此,4℃配制的缓冲液拿到37℃测量时,其氢离子浓度就增加了10倍。
而且它在pH7.5以下,缓冲能力很差。
缓冲液的pH值由哪些因素决定?设缓冲系统的弱酸的电离常数为K(平衡常数),平衡时弱酸的浓度为[酸],弱酸盐的浓度为[盐],则由弱酸的电离平衡式可得下式:根据此式可得出下列几点结论:(1)缓冲液的pH值与该酸的电离平衡常数K及盐和酸的浓度有关。
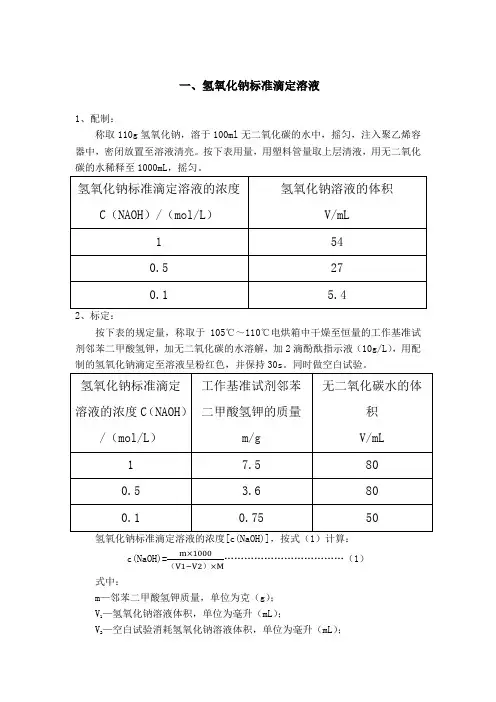
一、氢氧化钠标准滴定溶液1、配制:称取110g氢氧化钠,溶于100ml无二氧化碳的水中,摇匀,注入聚乙烯容器中,密闭放置至溶液清亮。
按下表用量,用塑料管量取上层清液,用无二氧化碳的水稀释至1000mL,摇匀。
2、标定:按下表的规定量,称取于105℃~110℃电烘箱中干燥至恒量的工作基准试剂邻苯二甲酸氢钾,加无二氧化碳的水溶解,加2滴酚酞指示液(10g/L),用配制的氢氧化钠滴定至溶液呈粉红色,并保持30s。
同时做空白试验。
氢氧化钠标准滴定溶液的浓度[c(NaOH)],按式(1)计算:c(NaOH)= (1)()式中:m—邻苯二甲酸氢钾质量,单位为克(g);—氢氧化钠溶液体积,单位为毫升(mL);V1—空白试验消耗氢氧化钠溶液体积,单位为毫升(mL);V2M—邻苯二甲酸氢钾的摩尔质量,单位为克每摩尔(g/mol)[M(KHC8H4O4)=204.22]二、盐酸标准滴定溶液1、配制:按下表规定量,量取盐酸,注入1000mL水中,摇匀。
2、标定按下表规定量,称取于270℃~300℃高温炉中灼烧至恒量的工作基准试剂无水碳酸钠,溶于50mL水中,加10滴溴甲酚绿-甲基红指示液,用配制的盐酸溶液滴定至溶液由绿色变为暗红色,煮沸2min,加盖具钠石灰管的橡胶塞,冷却,继续滴定至溶液再呈暗红色。
同时做空白试验。
盐酸标准滴定溶液的浓度c[HCl],按式(2)计算:c(HCl)=() (2)式中:m—无水碳酸钠质量,单位为克(g);V1—盐酸溶液体积,单位为毫升(mL);V2—空白试验消耗盐酸溶液体积,单位为毫升(mL);M—无水碳酸钠的摩尔质量,单位为克每摩尔(g/mol)[M(1/2Na2CO3)=52.994]三、硫酸标准滴定溶液1、配制:按下表规定量,量取硫酸,缓缓注入1000mL水中,冷却,摇匀。
2、标定按下表规定量,称取于270℃~300℃高温炉中灼烧至恒量的工作基准试剂无水碳酸钠,溶于50mL水中,加10滴溴甲酚绿-甲基红指示液,用配制的硫酸溶液滴定至溶液由绿色变为暗红色,煮沸2min,加盖具钠石灰管的橡胶塞,冷却,继续滴定至溶液再呈暗红色。

中华人民共和国国家标准UDC 543.06:54 —41GB 601—2002化学试剂滴定分析(容量分析)用标准溶液的制备Chemical reagentPreparations of standard volumetrie solutions1主题内容与适用范围本标准规定了滴定分析(容量分析)用标准溶液的配制和标定方法。
本标准适用于制备准确浓度之溶液,应用于滴定法测定化学试剂的主体含量及杂质含量,也可供其他的化学产品标准选用。
2引用标准GB 603 化学试剂试验方法中所用制剂及制品的制备GB 6682 实验室用水规格GB 9725 化学试剂电位滴定法通则3一般规定本标准中所用的水,在没有注明其他要求时,应符合GB6682中三级水的标准。
本标准中所用试剂的纯度应在分析纯以上。
工作中所用的分析天平的砝码、滴定管、容量瓶及移液管均需定期校正。
本标准中标定时所用的基准试剂为容量分析工作基准试剂;制备标准溶液是所用的试剂为分析纯以上试剂。
本标准中所制备的标准溶液的浓度均指20c时的浓度。
在标定和使用时,如温度有差异,应只能附录A(补充件)补正。
“标定”或“比较”标准溶液浓度时,平行试验不得少于8次,两人各作4平行,每人4平行测定结果的极差与平均值之比不得大于0.1%。
两人测定结果的差值与平均值之比不得大于0.1%,最终取两人测定结果的平均值。
浓度值取四位有效数字。
本标准中凡规定用“标定”和“比较”两种方法测定浓度时,不得略去其中的任何一种,且两种方法测得的浓度值之差值与平均值之比不得大于0.2%,最终以标定结果为准。
制备的标准溶液与规定浓度之差不得超出规定浓度的+—5%。
配制浓度等于或低于0.02mol/L 标准溶液时乙二胺四乙酸二钠标准滴定溶液除外,应于临用前将浓度高的标准溶液用煮沸并冷却的水稀释,必要时重新标定。
碘量法反应时,溶液的温度不能过高,一般在15~20c之间进行滴定。
滴定分析(容量分析)用标准溶液在常温(15~25)下,保存时间一般不得超过两个月。

制药企业用滴定液的配制及标定标准操作规程1.目的建立滴定液的配制及标定标准操作规程,并按规程进行操作,保证操作规范性与正确性。
2. 依据《中华人民共和国药典》2015年版四部通则8006。
3.范围4.责5. 内5.1? 4?5.2?5.3?5.3.1 ?5.3.2 ?5.4滴定液的配制方法有间接配制法与直接配制法两种,应根据规定选用,并应遵循下列有关规定。
?5.4.1所用溶剂“水”,系指蒸馏水或去离子水,在未注明有其他要求时,应符合《中国药典》“纯化水”项下的规定。
?5.4.2采用间接配制法时,溶质与溶剂的取用量均应根据规定量进行称取或量取,并且制成后滴定液的浓度值应为其名义值的0.95~1.05;如在标定中发现其浓度值超出其名义值的0.95~1.05范围时,应加人适量的溶质或溶剂予以调整。
当配制量大于1000ml时,其溶质与溶剂的取用量均应按比例增加。
?5.4.3采用直接配制法时,其溶质应采用“基准试剂”,并按规定条件干燥至恒重后称取,取用量应为精密称定(精确至4?~5?位有效数字),并置1000ml量瓶中,加溶剂溶解并稀释至刻度,摇匀。
配制过程中应有核对人,并在记录中签名以示负责。
?5.4.4配制浓度等于或低于0.02?mol?/?L的滴定液时,除另有规定外,应于临用前精密量取浓度等于或大于0.?l?mol?/?L的滴定液适量,加新沸过的冷水或规定的溶剂定量稀释制成。
? 5.4.?5?配制成的滴定液必须澄清,必要时可滤过;并按药典中各该滴定液项下的[贮藏]条件贮存,经下述标定其浓度后方可使用。
?5.5? 5.5.1?5.5.2?5.5.3,其5.5.45.5.5于20ml5.5.6滴定所得的结果。
?5.5.7标定工作应由初标者(一般为配制者)和再标者在相同条件下各作平行试验3?份,各项原始数据经校正后,根据计算公式分别进行计算:3?份平行试验结果的相对平均偏差,除另有规定外,不得大于0.1?%?;初标平均值和复标平均值的相对偏差也不得大于0.1%;?标定结果按初、复标的平均值计算,取4?位有效数字。
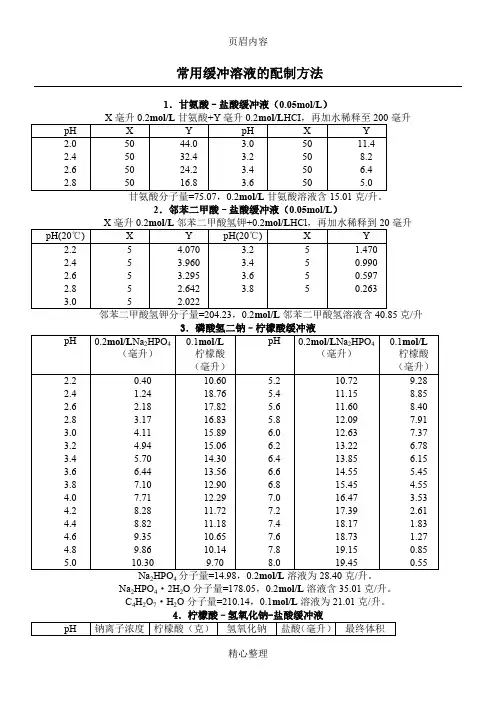
常用缓冲溶液的配制方法
1.甘氨酸–盐酸缓冲液(0.05mol/L)
毫升
24
Na2HPO4·2H2O分子量=178.05,0.2mol/L溶液含35.01克/升。
C4H2O7·H2O分子量=210.14,0.1mol/L溶液为21.01克/升。
????
22
7.磷酸盐缓冲液
毫升。
2472
硼酸H 2BO 3,分子量=61.84,0.2M 溶液为12.37克/升。
硼砂易失去结晶水,必须在带塞的瓶中保存。
克/升。
2472
硼酸H2BO3,分子量=61.84,0.2M溶液为12.37克/升。
硼砂易失去结晶水,必须在带塞的瓶中保存。
12.甘氨酸–氢氧化钠缓冲液(0.05M)
1)pH4,邻苯二甲酸氢钾标准缓冲液:
精密称取在115±5℃干燥2~3小时的邻苯二甲酸氢钾[KHC8H4O4]10.12g,加水使溶解并稀释至
1000ml。
2)pH7,磷酸盐标准缓冲液(pH7.4):
精密称取在115±5℃干燥2~3小时的无水磷酸氢二钠4.303g与磷酸二氢钾1.179g,加水使溶解并
稀释至1000ml。
另补充:磷酸盐标准缓冲液(pH6.8)精密称取在115±5℃干燥2~3小时的无水磷酸氢二钠3.533g与磷酸二氢钾3.387g,加水使溶解并稀释至1000ml。
3)pH9,硼砂标准缓冲液:
精密称取硼砂[Na2B4O7·10H2O]3.80g(注意:避免风化),加水使溶解并稀释至1000ml,置聚乙烯
塑料瓶中,密塞,避免与空气中二氧化碳接触。
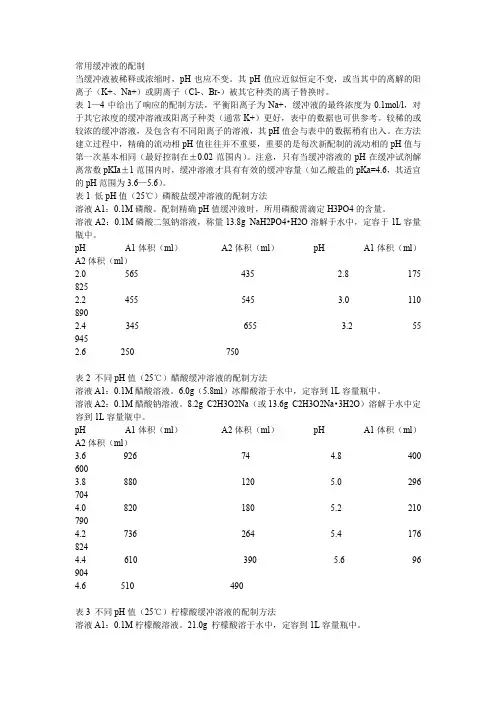
常用缓冲液的配制当缓冲液被稀释或浓缩时,pH也应不变。
其pH值应近似恒定不变,或当其中的离解的阳离子(K+、Na+)或阴离子(Cl-、Br-)被其它种类的离子替换时。
表1—4中给出了响应的配制方法,平衡阳离子为Na+,缓冲液的最终浓度为0.1mol/l,对于其它浓度的缓冲溶液或阳离子种类(通常K+)更好,表中的数据也可供参考。
较稀的或较浓的缓冲溶液,及包含有不同阳离子的溶液,其pH值会与表中的数据稍有出入。
在方法建立过程中,精确的流动相pH值往往并不重要,重要的是每次新配制的流动相的pH值与第一次基本相同(最好控制在±0.02范围内)。
注意,只有当缓冲溶液的pH在缓冲试剂解离常数pKIa±1范围内时,缓冲溶液才具有有效的缓冲容量(如乙酸盐的pKa=4.6,其适宜的pH范围为3.6—5.6)。
表1 低pH值(25℃)磷酸盐缓冲溶液的配制方法溶液A1:0.1M磷酸。
配制精确pH值缓冲液时,所用磷酸需滴定H3PO4的含量。
溶液A2:0.1M磷酸二氢钠溶液,称量13.8g NaH2PO4•H2O溶解于水中,定容于1L容量瓶中。
pH A1体积(ml)A2体积(ml)pH A1体积(ml)A2体积(ml)2.0 565 435 2.8 175 8252.2 455 5453.0 110 8902.4 345 6553.2 55 9452.6 250 750表2 不同pH值(25℃)醋酸缓冲溶液的配制方法溶液A1:0.1M醋酸溶液。
6.0g(5.8ml)冰醋酸溶于水中,定容到1L容量瓶中。
溶液A2:0.1M醋酸钠溶液。
8.2g C2H3O2Na(或13.6g C2H3O2Na•3H2O)溶解于水中定容到1L容量瓶中。
pH A1体积(ml)A2体积(ml)pH A1体积(ml)A2体积(ml)3.6 926 744.8 400 6003.8 880 120 5.0 296 7044.0 820 1805.2 210 7904.2 736 2645.4 176 8244.4 610 3905.6 96 9044.6 510 490表3 不同pH值(25℃)柠檬酸缓冲溶液的配制方法溶液A1:0.1M柠檬酸溶液。


药液配制标准1前言为了规范实验室药液配制标准,使之能更好的为教学服务,使之符合教学的规定。
2合用范围本标准合用于公司生产检测及分析化验所用的化学试剂的配制。
3引用标准GB601-88 《化学试剂滴定分析用标准药液的制备》《制浆造纸分析与检查》附录指示剂的配制《制浆造纸分析与检查》附录不同pH值缓冲溶液的配制4药液配制标准4.1 0.5mol/L,0.1mol/L盐酸标准溶液0.5mol/L,0.1mol/L盐酸标准溶液是指1升中具有18.3g,3.65g HCl。
4.11盐酸体积的计算V HCl=G/(1.19×0.38)式中: G ——盐酸重量(g);1.19——浓盐酸比重;0.38——浓盐酸的百分含量。
4.12 0.5mol/L配制和标定方法配制方法:配制0.5mol/L盐酸标准溶液,量取840ml盐酸(比重1.19)稀释至20230ml,摇匀备用。
标定方法:称取1.0000g左右于270~300℃干燥至恒重的基准无水碳酸钠(称准至0.0002g)溶于100ml蒸馏水中,加入1~2滴甲基红-溴甲酚绿指示剂,用待标定的盐酸标准溶液滴定至恰显酒红色。
C HCl=m/(V × 0.05299)式中: m——基准无水碳酸钠量(g);V——盐酸标准溶液用量(ml);0.05299—与1毫升盐酸标准溶液相称的NaCO3的质量(g)4.13 0.1mol/L配制和标定方法配制方法:配制0.1mol/L盐酸标准溶液:量取0.5mol/L盐酸4000ml,用蒸馏水稀释至20230ml,摇匀待用。
标定方法:称取0.2023g左右已于270~300℃干燥至恒重的基准无水碳酸钠(称准至0.0002g)溶于100ml蒸馏水中,加入1~2滴甲基红-溴甲酚绿指示剂,用待标定的盐酸标准溶液滴定至恰显酒红色。
C HCl=m/(V×0.05299)式中: m——基准无水碳酸钠量(g);V——盐酸标准溶液用量(ml);0.05299—与1毫升盐酸标准溶液相称的NaCO3的量(g).4.2硫酸的配制2mol/L硫酸标准溶液是指1升中具有196g H2SO4。

1范围本规程适用于标准溶液的配制与标定2规范性引用文件下列标准中的条款通过本标准的引用而成为本标准的条款。
GB/T603化学试剂试验方法中所用制剂及制品的制备GB/T6682分析实验室用水规格和试验方法GB/T9725化学试剂电位滴定法通则3一般规定3.1除另有规定外,本规程所用试剂的级别应在分析纯(含分析纯)以上,所用制剂及制品,应按GB/T603的规定制备,实验用水应符合GB/T6682中三级水的规格。
3.2本规程制备标准滴定溶液的浓度,除高氯酸标准滴定溶液、盐酸-乙醇标准滴定溶液、)=0.5mol/L]外,均指20℃时的浓度;在标准滴定溶液标亚硝酸钠标准滴定溶液[c(NaNO2定、直接制备和使用时若温度不为20℃时,应对标准滴定溶液体积进行补正。
规定“临用前标定”的标准滴定溶液,若标定和使用时的温度差异不大时,可以不进行补正。
标准滴定溶液标定、直接制备和使用时所用分析天平、滴定管、单标线容量瓶、单标线吸管等按相关检定规程定期进行检定或校准。
3.3在标定和使用标准滴定溶液时,滴定速度一般应保持在6-8mL/min。
3.4称量工作基准试剂的质量小于或等于0.5g时,按精确至0.01mg称量;大于0.5g时,按精确至0.1mg称量。
3.5制备标准滴定溶液的浓度应在规定浓度的±5%范围以内。
3.6除另有规定外,标定标准滴定溶液的浓度时,需两人进行实验,分别做四平行,每人四平行标定结果相对极差不得大于相对重复性临界极差[CR(4)r=0.15%],两人共八平行标0.95(8)r=0.18%]。
在运算过程中保留5位定结果相对极差不得大于相对重复性临界极差[CR0.95有效数字,取两人八平行标定结果的平均值为标定结果,报出结果取4位有效数字。
3.7本规程中标准滴定溶液浓度的相对扩展不确定度不大于0.2%(k=2)。
3.8本规程使用工作基准试剂标定标准滴定溶液的浓度;当对标准滴定溶液浓度的准确度有更高要求时,可使用标准物质(扩展不确定度应小于0.05%)代替工作基准试剂进行标定或直接制备,并在计算标准滴定溶液浓度时,将其质量分数代入计算式中。

化验室常用试剂(溶液)配制标准操作规程1 制定目的为使试剂(溶液)配制操作标准化,特建立本操作规程。
2 适用范围本操作规程适用于化验室常用试剂(溶液)的配制。
3 职责3.1 QA及管理人员负责监督其实施情况。
4 规程细则4.1 氢氧化钠滴定液(1mol/L、0.5mol/L或0.1mol/L)4.1.1 取氢氧化钠适量,加水振摇使溶解成饱和溶液,冷却后,置聚乙烯塑料瓶中,静置数日,澄清后备用。
4.1.2 氢氧化钠滴定液(1mol/L):取澄清的氢氧化钠饱和溶液56ml,加新沸过的冷水使成1000ml,摇匀。
4.1.3 氢氧化钠滴定液(0.5mol/L):取澄清的氢氧化钠饱和溶液28ml,加新沸过的冷水使成1000ml,摇匀。
4.1.4 氢氧化钠滴定液(0.1mol/L):取澄清的氢氧化钠饱和溶液5.6ml,加新沸过的冷水使成1000ml,摇匀。
4.1.5 标定4.1.5.1 氢氧化钠滴定液(1mol/L):取在105℃干燥至恒重的基准邻苯二甲酸氢钾约6g,精密称定,加新沸过的冷水50ml,振摇,使其尽量溶解;加酚酞指示液2滴,用本液滴定;在接近终点时,应使邻苯二甲酸氢钾完全溶解,滴定至溶液显粉红色。
每1ml氢氧化钠滴定液(1mol/L )相当于204.2mg 的邻苯二甲酸氢钾。
根据本液的消耗量与邻苯二甲酸氢钾的取用量,算出本液的浓度,即得。
4.1.5.2 氢氧化钠滴定液(0.5mol/L ):取在105℃干燥至恒重的基准邻苯二甲酸氢钾约3g ,照4.1.5.1标定。
每1ml 氢氧化钠滴定液(0.5mol/L )相当于102.1mg 的邻苯二甲酸氢钾。
4.1.5.3 氢氧化钠滴定液(0.1mol/L )取在105℃干燥至恒重的基准邻苯二甲酸氢钾约0.6g ,照4.1.5.1标定。
每1ml 氢氧化钠滴定液(0.1mol/L )相当于20.42mg 的邻苯二甲酸氢钾。
4.1.5.4 如需用氢氧化钠滴定液(0.05mol/L 、0.02mol/L 或0.01mol/L )时,可取氢氧化钠滴定液(0.1mol/L )加新沸过的冷水稀释制成。
常见缓冲溶液配制方法乙醇-醋酸铵缓冲液(pH3.7):取5mol/L醋酸溶液15.0ml,加乙醇60ml和水20ml,用10mol/L氢氧化铵溶液调节pH值至3.7,用水稀释至1000ml。
三羟甲基氨基甲烷缓冲液(pH8.0):取三羟甲基氨基甲烷12.14g,加水800ml,搅拌溶解,并稀释至1000ml,用6mol/L盐酸溶液调节pH值至8.0。
三羟甲基氨基甲烷缓冲液(pH8.1):取氯化钙0.294g,加0.2mol/L三羟甲基氨基甲烷溶液40ml使溶解,用1mol/L盐酸溶液调节pH值至8.1,加水稀释至100ml。
三羟甲基氨基甲烷缓冲液(pH9.0):取三羟甲基氨基甲烷6.06g,加盐酸赖氨酸3.65g,氯化钠5.8g,乙二胺四醋酸二钠0.37g,再加水溶解使成1000ml,调节pH值至9.0。
乌洛托品缓冲液:取乌洛托品75g,加水溶解后,加浓氨溶液4.2ml,再用水稀释至250ml。
巴比妥缓冲液(pH7.4):取巴比妥钠4.42g,加水使溶解并稀释至400ml,用2mol/L盐酸溶液调节pH 值至7.4,滤过。
巴比妥缓冲液(pH8.6):取巴比妥5.52g与巴比妥钠30.9g,加水使溶解成2000ml。
巴比妥-氯化钠缓冲液(pH7.8):取巴比妥钠5.05g,加氯化钠3.7g及水适量使溶解,另取明胶0.5g 加水适量,加热溶解后并入上述溶液中。
然后用0.2mol/L盐酸溶液调节pH值至7.8,再用水稀释至500ml。
甲酸钠缓冲液(pH3.3):取2mol/L甲酸溶液25ml,加酚酞指示液1滴,用2mol/L氢氧化钠溶液中和,再加入2mol/L甲酸溶液75ml,用水稀释至200ml,调节pH值至3.25~3.30。
邻苯二甲酸盐缓冲液(pH5.6):取邻苯二甲酸氢钾10g,加水900ml,搅拌使溶解,用氢氧化钠试液(必要时用稀盐酸)调节pH值至5.6,加水稀释至1000ml,混匀。
枸橼酸盐缓冲液:取枸橼酸4.2g,加1mol/L的20%乙醇制氢氧化钠溶液40ml使溶解,再用20%乙醇稀释至100ml。
常用缓冲溶液的配制方法1.甘氨酸–盐酸缓冲液(0.05mol/L)2.邻苯二甲酸–盐酸缓冲液(0.05 mol/L)邻苯二甲酸氢钾分子量= 204.23,0.2 mol/L邻苯二甲酸氢溶液含40.85克/升3.磷酸氢二钠–柠檬酸缓冲液24Na2HPO4·2H2O分子量= 178.05,0.2 mol/L溶液含35.01克/升。
C4H2O7·H2O分子量= 210.14,0.1 mol/L溶液为21.01克/升。
4.柠檬酸–氢氧化钠-盐酸缓冲液① 使用时可以每升中加入1克克酚,若最后pH 值有变化,再用少量50% 氢氧化钠溶液或浓盐酸调节,冰箱保存。
5.柠檬酸–柠檬酸钠缓冲液(0.1 mol/L )6872柠檬酸钠Na 3 C 6H 5O 7·2H 2O :分子量294.12,0.1mol/L 溶液为29.41克/毫升。
6.乙酸–乙酸钠缓冲液(0.2 mol/L )Na 2Ac·3H 2O 分子量 = 136.09,0.2 mol/L 溶液为27.22克/升。
7.磷酸盐缓冲液(1)磷酸氢二钠–磷酸二氢钠缓冲液(0.2)242Na2HPO4·12H2O分子量= 358.14,0.2 mol/L溶液为71.628克/升。
NaH2PO4·2H2O分子量= 156.01,0.2 mol/L溶液为31.202克/升。
磷酸盐是生物化学研究中使用最广泛的一种缓冲剂,由于它们是二级解离,有二个pKa 值,所以用它们配制的缓冲液,pH 范围最宽:NaH2PO4:pKa1=2.12,pKa2=7.21;Na2HPO4:pKa1=7.21,pKa2=12.32配酸性缓冲液:用NaH2PO4,pH=1~4,配中性缓冲液:用混合的两种磷酸盐,pH=6~8,配碱性缓冲液:用Na2HPO4,pH=10~12。
用钾盐比钠盐好,因为低温时钠盐难溶,钾盐易溶,但若配制SDS-聚丙烯酰胺凝胶电泳的缓冲液时,只能用磷酸钠而不能用磷酸钾,因为SDS(十二烷基硫酸钠)会与钾盐生成难溶的十二烷基硫酸钾。
(完整)最全常见缓冲溶液配制方法编辑整理:尊敬的读者朋友们:这里是精品文档编辑中心,本文档内容是由我和我的同事精心编辑整理后发布的,发布之前我们对文中内容进行仔细校对,但是难免会有疏漏的地方,但是任然希望((完整)最全常见缓冲溶液配制方法)的内容能够给您的工作和学习带来便利。
同时也真诚的希望收到您的建议和反馈,这将是我们进步的源泉,前进的动力。
本文可编辑可修改,如果觉得对您有帮助请收藏以便随时查阅,最后祝您生活愉快业绩进步,以下为(完整)最全常见缓冲溶液配制方法的全部内容。
常见缓冲溶液配制方法乙醇-醋酸铵缓冲液(pH3。
7):取5mol/L醋酸溶液15.0ml,加乙醇60ml和水20ml,用10mol/L氢氧化铵溶液调节pH值至3。
7,用水稀释至1000ml。
三羟甲基氨基甲烷缓冲液(pH8。
0):取三羟甲基氨基甲烷12。
14g,加水800ml,搅拌溶解,并稀释至1000ml,用6mol/L盐酸溶液调节pH值至8。
0。
三羟甲基氨基甲烷缓冲液(pH8。
1):取氯化钙0。
294g,加0。
2mol/L三羟甲基氨基甲烷溶液40ml使溶解,用1mol/L盐酸溶液调节pH值至8。
1,加水稀释至100ml。
三羟甲基氨基甲烷缓冲液(pH9.0):取三羟甲基氨基甲烷6.06g,加盐酸赖氨酸3.65g,氯化钠5。
8g,乙二胺四醋酸二钠0.37g,再加水溶解使成1000ml,调节pH值至9。
0.乌洛托品缓冲液:取乌洛托品75g,加水溶解后,加浓氨溶液4.2ml,再用水稀释至250ml。
巴比妥缓冲液(pH7。
4):取巴比妥钠4.42g,加水使溶解并稀释至400ml,用2mol/L盐酸溶液调节pH值至7。
4,滤过。
巴比妥缓冲液(pH8。
6):取巴比妥5.52g与巴比妥钠30.9g,加水使溶解成2000ml。
巴比妥-氯化钠缓冲液(pH7。
8):取巴比妥钠5.05g,加氯化钠3。
7g及水适量使溶解,另取明胶0.5g加水适量,加热溶解后并入上述溶液中。
常⽤缓冲溶液配制1、选择合适的缓冲对:原则是所选缓冲对弱酸的pKa尽量接近于所需pH,并尽量在缓冲对的缓冲范围内(pH= pKa±1)。
⼆是所选缓冲对不能与溶液中主物质发⽣作⽤。
2、缓冲溶液的总浓度要适当,⼀般0.1-0.5 mol·L-1之间3、计算所需缓冲对的量,为⽅便计算和配制,常⽤相同浓度的共轭酸、碱溶液,分别取不同体积混合即可4、校正,实际pH值与计算pH值常有出⼊,⽤pH计或精密pH纸校正。
表1. 常⽤pH缓冲溶液的配制和pH值Preparation and pH Values of Common pH Buffer Solutions表2. pH标准缓冲溶液Standard pH Buffer Solutions表3. 标准缓冲液pH值与温度对照表表4。
常⽤缓冲溶液的配制⽅法1.⽢氨酸–盐酸缓冲液(0.05mol/L)2.邻苯⼆甲酸–盐酸缓冲液(0.05 mol/L)24Na2HPO4-2H2O分⼦量= 178.05,0.2 mol/L溶液含35.01克/升。
C4H2O7·H2O分⼦量= 210.14,0.1 mol/L溶液为21.01克/升。
溶液或浓盐酸调节,冰箱保存。
6872柠檬酸钠Na 3 C 6H 5O7·2H 2O :分⼦量294.12,0.1 mol/L 溶液为29.41克/毫升。
227.磷酸盐缓冲液242Na2HPO4·2H2O分⼦量= 358.22,0.2 mol/L溶液为71.64克/升。
Na2HPO4·2H2O分⼦量= 156.03,0.2 mol/L溶液为31.21克/升。
242KH2PO4分⼦量= 136.09,1/15M溶液为9.078克/升。
8.磷酸⼆氢钾–氢氧化钠缓冲液(0.05M)X毫升0.2M K2PO4 + Y毫升0.2N NaOH加⽔稀释⾄29毫升10.Tris–盐酸缓冲液(0.05M,25℃)50毫升0.1M三羟甲基氨基甲烷(Tris)溶液与X毫升0.1N盐酸混匀后,加⽔稀释⾄100CHOCH2 NH2分⼦量=121.14;1M溶液为12.114克/升。
溶液的标定.附1 标准溶液的配制与标定0.1mol/LNaOH溶液配制与标定(1)配制:称取110gNa0H,溶于100mL⽆CO2蒸馏⽔中,摇匀,注⼊⼄烯容器中,密闭放置⾄溶液清亮。
⽤塑料管量取5.4ml上层清夜,⽤CO2⽆蒸馏⽔定容⾄1000mL,摇匀。
(2)标定:称取0.75g于105℃⼀110℃烘箱中⼲燥⾄恒重的⼯作基准试剂邻苯⼆甲酸氢钾,加50mL⽆CO2蒸馏⽔溶解,加2滴酚酞指⽰液,⽤配制好的NaOH 溶液滴定⾄溶液呈粉红⾊,并保持30s,同时做空⽩试验。
NaOH标准溶液浓度[c(NaOH)」,数值以mol/L表⽰,按下式m×1000c(NaOH)=(V1-V2) ×M式中m-邻苯⼆甲酸氢钾质量的准确数值,单位g;Vl—氢氧化钠溶液的体积,单位mL;V2—空⽩试验氢氧化钠溶液的体积,单位为mL;M—邻苯⼆甲酸氢钾的摩尔质量[M(KHC8H4O4)=204.22g/mol]滴定酸度测定取搅拌均匀的样品10mL于锥形瓶中,加⼊20mL蒸馏⽔及2-3滴酚酞指⽰剂,⽤0.1mol/L NaoH标液滴定⾄初现粉红⾊且30s内不褪⾊。
酸度(O T)按下式计算酸度(0T)=A×F×10式中:A—滴定样品所消耗NaOH标液体积毫升数;F⼀0.lmol/L Na0H标准液的校正系数;10—样品的倍数。
(⼀)标准溶液的配制与标定的⼀般规定:1.配制及分析中所⽤的⽔及稀释液,在没有注明其它要求时,系指其纯度能满⾜分析要求的蒸馏⽔或离⼦交换⽔。
2.⼯作中使⽤的分析天平砝码,滴管,容量瓶及移液管均需较正。
3.标准溶液规定为20℃时,标定的浓度为准(否则应进⾏换算)。
4.在标准溶液的配制中规定⽤“标定”和“⽐较”两种⽅法测定时,不要略去其中任何⼀种,⽽且两种⽅法测得的浓度值之相对误差不得⼤于0.2%,以标定所得数字为准。
5.标定时所⽤基准试剂应符合要求,含量为99.95-100.05%,换批号时,应做对照后再使⽤。
配制500ml,0.1mol/l碳酸钠溶液步骤及注意事项所需的仪器:烧杯、容量瓶、玻璃棒、胶头滴管、分析天平、药匙、量筒步骤:第一步:计算:所需碳酸钠的质量=0.5*0.1*106=5.3克。
第二步:称量:在天平上称量5.3克碳酸钠固体,并将它倒入小烧杯中。
第三步:溶解:在盛有碳酸钠固体的小烧杯中加入适量蒸馏水,用玻璃棒搅拌,使其溶解。
第四步:移液:将溶液沿玻璃棒注入500ml容量瓶中。
第五步:洗涤:用蒸馏水洗烧杯2—3次,并倒入容量瓶中。
第六步:定容:倒水至刻度线1—2cm处改用胶头滴管滴到与凹液面平直。
第七步:摇匀:盖好瓶塞,上下颠倒、摇匀。
第八步:装瓶、贴签。
误差分析:固体药品的称量与液体药品的量取是否准确;把溶液向容量瓶中转移,溶液洒了;未洗涤烧杯和玻璃棒;用待配液润洗了容量瓶;定容时水加多了或加少了;定容时未平视刻度线。
仰视、俯视对溶液浓度有何影响?★俯视刻度线,实际加水量未到刻度线,使溶液的物质的量浓度增大;★仰视刻度线,实际加水量超过刻度线,使溶液的物质的量浓度减小。
三、容量瓶的使用六忌:★一忌用容量瓶进行溶解(体积不准确)★二忌直接往容量瓶倒液(洒到外面)★三忌加水超过刻度线(浓度偏低)★四忌读数仰视或俯视(仰视浓度偏低,俯视浓度偏高)★五忌不洗涤玻璃棒和烧杯(浓度偏低)★六忌标准液存放于容量瓶(容量瓶是量器,不是容器)1 mol/L的氢氧化钠溶液250mL,完成下列步骤:①用天平称取氢氧化钠固体克。
②将称好的氢氧化钠固体放入烧杯中加少量蒸馏水将其溶解,待完全溶解后将溶液沿玻璃棒移入250mL的容量瓶中。
③用少量蒸馏水冲洗2-3次,将冲洗液移入容量瓶中,在操作过程中不能损失点滴液体,否则会使溶液的浓度偏低。
④向容量瓶内加水至刻度线1-2cm时,改用胶头滴管小心地加水至溶液凹液面与刻度线相切,若加水超过刻度线,会造成溶液浓度偏低应该重新配制。
⑤最后盖好瓶盖,摇匀,将配好的溶液移入试剂瓶中贴好标签。