索尔维制碱法与侯氏制碱法(也叫做氨碱法与联碱法)PPT课件
- 格式:ppt
- 大小:74.00 KB
- 文档页数:9

侯氏制碱法与索尔维制碱法(也叫做氨碱法与联碱法)的比较一、氨碱法(又称索尔维法)以食盐(氯化钠)、石灰石(经煅烧生成生石灰和二氧化碳)、氨气为原料来制取纯碱。
先使氨气通入饱和食盐水中而成氨盐水,再通入二氧化碳生成溶解度较小的碳酸氢钠沉淀和氯化铵溶液。
其化学反应原理是:NaCl+NH3+H2O+CO2=NaHCO3↓+NH4Cl 将经过滤、洗涤得到的NaHCO3微小晶体,再加热煅烧制得纯碱产品。
2NaHCO3=Na2CO3+H2O+CO2含有氯化铵的滤液与石灰乳[Ca(OH)2]CaO+H2O=Ca(OH)2,2NH4Cl+Ca(OH)2=CaCl2+2NH3↑+2H2O。
氨碱法的优点是:原料(食盐和石灰石)便宜;产品纯碱的纯度高;副产品氨和二氧化碳都可以回收循环使用;制造步骤简单,适合于大规模生产。
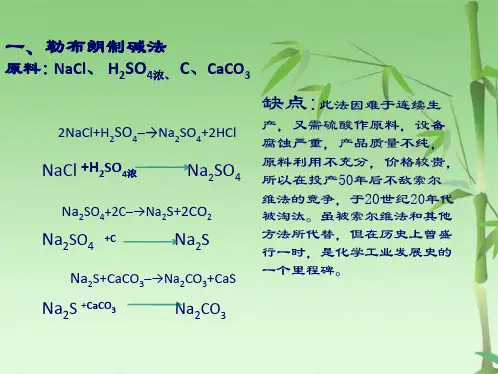
但氨碱法也有许多缺点:首先是两种原料的成分里都只利用了一半—食盐成分里的钠离子(Na+)和石灰石成分里的碳酸根离子(CO32-)结合成了碳酸钠,可是食盐的另一成分氯离子(Cl-)和石灰石的另一成分钙离子(Ca2+)却结合成了没有多大用途的氯化钙(CaCl2),因此如何处理氯化钙成为一个很大的负担。
氨碱法的最大缺点还在于原料食盐的利用率只有72%~74%,其余的食盐都随着氯化钙溶液作为废液被抛弃了,这是一个很大的损失。
二、联合制碱法(又称侯氏制碱法)将氨碱法和合成氨法两种工艺联合起来,同时生产纯碱和氯化铵两种产品的方法。
原料是食盐、氨和二氧化碳—合成氨厂用水煤气制取氢气时的废气。
其化学反应原理是:C+H2O=CO+H2 CO+H2O=CO2+H2联合制碱法包括两个过程:第一个过程与氨碱法相同,将氨通入饱和食盐水而成氨盐水,再通入二氧化碳生成碳酸氢钠沉淀,经过滤、洗涤得NaHCO3微小晶体,再煅烧制得纯碱产品,其滤液是含有氯化铵和氯化钠的溶液。
第二个过程是从含有氯化铵和氯化钠的滤液中结晶沉淀出氯化铵晶体。





索尔维制碱法与侯氏制碱法无水碳酸钠,俗名纯碱、苏打。
它是玻璃、造纸、肥皂、洗涤剂、纺织、制革等工业的重要原料,还常用作硬水的软化剂,也用于制造钠的化合物。
它的工业制法主要有氨碱法和联合制碱法两种。
一、氨碱法(又称索尔维法)它是比利时工程师苏尔维(1838~1922)于1892年发明的纯碱制法。
他以食盐(氯化钠)、石灰石(经煅烧生成生石灰和二氧化碳)、氨气为原料来制取纯碱。
先使氨气通入饱和食盐水中而成氨盐水,再通入二氧化碳生成溶解度较小的碳酸氢钠沉淀和氯化铵溶液。
其化学反应原理是:NaCl+NH3+H2O+CO2=NaHCO3↓+NH4Cl将经过滤、洗涤得到的NaHCO3微小晶体,再加热煅烧制得纯碱产品。
2NaHCO3=Na2CO3+H2O+CO2↑放出的二氧化碳气体可回收循环使用。
含有氯化铵的滤液与石灰乳[Ca(OH)2]混合加热,所放出的氨气可回收循环使用。
CaO+H2O=Ca(OH)2,2NH4Cl+Ca(OH)2=CaCl2+2NH3↑+2H2O其工业生产的简单流程如图所示。
氨碱法的优点是:原料(食盐和石灰石)便宜;产品纯碱的纯度高;副产品氨和二氧化碳都可以回收循环使用;制造步骤简单,适合于大规模生产。
但氨碱法也有许多缺点:首先是两种原料的成分里都只利用了一半——食盐成分里的钠离子(Na+)和石灰石成分里的碳酸根离子(CO32-)结合成了碳酸钠,可是食盐的另一成分氯离子(Cl-)和石灰石的另一成分钙离子(Ca2+)却结合成了没有多大用途的氯化钙(CaCl2),因此如何处理氯化钙成为一个很大的负担。
氨碱法的最大缺点还在于原料食盐的利用率只有72%~74%,其余的食盐都随着氯化钙溶液作为废液被抛弃了,这是一个很大的损失。
二、联合制碱法(又称侯氏制碱法)它是我国化学工程专家侯德榜(1890~1974)于1943年创立的。
是将氨碱法和合成氨法两种工艺联合起来,同时生产纯碱和氯化铵两种产品的方法。
原料是食盐、氨和二氧化碳——合成氨厂用水煤气制取氢气时的废气。




文档收集于互联网,已重新整理排版.word版本可编辑•欢迎下载支持.补充:索尔维制碱法与侯氏制碱法(08.29)无水碳酸钠,俗名纯碱、苏打。
它是玻璃、造纸、肥皂、洗涤剂、纺织、制革等工业的重要原料,还常用作硬水的软化剂,也用于制造钠的化合物。
它的工业制法主要有氨碱法和联合制碱法两种。
一、氨碱法(又称索尔维法)它是比利时工程师苏尔维(1838〜1922)于1892年发明的纯碱制法。
他以食盐(氯化钠)、石灰石(经锻烧生成生石灰和二氧化碳)、氨气为原料来制取纯碱。
先使氨气通入饱和食盐水中而成氨盐水,再通入二氧化碳生成溶解度较小的碳酸氢钠沉淀和氯化钱溶液。
其化学反应原理是:NaCl+NH』+H?0+C0尸NaHCO』J +网6将经过滤、洗涤得到的NaHC0$微小晶体,再加热锻烧制得纯碱产品.2NaHC03=Na2C03+H=0+C0: t放出的二氧化碳气体可回收循环使用•:含有氯化彼的滤液与石灰乳[Cd(0H)2】混合加热,所放出的氨气可回收循环使用。
CdO+H:O =Ca(0H)c, 2NH>Cl+Ca(0H):=CaC12+2NH3 t +2H;0 其工业生产的简单流程如图所示。
氨碱法的优点是:原料(食盐和石灰石)便宜;产品纯碱的纯度高;副产品氨和二氧化碳都可以回收循环使用;制造步骤简单,适合于大规模生产。
但氨碱法也有许多缺点:首先是两种原料的成分里都只利用了一半一一食盐成分里的钠离子(NJ)和石灰石成分里的碳酸根离子(C0D结合成了碳酸钠,可是食盐的另一成分氯离子(CD和石灰石的另一成分钙离子(Cf+)却结合成了没有多大用途的氯化钙(CaCl:),因此如何处理氯化钙成为一个很大的负担。
氨碱法的最大缺点还在于原料食盐的利用率只有72%〜74%,其余的食盐都随着氯化钙溶液作为废液被抛弃了,这是一个很大的损失。
二、联合制碱法(又称侯氏制碱法)它是我国化学工程专家侯德榜(1890〜1974)于1943年创立的。
【纯碱工业】索尔维制碱法与侯氏制碱法〔也叫做氨碱法与联碱法〕氨碱法:先使氨气通入饱和食盐水中而成氨盐水,再通入二氧化碳生成溶解度较小的碳酸氢钠沉淀和氯化铵溶液。
其化学反响原理是:NaCl+NH3+H2O+CO2→NaHCO3↓+NH4Cl将经过滤、洗涤得到的NaHCO3微小晶体,再加热煅烧制得纯碱产品。
2NaHCO3−−−→煅烧Na2CO3+H2O+CO2↑放出的CO2气体可回收循环使用。
含有NH4Cl的滤液与石灰乳[Ca(OH)2]混合加热,所放出的NH3可回收循环使用。
CaO+H2O→Ca(OH)2,2NH4Cl+Ca(OH)2=CaCl2+2NH3↑+2H2O氨碱法的优点是:原料〔食盐和石灰石〕廉价;产品纯碱的纯度高;副产品氨和二氧化碳都可以回收循环使用;制造步骤简单,适合于大规模生产。
但氨碱法也有许多缺点:首先是两种原料的成分里都只利用了一半—食盐成分里的Na+和石灰石成分里的CO32-结合成了Na2CO3,可是食盐的另一成分Cl-和石灰石的另一成分Ca2+却结合成了没有多大用途的CaCl2,因此如何处理CaCl2成为一个很大的负担。
氨碱法的最大缺点还在于原料食盐的利用率只有72%~74%,其余的食盐都随着CaCl2溶液作为废液被抛弃了,这是一个很大的损失。
联合制碱法〔又称侯氏制碱法〕:它是我国化学工程专家侯德榜〔1890~1974〕于1943年创立的。
是将氨碱法和合成氨法两种工艺联合起来,同时生产纯碱和氯化铵两种产品的方法。
原料是食盐、氨和二氧化碳〔合成氨厂用水煤气制取氢气时的废气,其化学反响原理是:C+H2O→CO+H2 CO+H2O→CO2+H2〕联合制碱法包括两个过程:第一个过程与氨碱法一样,将氨通入饱和食盐水而成氨盐水,再通入二氧化碳生成碳酸氢钠沉淀,经过滤、洗涤得NaHCO3微小晶体,再煅烧制得纯碱产品,其滤液是含有氯化铵和氯化钠的溶液。
第二个过程是从含有氯化铵和氯化钠的滤液中结晶沉淀出氯化铵晶体。
侯氏制碱法与索尔维制碱法(也叫做氨碱法与联碱法)的比较【2 】一.氨碱法(又称索尔维法)以食盐(氯化钠).石灰石(经煅烧生成生石灰和二氧化碳).氨气为原料来制取纯碱.先使氨气通入饱和食盐水中而成氨盐水,再通入二氧化碳生成消融度较小的碳酸氢钠沉淀和氯化铵溶液.其化学反响道理是:NaCl+NH3+H2O+CO2=NaHCO3↓+NH4Cl 将经由滤.洗涤得到的NaHCO3渺小晶体,再加热煅烧制得纯碱产品.2NaHCO3=Na2CO3+H2O+CO2↑.含有氯化铵的滤液与石灰乳[Ca(OH)2]混杂加热,.CaO+H2O=Ca(OH)2,2NH4Cl+Ca(OH)2=CaCl2+2NH3↑+2H2O.氨碱法的长处是:原料(食盐和石灰石)昂贵;产品纯碱的纯度高;副产品氨和二氧化碳都可以收受接管轮回运用;制作步骤简略,合适于大范围临盆.但氨碱法也有很多缺陷:起首是两种原料的成分里都只运用了一半—食盐成分里的钠离子(Na+)和石灰石成分里的碳酸根离子(CO32-)结合成了碳酸钠,可是食盐的另一成分氯离子(Cl-)和石灰石的另一成分钙离子(Ca2+)却结合成了没有多大用处的氯化钙(CaCl2),是以若何处理氯化钙成为一个很大的累赘.氨碱法的最大缺陷还在于原料食盐的运用率只有72%~74%,其余的食盐都跟着氯化钙溶液作为废液被摈弃了,这是一个很大的损掉.二.结合制碱法(又称侯氏制碱法)将氨碱法和合成氨法两种工艺结合起来,同时临盆纯碱和氯化铵两种产品的方法.原料是食盐.氨和二氧化碳—合成氨厂用水煤气制取氢气时的废气.其化学反响道理是:C+H2O=CO+H2 CO+H2O=CO2+H2结合制碱法包括两个进程:第一个进程与氨碱法雷同,将氨通入饱和食盐水而成氨盐水,再通入二氧化碳生成碳酸氢钠沉淀,经由滤.洗涤得NaHCO3渺小晶体,再煅烧制得纯碱产品,其滤液是含有氯化铵和氯化钠的溶液.第二个进程是从含有氯化铵和氯化钠的滤液中结晶沉淀出氯化铵晶体.因为氯化铵在常温下的消融度比氯化钠要大,低温时的消融度则比氯化钠小,并且氯化铵在氯化钠的浓溶液里的消融度要比在水里的消融度小得多.所以在低温前提下,向滤液中参加细粉状的氯化钠,并通入氨气,可以使氯化铵单独结晶沉淀析出,经由滤.洗涤和湿润即得氯化铵产品.此时滤出氯化铵沉淀后所得的滤液,已根,可收受接管轮回运用,其最大的长处是使食盐的运用率进步到96%以上,运用同量的食盐比氨碱法临盆更多的纯碱.别的它分解运用了氨厂的二氧化碳和碱厂的氯离子,同时,临盆出两种宝贵的产品——纯碱和氯化铵.将氨厂的废气二氧化碳,改变为碱厂的重要原料来制取纯碱,如许就节俭了碱厂里用于制取二氧化碳的宏大的石灰窑;将碱厂的无用的成分氯离子(Cl-)来代替价钱较高的硫酸固定氨厂里的氨,制取氮肥氯化铵.从而不再生成没有多大用处,又难于处理的氯化钙,削减了对情况的污染,并且大大下降了纯碱和氮肥的成本,充分表现了大范围结合临盆的优胜性.由氨厂供给碱厂须要的氨和二氧化碳.母液里的氯化铵用参加食盐的方法使它结晶出来,作为化工产品或化肥.食盐溶液又可以轮回运用.这个新工艺使食盐运用率从70%进步到96%,也使本来无用的氯化钙转化成化肥氯化铵,.污染情况的难题.所谓“结合制碱法”中的“结合”,指该法将合成氨工业与制碱工业组合在一路,运用了临盆氨时的副产品CO2,铲除了用石灰石分化来临盆,简化了临盆装备.此外,结合制碱法也避免了临盆氨碱法顶用处不大的副产物氯化钙,而用可作化肥的氯化铵来收受接管,进步了食盐运用率,缩短了临盆流程,削减了对情况的污染,下降了纯碱的成本.侯氏道理是根据离子反响产生的道理进行的,离子反响会向着离子浓度减小的偏向进行.也就是所说的复分化反响应有沉淀,气体和难电离的物资生成.他要制纯碱(Na2CO3),就运用NaHCO3在溶液中溶液中消融度较小,所以先制得NaHCO3.再运用碳酸氢钠不稳固性分化得到纯碱.要制得碳酸氢钠就要有大量钠离子和碳酸氢根离子,所以就在饱和食盐水中通入氨气,形成饱和氨盐水,再向个中通入二氧化碳,在溶液中就有了大量的钠离子,铵根离子,氯离子和碳酸氢根离子,这个中NaHCO3消融度最小,所以析出,其余产品处理后可作肥料或轮回运用.所不同的是索氏法在全部制取进程中NH3是轮回运用的:2NH4Cl+Ca(OH)2=2NH3+CaCl2+2H2O,而侯氏法在全部制取进程中,NH4Cl直接做为纯碱的副产品----肥料.。