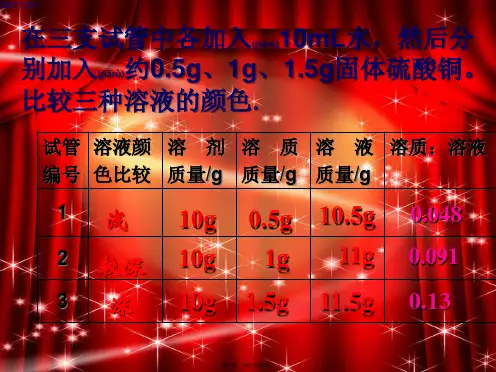
知2-练
感悟新知
知2-练
解题秘方:(1)根据质量守恒定律计算生成二 氧化碳的质量。
(2)利用二氧化碳的质量结合反应的化学方程 式计算氯化氢的质量,进而计算其质量分数。
感悟新知
知2-讲
总结
求反应后溶液的质量的方法通常有两种: 质量守恒法。
反应物的质量总和减去生成的气体或沉淀质 量,但要注意难溶于水的杂质也要减掉;
反应后所得溶液中硫酸铜的质量分数为2.93%。
感悟新知
知1-练
解题秘方:(1)先求出参加反应的过氧化氢的 质量即溶液中溶硫酸铜的质量,依据是 催化剂在反应前后质量不变,再根据质量守恒定律 求出硫酸铜溶液质量,然后计算硫酸铜的质量分数。
解:(1)过氧化氢溶液中溶质的质量为40 g ×8.5%=3.4 g。设产生氧气的质量为x。
第九单元 溶液
9.3.2 溶质的质量分数 的综合计算
学习目标
1 课时讲解 溶质质量分数与化学方程式
的基础计算
化学方程式与溶质质量分数
2 课时流程 的综合计算
逐点 导讲练
课堂 小结
作业 提升
感悟新知
知识点 1 溶质质量分数与化学方程式的基础计算
例1 [中考·德阳] 硫酸铜溶液对过氧化氢(H2O2)的分 解有催化作用。取8.5% 的过氧化氢溶液40 g 倒入小烧 杯中,向其中加入20% 的硫酸铜溶液6.6 g,使过氧化 氢完全分解。计算: (1)产生氧气的质量; 产生氧气的质量为1.6 g; (2)反应后所得溶液中硫酸铜的质量分数。
感悟新知
2H2O2 =C=u=S=O==4 = 2H2O+O2 ↑
68
32
知1-练
3.4 g
x
68 3.4 g =