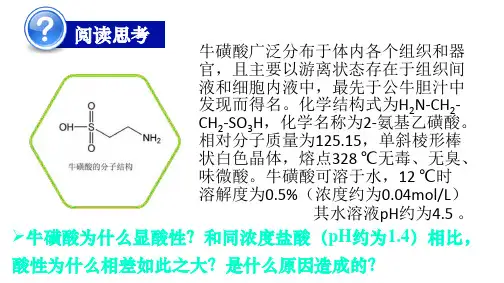
例1:冰醋酸加水溶解并不断稀释过程中, 溶液导电能力与加入水的体积有如下变化关 系:试回答: ⑴“0”点导电能力为0的理由是:冰醋酸中只 存在醋酸分子,无离子。 ⑵a、b、c三点对应溶液的PH值由大到小的 顺序是 a﹥c﹥ b ⑶a、b、c三点中电离程度最大的是 C 。电 离平衡常数的关系 相等 . ⑷若使c点溶液中[Ac-]、PH 值均增大,可采取的措施有: ①加碱②加碳酸钠③加镁或锌
磷酸
H3PO4 ⇌ H++H2PO4H2PO4 ⇌ H++HPO42HPO4 ⇌ H++PO43-
K3=2.2×10-13
回答下列各问:
( 1 )、 K 只于温度有关,当温度升高时, K 值 增大 。 (2)、在温度相同时,各弱酸的K值不同,K 值越大酸的酸性 越强 。 (3)、若把CH3COOH ,H2CO3,HCO3-,H2S,HS- , H3PO4。H2PO4-;HPO42-都看成酸,其中酸性最强 2HPO 的是H3PO4 ;酸性最强弱的是 。 4 (4)、多元弱酸是分步电离的,每一步都有 相应的电离平衡常数,对于同一种多元弱酸 的K1、K2 、K3之间存在着数量上的规律是: 。 K1>K2 >K3
二、弱电解 质的电离平衡
25℃时将0· 1mol· L-1HAc溶液中改变某种条件 后各量的变化情况填入下表:
加入物质
加水稀释
通入HCl(气) 加少量NaAc晶体 加少量冰醋酸 加少量NaOH固体 加少量Na2CO3固体 加同浓度醋酸 加热
平衡移动方向 H+数 [Ac–] [H+] PH Ka
向右移动 增大 增大 减小 减小 减小 增大 减小 增大 增大 减小 不 减小 增大
H2CO3 ⇌ H++HCO3HCO3- ⇌ H++ CO32H2S ⇌ H++HSHS- ⇌ H++ S2-