2019学年高一化学人教版必修1课件 第4章 第2节 第
- 格式:ppt
- 大小:3.94 MB
- 文档页数:63

阶段重点突破练(七)题组一氯气的性质1.下列关于氯气的说法正确的是()A.Cl2具有很强的氧化性,在化学反应中只能作氧化剂B.氯元素在自然界中既以化合态存在,也以游离态存在C.实验室制备Cl2可用排饱和食盐水法收集D.1.12 L Cl2含有1.7N A个质子(N A为阿伏加德罗常数的值)答案 C解析Cl2中的氯元素处于中间价态,所以在化学反应中既可以作氧化剂也可以作还原剂(如Cl2与H2O反应),A项错误;氯元素主要以Cl-的形式存在于海水中,自然界中只有化合态的氯,没有游离态的氯,B项错误;D项没有说明在标准状况下,错误。
【考点】氯气的性质【题点】氯气的性质及应用2.氯气是一种重要的工业原料。
工业上利用反应3Cl2+2NH3===N2+6HCl检查氯气管道是否漏气。
下列说法错误的是()A.若管道漏气遇氨就会产生白烟B.该反应利用了Cl2的强氧化性C.该反应属于复分解反应D.生成1 mol N2有6 mol电子转移答案 C解析本题通过一个陌生的化学反应方程式,考查氨气和氯气的性质及氧化还原知识。
当NH3过量时会与HCl反应生成NH4Cl白烟,故A对;反应中氮和氯两元素的化合价发生了变化,因而属于氧化还原反应,故C错;氯气中的氯元素化合价从0价变为-1价,化合价降低,氯气为氧化剂,NH3中的氮由-3价升高至0价(失去3个电子),为还原剂,生成1 mol N2需2 mol氮原子,失去6 mol电子,故D对。
【考点】氯气的性质【题点】氯气的性质及应用3.如图所示,A处通入干燥的Cl2,关闭B阀时,C处湿的红色布条看不到明显现象,打开B阀后,C处红色布条逐渐褪色,则D瓶中装的是()A.浓H2SO4B.NaOH溶液C.浓盐酸D.饱和NaCl溶液答案 B解析由题意说明D处的液体能吸收Cl2,A、C、D选项中的溶液都不能吸收Cl2,故B项正确。
【考点】氯气的性质【题点】氯气的性质实验4.下列有关化学反应过程或实验现象的叙述中,正确的是()A.氯气的水溶液可以导电,说明氯气是电解质B.漂白粉和明矾都常用于自来水的处理,二者的作用原理是相同的C.氯气可以使湿润的有色布条褪色,但实际起漂白作用的物质是次氯酸而不是氯气D.氯水中加入有色布条,布条褪色,说明溶液中有Cl2存在答案 C解析电解质必须是化合物,Cl2是单质,既不是电解质,也不是非电解质,A不正确;漂白粉是利用强氧化性杀菌消毒,而明矾是利用Al3+和水反应生成Al(OH)3胶体吸附杂质,B不正确;D项只能说明存在HClO,D不正确。

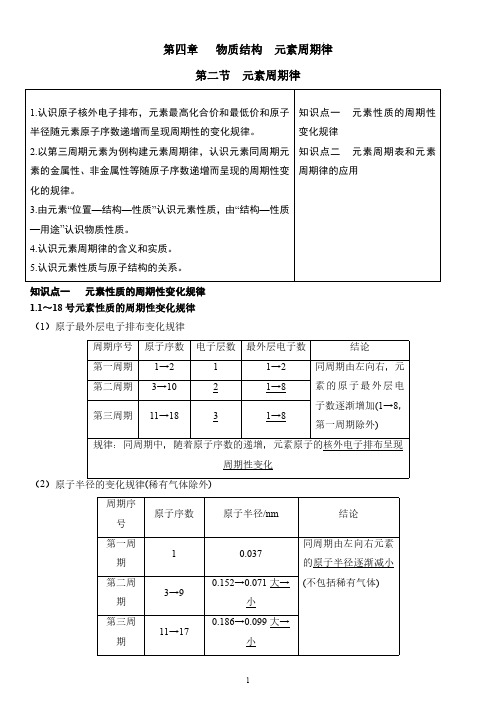
第四章物质结构元素周期律第二节元素周期律1.认识原子核外电子排布,元素最高化合价和最低价和原子半径随元素原子序数递增而呈现周期性的变化规律。
2.以第三周期元素为例构建元素周期律,认识元素同周期元素的金属性、非金属性等随原子序数递增而呈现的周期性变化的规律。
3.由元素“位置—结构—性质”认识元素性质,由“结构—性质—用途”认识物质性质。
4.认识元素周期律的含义和实质。
5.认识元素性质与原子结构的关系。
知识点一元素性质的周期性变化规律知识点二元素周期表和元素周期律的应用知识点一元素性质的周期性变化规律1.1~18号元素性质的周期性变化规律(1)原子最外层电子排布变化规律(2周期序号原子序数原子半径/nm结论第一周期10.037同周期由左向右元素的原子半径逐渐减小(不包括稀有气体)第二周期3→90.152→0.071大→小第三周期11→170.186→0.099大→小规律:同周期中,随着原子序数的递增,元素的原子半径呈现周期性变化3.元素的主要化合价周期序号原子序数主要化合价结论第一周期1→2+1→0①同周期由左向右,元素的最高正价逐渐升高(+1→+7,O和F无最高正价);②元素的最低负价由第ⅣA族的-4价逐渐升高至第ⅦA族的-1价;③最高正价+|最低负价|=8第二周期3→9最高价+1→+5(不含O、F)最低价-4→-1第三周期11→17最高价+1→+7最低价-4→-1规律:同周期中,随着原子序数的递增,元素的主要化合价呈现周期性变化4.实验探究:金属性的递变规律(1)Na、Mg元素金属性强弱比较原理金属与水反应置换出H2的难易程度操作现象镁条表面附着少量气泡剧烈反应,溶液变成浅红色化学反应-Mg+2H2OMg(OH)2+H2↑结论结合Na与水的反应的现象,Na与水反应置换H2比Mg 容易,则金属性:Na>Mg(2)Mg、Al元素金属性强弱比较原理金属的最高价氧化物对应水化物的碱性强弱物质Al(OH)3Mg(OH)2操作现象A 中沉淀溶解B 中沉淀溶解C 中沉淀溶解D 中沉淀不溶解A 、B 、C 、D 试管中的离子方程式A :Al(OH)3+3H +===Al 3++3H 2O B :Al(OH)3+OH -===AlO -2+2H 2OC :Mg(OH)2+2H +===Mg 2++2H 2OD :不反应结论Al(OH)3是两性氢氧化物,其碱性弱于Mg(OH)2(中强碱),更弱于NaOH(强碱),则金属性:Na>Mg>Al5.非金属性的递变规律6.元素周期律(1)内容:元素的性质随着原子序数的递增而呈周期性的变化。


