2-2-多电子原子的结构
- 格式:ppt
- 大小:2.57 MB
- 文档页数:52


核外电子的分层排布规律:1、第一层不超过2个,第二层不超过8个;2、最外层不超过8个。
每层最多容纳电子数为2n2个(n代表电子层数),即第一层不超过2个,第二层不超过8个,第三层不超过18个;3、最外层电子数不超过8个(只有1个电子层时,最多可容纳2个电子)。
4、最低能量原理:电子尽可能地先占有能量低的轨道,然后进入能量高的轨道,使整个原子的能量处于最低状态。
5、泡利原理:每个原子轨道里最多只能容纳2个电子,且自旋状态相反。
6、洪特规则:当电子排布在同一能级的不同轨道时,基态原子中的电子总是优先单独占据一个轨道,且自旋状态相同。
扩展资料一、核外电子排布与元素性质的关系1、金属元素原子的最外层电子数一般小于4,较易失去电子,形成阳离子,表现出还原性,在化合物中显正化合价。
2、非金属元素原子的最外层电子数一般大于或等于4,较易获得电子,活泼非金属原子易形成阴离子。
在化合物中主要显负化合价。
3、稀有气体元素的原子最外层为8电子(氦为2电子)稳定结构,不易失去或得到电子,通常表现为0价。
4、核外电子排布的几条规律之间既相互独立又相互统一,不能孤立地应用其中一条,如当M层不是最外层时,最多排布的电子数为2×32=18个,而当M 层是最外层时,则最多只能排布8个电子。
5、书写原子结构示意图时要注意审题和书写规范:看清是原子还是离子结构示意图,勿忘记原子核内的“+”号。
二、1~18号元素原子结构的特征1、原子核中无中子的原子:H。
2、最外层有1个电子的元素:H、Li、Na。
3、最外层有2个电子的元素:Be、Mg、He。
4、最外层电子数等于次外层电子数的元素:Be、Ar。
5、最外层电子数是次外层电子数2倍的元素:C;是次外层3倍的元素:O;是次外层4倍的元素:Ne。
6、电子层数与最外层电子数相等的元素:H、Be、Al。
7、电子总数为最外层电子数2倍的元素:Be。
8、次外层电子数是最外层电子数2倍的元素:Li、Si。
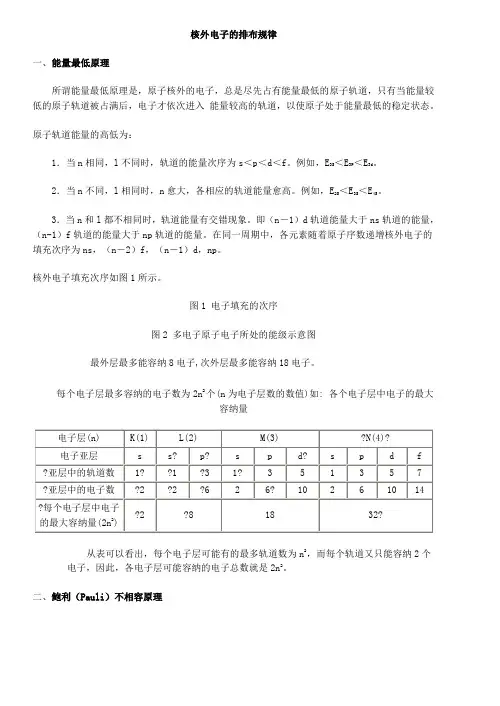
核外电子的排布规律一、能量最低原理所谓能量最低原理是,原子核外的电子,总是尽先占有能量最低的原子轨道,只有当能量较低的原子轨道被占满后,电子才依次进入能量较高的轨道,以使原子处于能量最低的稳定状态。
原子轨道能量的高低为:1.当n相同,l不同时,轨道的能量次序为s<p<d<f。
例如,E3S<E3P<E3d。
2.当n不同,l相同时,n愈大,各相应的轨道能量愈高。
例如,E2S<E3S<E4S。
3.当n和l都不相同时,轨道能量有交错现象。
即(n-1)d轨道能量大于ns轨道的能量,(n-1)f轨道的能量大于np轨道的能量。
在同一周期中,各元素随着原子序数递增核外电子的填充次序为ns,(n-2)f,(n-1)d,np。
核外电子填充次序如图1所示。
图1 电子填充的次序图2 多电子原子电子所处的能级示意图最外层最多能容纳8电子,次外层最多能容纳18电子。
每个电子层最多容纳的电子数为2n2个(n为电子层数的数值)如: 各个电子层中电子的最大容纳量从表可以看出,每个电子层可能有的最多轨道数为n2,而每个轨道又只能容纳2个电子,因此,各电子层可能容纳的电子总数就是2n2。
二、鲍利(Pauli)不相容原理鲍利不相容原理的内容是:在同一原子中没有四个量子数完全相同的电子,或者说在同一原子中没有运动状态完全相同的电子。
例如,氦原子的1s轨道中有两个电子,描述其中一个原子中没有运动状态的一组量子数(n,l,m,ms)为1,0,0,+1/2,另一个电子的一组量子数必然是1,0,0,-1/2,即两个电子的其他状态相同但自旋方向相反。
根据鲍利不相容原理可以得出这样的结论,在每一个原子轨道中,最多只能容纳自旋方向相反的两个电子。
于是,不难推算出各电子层最多容纳的电子数为2n2个。
例如,n=2时,电子可以处于四个量子数不同组合的8种状态,即n=2时,最多可容纳8个电子,见下表。
在等价轨道中,电子尽可能分占不同的轨道,且自旋方向相同,这就叫洪特规则。

原子一、原子1.原子的结构原子是由位于原子中心的中子构成的。
原子核位于原子的做高速运动。
注:(1)不是所有原子的原子(2)核电荷数=质子数(3)原子的质子数(或核数不同。
(4)原子核内质子数与中2.核外电子的排布 (1)原子的核外电子排布①电子层在含有多个电子的原子里能量高的通常在离核较远的区稍远的叫第二层,由里向外依②原子结构示意图:如钠(2)元素原子最外层电子原子的相关知识 中心的带正电的原子核和核外带负电的电子构成。
原子原子的中心,体积很小,原子里有很大的空间,电子的原子核中都有中子。
子数=核外电子数。
或核电荷数)决定原子的种类,因此不同种类的原数与中子数不一定相等。
子排布 原子里,电子的能量并不相同,能量低的通常在离核较近远的区域运动。
把能量最低、离核最近的叫第一层,向外依次类推,叫三、四、五、六、七层。
如钠原子结构示意图。
层电子数与元素化学性质的关系原子核是由质子和电子在这个空间里类的原子,核内质子核较近的区域运动,,能量稍高、离核元素类别 稀有气体元素 金属元素非金属元素 一般多(3)原子结构示意图的书要正确书写原子结构示意①每一电子层上所容纳的纳2×12=2个;第二层上能容纳②核外电子是逐层排布的依此类推。
③最外层电子数不得超过二、离子1.离子概念:带电的原子(或原分类:阳离子:带正电的原子或原阴离子:带负电的原子或原离子的形成过程:(1)金属原子的最外层电核外电子数,所以带正电荷(2)非金属原子的最外层于核外电子数,所以带负电荷2.离子符号(1)离子符号表示的意义(2)分子、原子和离子的最外层电子数 得失电子倾向 8个(He 为2) 不易得失 一般少于4个 易失去最外层电子 一般多于4个或等于4个 易得到电子图的书写及相关判断构示意图,必须遵循核外电子排布的一般规律:容纳的电子数不超过2n 2个(n 为电子层数)。
例如,能容纳2×22=8个电子;第三层上能容纳2×32=18个电子排布的,先排满第一层,再排第二层,第二层排满后得超过8个。



多电子原子的结构首先要了解的是,每个电子都有四个量子数,即主量子数(n)、角量子数(l)、磁量子数(ml)和自旋量子数(ms)。
主量子数决定了电子所处的能级,角量子数决定了电子轨道的形状和能量,磁量子数决定了电子轨道在空间中的取向,而自旋量子数表示电子自旋方向上的差异。
根据波尔的原子模型,多电子原子的结构可以用壳、亚壳、轨道来描述。
壳是由具有相同主量子数的电子的集合组成,亚壳是由具有相同主量子数和角量子数的电子的集合组成,而轨道则是由具有相同主量子数、角量子数和磁量子数的电子的集合组成。
每个壳包含的亚壳数目等于主量子数n的值,而每个亚壳包含的轨道数目等于2l+1,其中l是角量子数的值。
例如,当n=1时,只有一个壳,其中含有一个s亚壳,包含一个s轨道。
当n=2时,有两个壳,其中一个含有一个s亚壳和一个p亚壳,而另一个则只含有一个s亚壳,每个亚壳又包含一个s轨道和三个p轨道。
多电子原子的能级结构比氢原子更加复杂,这是因为电子之间的相互作用会引起能级的分裂。
这种相互作用包括库仑相互作用(电子之间的静电相互作用)和斯塔克效应(电子在外加电场中的行为)。
当电子之间的相互作用不考虑时,多电子原子的能级就是简并的,也就是说,拥有相同主量子数的能级具有相同的能量。
然而,这种简并可以通过考虑相互作用来取消。
由于库仑相互作用,主量子数相同但角量子数不同的亚壳之间的能级发生了分裂。
例如,在n=2的壳中,2s亚壳的能级低于2p亚壳的能级。
同样,角量子数相同但磁量子数不同的轨道之间的能级也发生了分裂。
最后,自旋量子数不同的电子具有不同的能量。
这种由于相互作用引起的能级分裂称为自旋-轨道相互作用。
要描述多电子原子的结构,可以使用一种方法称为Hartree-Fock方法。
在这种方法中,先假设每个电子都处于一个平均势场中,其它所有电子引起的平均势场。
然后,通过求解薛定谔方程来获得每个电子的波函数和能量。
然而,Hartree-Fock方法只能给出近似解,因为它没有考虑到电子之间的动态相关性。


第三节多电子原子的原子结构外层只有一个电子时,由于该电子仅受到核的吸引如氢原子或类氢原子,可以精确求解出波函数。
但多电子原子核外有2个以上的电子,电子除受核的作用外,还受到其他电子对它的排斥作用,情况要复杂得多,只能作近似处理。
但上述氢原子结构的某些结论还可用到多电子原子结构中:在多电子原子中,每个电子都各有其波函数ψi,其具体形式也取决一组量子数n、l、m。
多电子原子中的电子在各电子层中可能占据的轨道数,与氢原子中各电子层轨道数相等。
多电子原子中每个电子的波函数的角度部分Y(θ,φ)和氢原子Y(θ,φ)相似,所以多电子原子的各个原子轨道角度分布图与氢原子的各个原子轨道的角度分布图相似。
同理两者的Y 2图也相似。
处理多电子原子问题时,认为其他电子对某个电子i的排斥,相当于其他电子屏蔽住原子核,抵消了一部分核电荷对电子i的吸引力,称为其他电子对电子i的屏蔽作用(screening effect),引进屏蔽常数σ(screening constant)表示其他电子所抵消掉的核电荷。
这样多电子原子中电子i的能量公式可表示为式中(Z –σ)= Z′称为有效核电荷(effective nuclear charge)。
多电子原子电子的能量和Z、n、σ有关。
Z愈大,相同轨道的能量愈低,如基态氟原子1s电子的能量比基态氢原子1s电子的能量低;n愈大,能量愈高;起屏蔽作用的电子愈多,总的屏蔽作用愈强。
σ愈大,能量愈高。
影响σ有以下因素:1. 外层电子对内层电子的屏蔽作用可以不考虑,σ=0;2. 内层 (n-1层)电子对最外层(n层)电子的屏蔽作用较强,σ=,离核更近的内层(n-2层)电子对最外层电子的屏蔽作用更强,σ=;3. 同层电子之间也有屏蔽作用,但比内层电子的屏蔽作用弱,σ=,1s之间σ=。
n相同l不同时,l愈小的电子,它本身的钻穿能力愈强,离核愈近,它受到其他电子对它的屏蔽作用就愈弱,能量就愈低E n s <E n p <E n d <E n f。
电子的结构和化学键电子结构是研究原子和分子中电子排布、能级分布和化学键形成的基本概念。
电子是原子和分子中带有负电荷的基本粒子,其运动状态决定了物质的性质和行为。
了解电子结构对于理解化学反应、物质变化以及材料性能具有重要意义。
本文将介绍电子结构的基本原理和化学键的形成过程。
一、原子的电子结构原子是电子、质子和中子组成的基本粒子。
电子绕核运动,并占据特定的能级。
根据量子力学原理,电子的能级分布可以用电子壳层和亚壳层表示。
电子壳层是原子中电子能量级的主要分类单位。
第一主壳层最多容纳2个电子,第二主壳层最多容纳8个电子,第三主壳层最多容纳18个电子。
亚壳层则细分了电子在主壳层中的位置。
s亚壳层最多容纳2个电子,p亚壳层最多容纳6个电子,d亚壳层最多容纳10个电子,f亚壳层最多容纳14个电子。
电子结构的表示方法有多种,常用的是电子组态表示法,如氦原子的电子组态为1s²,表示氦原子有两个电子,都位于1s亚壳层。
原子的电子结构遵循狄拉克原理和希尔伯特空间原理,即每个电子状态必须唯一,不能由两个电子共享。
根据泡利不相容原理,每个轨道上的电子自旋量子数不同。
根据阿伦尼乌斯轨道填充原理,电子首先填充低能级的轨道。
二、化学键的形成化学键是原子间或离子间的相互作用力,将原子和离子连接在一起形成分子或晶体。
化学键的形成使原子或离子外层电子结构得到填充或稳定。
常见的化学键包括离子键、共价键和金属键。
1.离子键离子键形成于金属元素和非金属元素之间。
金属元素具有低电负性,易失去电子形成阳离子。
非金属元素具有高电负性,易获得电子形成阴离子。
离子键的形成是通过阳离子和阴离子之间的电荷吸引力,使它们互相吸引而结合形成晶体。
如氯离子与钠离子结合形成氯化钠晶体。
2.共价键共价键形成于非金属元素之间或非金属元素和氢之间。
共价键是通过原子之间的电子共享来达到电子结构稳定的目的。
共价键可以是单键、双键或三键,取决于原子之间共享的电子对数目。
族IA IIA ⅢB ⅣB ⅤB ⅥB ⅦB ⅠB ⅡB ⅢA ⅣA ⅤA ⅥA ⅦA 0周期表中纵列数第1列第2列第3列第4列第5列第6列第7列第8列第9列第10列第11列第12列第13列第14列第15列第16列第17列第18列第一周期(1-2号)原子序数元素符号名称1 H 氢2 He 氦2种元素电子排布式 1s 11s 2电子排布图原子结构示意图第二周期(3-10号)原子序数元素符号名称3 Li 锂4 Be 铍5 B 硼6 C 碳7 N 氮8 O 氧9 F 氟10 Ne 氖8种元素电子排布式 1s 22s 1 1s 22s 21s 22s 22p 11s 22s 22p 21s 22s 22p 31s 22s 22p 41s 22s 22p 51s 22s 22p 6电子排布图原子结构示意图第三周期(11-18号)原子序数元素符号名称11 Na 钠12 Mg 镁13 Al 铝14 Si 硅15 P 磷16 S 硫17 Cl 氯18 Ar 氩8种元素电子排布式1s 22s 22p 63s 11s 22s 22p 63s 21s 22s 22p 63s 23p 11s 22s 22p 63s 23p 21s 22s 22p 63s 23p 31s 22s 22p 63s 23p 41s 22s 22p 63s 23p 51s 22s 22p 63s 23p 6电子排布图原子结构示意图第四周期18种(19-36号)原子序数元素符号名称19 K 钾20 Ca 钙21 Sc 钪22 Ti 钛23 V 钒24 Cr 铬25 Mn 锰26 Fe 铁27 Co 钴28 Ni 镍29 Cu 铜30 Zn 锌31 Ga 镓32 Ge 锗33 As 砷34 Se 硒35 Br 溴36 Kr 氪电子排布式【Ar 】4s 11s 22s 22p 63s 23p 64s 21s 22s 22p 63s 23p 63d 14s2【Ar 】3d 24s 21s 22s 22p 63s 23p 63d 34s21s 22s 22p 63s 23p 63d 54s 1【Ar 】3d 24s 21s 22s 22p 63s 23p 63d 64s2【Ar 】3d 74s 21s 22s 22p 63s 23p 63d 84s21s 22s 22p 63s 23p 63d 104s 11s 22s 22p 63s 23p 63d 104s21s 22s 22p 63s 23p 63d 104s 24p 11s 22s 22p 63s 23p 63d 104s 24p2【Ar 】3d 104s 24p 31s 22s 22p 63s 23p 63d 104s 24p4【Ar 】3d 104s 24p 5【Ar 】3d 104s 24p 6第五周期18种37-54号价电子排布式4s 14s 23d 14s 23d 24s 23d 34s 23d 54s 13d 54s 23d 64s 23d 74s 23d 84s 23d104s 13d 104s 24s 24p 14s 24p 24s 24p 34s 24p 44s 24p 54s 24p 6第六周期32种55-86号 镧系电子排布图价电子排布图第七周期?种满32种87-满118号锕系原子结构示意图共价键分类s-s σ键s-p σ键p-p σ键p-p Π键分子或离子CO 2SO 2 CO 32-CH 4NH 4+ 中心原子杂化轨道类型spsp2sp3a 64+2=65-1=4x 234H 2O NH 3b221sp3sp3中心原子上的孤对电子数0100分子或离子的价层电子对数2334VSEPR模型名称直线形平面三角形平面三角形正四面体形正四面体形分子或离子的立体构型名称直线形V形平面三角形正四面体形正四面体形形成配合物的条件:①配位体有孤电子对;②中心原子有空轨道。