溶液中的三大守恒式练习题-2
- 格式:doc
- 大小:58.00 KB
- 文档页数:3
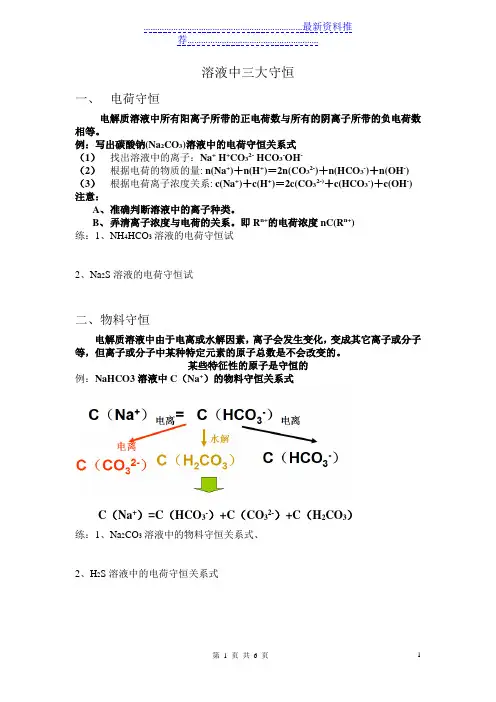
溶液中三大守恒一、电荷守恒电解质溶液中所有阳离子所带的正电荷数与所有的阴离子所带的负电荷数相等。
例:写出碳酸钠(Na2CO3)溶液中的电荷守恒关系式(1)找出溶液中的离子:Na+ H+CO32- HCO3-OH-(2)根据电荷的物质的量: n(Na+)+n(H+)=2n(CO32-)+n(HCO3-)+n(OH-) (3)根据电荷离子浓度关系: c(Na+)+c(H+)=2c(CO32-)+c(HCO3-)+c(OH-) 注意:A、准确判断溶液中的离子种类。
B、弄清离子浓度与电荷的关系。
即R n+的电荷浓度nC(R n+)练:1、NH4HCO3溶液的电荷守恒试2、Na2S溶液的电荷守恒试二、物料守恒电解质溶液中由于电离或水解因素,离子会发生变化,变成其它离子或分子等,但离子或分子中某种特定元素的原子总数是不会改变的。
某些特征性的原子是守恒的例:NaHCO3溶液中C(Na+)的物料守恒关系式C(Na+)=C(HCO3-)+C(CO32-)+C(H2CO3)练:1、Na2CO3溶液中的物料守恒关系式、2、H2S溶液中的电荷守恒关系式三、质子守恒电解质溶液中分子或离子得到质子的物质的量应相等失去质子的物质的量(由水电离出来的c(H+)、c(OH-)相等)例:NaHCO3溶液中的质子守恒关系式1、先找出溶液电离出的阴离子HCO3-2、列下列式子练:1、Na2CO3溶液中的质子守恒关系式2、Na HS溶液中的质子守恒关系式综合练习:1、CH3COONa溶液中三大守恒关系式电荷守恒:物料守恒:质子守恒:2、Na2CO3溶液中三大守恒关系式电荷守恒:物料守恒:质子守恒:[规律总结]正确的思路:一、溶质单一型※※关注三个守恒1.弱酸溶液:【例1】在0.1mol/L的H2S溶液中,下列关系错误的是()A.c(H+)=c(HS-)+c(S2-)+c(OH-)B.c(H+)=c(HS-)+2c(S2-)+c(OH-)C.c(H+)>[c(HS-)+c(S2-)+c(OH-)]D.c(H2S)+c(HS-)+c(S2-)=0.1mol/L分析:由于H 2S溶液中存在下列平衡:H2S H++HS-,HS-H++S2-,H2O H++OH-,根据电荷守恒得c(H+)=c(HS-)+2c(S2-)+c(OH-),由物料守恒得c(H2S)+c(HS-)+c(S2-)=0.1mol/L,所以关系式错误的是A项。

溶液中的离子守恒关系的典型题例1、在0.1 mol·L-1NaHCO3溶液中有关粒子浓度关系正确的是A.c(Na+)>c(HCO3-)>c(CO32-)>c(H+)>c(OH-)B.c(Na+)+c(H+)=c(HCO3-)+c(CO32-)+c(OH-)C.c(Na+)+c(H+)=c(HCO3-)+2c(CO32-)+c(OH-)D.c(Na+)=c(HCO3-)+c(CO32-)+c(H2CO3)2、关于Na2CO3溶液,下列关系不正确的是A、c(Na+)>2c(CO32-)B、c(Na+)>c(CO32-)>c(H CO3-)>c(OH—)C、c(Na+)>c(CO32-)>c(OH—)>c(H CO3-)>c(H2CO3)D、c(Na+)+c(H+)=c(OH—)+c(H CO3-) +2c(CO32-)3、标准状况下,向3mol·L-1的NaOH溶液100mL中缓缓通入4.48LCO2气体,充分反应后溶液中离子浓度大小排列顺序正确的是A.c(Na+)>c(CO32-)>c(HCO3-)>c(OH-)>c(H+)B.c(Na+)>c(CO32-)=c(HCO3-)>c(OH-)>c(H+)C.c(Na+)>c(HCO3-)>c(CO-)>c(CO32-)>c(H+)D.c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+)4、等体积的下列溶液,阴离子的总浓度最大的是A 0.2mol/L K2SB 0.1mol/L Ba(OH)2C 0.2mol/L NaClD 0.2mol/L (NH4)2SO45、把0.02mol/LHAc溶液和0.01mol/LNaOH溶液等体积混合,则混合溶液中微粒浓度关系正确的是A.c(Ac-)>c(Na+) B.c(HAc)>c(Ac-)C.2c(H+)=c(Ac-)-c(HAc) D.c(HAc)+ c(Ac-)=0.01mol·L-16、(2006四川理综)25℃时,将稀氨水逐滴加入到稀硫酸中,当溶液的pH=7时,下列关系正确的是A、c(NH4+)=c(SO42-)B、c(NH4+)>c(SO42-)C、c(NH4+)<c(SO42-)D、c(OH-)+c(SO42-)=c(H+)+(NH4+)7、已知某温度下,在100 mL浓度为0.01 mol/L的NaHS强电解质溶液中,c(H+)>(OH-),则下列关系式一定正确的是A.溶液的pH=2 B.C(Na+)=0.01 mol/L≥c(B2-)C.C(H+)·c(OH-)=10-14 D.C(Na+)+c(H+)=c(HB-)+c(B2-)+c(OH-)8、(2006苏州二测)已知某温度下0.1 mol·L-1的NaHB溶液中c(H+)>c(OH-),则下列关系中一定正确的是A.c(Na+)=c(HB-)+2c(B2-)+c(OH-)B.c(Na+)=0.1 mol·L-1≥c(B2-)C.c(H+)·c(OH-)=10-14D.溶液的pH=19、用物质的量是0.1 mol的CH3COOH和CH3COONa配成1L混合溶液,已知其中c(CH3COO-)大于c(Na+),对该混合溶液的下列判断正确的是A.c(H+)>c(OH-) B.c(CH3COO-)+c(CH3COOH)=0.2 mol·L-1C.c(CH3COOH)>c(CH3COO-) D.c(CH3COO-)+c(OH-)=0.1 mol·L-110、(2007四川高考)在25℃时,将pH=11的NaOH溶液与pH=3的CH3COOH溶液等体积混合后,下列关系式中正确的是A、c(Na+)=c(CH3COO-)+c(CH3COOH)B、c(H+)=c(CH3COO-)+c(OH-)C、c(Na+)>c(CH3COO-)>c(OH-)>c(H+)D、c(CH3COO-)>c(Na+)>c(H+)>c(OH-)11、(2006揭阳调研)常温时,将V1mL c1mol/L的氨水滴加到V2mL c2mol/L的盐酸中,下述结论中正确的是:A.若混合溶液的pH=7,则c1V1=c2V2B.若V1=V2,c1=c2,则混合液中c(NH4+)=c(Cl-)C.若混合液的pH<7,则混合液中c(NH4+)>c(Cl-)>C(H+)>C(OH-)D.若V1=V2,且混合液的pH<7,则一定有c1<c212、(2006成都一诊)常温时,将V1mL c1 mol·L-1的醋酸滴加到V2mL c2 mol·L-1的烧碱溶液中,下列结论正确的是A.若V1=V2,且混合溶液pH<7,则有c1<c2B.若V1=V2,c1=c2,则混合溶液中c(Na+)=c(CH3COO-)C.若混合溶液的pH=7,则有c1V1>c2V2D.若混合溶液的pH=7,则混合溶液中c(Na+)>c(CH3COO-)13、(2007合肥一检)下列指定条件下的结果正确的是,c(OH—)=c(NH4+)B.10mL 0.02mol·L—1 HCl溶液与10mL 0.02mol·L—1 Ba(OH)2溶液充分混合,若混合后溶液的体积为20mL,则溶液的pH=7C.在0.1mol·L—1 CH3COONa溶液中,c(OH—)=c(CH3COOH)+c(H+),c(Na+)=2c(A2—)+c(HA—)+c(H2A)14、(2007南昌二考)下列叙述正确的是A.室温下pH=7的CH3COOH与CH3COONa的混合液中离子浓度大小顺序为:c(Na+)>c(CH3COO-)>c(H+)=c(OH)-B.0.1mol·L-1KHS溶液中,c(K+)=2c(S2-)+c(HS-)+c(H2S)C.25℃时,pH均为12的NaOH溶液和Na2CO3溶液中由水电离出的c(OH-),前者小于后者D.中和pH与体积相同的盐酸和醋酸溶液消耗NaOH的物质的量相等15、(2005泉州模拟)已知0.1mol/L酸式盐NaHA溶液的pH为8.5,请回答下列问题:(1)溶液中HA-的电离程度(填“大于”、“小于”或“等于”)水解程度。


溶液中的“三大守恒”1.溶液中的“三大守恒”规律,即电荷守恒、物料守恒、质子守恒。
2.以NaHCO3溶液为例来说明溶液中的“三大守恒”规律(1)NaHCO3溶液存在的微粒有________________________________________________。
Na+、H+、HCO-3、CO2-3、OH-、H2CO3、H2O(2)电荷守恒:溶液显电中性,溶液中阳离子所带的正电荷总数等于阴离子所带的负电荷总数。
NaHCO3溶液中电荷守恒等式为:c(Na+)+c(H+)=c(HCO-3)+2c(CO2-3)+c(OH-)。
电荷守恒的等式特点为______________________________________。
(3)物料守恒:物质初始的某些元素的物质的量或物质的量浓度的比值为定值,如NaHCO3溶液中c(Na+)总:c(含C元素的微粒)总=1:1。
NaHCO3溶液中物料守恒等式为:c(Na+)=c(H2CO3)+c(HCO-3)+c(CO2-3)。
物料守恒的等式特点为______________________________________。
思考:电荷守恒的等式与物料守恒的等式相减得到:___________________________。
(4)质子守恒:电解质溶液中,由于电离、水解等过程的发生,有的微粒得H+(质子),有的微粒失H+,在这个过程中H+得失守恒,称为质子守恒。
溶液的质子守恒可以用图示法,如NaHCO3溶液中:NaHCO3溶液中质子守恒等式为:c(H2CO3)+c(H+)=c(CO2-3)+c(OH-)。
质子守恒的等式特点为______________________________________。
注意:a.溶液的质子守恒图示法只适合于单一溶质的溶液,能得失H+的微粒为溶液初始状态的H2O+弱酸阴离子或H2O+弱碱阳离子。
b.多溶质的混合溶液质子守恒等式要用电荷守恒的等式与物料守恒的等式相减得到。


专题三三大守恒原理:三个守恒:(1)电荷守恒:是指溶液中所有阳离子所带的正电荷总数等于溶液中所有阴离子所带的负电荷总数。
整个溶液呈电中性。
+ + 2Na2CO3: c(Na )+c(H )=2c(C0 3 )+c(HCO 3-)+c(0H -)(2)物料守恒:是指某一成份的原始浓度应该等于该成份在溶液中各种存在形式的浓度之和。
+ 2Na2CO3 : c(Na )=2[c(C0 3 )+c(HCO 3-)+c(H 2CO3)]⑶质子守恒:水电离的H+与OH守恒。
Na2CO3:c(OH -)=c(H +)+c(HCO 3-)+2c(H 2CO3)不等式关系:一元弱酸盐溶液中离子浓度的一般关系是:C(不水解离子)> C(水解离子)>C(显性离子)>C(水电离出的另外一种离子)CH s COONa :c(Na +)>c(CH 3COO —)>c(OH —)>c(H +)二元弱酸盐溶液中离子浓度的一般关系是:C(不水解离子)> C(水解离子)>C(显性离子)>C(二级水解离子)>C(水电离出的另一离子)Na2CO3: c(Na ) >c(CO 32) >c(OH ) >c(HCO 3 ) >c(H )二元弱酸的酸式盐溶液中离子浓度大小的一般关系是:C(不水解离子)>C(水解离子)>C(显性离子)>C(水电离出的另一离子)>C(电离得到的酸根离子)NaHCO 3:C(Na + )>C(HCO 3—)>C(OH —)>C(H +) > C(CO 32 —)一.单项选择题1. 20 mL 1 mol / L醋酸溶液跟40 mL 0.5 mol / L氢氧化钠溶液相混合,所得溶液中离子浓度由大到小的顺序是(Ac-代表醋酸根离子) ( )A.c Na+> cAc_ > cOH_ > c H +B.c Na+= c Ac 一, c Ac-> c OH 一> c H+C.c Na+> c OH - > c Ac-> c H +D.c Na+>cOH_>c H+>c Ac-2.将0.2 mol / L CH 3COOK与0.1 mol / L盐酸等体积混合后,溶液中下列微粒的物质的量浓度的关系正确的是(A.C CH3COO「= cC「= c H+> c CH3COOHB.c CH3COO —= cC「> c CH3COOH > c H +C.c CH3COO > c Cl > c H+> CCH3COOHD.c CH3COO > c Cl > c CH3COOH > c H +3.将20 mL 0.1 mol / L的醋酸与24 mL 0.1 mol / L的氢氧化钠混合后,溶液中各离子摩尔浓度由大到小的顺序是(A.c Na+> c CH3COO - > c H+>c OH _B.c Na+> c CH3COO - > c OH - > c H +C.c OH _ > c Na+ > c H+>c CH3COO-D.c Na+> c OH - >c H+> c CH3COO-4.在氯化铵溶液中,下列关系式正确的是( )A. c(C「)>c(NH;)>qH+尸qOH_)B. q NH; >cC「)>c(H+)>qOH)C. c(C「尸c(NH:>c(H+尸c(OH「)D. c(NH:)= c(C「)>c(H +)> qOH)5.100 mL 0.1 mol / L醋酸与50 mL 0.2 mol / L氢氧化钠溶液混合,在所得溶液中A.c Na+> CCH3COO > c OH > c H+B.c Na+> c CH3COO > c H+> c OH+ —+ —C.c Na > c CH3COO > c H = c OHD.c Na+= c CH3COO — > c OH— > c H+6.将pH = 3的盐酸溶液和pH = 11的氨水等体积混合后,溶液中离子浓度关系正确的是A.c(NH:> c(CI >c(H+)>c(OH )B. c(NH;)>qCl > qOH > qH+)C. c(ci >qNH:)>qH+)>qOH)D. cci >C(NH:)>C(OH)>qH+)7•物质的量浓度相同的下列溶液中,NH;最大的是A. NH:ClB. NH:HSO:C. CH3COONH4D. NH4HCO38.0.1 mol • L—1 NaOH和0.1 mol • L—1 NH 4CI溶液等体积混合后,离子浓度大小正确的次序是A.c Na+>c Cl > c OH > c H+B. c Na+= c Cl > c OH > c H+C. c Na+= c Cl > c H+> c OHD. c Cl > c Na+> c OH > c H+9.在0.1 mol / L Na 2CO3溶液中,下列关系正确的是A . c(Na ) = 2c( CO 3 B.c(OH—) = 2 c(H+)C.c(HCOf) >C(H2CO3) D . c(Na+) v[c(Co3_) + c( HCOf)]10.已知0.1 mol • L —1的二元酸H2A溶液的pH = 4.0,则下列说法中正确的是A.在Na z A、NaHA两溶液中,离子种类不相同B.在溶质物质的量相等的Na z A、NaHA两溶液中,阴离子总数相等C.在NaHA 溶液中一定有:c Na++ c H+= c HA — + c OH — + 2 c A2—+ 2一+ 一D.在Na2A 溶液中一定有:c Na > c A > cH > c OH11.下列混合溶液中,各离子浓度的大小顺序正确的是A.10 mL 0.1 mol / L 氨水与10 mL 0.1 mol / L 盐酸混合,c Cl-〉c NH;> cOH - > c H +B.10 mL 0.1 mol / L NH 4CI 溶液与5 mL 0.2 mol / L NaOH 溶液混合,c Na+= c Cl - > c OH - > c H +C.10 mL 0.1 mol / L CH 3COOH 溶液与5 mL 0.2 mol / L NaOH 溶液混合,c Na+= c CH 3COO - > c OH - > c H+D.10 mL 0.5 mol / L CH s COONa 溶液与6 mL 1 mol / L 盐酸混合,c Cl - > c Na+> c OH - > c H +12、常温时,将V1mL c1 mol • L —1的醋酸滴加到V2mL c2 mol • L —1的烧碱溶液中,下列结论正确的是A. 若W=V2,且混合溶液pH<7,则有c1<c2B .若V1=V2 , c仁c2,则混合溶液中c(Na+)=c(CH3COO —)C.若混合溶液的pH=7,则有c1V1>c2V2D.若混合溶液的pH=7,则混合溶液中c(Na+)>c(CH3COO —)13、下列叙述正确的是A .室温下pH=7的CH3COOH与CH3COONa的混合液中离子浓度大小顺序为:c(Na+)>c(CH3COO —)>c(H+)=c(OH)—B.0.1mol • L —1KHS 溶液中,c(K+)=2c(S2 —)+c(HS —)+c(H2S)C.25C时,pH均为12的NaOH溶液和Na2CO3溶液中由水电离出的c(OH —), 前者小于后者D •中和pH与体积相同的盐酸和醋酸溶液消耗NaOH的物质的量相等二.双项选择题1.在物质的浓度均为0.01 mol / L的CH3COOH和CH3COONa的混合液中,测得cCH3COO— > c Na+,则下列关系式正确的是A. c H+> c OH—}B. c H+v c OH —C.c CH3COOH > c CH3COO —D. c CH3COOH + c CH3COO — = 0.02mol / L2•等体积、等浓度的MOH强碱溶液和HA弱酸溶液混合后,混合液中有关离子的浓度应满足的关系是A. c M+>c OH — > c A— > c H+B. c M+> c A > c H + > c OH —C. c M+> c A— > cOH — > c H+D. c M++ c H+ = c A — + c OH —3.把0.02 mol / L HAc溶液和0.01 mol / L NaOH溶液以等体积混合,则混合液中粒子浓度关系正确的为A .c(Ac ) > c(Na+)B . c(HAc) > c(Ac JC. 2c(H+) = c(AcJ—c(HAc) D ,c(HAc) + c(AcJ = 0.01 mol / L4.将0.2 mol • L —1 HCN溶液和0.1 mol • L —1的NaOH溶液等体积混合后,溶液显碱性,下列关系式中正确的是A ,c HCN v c CNB ,c Na > c CNC.cHCN —cCN「= cOH —D ,c HCN + c CN —= 0.1 mol L「15•草酸是二元弱酸,草酸氢钾溶液呈酸性,在0 1 mol / L KHC 2O4溶液中,下列关系正确的是+ + QA ,c K + c H = c HC2O^ + cOH- + c C?。

溶液中三大守恒一、电荷守恒电解质溶液中所有阳离子所带的正电荷数与所有的阴离子所带的负电荷数相等。
例:写出碳酸钠(Na2CO3)溶液中的电荷守恒关系式(1)找出溶液中的离子:Na+ H+ CO32- HCO3- OH-(2)根据电荷的物质的量: n(Na+)+n(H+)=2n(CO32-)+n(HCO3-)+n(OH-)(3)根据电荷离子浓度关系: c(Na+)+c(H+)=2c(CO32-)+c(HCO3-)+c(OH-)注意:A、准确判断溶液中的离子种类。
B、弄清离子浓度与电荷的关系。
即R n+的电荷浓度nC(R n+)练:1、NH4HCO3溶液的电荷守恒试2、Na2S溶液的电荷守恒试二、物料守恒电解质溶液中由于电离或水解因素,离子会发生变化,变成其它离子或分子等,但离子或分子中某种特定元素的原子总数是不会改变的。
某些特征性的原子是守恒的例:NaHCO3溶液中C(Na+)的物料守恒关系式C(Na+)=C(HCO3-)+C(CO32-)+C(H2CO3)练:1、Na2CO3溶液中的物料守恒关系式、2、H2S溶液中的电荷守恒关系式三、质子守恒电解质溶液中分子或离子得到质子的物质的量应相等失去质子的物质的量(由水电离出来的c(H+)、 c(OH-)相等)例:NaHCO3溶液中的质子守恒关系式1、先找出溶液电离出的阴离子HCO3-2、列下列式子练:1、Na2 CO3溶液中的质子守恒关系式2、Na HS溶液中的质子守恒关系式综合练习:1、CH3COONa溶液中三大守恒关系式电荷守恒:物料守恒:质子守恒:2、Na2 CO3溶液中三大守恒关系式电荷守恒:物料守恒:第1 页共5 页 1质子守恒:[规律总结]正确的思路:一、溶质单一型※※关注三个守恒1.弱酸溶液:【例1】在0.1mol/L的H2S溶液中,下列关系错误的是()A.c(H+)=c(HS-)+c(S2-)+c(OH-)B.c(H+)=c(HS-)+2c(S2-)+c(OH-)C.c(H+)>[c(HS-)+c(S2-)+c(OH-)]D.c(H2S)+c(HS-)+c(S2-)=0.1mol/L分析:由于H2S溶液中存在下列平衡:H2S H++HS-,HS-H++S2-,H2O H++OH-,根据电荷守恒得c(H+)=c(HS-)+2c(S2-)+c(OH-),由物料守恒得c(H2S)+c(HS-)+c(S2-)=0.1mol/L,所以关系式错误的是A项。


高二化学盐溶液中离子的三大守恒专项练习一、单选题1.常温下,用AgNO 3溶液分别滴定浓度均为0.01mol·L -1的KCl 、K 2C 2O 4溶液,所得的沉淀溶解平衡图象如图所示(不考虑224C O -的水解)。
下列叙述正确的是( )A.K sp (Ag 2C 2O 4)的数量级等于10-7 B.n 点表示AgCl 的不饱和溶液C.向c (Cl -)=c (224C O -)的混合液中滴入AgNO 3溶液时,先生成Ag 2C 2O 4沉淀D. Ag 2C 2O 4+2Cl-2AgCl+224C O -的平衡常数为109.042.室温下,将0.1mol/L 的一元酸HA 溶液逐滴滴加到10mL0.1mol/LNaOH 溶液中,pH 的变化曲线如图所示。
下列说法错误的是( )A.a 点所示溶液中()+--()()Na A OH HA ()c c c c >>>B.a 、b 两点所示溶液中水的电离程度a 点大于b 点C.pH=7时,()+-()(N )a A HA c c c =+D.一元酸HA 为弱酸3.某二元弱碱()25122B OH 5.910 6.410()K K --=⨯=⨯、。
常温下向10mL 稀()2B OH 溶液中滴加等浓度盐酸溶液,()()+2+2B OH B OH B 、、的浓度分数δ随溶液()-c POH POH=-lg OH []变化的关系如图,以下说法正确的是( )A.交点a 处对应加入的盐酸溶液的体积为5mLB.当加入的盐酸溶液的体积为10mL 时存在()+-+-2+Cl B OH H OH ()(()(B )()c c c c c >>>> C.交点b 处-5OH 6.410()c -=⨯D.当加入的盐酸溶液的体积为15mL 时存在:()+--2++()()()Cl OH B B +()H )(OH c c c c c +=+4.25℃时,在120 mL 0.1 mol L ⋅-一元弱酸HA 溶液中滴加10.1 mol L NaOH ⋅- 溶液,溶液中(A )lg(HA)c c -与pH 关系如图所示。

三大守恒及溶液中离子浓度大小比较1、两个微弱(1)微弱电离:溶质分子是主要的。
①弱电解质电离是微弱的②多元弱酸电离是分步,主要由第一步决定(2)微弱水解:盐溶液离子是主要的。
①水解是微弱②多元弱酸酸根水解是分步,主要由第一步决定。
2、三个守恒(1)电荷守恒:溶液呈电中性——阳离子所带正电荷总数=阴离子所带负电荷总数(2)物料守恒(原子守恒):某原子的原始的浓度=该元素在溶液中的各种形式存在微粒的浓度和(3)质子守恒:在电解质溶液中,水电离出的c(H+)水与c(OH-)水总是相等。
(联立电荷守恒和物料守恒等式)。
3、特殊(1)弱酸酸式盐:比较电离,水解的相对强弱。
(2)混合溶液①不反应:比较电离、水解的相对强弱。
②会反应:根据过量程度来考虑电离与水解的相对强弱。
【练习题】一、单一溶液中各粒子浓度1.在0.1mol/L的Na2S溶液中,下列关系正确的是( )A.c(Na+)>c(S2-)>c(H+)>c(HS-)>c(OH-)B.c(OH-)=c(H+)+c(HS-)+2c(H2S)C.c(Na+)+c(H+)=1/2c(S2-)+c(HS-)+c(OH-)D.c(S2-)+c(HS-)+c(H2S)=0.1mol/L二、混合溶液中各粒子浓度2.把0.02mol/LCH3COOH和0.01mol/LNaOH以等体积混合后溶液显酸性,则混合溶液中微粒浓度关系正确的是()A.c(CH3COO-)>c(Na+)B.c(CH3COOH)>c(CH3COO-)C.2c(H+)=c(CH3COO-) - c(CH3COOH)D.c(CH3COOH) + c(CH3COO-)=0.01mol/L3.0.1mol/L的NaOH溶液0.2L,通入448mL(标况)H2S气体,所得溶液离子浓度大小关系正确的是( )A.c(Na+)>c(HS-)>c(OH-)>c(H2S)>c(S2-)>c(H+)B.c(Na+) + c(H+) = c(HS-) + c(S2-) + c(OH-)C.c(Na+) = c(H2S) + c(HS-) + c(S2-) + c(OH-)D.c(S2-) + c(OH-) = c(H+) + c(H2S)4.常温下,一定体积pH=2的二元弱酸H2R溶液与一定体积pH=12的NaOH溶液混合后溶液呈中性。

溶液中的离子守恒关系的典型题例1、在 mol·L-1NaHCO3溶液中有关粒子浓度关系正确的是(Na+)>c(HCO3-)>c(CO32-)>c(H+)>c(OH-)(Na+)+c(H+)=c(HCO3-)+c(CO32-)+c(OH-)(Na+)+c(H+)=c(HCO3-)+2c(CO32-)+c(OH-)(Na+)=c(HCO3-)+c(CO32-)+c(H2CO3)2、关于Na2CO3溶液,下列关系不正确的是A、c(Na+)>2c(CO32-)B、c(Na+)>c(CO32-)>c(H CO3-)>c(OH—)C、c(Na+)>c(CO32-)>c(OH—)>c(H CO3-)>c(H2CO3)D、c(Na+)+c(H+)=c(OH—)+c(H CO3-) +2c(CO32-)3、标准状况下,向3mol·L-1的NaOH溶液100mL中缓缓通入气体,充分反应后溶液中离子浓度大小排列顺序正确的是A.c(Na+)>c(CO32-)>c(HCO3-)>c(OH-)>c(H+)B.c(Na+)>c(CO32-)=c(HCO3-)>c(OH-)>c(H+)C.c(Na+)>c(HCO3-)>c(CO-)>c(CO32-)>c(H+)D.c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+)4、等体积的下列溶液,阴离子的总浓度最大的是A L K2SB L Ba(OH)2C L NaClD L (NH4)2SO45、把LHAc溶液和LNaOH溶液等体积混合,则混合溶液中微粒浓度关系正确的是A.c(Ac-)>c(Na+) B.c(HAc)>c(Ac-)C.2c(H+)=c(Ac-)-c(HAc) D.c(HAc)+ c(Ac-)=·L-16、(2006四川理综)25℃时,将稀氨水逐滴加入到稀硫酸中,当溶液的pH=7时,下列关系正确的是A、c(NH4+)=c(SO42-)B、c(NH4+)>c(SO42-)C、c(NH4+)<c(SO42-)D、c(OH-)+c(SO42-)=c(H+)+(NH4+)7、已知某温度下,在100 mL浓度为 mol/L的NaHS强电解质溶液中,c(H+)>(OH-),则下列关系式一定正确的是A.溶液的pH=2 B.C(Na+)= mol/L≥c(B2-)C.C(H+)·c(OH-)=10-14 D.C(Na+)+c(H+)=c(HB-)+c(B2-)+c(OH-)8、(2006苏州二测)已知某温度下 mol·L-1的NaHB溶液中c(H+)>c(OH-),则下列关系中一定正确的是(Na+)=c(HB-)+2c(B2-)+c(OH-) (Na+)= mol·L-1≥c(B2-)(H+)·c(OH-)=10-14D.溶液的pH=19、用物质的量是 mol的CH3COOH和CH3COONa配成1L混合溶液,已知其中c(CH3COO-)大于c(Na+),对该混合溶液的下列判断正确的是A.c(H+)>c(OH-) B.c(CH3COO-)+c(CH3COOH)= mol·L-1C.c(CH3COOH)>c(CH3COO-) D.c(CH3COO-)+c(OH-)=mol·L -110、(2007四川高考)在25℃时,将pH=11的NaOH溶液与pH=3的CH3COOH溶液等体积混合后,下列关系式中正确的是A、c(Na+)=c(CH3COO-)+c(CH3COOH)B、c(H+)=c(CH3COO-)+c(OH-)C、c(Na+)>c(CH3COO-)>c(OH-)>c(H+)D、c(CH3COO-)>c(Na+)>c(H+)>c(OH-)11、(2006揭阳调研)常温时,将V1mL c1mol/L的氨水滴加到V2mL c2mol/L的盐酸中,下述结论中正确的是:A.若混合溶液的pH=7,则c1V1=c2V2B.若V1=V2,c1=c2,则混合液中c(NH4+)=c(Cl-)C.若混合液的pH<7,则混合液中c(NH4+)>c(Cl-)>C(H+)>C(OH-)D.若V1=V2,且混合液的pH<7,则一定有c1<c212、(2006成都一诊)常温时,将V1mL c1 mol·L-1的醋酸滴加到V2mL c2 mol·L-1的烧碱溶液中,下列结论正确的是A.若V1=V2,且混合溶液pH<7,则有c1<c2B.若V1=V2,c1=c2,则混合溶液中c(Na+)=c(CH3COO-)C.若混合溶液的pH=7,则有c1V1>c2V2D.若混合溶液的pH=7,则混合溶液中c(Na+)>c(CH3COO-)13、(2007合肥一检)下列指定条件下的结果正确的是A.0.1mol·L—1氨水中,c(OH—)=c(NH4+)·L—1 HCl溶液与10mL ·L—1 Ba(OH)2溶液充分混合,若混合后溶液的体积为20mL,则溶液的pH=7C.在·L—1 CH3COONa溶液中,c(OH—)=c(CH3COOH)+c(H+)—1某二元弱酸盐NaHA溶液中,c(Na+)=2c(A2—)+c(HA—)+c(H2A)14、(2007南昌二考)下列叙述正确的是A.室温下pH=7的CH3COOH与CH3COONa的混合液中离子浓度大小顺序为:c(Na+)>c(CH3COO-)>c(H+)=c(OH)-B.·L-1KHS溶液中,c(K+)=2c(S2-)+c(HS-)+c(H2S)C.25℃时,pH均为12的NaOH溶液和Na2CO3溶液中由水电离出的c(OH-),前者小于后者D.中和pH与体积相同的盐酸和醋酸溶液消耗NaOH的物质的量相等15、(2005泉州模拟)已知L酸式盐NaHA溶液的pH为,请回答下列问题:(1)溶液中HA-的电离程度(填“大于”、“小于”或“等于”)水解程度。
溶液中的“三大守恒”规律(二)班级:___________,姓名:_____________。
1.(2016全国Ⅲ)下列有关电解质溶液的说法正确的是( )A .向0.1mol/L CH 3COOH 溶液中加入少量水,溶液中c(H +)/c(CH 3COOH)减小B .将CH 3COONa 溶液从20Ⅲ升温至30Ⅲ,溶液中c(CH 3COOH)/[c(CH 3COOH)·c(OH -)]增大C .向盐酸中加入氨水至中性,溶液中c(NH 4+)/c(Cl -)>1D .向AgCl 、AgBr 的饱和溶液中加入少量AgNO 3,溶液中c(Cl -)/c(Br -)不变【答案】D 【解析】3(H )(CH COOH)c c +=3(CH COO )K c -,因为加水,稀释溶液,醋酸电离程度增大,但醋酸根离子浓度减小,平衡常数不变,故比值变大,A 错误;醋酸钠溶液加热,醋酸根离子水解程度增大,其33(CH COO )(CH COOH)(OH )c c c --⋅=1/K ,K 变大,所以比值变小,B 错误;盐酸中加入氨水到中性,则有c(H +)=c(OH -),根据电荷守恒,c(NH 4+)=c(Cl -),C 错误;向氯化银和溴化银的饱和溶液中加入少量硝酸银,沉淀溶解平衡逆向移动,氯离子和溴离子浓度比仍等于其溶度积的比值,故不变,D 正确。
2.(2019全国Ⅲ)设N A 为阿伏加德罗常数值。
关于常温下pH=2的H 3PO 4溶液,下列说法正确的是( )A .每升溶液中的H +数目为0.02N AB .c (H +)= c (H 2PO 4-)+2c (HPO 42-)+3c (PO 43-)+ c (OH -)C .加水稀释使电离度增大,溶液pH 减小D .加入NaH 2PO 4固体,溶液酸性增强【答案】B【解析】常温下pH =2,则溶液中氢离子浓度是0.01mol/L ,因此每升溶液中H +数目为0.01N A ,A 错误;根据电荷守恒可知,B 正确;加水稀释促进电离,电离度增大,但氢离子浓度减小,pH 增大,C 错误;加入NaH 2PO 4固体,H 2PO 4-浓度增大,抑制磷酸的电离,溶液的酸性减弱,D 错误。
电解质溶液中三⼤守恒专练(带答案)电解质溶液中三⼤守恒专练1. 室温下,取20 mL 0.1 mol?L﹣1某⼆元酸H2A,滴加0.2 mol?L﹣1 NaOH溶液。
已知H2A═H++HA﹣,HA﹣H++A2﹣,下列说法不正确的是()A.0.1 mol?L﹣1 H2A溶液中有c(H+)﹣c(OH﹣)﹣c(A2﹣)=0.1 mol?L﹣1B.当滴加⾄中性时,溶液中c(Na+)=c(HA﹣)+2c(A2﹣),⽤去NaOH溶液的体积⼩于10 mLC.当⽤去NaOH溶液体积10 mL时,溶液pH<7,此时溶液中c(A2﹣)=c(H+)﹣c(OH﹣)D.当⽤去NaOH溶液体积20 mL时,此时溶液中有c(Na+)=2c(HA﹣)+2c(A2﹣)2. 25℃时,弱电解质的电离平衡常数K a(CH3COOH)=K b(NH3?H2O)=1.75×10﹣5,下列说法正确的是()A.⽤0.1mol/L盐酸滴定0.1mol/L氨⽔时,可⽤酚酞作指⽰剂B.0.2mol/L的醋酸与0.1mol/L的NaOH溶液等体积混合,所得溶液中:c(CH3COO﹣)+c(OH﹣)=c(CH3COOH)+c(H+)C.pH相同的①CH3COONa、②NaClO的两种溶液的c(Na+):①>②D.pH=3的醋酸与pH=11的氨⽔等体积混合,所得溶液中由⽔电离出的c(H+)=1×10﹣7mol/L3. 下列说法正确的是()A. 0.1mol?L﹣1Na2CO3溶液中:c(HCO3﹣)+c(H2CO3)+2c(CO32﹣)=c(Na+)B.物质的量浓度相等的Na2SO3和NaHSO3溶液中:3c(Na+)=2【c(SO32﹣)+c(HSO3﹣)+c(H2SO3)】C.同浓度的下列溶液中,①NH4HSO4 ②NH4Cl ③NH3?H2O,c(NH4+)由⼤到⼩的顺序是②>①>③D.常温下,浓度均为0.1mol?L﹣1 NaCN和HCN溶液中pH=9,则c(HCN)>c(Na+)>c(CN﹣)>c(OH﹣)>c(H+)4. ⽤0.10 mol?L﹣1的氨⽔滴定20.00 mL a mol?L﹣1的盐酸,混合溶液的pH与氨⽔的体积(V)的关系如图所⽰。
水溶液中的离子守恒(三大守恒)专项练习(选择题25题)一、单选题(共25题,每题4分,共100分)1.NH4Cl溶液中,下列叙述错误的是()A.c(NH4+)>c(Cl-)>c(OH-)>c( H+)B.c(Cl-)>c(NH4+)>c( H+)>c(OH-)C.c(NH4+)+c( H+)=c(Cl-)+c(OH-)D.c(NH4+)+c( NH3·H2O)=c(Cl-)2.常温下,下列各溶液的叙述中正确的是()A.pH=7的NaHSO3与Na2SO3混合溶液中:c(Na+)=c(HSO3−)+c(SO32−)B.等物质的量浓度的下列溶液中:①NH4Al(SO4)2②NH4Cl③CH3COONH4④NH3·H2O,c(NH4+)由大到小的顺序是①>②>③>④C.0.1 mol·L-1的醋酸的pH=a,0.01 mol·L-1的醋酸的pH=b,则a+1=bD.0.1 mol·L-1的醋酸钠溶液20 mL与0.1 mol·L-1的盐酸10 mL混合后溶液显酸性,则有:c(CH3COOH)>c(H+)>c(Cl-)>c(CH3COO-)3.如图为向25mL 0.1 mol·L-1 NaOH溶液中逐滴滴加0. 2 mol·L-1 CH3COOH溶液过程中溶液pH的变化曲线。
AB区间,c(OH-)>c(H+),则c(OH-)与c(CH3COO-)大小关系是:()A.c(OH-)一定大于c(CH3COO-)B.c(OH-)一定小于c(CH3COO-)C.c(OH-)一定等于c(CH3COO-)D.c(OH-)大于、小于或等于c(CH3COO-)4.NH3与O2作用分别生成N2、NO、N2O的反应均为放热反应。
工业尾气中的NH3可通过催化氧化为N2除去。
将一定比例NH3、O2和N2的混合气体以一定流速通过装有催化剂的反应管,NH3的转化率、N2的选择性[2n生成(N2)n总转化(NH3)×100%]与温度的关系如图所示。
电荷守恒基本看法化合物中元素正负化合价代数和为零指溶液一定保持电中性,即溶液中全部阳离子所带的电荷数等于全部阴离子所带的电荷数除六大强酸,四大强碱外都水解,多元弱酸部分水解。
产物中有分步水解时产物。
拜见例题Ⅳ这个离子所带的电荷数是多少,离子前写几。
比方:Na2CO3:c(Na+)+c(H+)=c(OH-)+c(HCO3-)+2c(CO32-)因为碳酸根为带两个单位的负电荷,因此碳酸根前有一个 2。
比方:在LNaHCO3溶液中Ⅰ.CH3COONa: c(Na+)+c(H+)=c(CH3COO-)+c(OH-)Ⅱ.Na2CO3:c(Na+)+c(H+)=c(OH-)+c(HCO3-)+2c(CO32-)Ⅲ.NaHCO3:c(Na+)+c(H+)=c(HCO3-)+2c(CO32-)+c(OH-)Ⅳ.Na3PO4:c(Na+)+c(H+)=3c(PO43-)+2c(HPO42-)+c(H2PO4-)+c(OH-)电荷守恒定律物理学的基本定律之一。
它指出,对于一个孤立系统,无论发生什么变化,此中全部电荷的代数和永久保持不变。
电荷守恒定律表示,假如某一地域中的电荷增添或减少了,那么必然有等量的电荷进入或走开该地域;假如在一个物理过程中产生或消逝了某种符号的电荷,那么必然有等量的异号电荷同时产生或消逝。
电荷守恒应用所谓电荷守恒是指溶液中全部阳离子所带的正电荷总数与全部阴离子所带的负电荷总数相等。
1.正确解析溶液中存在的阴阳离子是书写电荷守恒式的重点,需要联合电解质电离及盐类的水解知识,特别是对多级电离或多级水解,不可以有所遗漏。
如Na2CO3溶液中存在以下电离和水解均衡:Na2CO3==2Na++CO32-;CO32-+H2OHCO3-+OH;-HCO3—+H2OH2CO3+OH—;H2OH++OH—。
因此溶液中阳离子有:Na+、H+,阴离子有:CO32—、HCO3—、OH—。
2.联合阴阳离子的数目及其所带的电荷可以写出:N(Na+)+N(H+)=2N(CO32 —)+N(HCO3—)+N(OH—)3.将上式两边同时除以NA得:n(Na+)+n(H+)=2n(CO32 —)+n(HCO3—)+n(OH—);再同时除以溶液体积V得:C(Na+)+C(H+)=2C(CO32—)+C(HCO3—)+C(OH—),这就是Na2CO3溶液的电荷守恒式。
溶液中的三大守恒习题1、在0.1 mol·L-1NaHCO3溶液中有关粒子浓度关系正确的是A、c(Na+)>c(HCO3-)>c(CO32-)>c(H+)>c(OH-)B、c(Na+)+c(H+)=c(HCO3-)+c(CO32-)+c(OH-)C、c(Na+)+c(H+)=c(HCO3-)+2c(CO32-)+c(OH-)D、c(Na+)=c(HCO3-)+c(CO32-)+c(H2CO3)2、关于Na2CO3溶液,下列关系不正确的是A、c(Na+)>2c(CO32-)B、c(Na+)>c(CO32-)>c(H CO3-)>c(OH—)C、c(Na+)>c(CO32-)>c(OH—)>c(H CO3-)>c(H2CO3)D、c(Na+)+c(H+)=c(OH—)+c(H CO3-) +2c(CO32-)3、标准状况下,向3mol·L-1的NaOH溶液100mL中缓缓通入4.48LCO2气体,充分反应后溶液中离子浓度大小排列顺序正确的是A.c(Na+)>c(CO32-)>c(HCO3-)>c(OH-)>c(H+)B.c(Na+)>c(CO32-)=c(HCO3-)>c(OH-)>c(H+)C.c(Na+)>c(HCO3-)>c(CO-)>c(CO32-)>c(H+)D.c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+)4、等体积的下列溶液,阴离子的总浓度最大的是A、0.2mol/L K2SB、0.1mol/L Ba(OH)2C、0.2mol/L NaClD、0.2mol/L (NH4)2SO45、把0.02mol/LHAc溶液和0.01mol/LNaOH溶液等体积混合,则混合溶液中微粒浓度关系正确的是A.c(Ac-)>c(Na+)B.c(HAc)>c(Ac-)C.2c(H+)=c(Ac-)-c(HAc)D.c(HAc)+ c(Ac-)=0.01mol·L-16、25℃时,将稀氨水逐滴加入到稀硫酸中,当溶液的pH=7时,下列关系正确的是A、c(NH4+)=c(SO42-)B、c(NH4+)>c(SO42-)C、c(NH4+)<c(SO42-)D、c(OH-)+c(SO42-)=c(H+)+(NH4+)7、已知某温度下,在100 mL浓度为0.01 mol/L的NaHS强电解质溶液中,c(H+)>(OH-),则下列关系式一定正确的是A.溶液的pH=2 B.C(Na+)=0.01 mol/L≥c(B2-)C.C(H+)·c(OH-)=10-14D.C(Na+)+c(H+)=c(HB-)+c(B2-)+c(OH-)8、已知某温度下0.1 mol·L-1的NaHB溶液中c(H+)>c(OH-),则下列关系中一定正确的是A.c(Na+)=c(HB-)+2c(B2-)+c(OH-)B.c(Na+)=0.1 mol·L-1≥c(B2-)C.c(H+)·c(OH-)=10-14D.溶液的pH=19、用物质的量是0.1 mol的CH3COOH和CH3COONa配成1L混合溶液,已知其中c(CH3COO-)大于c(Na+),对该混合溶液的下列判断正确的是A.c(H+)>c(OH-) B.c(CH3COO-)+c(CH3COOH)=0.2 mol·L-1 C.c(CH3COOH)>c(CH3COO-) D.c(CH3COO-)+c(OH-)=0.1mol·L-110、在25℃时,将pH=11的NaOH溶液与pH=3的CH3COOH溶液等体积混合后,下列关系式中正确的是A、c(Na+)=c(CH3COO-)+c(CH3COOH)B、c(H+)=c(CH3COO-)+c(OH-)C、c(Na+)>c(CH3COO-)>c(OH-)>c(H+)D、c(CH3COO-)>c(Na+)>c(H+)>c(OH-)13、下列指定条件下的结果正确的是A.0.1mol·L—1氨水中,c(OH—)=c(NH4+)B.10mL 0.02mol·L—1 HCl溶液与10mL 0.02mol·L—1 Ba(OH)2溶液充分混合,若混合后溶液的体积为20mL,则溶液的pH=7C.在0.1mol·L—1 CH3COONa溶液中,c(OH—)=c(CH3COOH)+c(H+)D.0.1mol·L—1某二元弱酸盐NaHA溶液中,c(Na+)=2c(A2—)+c(HA—)+c(H2A)14、下列叙述正确的是A.室温下pH=7的CH3COOH与CH3COONa的混合液中离子浓度大小顺序为:c(Na+)>c(CH3COO-)>c(H+)=c(OH)-B.0.1mol·L-1KHS溶液中,c(K+)=2c(S2-)+c(HS-)+c(H2S)C.25℃时,pH均为12的NaOH溶液和Na2CO3溶液中由水电离出的c(OH-),前者小于后者D.中和pH与体积相同的盐酸和醋酸溶液消耗NaOH的物质的量相等15、已知0.1mol/L酸式盐NaHA溶液的pH为8.5,请回答下列问题:(1)溶液中HA-的电离程度(填“大于”、“小于”或“等于”)水解程度。
(2)溶液中Na+、HA-、H+、OH-离子的浓度由大到小的顺序是。
(3)溶液中逐滴加入H2A溶液至pH == 7,则c(Na+) c(HA-)。
(填“大于”“小于”“等于”)20、物质的量浓度相等的下列溶液pH值由大到小的顺序正确的是A. Na2CO3>NaAlO2>Na2SiO3>NaHCO3>Na2SO3>NH4ClB. CH3COONa>Na2CO3>NaHCO3>NaCl>NH4ClC. NaAlO2>Na2SiO3>Na2CO3>NaHCO3>Na2SO3>NH4ClD. Ba(OH)2>NaOH>NH3·H2O>NaCl>Al2(SO4)321、物质的量浓度均为1 mol/L的下列电解质溶液,各取10 mL混合后,pH值小于7的是A. Na2S、NaCl、HClB. Na2CO3、HCl、HNO3C. CaCl2、NaCl、NH4ClD. Na2CO3、HCl、CH3COOH22、有BaCl2和NaCl的混合溶液aL,将它均分成两份。
一份滴加稀硫酸,使Ba2+离子完全沉淀;另一份滴加AgNO3溶液,使Cl-离子完全沉淀。
反应中消耗xmol H2SO4、ymol AgNO3。
据此得知原混合溶液中的c(Na+)/ mol·L-1为A.(y-2x)/a B.(y-x)/a C.(2y-2x)/a D.(2y-4x)/a23、在下列反应中,aXO4-+bY―+cH+=dX2++eY2+8H2O,化学计量数b、d分别为A.5,6B.10,2C.6,2D.10,524、经测定,某溶液中只含有NH4+、Cl-、H+、OH-四种离子,下列说法中错误的是A.溶液中四种离子之间可能满足:c(Cl-)>c(H+)>c(NH4+)>c(OH-)B.若溶液中的溶质是NH4Cl和NH3·H2O,则离子间可能满足:c(NH4+)>c(Cl-)>c(OH-) >c(H+)C.若溶液中的四种离子满足:c(Cl-) >c(NH4+)>c(H+)>c(OH-),则溶液中的溶质一定只有NH4ClD.若溶液中c(Cl-) =c(NH4+),则该溶液一定呈中性25、下列说法正确的是A.若酸性HA>HB,则相同条件下,溶液的pH大小为NaA>NaBB.相同条件下,将pH=11的NaOH溶液和氨水分别稀释成pH=9的溶液,所加水的体积前者大C.pH=3的醋酸与pH=11的NaOH溶液等体积混合时,溶液中离子浓度的大小顺序是c(Na+)>c(CH3COO-)>c(OH-)>c(H+)D.0.1mol/L的某二元弱酸盐Na2A溶液中,c(Na+)=2[c(HA-)+c(A2-)+c(H2A)]26、0.1mol/L 的H2S溶液中所存在离子的浓度由大到小的排列顺序是_________________27、在CH3COONa 溶液中各离子的浓度由大到小排列顺序正确的是( )A、c(Na+)>c(CH3COO―)>c(OH―)>c(H+)B、c(CH3COO―)>c(Na+)>c(OH―)>c(H+)C、c(Na+)>c(CH3COO―)>c(H+)>c(OH―)D、c(Na+)>c(OH―)>c(CH3COO―)>c(H+)28、在Na2CO3溶液中各离子的浓度由小到大的排列顺序是______29、判断0.1mol/L 的NaHCO3溶液中离子浓度的大小关系30、草酸是二元弱酸,在0.1mol/LKHC2O4溶液中,下列正确的是A.c(K+)+c(H+)=c(HC2O4-)+c(OH-)+ c(C2O42-) B.c(HC2O4-)+ c(C2O42-)=0.1mol/LC.c(C2O42-)>c(H2C2O4) D.c(K+)= c(H2C2O4)+ c(HC2O4-)+ c(C2O42-) 31、PH=13的NH3·H2O和PH=1的盐酸等体积混合后所得溶液中各离子浓度由大到小的排列顺序是____________32、PH=X的NaOH溶液与PH=Y的CH3COOH溶液,已知X+Y=14,且Y<3。
将上述两溶液等体积混合后,所得溶液中各离子浓度由大到小的顺序正确的是( )A、C(Na+)>C(CH3COO―)>C(OH―)>C(H+)B、C(CH3COO―)>C(Na+)>C(H+)>C(OH―)C、C(CH3COO―)>C(Na+)>C(OH―)>C(H+)D、C(Na+)>C(CH3COO―)>C(H+)>C(OH―)33、 0.2 mol/L的CH3COOK与0.1 mol/L的盐酸等体积混合后,溶液中下列粒子的物质的量关系正确的是( )A、C(CH3COO―)= C(Cl―)=C(H+)>C(CH3COOH)B、C(CH3COO―)=C(Cl―)>C(CH3COOH)>C(H+)C、C(CH3COO―)>C(Cl―)>C(H+)>C(CH3COOH)D、C(CH3COO―)>C(Cl―)>C(CH3COOH)>C(H+)34、在10ml 0.1mol·L-1NaOH溶液中加入同体积、同浓度HAc 溶液,反应后溶液中各微粒的浓度关系错误的是( )。